FABP4在妊娠期高血压疾病胎盘滋养细胞免疫炎症反应中的作用研究
毛彩艳,张 辉,李旭生,杨松昊,邓 梅,丁 宁,吴 凯,杨晓玲,张慧萍,姜怡邓
(宁夏医科大学 1. 总医院、2. 基础医学院、3. 临床医学院,宁夏 银川 750004)
FABP4在妊娠期高血压疾病胎盘滋养细胞免疫炎症反应中的作用研究
毛彩艳2,张 辉3,李旭生1,杨松昊2,邓 梅2,丁 宁2,吴 凯2,杨晓玲2,张慧萍1,姜怡邓2
(宁夏医科大学 1. 总医院、2. 基础医学院、3. 临床医学院,宁夏 银川 750004)
目的 探讨脂肪酸结合蛋白4(fatty acid binding protein 4, FABP4)在妊娠期高血压疾病胎盘滋养细胞免疫炎症反应中的作用。方法 体外培养人胎盘滋养细胞株(HTR-8),分别加入0、10、100、500、1 000 μmol·L-1N-硝基-L-精氨酸甲酯(L-NAME),孵育48 h后,采用ELISA检测炎症因子IL-6、TNF-α改变;qRT-PCR、Western blot检测FABP4 mRNA和蛋白表达;构建FABP4腺病毒过表达载体转染细胞后,采用100 μmol·L-1L-NAME干预,ELISA分析炎症因子IL-6、TNF-α的变化。 结果 与对照组比较,L-NAME干预组IL-6、TNF-α及FABP4表达量明显增高(P<0.01);过表达FABP4组与对照组相比,炎症因子IL-6、TNF-α明显增加(P<0.01)。结论 FABP4参与了妊娠期高血压疾病胎盘滋养细胞免疫炎症反应的调控。
脂肪酸结合蛋白4;妊娠期高血压疾病;滋养细胞;IL-6;TNF-α;N-硝基-L-精氨酸甲酯
妊娠期高血压疾病(hypertension disorder complicating pregnancy,HDCP)是孕妇因妊娠后内环境改变而导致的以一过性血压升高、全身小动脉痉挛等致血管内皮广泛损伤为主要特征的严重危害母婴健康的疾病,是引起孕产妇和围生儿死亡的主要原因之一[1]。胎盘滋养细胞是妊娠得以建立和维持的基础,参与局部的免疫调节[2],在免疫调节中与其它来源的细胞因子共同发挥重要的作用,分泌集落刺激因子-Ⅰ(colony stimulating factor-Ⅰ, CSF-Ⅰ)、粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage-colony stimulating factor,GM-CSF)、白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等[3]。脂肪酸结合蛋白4(fatty acid binding protein 4, FABP4)分布于各种正常组织和细胞中,其在机体炎症、代谢及免疫等方面均具有重要的调节作用[4]。同时FABP4也是一类分子量较小,且对脂肪酸有高亲和力的可溶性载体蛋白,在糖脂代谢、炎症反应中起了重要的作用[5]。且HDCP是以血管内皮细胞受损、功能紊乱和胎盘血流灌注量减少为特征的一种妊娠期特有疾病,因此,阐明FABP4在HDCP胎盘滋养细胞免疫炎症反应中的作用,将为进一步深入研究HDCP的作用机制提供实验依据。
1 材料与方法
1.1 仪器与试剂 电泳仪、凝胶成像仪(Bio-Rad,美国);酶标仪、荧光定量PCR仪(上海枫岭生物技术有限公司)。总RNA提取试剂盒(北京天根生物技术有限公司);逆转录试剂盒、荧光定量PCR(qRT-PCR)试剂盒(Fermentas公司,英国); BCA蛋白含量检测试剂盒(凯基生物科技发展有限公司,南京);FABP4抗体(Abcam);引物由上海生工公司合成;DMEM F12培养基、胎牛血清、100 kU·L-1青霉素和0.1 g·L-1链霉素(Gibco 公司);N-硝基-L-精氨酸甲酯(N- nitro-L-arginine methylester,L-NAME)(Sigma公司)。
1.2 细胞培养 人胎盘滋养细胞株(HTR-8)购自复旦大学上海细胞库,采用DMEM F12培养基培养细胞(含10%胎牛血清、100 kU·L-1青霉素和0.1g·L-1链霉素),培养条件为:37 ℃、5%的CO2。不同浓度的L-NAME(10、100、500、1 000 μmol·L-1) 干预48 h,收集细胞用于后续实验。
1.3 qRT-PCR法检测IL-6、TNF-α、FABP4 mRNA表达 按照总RNA抽提试剂盒说明书抽提总RNA。取5 μL RNA样品进行凝胶电泳,琼脂糖胶浓度为1.0% ,电压为120 V,电泳15 min,利用凝胶成像系统检测RNA的完整性和纯度。在NCBI GenBank 数据库中查询IL-6、TNF-α、FABP4,利用Premier 5.0设计荧光PCR引物,IL-6的引物为上游:5′-GGTGAGTGGCTGTCTGTGTG-3′,下游:5′-TTCGGTCCAGTTGCCTTC-3′。TNF-α引物为上游:5′-AGCCCATGTTGTAGCAAACC-3′,下游:5′-GCTGGTTATCTCTCAGCTCCA-3′。FABP4引物为上游:5′-AAGAGAAAACGAGAGGATGATAAAC-3′,下游:5′-ATGCGAACTTCAGTCCAGGTC-3′。GAPDH引物为上游:5′-GGTGAAGGTCGGTGTGAACG-3′,下游:5′-CTCGCTCCTGGAAGATGGTG-3′。按反转录试剂盒说明书加入相应试剂反转录成cDNA,以cDNA为模板进行qRT-PCR。荧光PCR反应条件为: 95℃预变性2 min,95℃变性10 s、59℃退火30 s,72℃延长30 s,扩增40个循环。待反应结束后,结合扩增曲线及熔解曲线分析,选择符合要求的qRT-PCR原始数据,用内参基因GAPDH 校正,结果用2-△△CT法分析。
1.4 Western blot检测FABP4蛋白表达 收集实验各组滋养细胞,提取总蛋白并定量;取30 μg总蛋白,8%分离胶和4%浓缩胶进行聚丙烯酰胺凝胶电泳;然后,将蛋白质电转移至孔径0.45 μm硝酸纤维素薄膜;取出含目的蛋白的膜,用含5%脱脂奶粉的PBST 封闭1 h;加入一抗(免抗FABP4,1 ∶1 000;鼠抗β-actin,1 ∶1 000),4℃过夜;PBST 洗涤10 min,3次;再加入HRP 标记的羊抗兔或鼠二抗(均1 ∶5 000),摇床孵育2 h;PBST 洗涤10 min,3次;用SuperSignal West Pico 化学发光底物显影,胶片定影。图片用Image-Pro Plus 6.0软件进行光密度值分析,以β-actin为内参对照。
1.5 腺病毒转染 委托上海汉恒生物公司构建FABP4腺病毒过表达载体,感染前选择生长状态较好的HTR-8细胞进行培养,吸去旧的培养液,PBS洗1遍,然后加入调整好滴度的腺病毒液,病毒感染2 h后,将培养液倒掉,加入新培养液3 mL,继续培养,病毒感染48 h后,荧光倒置显微镜下观察Ad-FABP4组绿色荧光,检测是否转染成功。
1.6 ELISA检测炎症因子的表达 设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样品孔中加待测样品10 μL,再加稀释液40 μL;除空白孔外,标准品孔和样品孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,封板膜封闭,37℃水浴锅或恒温箱温育60 min;弃去液体,吸水纸上拍干,每孔加满洗涤液静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次;每孔加底物A、B各50 μL,37℃避光孵育15 min;每孔加入终止液50 μL,15 min内,450 nm波长处测定各孔的OD值。
2 结果
2.1 胎盘滋养细胞免疫炎症因子IL-6、TNF-α的表达 与对照组比较,各组炎症因子IL-6表达量随着L-NAME剂量增大而逐渐增加(Fig 1A),差异具有显著性(P<0.05);而TNF-α表达量则从100 μmol·L-1L-NAME干预组开始,随着剂量增大呈逐渐降低的趋势(Fig 1B),差异具有显著性(P<0.05)。结果提示,IL-6、TNF-α可能参与HDCP的发生过程。

Fig 1 Expression of immune inflammation factor IL-6 and TNF-α in placental trophoblast cells
A: ELISA method was used to detect the IL-6 expression level; B: TNF-α expression was detected by ELISA method.*P<0.05vscontrol
2.2 胎盘滋养细胞中FABP4表达 不同浓度L-NAME干预滋养细胞48 h后,qRT-PCR以及Western blot检测各组细胞FABP4的mRNA、蛋白表达。Fig 2A结果显示,100 μmol·L-1L-NAME组中FABP4 mRNA相对表达量较对照组升高了2.5倍,差异具有显著性(P<0.01)。Fig 2B蛋白表达趋势与FABP4 mRNA表达趋势相一致,100 μmol·L-1L-NAME组中FABP4蛋白表达水平是对照组的2.6倍,差异具有显著性(P<0.05)。
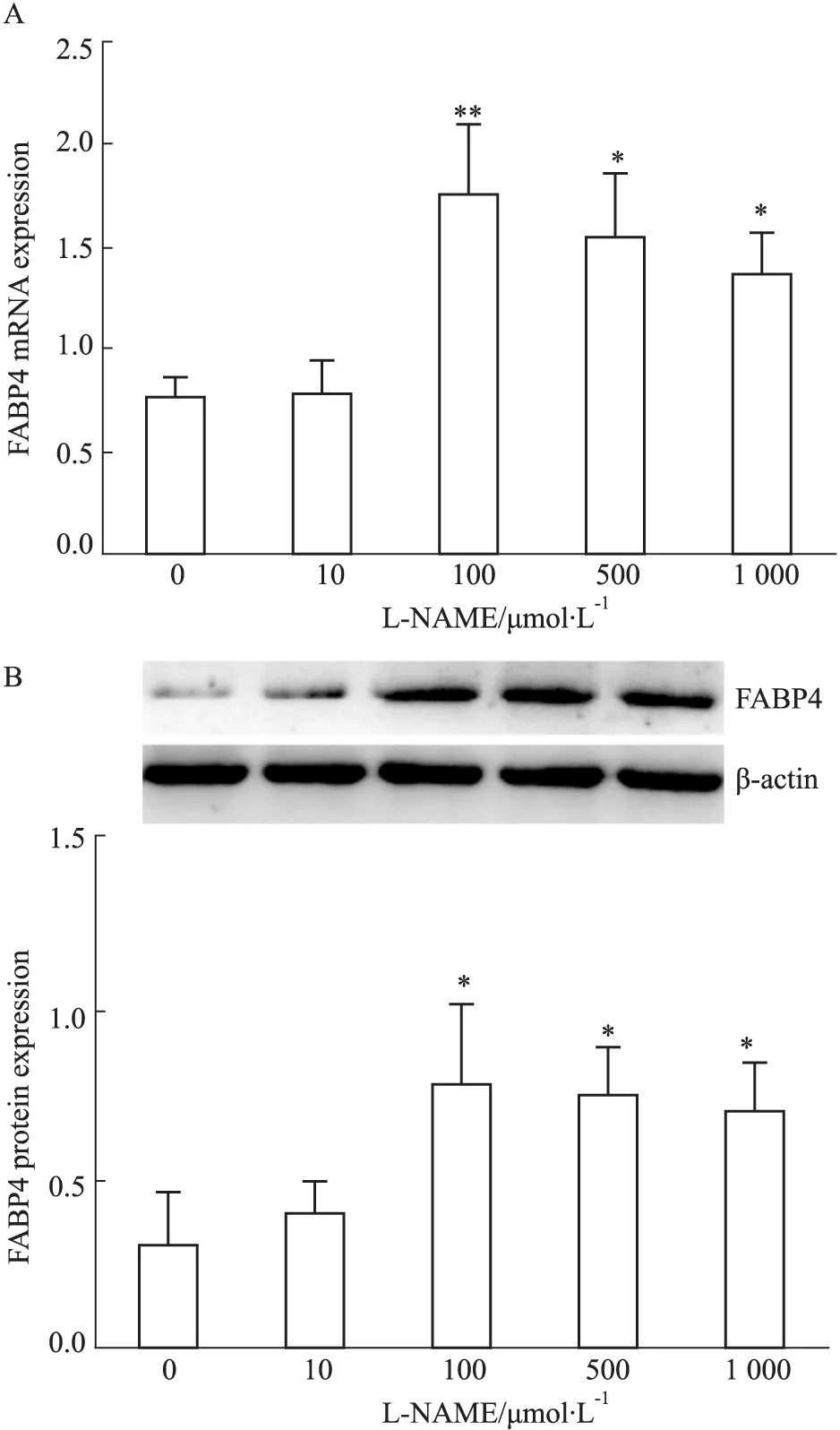
Fig 2 Expression of FABP4 in placental trophoblast cells
A: qRT-PCR detected the mRNA expression of FABP4; B:Western blot was used to detect the protein expression level of FABP4.*P<0.05,**P<0.01vscontrol
2.3 Ad-FABP4对滋养细胞炎症因子IL-6、TNF-α表达的影响 为进一步探讨FABP4在L-NAME对滋养细胞免疫炎症因子表达的影响,将FABP4重组包装的腺病毒感染HTR-8细胞48 h,荧光显微镜观察,结果如Fig 3A所示,对照组中无荧光,空质粒组和重组质粒组细胞中可见绿色荧光。100 μmol·L-1L-NAME干预转染慢病毒滋养细胞组48 h后,qRT-PCR以及Western blot检测各组细胞FABP4的mRNA、蛋白表达。结果显示,Ad-FABP4组比空质粒组FABP4 mRNA升高了5.7倍,差异具有显著性(P<0.01)。100 μmol·L-1L-NAME干预转染慢病毒组较Ad-FABP4组、100 μmol·L-1L-NAME组FABP4 mRNA各升高1.3倍、3.2倍(Fig 3B),差异具有显著性(P<0.01)。FABP4蛋白水平与FABP4 mRNA水平变化一致(Fig 3C)。为明确FABP4对妊娠高血压胎盘滋养细胞炎症因子表达的影响,ELISA法检测各组细胞培养基上清中的炎症因子IL-6、TNF-α表达。结果显示,与FABP4表达趋势相同(Fig 3D、3E),差异具有显著性(P<0.05)。提示FABP4在滋养细胞免疫炎症中起了重要作用。
3 讨论
胎盘是母体与胎儿间进行物质交换的器官,具有复杂的生理功能,其中胎盘滋养细胞是妊娠得以建立和维持的基础,占妊娠胎盘的主要部分[6]。研究表明胎盘滋养细胞功能异常与HDCP 密切相关,同时研究发现,HDCP患者血浆NO较正常孕妇明显下降,其下降的程度与病情严重程度呈正比,提示妊娠期间NO分泌不足可能是HDCP的重要致病因素之一[7]。适量的NO水平是保证子宫胎盘循环低阻、低压、高流量的关键,这是机体对正常妊娠的保护性机制。L-NAME是一氧化氮合酶抑制剂,可以抑制NO的产生[8],进而导致胎盘螺旋小动脉痉挛引起HDCP。因此,本实验利用L-NAME干预胎盘滋养细胞抑制NO的合成来模拟HDCP微环境,这将有利于阐明HDCP的发病机制,为临床防治HDCP提供实验资料。
免疫炎症反应是T淋巴细胞、B淋巴细胞、巨噬细胞、树突细胞和肥大细胞的浸润导致的炎症过程,也是众多免疫炎性反应的共同致病途径。免疫细胞产生和分泌的一系列信号蛋白,如炎症因子IL-6、TNF-α等,可以调节炎症、免疫、造血系统等一系列生理活动[9]。IL-6 可通过体液和细胞免疫功能影响炎症、宿主防御和组织损伤,是炎症免疫反应的重要介质。TNF-α是一种对多种细胞的生长分化和功能具有抑制或刺激多重效应的细胞因子,其主要生物学活性为引起炎症反应和抗肿瘤效应。本实验结果显示,炎症因子IL-6表达量随着L-NAME剂量增大而呈剂量依赖性;而在L-NAME干预下,TNF-α表达量增加,差异有显著性。由于L-NAME是一氧化氮合酶抑制剂,可以改变胎盘滋养细胞NO的含量引起HDCP,而HDCP胎盘血流量下降,胎儿氧和营养物质的供应减少,使得胎儿处于急慢性缺氧状态,可能有大量的炎性因子分泌,从而引起免疫炎症[10],IL-6、TNF-α表达增加。

Fig 3 Influence of Ad-FABP4 on expression of inflammatory cytokines IL-6 and TNF-α in placental trophoblast cells
A: The placental trophoblast cell transfected Ad-FABP4 lentivirus was observed under the fluorescence microscope(×40); B: qRT-PCR determined the mRNA expression of FABP4 after transfected Ad-FABP4 lentivirus; C: Western blot detected the protein expression level of FABP4 in the same condition; D, E: With overexpressed the FABP4, ELISA method was used to detect the IL-6, TNF-α expression in medium.*P<0.05vscontrol;#P<0.05,##P<0.01vsAd-GFP group;△P<0.05vsAd-FABP4 group.
FABP4是近年新发现的细胞质基质蛋白家族中的一员,因最早在成熟脂肪细胞被发现,故又称脂肪型脂肪酸结合蛋白。脂肪酸结合蛋白家族包括9种高度保守的细胞质基质蛋白[11],可逆性地与各种疏水性配体相结合。FABP4能够调节脂肪细胞分化及糖脂代谢、调节巨噬细胞的胆固醇积聚、促进细胞的生长和分化、介导炎症反应等[12]。本研究体外培养HTR-8,分别加入0、10、100、500、1 000 μmol·L-1L-NAME,孵育48 h后,检测FABP4表达变化,发现随着L-NAME浓度增大,FABP4表达增加。为进一步明确FABP4在其中的作用,我们使用FABP4腺病毒过表达载体感染滋养细胞后发现,炎症因子IL-6、TNF-α的表达也进一步增加,这提示FABP4可以促进滋养细胞免疫炎症发生。目前认为在脂肪组织中免疫细胞的积累,特别是巨噬细胞的积累对于脂肪组织的炎症反应十分重要[13]。采用巨噬细胞系和脂肪细胞系共培养发现,脂肪细胞中FABP4的缺失将导致巨噬细胞炎性因子的表达减少[14],这进一步佐证了FABP4在免疫炎症中的作用。
本实验证实了FABP4在胎盘滋养细胞免疫炎症中有重要作用,FABP4水平异常对于预测HDCP的发生、发展有重要意义。
(致谢:本实验在宁夏医科大学基础医学院心脑血管重点实验室完成,感谢各位老师和同学们对本课题的大力支持和指导!)
[1] 苟文丽. 妊娠高血压疾病,妇产科学[M].8版.北京:人民卫生出版社,2013:64-73.
[1] Gou W L. Hypertensive disorder complicating pregnancy,Obstetrics and Gynaecology[M].8 edition.Beijing: People's Medical Publishing House,2013:64-73.
[2] Rusterholz C,Hahn S,Holzgreve W.Role of placentally produced inflammatory and regulatory cytokines in pregnancy and the etiology of preeclampsia[J].SeminImmunopathol,2007, 29(2): 151-62.
[3] Conrad K P, Miles T M, Benyo D F. Circulating levels of immunoreactive cytokines in women with preeclampsia[J].AmJReprodImmunol, 1998, 40(2):102-11.
[4] Scifres C M, Chen B, Nelson D M, et al. Fatty acid binding protein 4 regulates intracellular lipid accumulation in human trophoblasts [J].ClinEndocrinolMetab, 2011, 96(7):E1083-91.
[5] Elmasri H, Ghelfi E, Yu C W, et al. Endothelial cell-fatty acid binding protein 4 promotes angiogenesis: role of stem cell factor/c-kit pathway [J].Angiogenesis, 2012, 15(3): 457-68.
[6] Spencer-Jones J.Make every mother and child count[J].SAfrMedJ, 2005, 95(6) :382-4.
[7] 郭 丽,其木格.妊娠期高血压疾病的病因学研究进展[J].内蒙古医学杂志,2008,40(5): 571-4.
[7] Guo L ,Qi M G. Progress of study on etiology of hypertensive disorder complicating pregnancy[J].InnerMongoliaMedJ, 2008, 40(5):571-4.
[8] 王艳华,张慧萍,姜怡邓,等.NO水平下降通过氧化应激引起人胎盘滋养细胞凋亡[J]. 中国药理学通报, 2014, 30(9):1287-92.
[8] Wang Y H ,Zhang H P,Jiang Y D, et al. The levels of NO decrease induced apoptosis in human placental trophoblast cells through oxidative stress[J].ChinPharmacolBull, 2014,30(9):1287-92.
[9] 张惠芳,方莲花,杜冠华,等.免疫炎症反应在肺动脉高压中作用的研究进展[J].中国药理学通报, 2015, 31(11):1481-4.
[9] Zhang H F, Fang L H, Du G H, et al. Research progress on role of immuno-inflammatory response in pulmonary artery hypertension[J].ChinPharmacolBull, 2015, 31(11):1481-4.
[10] Sakawi Y, Tarpey M, Chen Y F, et al. Evaluation of low-dose endotoxin administration during pregnancy as a model of preeclampsia[J].Anesthesiology, 2000, 93(6): 1446-55.
[11] Jiang M, Zhang L, Ma X, et al. Tamoxifen inhibits macrophage FABP4 expression through the combined effects of the GR and PPAR gamma pathways[J].BiochemJ, 2013, 454(3):467-77.
[12] Yang A N, Zhang H P, Jiang Y D. et al. Modulation of FABP4 hypomethylation by DNMT1 and its inverse interaction with miR-148a/152 in the placenta of preeclamptic rats and HTR-8 cells [J].Placenta, 2016, 46:49-62.
[13] Furuhashi M,Fucho R,Gorgün C Z,et al.Adipocyte/macrophage fatty acid-binding proteins contribute to metabolic deterioration through actions in both macrophages and adipocytes in mice[J].JClinInvest,2008, 118(7) : 2640-50.
[14] Xu Y, Lyengar S, Roberts R L, et al. Primary culture model of peroxisome proliferators-activated receptor gamma activity in prostate cancer cells[J].JCellPhysiol,2003, 196(1) : 131-43.
Effect of FABP4 on placental trophoblastic immune inflammatory response in patients of hypertensive disorder complicating pregnancy
MAO Cai-yan2, ZHANG Hui3, LI Xu-sheng1, YANG Song-hao2, DENG Mei2, DING Ning2, WU Kai2, YANG Xiao-ling2, ZHANG Hui-ping1, JIANG Yi-deng2
(1.GeneralHospital, 2.DeptofPreclinicalMedicineCollege, 3.CollegeofClinicalMedicine,NingxiaMedicalUniversity,Yinchuan750004,China)
Aim To investigate the role of fatty acid binding protein 4 (FABP4) in placental trophoblastic immune response in patients with hypertensive disorder complicating pregnancy. Methods The human placental trophoblast cell line (HTR-8) was culturedinvitroand incubated with L-NAME for 0, 10, 100, 500 and 1 000 μmol·L-1for 48 h. The levels of IL-6 and TNF-α were analysed by ELISA. The mRNA and protein expression levels of FABP4 were detected by Western blot and qRT-PCR. The cells transfected FABP4 adenovirus expression vector were intervented with 100 μmol·L-1L-NAME. Then, the levels of IL-6 and TNF-α were determined by ELISA. Results Com-pared with the control group, the expression levels of IL-6, TNF-α and FABP4 were significantly increased in the intervention group (P<0.01). Meanwhile, the expression levels of IL-6 and TNF-α were significantly increased in the overexpressed FABP4 group, compared with the control group (P<0.01). Conclusion FABP4 is involved in regulating the trophoblastic immune-inflammatory response in patients of hypertensive disorder complicating pregnancy.
fatty acid binding protein 4; hypertensive disorder of pregnancy; trophoblast; IL-6; TNF-α; N-nitro-L-arginine methylester
2017-04-14,
2017-05-14
国家自然科学基金资助项目(No 81570452,81660258);宁夏高等学校科学研究项目(No NGY2016129,NGY2016086)
毛彩艳(1989-),女,硕士生,研究方向:心血管病理生理学,E-mail:996106124@qq.com; 张慧萍(1975-),女,主任医师,硕士生导师,研究方向:围生医学,通讯作者,Tel:0951-6980046,E-mail :zhp19760820@163.com; 姜怡邓(1974-),男,博士,教授,博士生导师,研究方向:心血管病理生理学,通讯作者,Tel:0951-6980998,E-mail: jwcjyd@163.com
时间:2017-7-7 11:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.034.html
10.3969/j.issn.1001-1978.2017.08.017
A
1001-1978(2017)08-1126-06
R321.4;R392.12;R544.1;R714.252;R714.56;R977.6