粗壮女贞总苷降脂作用及其基于AMPK通路的降脂作用机制研究
孙 乐,贺震旦,杨润梅,高南南,许利嘉,金 文
(1.中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室,北京 100193;2. 深圳大学医学院药学系,广东 深圳 518060)
粗壮女贞总苷降脂作用及其基于AMPK通路的降脂作用机制研究
孙 乐1,贺震旦2,杨润梅1,高南南1,许利嘉1,金 文1
(1.中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室,北京 100193;2. 深圳大学医学院药学系,广东 深圳 518060)
目的 探讨粗壮女贞总苷(total phenylpropanoid glycoside from CN, CNTG)降脂作用及其基于AMPK通路的降脂作用机制。方法 Syrian金黄地鼠随机分为正常组、高脂模型组、阳性药非诺贝特组及CNTG高、中、低剂量组。除正常组外,其余各组地鼠应用高脂饲料诱导建立混合型高脂血症模型。造模1周后取血,检测血清 TC、TG、LDL-C、HDL-C含量,确定模型形成。之后连续给药4周,在给药2周、3周及4周后分别取血,检测血清中TC、TG、LDL-C和HDL-C的含量。在给药4周后剖取肝脏,进行肝脏TG、TC含量测定和肝脏病理学检测。并应用实时定量PCR检测CNTG对肝脏中AMPK、CD36、CPT1、ACC的mRNA表达的影响;用Western blot法检测AMPK和其上游调控蛋白LKB1的磷酸化蛋白和总蛋白水平,并检测HMG-CoA还原酶的蛋白表达量。结果 给药2周、3周、4周后,与模型组相比,CNTG高剂量组血清中的TC、TG、LDL-C含量均明显降低(P<0.05,P<0.01);肝脏中TC、TG含量明显降低(P<0.01);并可明显减轻肝细胞病变。实时定量PCR结果显示,与模型组相比,CNTG可以明显升高AMPK的相对表达量(P<0.01),但CD36、ACC和CPT1的相对表达量无明显变化。Western blot结果显示,与模型组相比,CNTG高剂量组肝脏中的LKB1、phospho-LKB1及phospho-AMPKα的相对表达量均提高(P<0.05),差异具有显著性。结论 CNTG能有效降低高脂血症金黄地鼠的血脂和肝脂水平,其机制可能是CNTG促进肝脏中LKB1磷酸化以激活AMPK,从而调控机体脂质代谢。
粗壮女贞总苷;高脂血症;降脂; AMPK;LKB1;磷酸化
随着经济的迅猛发展和人们生活方式的改变,心脑血管疾病已成为影响身体健康的头号杀手。2015年卫计委公布的《中国心血管病报告》显示,2014年中国心血管疾病死亡率居首位,超过肿瘤成为对人们健康最具威胁性的病种[1]。大量研究资料表明,高脂血症是脑卒中、冠心病、心肌梗死、心脏猝死等心脑血管疾病独立而重要的危险因素,因此降低血脂、改善血脂异常的临床治疗是降低心脑血管病发生率和死亡率的至关重要的措施[2]。近年来,从天然产物中寻找具有降血脂潜能的新化合物已经成为研究的热点。粗壮女贞[Ligustrumrobustum(Roxb.) Blume,CN]是我国西南地区苦丁茶的主要基源植物之一,在我国拥有悠久的饮用历史,以茶剂的形式广泛用于高血压、高血脂和肥胖人群。粗壮女贞总苷(total phenylpropanoid glycoside from CN, CNTG)是从粗壮女贞老叶中提取制备的以阿克苷为主要成分的水溶性苯丙素苷类成分,课题组前期研究发现CNTG对高脂饮食诱导的C57BL/6J肥胖小鼠有明显的减肥降脂作用,其机制可能与CNTG上调瘦素基因有关[3]。但目前对于CNTG降血脂的机制研究报道较少,因此本实验应用较好模拟人类高脂血症发病过程的金黄地鼠高脂血症模型,在科学评价CNTG降脂作用的基础上,深入探讨其基于腺苷酸(AMP)活化的蛋白激酶(AMP-activated protein kinase,AMPK)信号通路的降脂作用机制,为其治疗高脂血症的作用特点和优势提供科学的实验数据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Syrian金黄地鼠,♂,6~8周龄,体质量90~110 g,购自北京维通利华实验动物中心,许可证号: SCXK(京)2012-0001。金黄地鼠常规饲料和高脂饲料,均由北京华阜康生物科技股份有限公司提供,生产许可证:SCXK(京)2014-0008。常规饲料可以满足金黄地鼠所有的营养需求。金黄地鼠在SPF级环境中饲养[许可证号SYXK(京)2013-0023],温度(22.0±2.0)℃,湿度50%~70%,10只/笼,12 h昼夜交替,定量给予常规饲料或高脂饲料,自由饮水。
1.1.2 药物与试剂 CNTG是从苦丁茶基源植物粗壮女贞的干燥树叶中提取的水溶性总苯丙素苷,由深圳大学贺震旦教授课题组制备提供。非诺贝特胶囊由法国利博福尼制药公司生产,批号23378。血清总胆固醇(total cholesterol, TC)批号141281、甘油三酯 (triglyceride, TG)批号150821、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)批号150781、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)批号150691、肝脏TC批号151841、肝脏TG批号157201,以上测定试剂盒均购自中生北控生物科技股份有限公司。反转录试剂盒PrimeScript RT Reagent Kit、实时定量PCR试剂盒SYBR PrimeScript Ex TaqⅡ,均购自TaKaRa宝生物工程有限公司。组织总蛋白抽提试剂盒、BCA法蛋白定量试剂盒、ECL高灵敏度化学发光试剂盒,均购自北京康为世纪生物科技有限公司。磷酸化腺苷酸AMP活化的蛋白激酶α(phospho-AMP-activated protein kinase α,phospho-AMPKα)抗体、AMPKα抗体、肝激酶B1(liver kinase B1,LKB1)抗体、磷酸化肝激酶B1(phospho-liver kinase B1,phospho-LKB1)抗体、β-肌动蛋白(β-actin)抗体均购自美国Cell Signaling Technology公司;羟甲基戊二酸单酰辅酶A(hydroxy methylglutaryl coenzyme A,HMG-CoA)还原酶抗体购自美国ABclonal公司。山羊抗鼠IgG、山羊抗兔IgG均购自北京康为世纪生物科技有限公司。
1.1.3 仪器 贝克曼AU480全自动生化分析系统;美国FLUKO F6/10超细匀浆器;美国Bio-TEK微孔板扫描分光光度计(MQX200);上海安亭TGL-16G型台式高速离心机;CFX96荧光定量PCR仪、Chemi Doc凝胶成像系统、电泳仪、半干转印系统,均为美国Bio-Rad公司产品。
1.2 方法
1.2.1 动物及处理 60只Syrian金黄地鼠适应性饲养1周。第2周起,根据体质量随机分为6组:正常对照组、模型组、阳性对照组(非诺贝特fenofibrate, 150 mg·kg-1)、CNTG低剂量(300 mg·kg-1)、中剂量(600 mg·kg-1)和高剂量组(1 200 mg·kg-1),每组10只。正常对照组喂饲基础饲料,其他各组喂饲高脂饲料。1周后,测定各组金黄地鼠的血脂水平(TC、TG、LDL-C、HDL-C),确定模型成立。各造模组根据血脂结果进行组间调整,使模型组和各给药组地鼠血脂水平无组间差异。阳性药对照组和实验组各组分别灌胃一定剂量的非诺贝特和相应剂量的CNTG(10 mL·kg-1),连续给药4周。正常对照组和模型组分别灌胃等体积的蒸馏水。每周测体重。末次給药后禁食不禁水12 h,麻醉眼眶取血,分离血清(15 min, 3 500 r·min-1, 4℃),测定生化指标(TC、TG、LDL-C、HDL-C);取部分肝脏组织制备肝匀浆,测定肝脏脂质(TC、TG)含量;另取部分肝脏组织以10%甲醛固定,供病理学检测。将余下的肝脏组织迅速投入液氮中,保存于-80℃冰箱,待测。
1.2.2 实时定量PCR 取金黄地鼠正常组、模型组和CNTG高剂量组的肝脏组织样品,用TRIzol法提取总RNA,用Nano Drop测定总RNA的浓度和纯度。反转录按照试剂盒Prime Script RT Reagent Kit说明设置20 μL反应体系:4 μL 5×Prime Script buffer,1 μL Prime Script RT Enzyme Mix,50 pmol Oligo dT Primer,100 pmol Random 6 mers,1 000 ng 总RNA,11.5 μL RNase Free dH2O。反转录流程为:37 ℃反应15 min,85 ℃灭活5 s,所得产物保存于-20 ℃备用。实时定量PCR参照试剂盒SYBR Prime Script Ex TaqⅡ说明设置20 μL反应体系:10 μL SYBR Prime Script Ex TaqⅡ,1.2 μL目的基因引物,2 μL cDNA模板,加入灭菌蒸馏水至20 μL。PCR反应条件如下:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。以β-actin为内参,使用REST 2009软件计算各目的基因的相对表达量,检测的目的基因及引物序列见Tab 1[4-7]。

Tab1 Primer sequences for target genes
1.2.3 Western blot法检测肝脏中蛋白的表达 称取(0.10±0.02) g肝脏组织,加入1 mL组织蛋白抽提液,10 000 r·min-1匀浆处理;冰上孵育20 min,10 000×g离心20 min,收集上清;按照试剂盒说明书,利用BCA法测定蛋白质浓度。将50 μg蛋白样品于10%的SDS-PAGE电泳,电转至PVDF膜。PVDF膜放入5%的脱脂牛奶中,于室温摇床封闭2 h。分别加入一抗phospho-AMPKα(1 ∶1 000)、AMPKα(1 ∶1 000)、phospho-LKB1(1 ∶1 000)、LKB1(1 ∶1 000)、HMG-CoA还原酶(1 ∶1 000)、β-actin(1 ∶4 000)4 ℃过夜。TBST洗3次,辣根过氧化酶HRP标记的二抗孵育,室温1 h,TBST洗3次。采用ECL试剂盒进行显色反应,并利用Bio-Rad图像分析软件进行分析。
2 结果
2.1 金黄地鼠体质量 高脂饲料诱导期间,各组金黄地鼠活动正常。给药期间,与正常组相比,模型组体重明显升高。给药2周、3周、4周后,与模型组相比,阳性组和CNTG高剂量组体重明显降低。给药期间各组金黄地鼠体重见Tab 2。
2.2 CNTG对高脂血症金黄地鼠血脂的影响
2.2.1 给药前金黄地鼠血脂水平变化 1周后,各造模组地鼠与正常对照组比较, 血清TC、TG、LDL-C均明显升高(P<0.01),差异有显著性,表明高脂血症金黄地鼠模型成功。见Tab 3。
2.2.2 给药2周后金黄地鼠血脂水平变化 给药2周后,与正常组相比,模型组金黄地鼠血清中TC、TG、LDL-C均明显升高,差异有显著性。与模型组相比,CNTG高剂量可明显降低高脂诱导的金黄地鼠血清中TC、TG、LDL-C的含量(P<0.05,P<0.01)。见Tab 4。
2.2.3 给药3周金黄地鼠血脂水平变化 给药3周后,与正常组相比,模型组金黄地鼠血清中TC、TG、LDL-C均持续明显升高,差异有显著性。与模型组相比,CNTG高剂量可以明显降低TC、TG和LDL-C(P<0.01),但CNTG低、中剂量组对模型组TC、TG和LDL-C的含量没有明显影响。见Tab 5。
2.2.4 给药4周金黄地鼠血脂水平变化 给药4周后,与正常组相比,模型组金黄地鼠血清中TC、TG、LDL-C均持续明显升高,差异有显著性。与模型组相比,CNTG高剂量可以明显降低LDL-C、TC(P<0.05)和TG(P<0.01),但CNTG低、中剂量组对模型组TC、TG和LDL-C的含量没有明显影响。见Tab 6。
2.3 各组金黄地鼠肝脂水平 实验结束时,模型组金黄地鼠与正常对照组比较,肝脏中TC、TG均明显升高,差异有显著性(P<0.01)。给药4周后,CNTG对模型金黄地鼠肝脏TC和TG有明显降低作用,差异有显著性,见Tab 7。
Tab 2 Body weight of Syrian hamster(±s,n=10,g)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
Tab 3 Serum lipid level of hamsters before administration of CNTG(±s,n=10)
**P<0.01vscontrol
Tab 4 Effect of CNTG on serum lipid level of hamsters in the 2nd week(±s,n=10)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
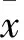
Tab 5 Effect of CNTG on serum lipid level of hamsters in the 3rd week(±s,n=10)
**P<0.01vscontrol;##P<0.01vsmodel
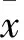
Tab 6 Effect of CNTG on serum lipid level of hamsters in the 4th week(±s,n=10)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
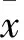
Tab 7 Effect of CNTG on hepatic triglyceride(TG),total cholesterol(TC) concentrations in hyperlipidemic hamsters(±s,n=10)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
2.4 各组金黄地鼠肝脏病理检测结果 实验结束时,正常组肝脏未见明显病理改变。模型组肝脏出现9例(9/10)肝细胞肿胀,5例中度病变,4例轻度病变;1例(1/10)少量纤维组织增生。给药4周后,阳性药和CNTG对高血脂金黄地鼠肝细胞病变具有明显的减轻效果。CNTG低剂量组出现9例(9/10)肝细胞肿胀,1例中度病变,8例轻度病变;1例(1/10)卵圆细胞增生;1例(1/10)灶性肝细胞坏死伴炎细胞浸润。CNTG中剂量组:7例(7/10)肝细胞肿胀,3例中度病变,4例轻度病变;2例(2/10)卵圆细胞增生;1例(1/10)小灶性炎细胞浸润。CNTG高剂量组出现6例(6/10)肝细胞肿胀,均为轻度病变;1例(1/10)多灶性炎细胞浸润。见Fig 1。
2.5 CNTG对金黄地鼠肝脏AMPK、ACC、CD36 和CPT1 mRNA表达的影响 实时定量PCR结果如Fig 2所示,与正常组和模型组相比,CNTG高剂量组AMPK的mRNA相对表达量明显升高(P<0.01);与正常组相比,模型组乙酰辅酶A羧化酶(acetyl-CoA carboxylase 1, ACC)的mRNA相对表达量明显升高,差异具有统计学意义(P<0.05)。而CD36和肉毒碱棕榈酰转移酶1(carnitine palmitoyl transterase-1, CPT1)的mRNA相对表达量在各组别中无明显差异。
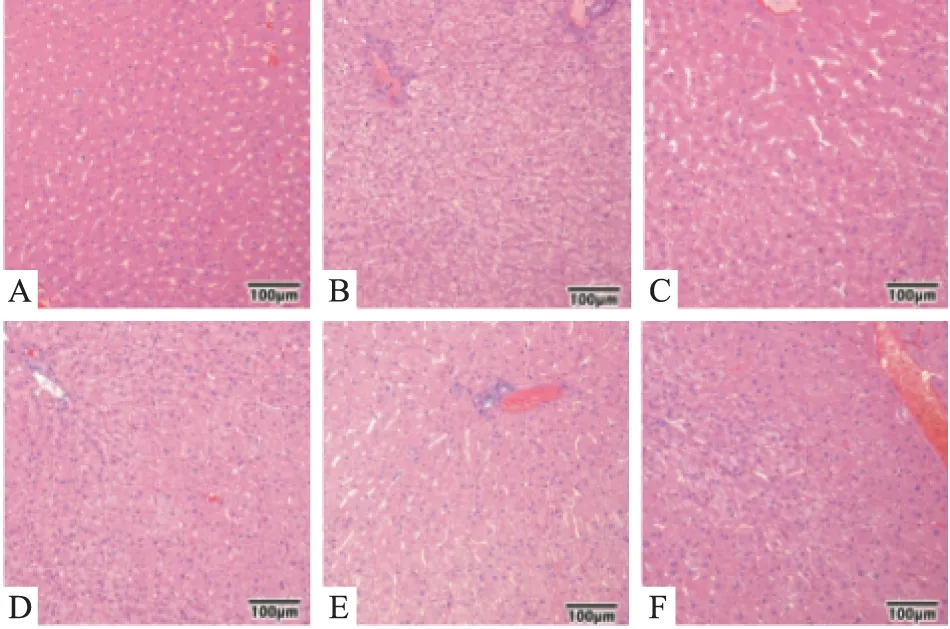
Fig 1 Representative photomicrographs of histopathological studies of livers stained with haematoxylin and eosin(HE,×100)
A: Control; B: Model; C: Fenofibrate; D: CNTG 300 mg·kg-1; E: CNTG 600 mg·kg-1; F: CNTG 1 200 mg·kg-1
2.6 CNTG对金黄地鼠肝脏AMPKα、LKB1和HMG-CoA还原酶表达水平的影响 Western blot检测金黄地鼠肝脏中AMPKα、phospho-AMPKα、LKB1、phospho-LKB1和HMG-CoA还原酶(HMG-CoAR)蛋白表达水平。利用Image-J对条带进行分析,将灰度值量化,以内参β-actin校正后得到各目的蛋白表达的相对值。如Fig 3所示,与模型组相比,CNTG高剂量组的phospho-AMPKα、LKB1和 phospho-LKB1的相对表达量明显升高(P<0.05);与正常组相比,模型组HMG-CoAR的相对表达量明显升高(P<0.01);AMPKα的相对表达量没有明显变化。
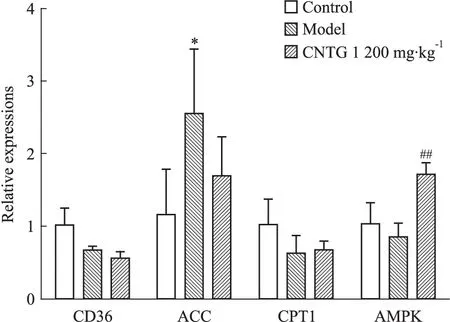
Fig 2 Effects of CNTG on the hepatic CD36, ACC,CPT1, AMPK mRNA expressions in hamsters(±s, n=10)
*P<0.05vscontrol;##P<0.01vsmodel

Fig 3 Effects of CNTG on hepatic AMPKα,phospho-AMPKα,LKB1, phospho-LKB1 and HMG-CoAR protein levels in hamsters(±s,n=10)
**P<0.01vscontrol;#P<0.05vsmodel
3 讨论
在本研究中,我们应用金黄地鼠高脂血症模型评价了CNTG的降脂活性,并探讨了其基于AMPK信号通路的降脂作用机制。金黄地鼠具有和人类相似的血浆脂蛋白构成,能够很好地模拟人类高脂血症的发病过程和机制[8-9]。经过高脂饲料诱导后,金黄地鼠的血清TC、TG、LDL-C水平明显升高,肝细胞肿胀病变,形成了具有典型高脂血症特征的混合型高脂血症模型。CNTG连续给药2~4周可明显降低高脂血症金黄地鼠血脂(TG、TC、LDL-C)水平,给药4周后还可明显降低肝脂(TG、TC)水平,并减轻地鼠肝细胞病变,进一步机制研究发现CNTG可激活金黄地鼠肝脏AMPKα和LKB1的表达。
AMPK是一种在真核细胞中高度保守的丝氨酸/苏氨酸蛋白激酶,能够调节机体的能量代谢,维持能量的平衡,与糖尿病、高脂血症、肥胖等多种由能量代谢异常引起的疾病相关。不同物种的AMPK蛋白都是一种异源三聚体复合物,包括1个α催化亚基,1个β调节亚基和1个γ调节亚基[10]。AMPK的激活机制多样,上游激酶对AMPKα亚基活化环上Thr172进行磷酸化、AMP/ATP或ADP/ATP比值升高以及运动肌肉收缩等生理刺激均可以激活AMPK。在肝脏中最主要的磷酸化激活AMPK信号通路是LKB1-AMPK通路[11]。LKB1通过促进AMPK α亚基上Thr172位点的磷酸化,增强AMPK的磷酸化水平,从而激活AMPK[12]。本研究发现,与模型组相比,高剂量CNTG上调了金黄地鼠肝脏AMPK的mRNA表达水平,以及肝脏LKB1、phospho-LKB1和 phospho-AMPKα的蛋白表达水平。表明CNTG通过LKB1-AMPK通路促进AMPK的磷酸化。
AMPK磷酸化后通过多条信号通路对机体脂质代谢发挥着重要的调控作用,主要包括:通过促进CD36和LPL的转运,增加脂肪酸摄入;通过磷酸化抑制ACC1,抑制脂肪酸的合成,同时磷酸化抑制固醇调节元件结合蛋白-1c(sterol regulation element binding protein-1c,SREBP-1c),在转录水平抑制脂肪酸和TG合成相关酶的表达;磷酸化抑制HMG-CoA还原酶,进而抑制胆固醇的合成;通过抑制ACC2,使CPT1活化,从而促进脂肪酸进入线粒体进行β氧化等[13-14]。前期研究已发现,CNTG能通过磷酸化作用抑制SREBP-1c的活性,在转录水平抑制其下游的脂肪酸和TG合成酶的表达。而本研究结果显示,CNTG对金黄地鼠肝脏CD36、ACC、CPT1以及HMG-CoA 还原酶的表达量都无明显调节作用,表明CNTG激活AMPK后并不能通过AMPK-CD36、AMPK-ACC、AMPK-HMG-CoA还原酶通路对肝脏脂肪酸摄入、氧化以及胆固醇合成等产生影响。
综上所述,CNTG能有效降低高脂血症金黄地鼠的血脂和肝脂水平,并能明显改善地鼠肝脏病变。机制研究表明,CNTG能促进地鼠肝脏中LKB1磷酸化从而激活AMPK,而对下游的AMPK-CD36、AMPK-ACC、AMPK-HMG-CoA还原酶通路无明显影响。本研究阐明了CNTG磷酸化AMPK的机制,以及其基于AMPK信号通路的降脂作用机制,为其深度开发和充分利用提供了科学的实验数据。
(致谢:本实验在中国医学科学院药用植物研究所中草药物质基础与资源利用教育部重点实验室完成,感谢实验室老师和同学们给予的帮助和指导!)
[1] 隋 辉,陈伟伟,王 文. 《中国心血管病报告2015》要点解读[J].中国心血管杂志, 2016,21(4):259-61.
[1] Sui H, Chen W W, Wang W. Interpretation of report on cardiovascular diseases in China(2015)[J].ChinJCardiovascMed, 2016, 21(4): 259-61.
[2] Zoungas S, Curtis A J, McNeil J J, et al. Treatment of dyslipidemia and cardiovascular outcomes: the journey so far-is this the end for statins[J]?ClinPharmacolTher, 2014, 96(2): 192-205.
[3] Yang R M, Liu F, He Z D, et al. Anti-obesity effect of total phenylpropanoid glycosides fromLigustrumrobustumBlume in fatty diet-fed mice via up-regulating leptin[J].JEthnopharmacol, 2015, 169: 459-65.
[4] Qin B, Dawson H, Anderson R A. Elevation of tumor necrosis factor-alpha induces the overproduction of postprandial intestinal apolipoprotein B48-containing very low-density lipoprotein particles: evidence for related gene expression of inflammatory, insulin and lipoprotein signaling in enterocytes[J].ExpBiolMed(Maywood), 2010, 235(2): 199-205.
[5] Zabala A, Churruca I, Fernández-Quintela A, et al. Trans-10, cis-12 conjugated linoleic acid inhibits lipoprotein lipase but increases the activity of lipogenic enzymes in adipose tissue from hamsters fed an atherogenic diet[J].BrJNutr, 2006, 95(6): 1112-9.
[6] Singh V, Rana M, Jain M, et al. Curcuma oil attenuates accelerated atherosclerosis and macrophage foam-cell formation by modulating genes involved in plaque stability, lipid homeostasis and inflammation[J].BrJNutr, 2015, 113(1): 100-13.
[7] Guo F, Huang C, Liao X, et al. Beneficial effects of mangiferin on hyperlipidemia in high-fat-fed hamsters[J].MolNutrFoodRes, 2011, 55(12): 1809-18.
[8] 康卓颖, 初欣欣, 杨润梅, 等. 金黄地鼠高脂血症模型胆固醇代谢紊乱的生物标志物的研究[J]. 中国药理学通报, 2014, 30(6): 880-3.
[8] Kang Z Y, Chu X X, Yang R M, et al. Biomarkers of hyperlipidemia cholesterol metabolism in hamster[J].ChinPharmacolBull, 2014, 30(6): 880-3.
[9] 初欣欣, 杨润梅, 于 莹, 等. 金黄地鼠高脂血症模型甘油三酯代谢紊乱的生物标志物的研究[J]. 中国药理学通报, 2014, 30(7): 1012-7.
[9] Chu X X, Yang R M, Yu Y, et al. Triglyceride disorder biomakers in hyperlipidemic hamsters[J].ChinPharmacolBull, 2014, 30(7): 1012-7.
[10]Hardie D G. AMPK-sensing energy while talking to other signaling pathways[J].CellMetab, 2014, 20(6): 939-52.
[11]Carling D, Sanders M J, Woods A. The regulation of AMP-activated protein kinase by upstream kinases[J].IntJObes(Lond), 2008, 32(Suppl 4): S55-9.
[12]Sanders M J, Grondin P O, Hegarty B D, et al. Investigating the mechanism for AMP activation of the AMP-activated protein kinase cascade[J].BiochemJ, 2007, 403(1): 139-48.
[13]Ruderman N B, Carling D, Prentki M, et al. AMPK, insulin resistance, and the metabolic syndrome[J].JClinInvest, 2013, 123(7): 2764-72.
[14]耿雅娜, 于 滨, 孔维佳. 天麻素通过激活 AMPK 通路减少油酸诱导的 HL-7702 细胞脂肪蓄积[J]. 中国药理学通报, 2015, 31(1): 39-44.
[14]Geng Y N, Yu B, Kong W J. Gastrodin ameliorates oleic acid-induced fat accumulation through activation of AMPK pathway in HL-7702 cells[J].ChinPharmacolBull, 2015, 31(1): 39-44.
Hypolipidemic activity of total phenylpropanoid glycosides fromLigustrumrobustum(Roxb.) Blume and its mechanisms on AMPK pathway
SUN Le1, HE Zhen-dan2, YANG Run-mei1, GAO Nan-nan1, XU Li-jia1, JIN Wen1
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,KeyLabofBioactiveSubstancesandResourcesUtilizationofChineseHerbalMedicine,MinistryofEducation,Beijing100193,China;2.DeptofPharmacy,SchoolofMedicine,ShenzhenUniversity,ShenzhenGuangdong518060,China)
Aim To evaluate the hypolipidemic effect of total phenylpropanoid glycoside extracted fromLigustrumrobustum(Roxb.) Blume(CNTG)and its mecha-nisms.Methods The 60 hamsters were randomly divided into six groups, namely the control group, the model group, the positive control group(fenofibrate, 150 mg·kg-1), the high(1 200 mg·kg-1), medium(600 mg·kg-1) and low(300 mg·kg-1) doses of CNTG groups. Only the control group was given control diet and other groups
high-fat diet. The changes of serum lipid were measured and analyzed in 1st week to ensure the successful establishment of the model. The drugs were administered daily for four weeks and the concentrations of lipids were determined in the 2nd week, 3rd week and 4th week respectively. Quantitative real-time PCR and Western blot were used to assay the mRNA and protein expression of related signaling enzymes and proteins.Results Compared with the model group, the concentrations of serum TG, TC, LDL-C(P<0.05,P<0.01) and hepatic TG, TC(P<0.01) were effectively reduced in hamsters in CNTG-treated groups. Mechanism research found that CNTG increased the levels of phospho-AMPKα, LKB1 and phospho-LKB1 in liver(P<0.05).Conclusion CNTG prevents hyperlipidemia via activation of hepatic LKB1-AMPK pathway.
total phenylpropanoid glycoside fromLigustrumrobustum(Roxb.) Blume (CNTG); hyperlipidemia; hypolipidemic; AMPK; LKB1;phosphorylation
2017-04-10,
2017-05-21
协和青年科研基金资助项目(No 3332015142);中国医学科学院医学与健康科技创新工程经费资助(No 2016-I2M-1-012)
孙 乐(1990-),女,硕士生,研究方向:中药药理学,E-mail:nicolelesun@outlook.com; 杨润梅(1981-),女,硕士,副研究员,研究方向:中药心脑血管药理学,通讯作者,E-mail:rmyang@implad.ac.cn
时间:2017-7-7 11:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.016.html
10.3969/j.issn.1001-1978.2017.08.008
A
1001-1978(2017)08-1073-07
R-332;R284.1;R322.47;R589.202.2;R972.6;R977.3