257例抗肿瘤药致药品不良反应报告
尹寿祥,鲁 微
(马鞍山市人民医院药事科,安徽 马鞍山 243000)
257例抗肿瘤药致药品不良反应报告
尹寿祥*,鲁 微
(马鞍山市人民医院药事科,安徽 马鞍山 243000)
目的:了解马鞍山市人民医院(以下简称“我院”)抗肿瘤药致药品不良反应(adverse drug reaction,ADR)发生情况,为临床用药提供参考。方法: 对2015—2016年上报的257例抗肿瘤药所致ADR患者的性别与年龄、药物种类、给药途径、ADR累及器官和(或)系统及临床表现、ADR级别分布及转归等情况进行回顾性分析。结果:257例ADR报告中,男性患者略多于女性,≥50岁患者发生ADR的比例较高;共涉及抗肿瘤药6类31种,其他抗肿瘤药及辅助治疗药物所致ADR病例数最多(119例,占46.31%),其次为植物来源的抗肿瘤药(52例,占20.23%),再次为抗代谢药(50例,占19.46%);致ADR病例数排序居前3位的药品分别为奥沙利铂(44例,占17.12%)、顺铂(31例,12.06%)和吉西他滨(23例,占8.95%);静脉滴注引起的ADR病例数最多(233例,占90.66%),其次为口服给药(12例,占4.67%);ADR共累及器官和(或)系统280例次,主要为累及消化系统(114例次,占40.71%)、血液系统(70例次,占25.00%)和皮肤及其附件(43例次,占15.36%);一般的ADR和严重的ADR病例数较多,经及时停药及对症处理后,患者均治愈或好转,未见死亡病例。结论: 临床应加强抗肿瘤药致ADR的监测工作,加强医、药、患合作,建立良好的医患关系,提高患者用药依从性,以降低ADR发生率,促进临床合理用药。
抗肿瘤药; 药品不良反应; 分析; 监测
目前,抗肿瘤药已从单一的非选择性细胞毒性药物向作用于多环节多靶点的新型药物发展,但由于其选择性较低,目前临床仍无有效手段避免该类药物在应用过程中可能出现的药品不良反应(adverse drug reaction,ADR)[1]。现对马鞍山市人民医院(以下简称“我院”)发现并上报的抗肿瘤药所致ADR报告进行回顾性分析,以了解ADR发生的特点及规律,为临床安全用药提供参考。
1 资料与方法
选取我院2015年1月1日—2016年12月31日上报国家ADR监测网数据库的抗肿瘤药致ADR报告,共257例。按患者性别及年龄、药物种类、给药途径、ADR累及器官和(或)系统及临床表现、ADR级别分布及转归等方面进行统计分析。
2 结果
2.1 发生ADR患者的性别及年龄分布
257例ADR报告中,男性患者153例(占56.67%),女性患者117例(占43.33%),男性略多于女性;7~89岁均有发生,≥50岁发生ADR的比例较高,见表1。
2.2 ADR涉及药物种类及构成比
257例ADR报告共涉及抗肿瘤药6类31种,其他抗肿瘤药及辅助治疗药物所致ADR病例数最多(119例,占46.31%),其次为植物来源的抗肿瘤药(52例,占20.23%),再次为抗代谢药(50例,占19.46%);致ADR病例数排序居前3位的药品分别为奥沙利铂(44例,占17.12%)、顺铂(31例,12.06%)和吉西他滨(23例,占8.95%),见表2。
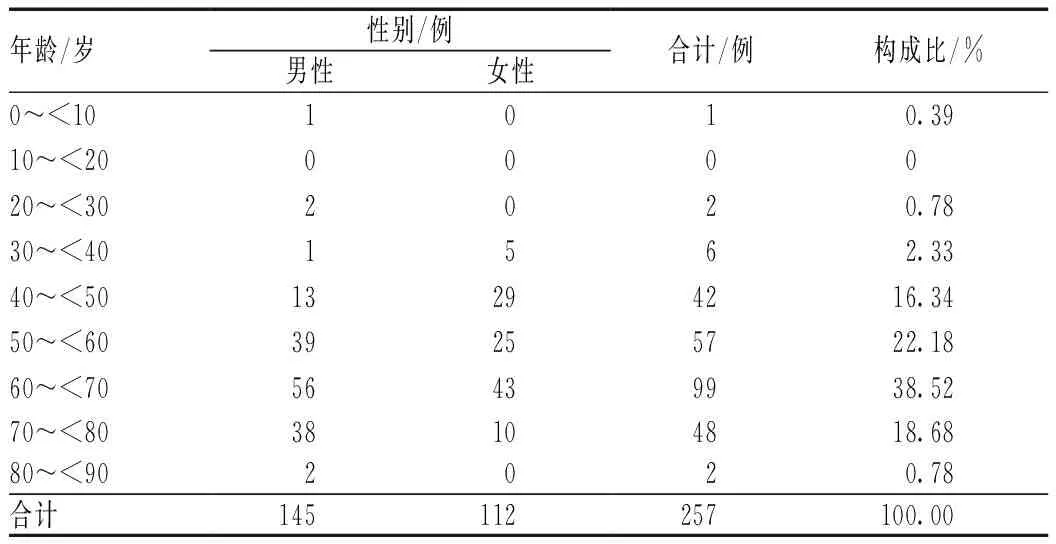
表1 发生ADR患者的性别及年龄分布Tab 1 Distribution of gender and age in ADR cases

表2 ADR涉及药物种类及构成比Tab 2 Categories and constitution ratio of ADR-inducing drugs
2.3 引发ADR的给药途径分布
257例ADR报告中,静脉滴注引起的为233例(占90.66%),口服12例(占4.67%),静脉注射5例(1.95%),泵内注射5例(占1.95%),皮下注射1例(占0.39%),腹膜腔内注射1例(占0.39%)。
2.4 ADR累及器官和(或)系统及主要临床表现
257例ADR共累及器官和(或)系统280例次,主要为消化系统(114例次,占40.71%)、血液系统(70例次,占25.00%)和皮肤及其附件(43例次,占15.36%),见表3。
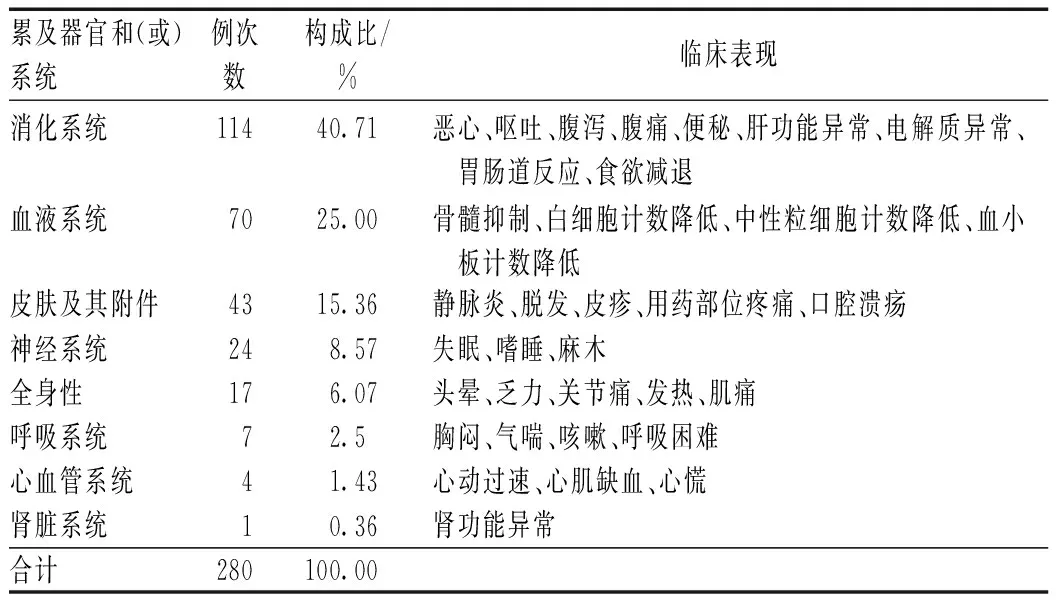
表3 ADR累及器官和(或)系统及主要临床表现Tab 3 Organs and (or) systems involving in ADR and clinical manifestation
注:由于部分病例累及多个器官和(或)系统,故总病例数>257
Note: due to partial cases may involve multiple organs and (or) systems, the total cases>257
2.5 ADR级别分布与转归
257例ADR报告中,一般的ADR 130例(占50.58%),严重的ADR 88例(占34.24%),新的、一般的ADR 30例(占11.67%),新的、严重的ADR 9例(3.50%),见表4。经及时停药及对症处理后,治愈227例(占88.33%),好转30例(占11.67%)。
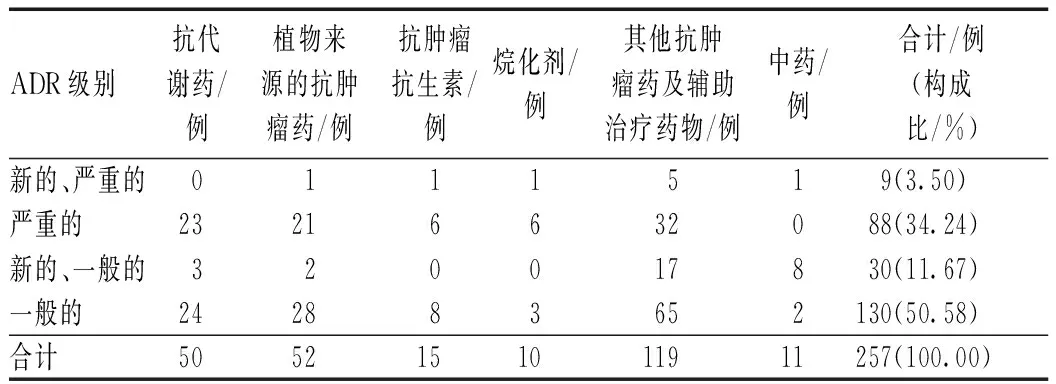
表4 ADR级别分布与转归Tab 4 Classification, categories and prognosis of ADR
3 讨论
3.1 ADR与患者性别及年龄的关系
由表1可见,我院257例发生ADR的患者中,男性多于女性;年龄呈正态分布,60~<70患者数最多,其次是50~<60岁者,与相关报道略有不同[2-4]。分析其原因可能为:(1)该地区居民医疗保健意识不强,病情发现较晚;(2)老年人生理机能减退,常联合应用多种药物。因此,临床制订化疗方案时,应充分考虑患者性别及年龄因素,综合评估患者病情,重视患者已用药与化疗药及辅助用药之间的相互作用,真正实现个体化给药。
3.2 ADR与药物种类的关系
由表2可见,我院ADR共涉及6类31种药品,其他抗肿瘤药及辅助治疗药品所致ADR病例数居首位,其次为植物来源的抗肿瘤药和抗代谢药;引发ADR病例数最多的药品分别为奥沙利铂、顺铂、吉西他滨。奥沙利铂为第3代铂类广谱抗肿瘤药,无肾毒性,消化道损伤及血液系统毒性轻,适用于经氟尿嘧啶治疗失败后的结、直肠癌转移患者,尤其适用于一般情况较差的晚期肿瘤患者[5]。本调查中发现,44例奥沙利铂所致ADR中,结、直肠癌患者17例(占38.64%),其余均为胃癌患者。2011版《美国国立综合癌症网络胃癌临床实践指南(中文版)》把卡培他滨和奥沙利铂代替氟尿嘧啶和顺铂作为I类证据推荐。本调查中,44例奥沙利铂所致ADR多为联合用药,患者主要临床表现为麻木,与相关研究结果一致。外周神经毒性作为奥沙利铂最具特征的ADR,呈剂量限制性。研究结果显示,奥沙利铂剂量累积至750 mg/m2,15%的患者可出现神经毒性;剂量累积至1 170 mg/m2,50%的患者可出现神经毒性。本调查中,50%的患者(22例)外周神经毒性发生时奥沙利铂的累积剂量均≤500 mg/m2,仅2例患者达到750 mg/m2,且多发生在第2次化疗后。分析其原因,可能与开始治疗时医、药、护人员对患者的健康教育不到位,患者用药依从性不高等因素有关。因此,临床应加大患者健康教育力度,与患者建立良好的医患关系,提高用药依从性。
3.3 ADR与给药途径的关系
257例ADR报告中,静脉滴注给药致ADR病例数最多,与相关文献报道一致[7-8]。其可能原因为:(1)静脉滴注给药后,药物直接进入血液,不经肝脏代谢,且药物的pH、渗透压、微粒等也可能引发ADR[9];(2)目前我国住院患者多以静脉滴注治疗为主。口服给药致ADR病例数居第2位,也应引起注意,因为患者多在家自行服药,大部分ADR程度较轻,可自行缓解,不需到医院处理,因此上报比例较少[10]。
3.4 ADR累及器官和(或)系统及主要临床表现
由表3可见,257例抗肿瘤药致ADR主要累及消化系统、血液系统、皮肤及附件,与文献报道一致[11-12]。消化系统ADR为早期常见的毒性反应,临床以恶心呕吐多见,一般可在使用抗肿瘤药前给予止吐药或胃黏膜保护剂进行预防。血液系统ADR多为骨髓抑制,大部分抗肿瘤药会引起不同程度的骨髓抑制,且联合用药或多次化疗可导致严重的骨髓抑制,因其与消化系统损伤相比,具有一定的隐匿性,这就要求医护人员在患者使用相关抗肿瘤药期间,定期监测患者的血液学指标,对于有过严重骨髓抑制的患者,再次用药前可减量或预防性使用粒细胞集落刺激因子、白细胞介素11或血小板生成素[13]。皮肤及附件损害主要表现为静脉炎、皮疹等,其与消化系统损伤均具有直观性,深静脉置管、增加液体摄入等方法可促进体内药物的排泄,有效减少或减轻ADR[13]。
3.5 ADR级别分布与转归
由表4可见,抗肿瘤药所致严重的ADR病例数较多,共88例(占34.24%),可能与抗肿瘤药特异性不高,在杀伤肿瘤细胞的同时损害机体正常的细胞、组织和器官(尤其是皮肤黏膜、血液系统等细胞周期短、代谢快的系统)等因素有关。经对症处理后,好转30例,治愈227例,未见死亡病例。
综上所述,抗肿瘤药引发ADR的原因较多,且严重的ADR较为常见,不仅浪费了医疗资源,还会影响患者的治疗及预后。因此,临床应尽量减少或避免ADR尤其是严重的ADR的发生[14]。临床药师应积极参与患者的治疗过程,在协助临床医师制订化疗方案的同时充分考虑药物的相互作用,做好抗肿瘤药致ADR的监测工作[15-16];加强医、药、患之间的合作,加大对患者的健康教育力度,通过建立良好的医患关系,提高用药依从性。
[1]冯娟,靳毅华,杨瑾,等.275例抗肿瘤药不良反应分析[J].中国药品与临床,2015,15(8):1186-1188.
[2]钱锦,闫鹏,张凯,等.回顾性研究422例抗肿瘤类药物不良反应报告[J].中国医院药学杂志,2013,33(18):1557-1561.
[3]章娟,吴洪斌,翟青.222例抗肿瘤药致不良反应报告分析[J].中国医院用药评价与分析,2011,11(10):937-940.
[4]刘广宣,赵茜.抗肿瘤药物11030例处方分析[J].中国医院药学杂志,2011,31(1):72-73.
[5]徐媛,陈利,朱卉,等.奥沙利铂处方合理性及安全性分析[J].中国药物警戒,2016,13(3):176-179.
[6]Extra JM,Marty M,Brienza S,et al.Pharmacokinetics and safety profile of oxaliplatin[J].Semin Oncol,1998,25(2 Suppl 5):13-22.
[7]王啸宇,郭代红,徐元杰,等.70672例静脉给药致药品不良反应报告分析[J].药品流行病学杂志,2016,25(4):233-238.
[8]翟爱华,张白,王琦.205例药品不良反应报告分析[J].中国医药导报,2015,12(8):109-112.
[9]任淑娟,吉金燕,解娟,等.我院304例药品不良反应报告分析[J].西北药学杂志,2014,29(1):93-96.
[10] 方向红,宁华,焦园园,等.2010—2011年北京大学肿瘤医院443例药物不良反应报告分析[J].山东医药,2012,52(34):82-84.
[11] 黎国栋.抗肿瘤药物的不良反应及临床防治措施[J].实用癌症杂志,2016,31(5):866-868.
[12] 陆明霞.抗肿瘤药品的不良反应分析[J].中国医药指南,2015,13(33):107-108.
[13] 王丹青,王红静.新辅助化疗的不良反应及预防处理[J].实用妇产科杂志,2013,29(4):253-256.
[14] 崔琪,闫素英.抗肿瘤药物引起的严重不良反应报告分析[J].中国临床药理学杂志,2015,31(8):654-656.
[15] 王燚.抗肿瘤药物的不良反应及防治[J].临床和实验医学杂志,2012,11(10):746-747.
[16] 刘红,张艳华.我院281例抗肿瘤药致不良反应报告分析[J].中国药房,2011,22(38):3607-3610.
257 Cases of Adverse Drug Reactions Induced by Antineoplastic Drugs
YIN Shouxiang, LU Wei
(Dept.of Pharmacy, People’s Hospital of Maanshan, Anhui Maanshan 243000, China)
OBJECTIVE: To investigate the incidence of adverse drug reactions(ADR) induced by antineoplastic drugs in People’s Hospital of Maanshan(hereinafter referred to as “our hospital”), so as to provide reference for clinical drug use. METHODS: Retrospective analysis was conducted on 257 cases of ADR induced by antineoplastic drugs during 2015-2016 in terms of gender and age, drug categories, administration route, involved organs and(or) systems and prognosis, etc. RESULTS: Of the 257 ADR cases, males were slightly more than females, the ratio of patients aged ≥50 years old with ADR was relatively high; there were 6 kinds of antineoplastic drugs involved, including 31 categories, cases of ADR induced by antineoplastic drugs and adjuvant therapy took the lead (119 cases, 46.31%), followed by antineoplastic drugs of species source(52 cases, 20.13%) and antimetabolites (50 cases, 19.46%). The top 3 drugs were respectively oxaliplatin(44 cases, 17.12%), cis-platinum(31 cases, 12.06%) and gemcitabine(23 cases, 8.95%). ADR induced by intravenous drip dominated the first place(233 cases, 90.66%), followed by oral medication(12 cases, 4.67%). ADR involved organs and (or) systems in 280 cases,and the most common were digestive system(114 cases, 40.71%), hematological system (70 cases, 25.00%) and skin and its accessories(43 cases, 15.36%). Cases of general ADR and severe ADR took the lead, after timely withdrawal and expectant treatment, patients were cured or recovered, without any death cases. CONCLUSIONS: The clinic should strengthen the monitoring of ADR induced by antineoplastic drugs and cooperation of medical, pharmacy and patient, establish the good doctor-patient relationship, increase the medication compliance of patients, so as to reduce the incidence of ADR and promote the rational drug application in clinic.
Antineoplastic agents; Adverse drug reactions; Analysis; Monitoring
R969.3
A
1672-2124(2017)06-0843-03
2017-02-27)
*副主任药师。研究方向:药事管理、医院药学。E-mail:1193975458@qq.com
DOI 10.14009/j.issn.1672-2124.2017.06.043

