遗传性朊病毒病额叶脑组织差异蛋白质组学研究
郭燕军 石琦 张宝云 黎建乐 王鲁宁 张红红 胡亚卓 韩志涛 赵伟秦 王得新 董小平 武双
100050 北京,首都医科大学附属北京友谊医院神经内科(郭燕军、黎建乐、赵伟秦、王得新);102206 北京,中国疾病预防控制中心病毒病预防控制所朊病毒室(石琦、张宝云、董小平);100853 北京,解放军总医院老年神经科(王鲁宁),老年医学研究所(张红红、胡亚卓、韩志涛);100023 北京联合大学生物化学工程学院、生物质废弃物资源化利用北京重点实验室(武双)
·论著·
遗传性朊病毒病额叶脑组织差异蛋白质组学研究
郭燕军 石琦 张宝云 黎建乐 王鲁宁 张红红 胡亚卓 韩志涛 赵伟秦 王得新 董小平 武双
100050 北京,首都医科大学附属北京友谊医院神经内科(郭燕军、黎建乐、赵伟秦、王得新);102206 北京,中国疾病预防控制中心病毒病预防控制所朊病毒室(石琦、张宝云、董小平);100853 北京,解放军总医院老年神经科(王鲁宁),老年医学研究所(张红红、胡亚卓、韩志涛);100023 北京联合大学生物化学工程学院、生物质废弃物资源化利用北京重点实验室(武双)
目的 应用蛋白质组学方法,筛选遗传性朊病毒病(Prion disease)额中回皮质差异表达蛋白以探究朊病毒病的发病机制和干预靶点。方法 对我国经临床、病理及分子生物学方法确诊的3例遗传性朊病毒病尸检脑组织额中回皮质,以3例同年龄组的心脏猝死且无神经系统病变的尸检脑组织为对照,进行了差异蛋白质组研究。应用荧光双向差异凝胶蛋白电泳、MALDI-TOF/MS 串联质谱仪进行差异蛋白质谱分析。Mascot search results 软件进行搜库,确定差异表达蛋白。结果表达上调的蛋白有:半乳糖凝集素-1(Galectin-1,Gal-1);泛素(Ubiquitin);兰尼碱受体2(Ryanodine receptor 2,RyR2);肌动蛋白结合蛋白(Profilin-2,PFN2);Rab相互作用溶酶体蛋白样蛋白-1(Rab-interacting lysomes protein-like protein 1,RILPL-1);髓鞘碱性蛋白异构体4(Isoform 4 of myelin basic protein);表达下调的蛋白是血色素β亚单位(Hemoglobin subunit beta)。结论 结合文献分析其中泛素、Gal-1、RyR、PFN2和RILPL-1可能与遗传性朊病毒病发病机制关系更为密切。Gal-1可能在朊病毒病中发挥内源性神经保护机制;RyR2与记忆及肌阵挛有关;泛素、 RILP-1与错误折叠蛋白质清除有关;PFN2可能与神经变性病的轴浆运输障碍有关。
Fund programs: National Natural Science Foundation of China (81301032)

表1 遗传性朊病毒病临床及主要实验室检查结果
朊病毒病(Prion disease)是一类由朊蛋白(Prion protein,PrP)构象变化所致的、以海绵样脑病为病理特点的、具有可传播性的致死性神经变性病。近年来国外学者倾向于将人类朊病毒病分为散发性、遗传性和获得性3类[1]。克雅氏病约80%~90%的CJD呈散发性,称之为散发性克雅氏病,病因尚不明确。获得性占5%,包括变异型CJD、医源性CJD和库鲁病。遗传性朊病毒病是由于朊蛋白基因(PRNP)的遗传性突变而引起的是一种常染色体显性遗传病,包括数十种密码子点突变或八肽重复区内重复片段的插入突变。包括家族性克雅氏病(Familiar creutzfeldt-jacob disease, fCJD)、家族性致死性失眠症(Fatal familial insomnia, FFI)和Gerstmann-straussler-scheinker综合征(GSS),我国也报道了中数10例临床、分子生物学诊断的遗传性朊病毒病[2]。其中经尸检证实的fCJD(八肽重复区插入突变[3]、G114V突变[4]各1例)、FFI 2 例[5]。
本研究以中国疾病预防控制中心病毒病所保存的3例遗传性朊病毒病尸检脑组织额中回皮质,以3例同年龄组的心脏猝死且无神经系统病变的尸检脑组织为对照,应用荧光双向差异蛋白电泳(Fluorescence two-dimensional differential gel electrophoresis, 2D-DIGE)技术,进行了遗传性朊病毒病差异蛋白质组研究,以发现遗传性朊病毒病可能的生物标志物和治疗靶点。
1.1 研究对象 遗传性朊病毒病脑组织由中国疾病预防控制中心病毒病所朊病毒室提供,包括2例FFI和1例fCJD。对照组脑组织由中国人民解放军总医院老年医学研究所组织库提供,为心脏猝死病例3例,全部为男性,年龄38~52岁。临床资料及实验室相关检查见表1。
1.2 研究方法
1.2.1 主要双向电泳及质谱分析试剂:IPG 缓冲液、IPG覆盖油、CyDye DIGE Fluors 购自于Amersham Pharmacia Biotech 公司;IPG 干胶条(Immobiline TMDrystrip, pH3-10, NL, 24 cm)购于GE公司;碘乙酰胺(Iodoacetamide)购自Acros公司;DNase Ⅰ 购自日本TaKaRa公司;protease inhibitor cocktail 购自美国Roche公司;Bradford定量试剂盒购于Bio-Rad公司;DMF购自Aldrich公司;其余试剂均为国产分析纯。
1.2.2 主要双向电泳及图像分析仪器:Hoefer MiniVE 垂直电泳仪,电源EPS301,一向等电聚焦仪IPGphor,二向垂直电泳仪EttanTMDALT Twelve,循环水浴MultiTemp Ⅲ,图像扫描仪 Image Scanner,多功能成像仪Typhoon9410,图像分析软件Image Master 2D Platinum、Image Quant、DeCyder(Version6.5)均为Amersham Pharmacia Biotech 公司产品;SmartspecTM plus 蛋白定量仪,Protein Ⅱ垂直电泳单元为Bio-Rad 公司产品。
1.2.3 组织蛋白样品提取:根据临床、病理和免疫印迹结果,选择出3例朊病毒病(PrP)、3 例对照(YC),分别称取适量(均约0.2 g)的-80 ℃冷冻保存的额中回皮质组织,加入液氮反复冻融3~4次,研磨粉碎,加裂解液,冰上超声粉碎,4 ℃离心(16 000 g/h)30 min。吸上清,重复离心,取上清合并,进行2-D Clean-up试剂盒纯化。应用Bradford 法测定每份蛋白质样品浓度。
1.2.4 2D-DIGE标记实验(均需避光操作):实验分组设计见表2。

表2 2D-DIGE样品分组Tab.2 Samples labeling in 2D-DIGE gels
注:YC:对照组;PrP:遗传性朊病毒组
Note:YC:contral;PrP:genetic prion diseases
CyDye标记方法:取4个样品各12.5 μg放入离心管中,制成内标样品,按50 μg/400 pmol CyDye染料的比例混匀,暗处冰上放置30 min,加入1 μl 10 mmol/L赖氨酸溶液,冰浴避光终止反应。
1.2.5 双向凝胶电泳制备: 分析胶分别混合标记后的3块胶样品及内标,用重泡涨液定容至 450 μl。在20 ℃一向等电聚焦仪IPGphor,将24 cm IPG胶条水化重泡涨6 h,用Ettan IPGphor II等电聚焦电泳仪,进行等电聚焦电泳。等电聚焦后,将胶条分别放置在含2%DTr和4%IAA的平衡液中振荡平衡,移至12.5%的SDS-PAGE胶上端,在DALTSix电泳仪中电泳。用Typhoon 9410 激光扫描仪在488/520 nm,532/580 nm,633/670 nm波长荧光模式下分别对Cy2,Cy3,Cy5荧光染料标记的图像进行扫描。
1.2.6 差异点分析:用Decyder V5.02图像分析软件对2D-DIGE图像进行分析和差异点寻找,蛋白点的确认、匹配,统计学分析均在Decyder-BVA软件中进行。差异点满足条件:P≤0.05,差异倍数1.5以上。
1.3 差异蛋白质谱分析
1.3.1 质谱分析及蛋白质鉴定:取对照组及实验组蛋白样品各500 μg,按常规方法进行制备胶双向电泳后,考马斯亮蓝染色,用Ettan spot picker (Amersham biosciences公司)机械手臂挖取与感兴趣差异蛋白相匹配的蛋白点。对所挖取蛋白点用50%乙腈冲洗、胰蛋白酶消化、标肽和蛋白样品点样后, 应用美国ABI-4800型反射式基质辅助激光解吸飞行时间串联质谱仪(MALDI-TOF/TOF 串联质谱仪4800 Proteomics analyzer(美国Applied Biosystem公司)分析蛋白质肽质量指纹谱,并将结果输入NCBI和SWISS.PROT 蛋白质数据库进行检索。
1.3.2 数据库检索:应用Matrix Science 商家生产的Mascot Search Results 软件进行搜库。GPS 软件检索:误差MS0.2Da;MS/MS0.3Da。数据库:物种选择为Homo sapiens(human),人数据库IPI HUMAN v3.23。数据取舍标准:取蛋白质打分大于61 分,置信水平在95%以上。
2 结果
本研究应用2D-DIGE技术,发现了14个差异蛋白点(见图1),经MALDI-TOF/TOF 串联质谱分析,鉴定得到7个蛋白质,获得7种蛋白质的明确质谱信息详见表3,共有1种蛋白质下调,6种蛋白质上调。表达上调的蛋白有:肌动蛋白结合蛋白(Profilin-2,PFN2)、半乳糖凝集素-1(Galectin-1,Gal-1)、泛素(Ubiquitin)、兰尼碱受体2(Ryanodine receptor 2,RyR2)、Rab相互作用溶酶体蛋白样蛋白-1(Rab-interacting lysosomes protein-like protein 1,RILPL-1)、髓鞘碱性蛋白异构体4(Isoform 4 of myelin basic protein);表达下调的蛋白是血色素β亚单位(Hemoglobin subunit beta)。

表3 遗传性朊蛋白病额叶脑组织差异表达蛋白鉴定结果
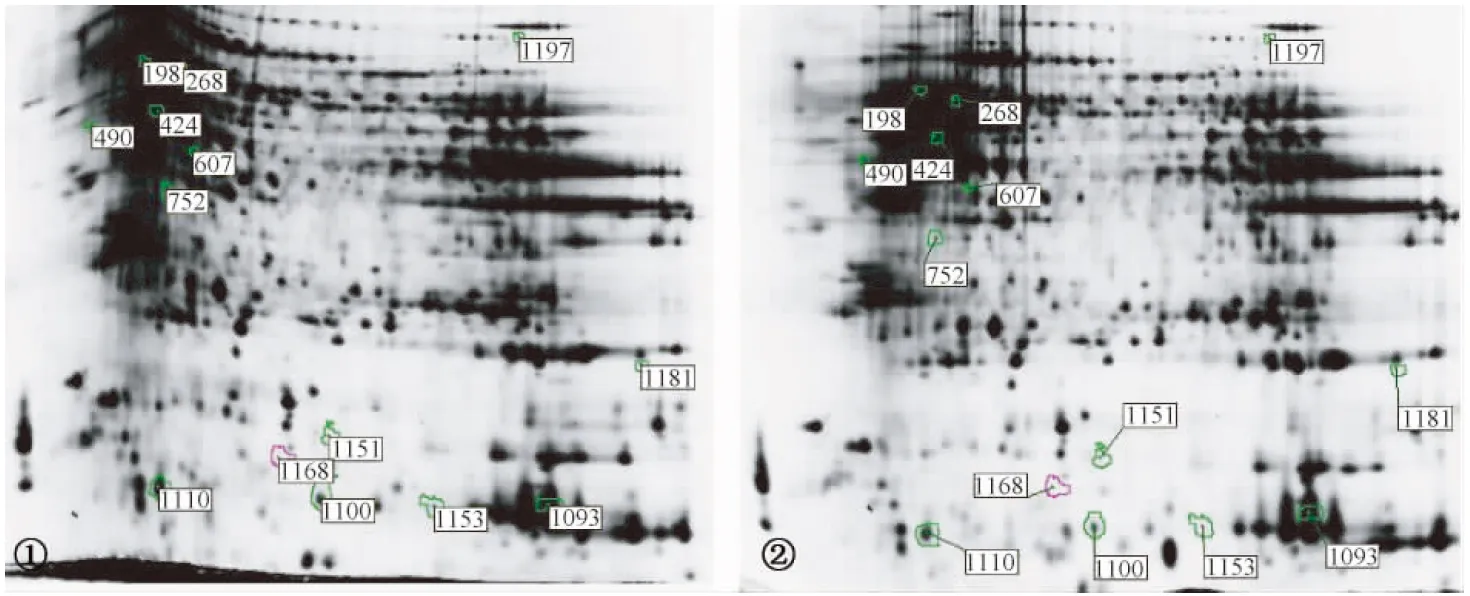
① PrP组Cy5染色蛋白点,② YC组Cy5染色蛋白点,两组间蛋白量表达表达量有显著差异(P<0.05)且差异倍数>1.5的蛋白点。 绿色圈为蛋白量增加点,红色圈为蛋白量减少点图1 遗传性朊病毒病额叶脑组织差异蛋白表达① CyP stained proteins in PrP-group, ②Cy5 stained proteins in YC-group. Proteins with numbers are those protein expression have significant difference (P<0.05) and difference fold > 1.5 between PrP group and YC-group. Proteins with green circle means protein expression upregulated and proteins with pink circle means protein expression downregulated in PrP groupFig.1 Differential proteomic expression of human genetic prion disease patients in frontal lobe tissues
3 讨论
结合文献分析其中5个蛋白与朊病毒病发病机制关系更为密切。Gal-1可能在朊病毒病中发挥内源性神经保护机制;RyR2与记忆及肌阵挛有关;泛素、 RILP-1与错误折叠蛋白质清除有关;PFN2与神经变性病的轴浆运输障碍有关。上述差异蛋白的发病机制中可能有重要作用,其中已应用免疫印迹等方法证实Gal-1和RyR2在朊病毒病尸检脑组织和实验动物模型脑组织存在差异表达。
半乳糖凝集素-1(Galectin-1,Gal-1)属于β-半乳糖苷-结合蛋白家族,由418个氨基酸组成,相对分子质量14.5×103,在神经发生、神经干细胞增殖、分化中具有重要作用[6]。Gal-1在成人神经干细胞/祖细胞(Neural stemcells/ neural progenitor cells, NS/NPCs)表达,促进星形胶质细胞表达脑源性神经营养因子(Brain derived neurotrophic facor, BDNF)[7]。Gal-1基因敲除小鼠在水迷宫实验中出现空间记忆力下降和情景学习障碍,提示Gal-1在海马记忆形成过程中具有重要作用[8]。本研究组发现遗传性朊病毒病额中回皮质Gal-1表达升高后,在后续的研究中应用免疫组化、免疫印迹和RT-PCR方法证实Gal-1在朊病毒病啮齿类动物模型263K、139A和ME7终末期脑组织的表达均升高,Gal-1的表达与动物模型脑组织接种朊病毒的时间长短有明显的时效关系[9]。
RYR2是一种广泛存在于肌浆网上的钙离子通道,在中枢神经系统中广泛分布,参与多种代谢。RYR2在胚胎期维持细胞内外钙离子稳态,影响神经元的正常发育[10]。RYR2可以促进海马突触的形成,参与到记忆以及学习的形成过程[11,13]。在早老素1基因突变的小鼠中,RyRs介导的钙离子转运作用明显增强[14]。晚发型AD患者L-电压依赖性钙离子通道与RyR基因突变的相互作用与淀粉样蛋白沉积有相关性[15]。阻断RyRs的作用或降低RyRs的表达,有利于改善认知功能[16,17]。小鼠RyR2基因突变导致RyR2通道泄露,可以出现自发性强直阵挛发作、运动诱发室性心律失常和猝死[18]。朊病毒病的进行性痴呆、肌阵挛和癫痫发作,是否与该蛋白表达变化有关尚不清楚。本课题组在后续的研究中应用免疫印迹发现RyR2在朊病毒病啮齿类动物模型263K、139A和ME7终末期脑组织的表达变化(结果未发表)。RyR2有可能成为神经变性疾病治疗的新靶点。
泛素-蛋白酶体系统是蛋白降解的主要通路,神经毒性蛋白积聚形成的细胞内泛素-阳性包涵体是神经变性病共同的病理通路之一,泛素在多种神经变性病的错误折叠蛋白或其他突变蛋白的降解过程中发挥重要作用,朊病毒病泛素-蛋白酶系统变化也有报道[19,20]。
RILP-1,即Ras-相关相互作用溶酶体蛋白样蛋白1。RILP是Rab7 GTP酶的下游产物,Rab蛋白的主要效应蛋白,是溶酶体和自噬溶酶体形成的关键蛋白。Rab与神经变性病有密切关系,抑制Rab7能够极大的促进神经生长因子活性。[21]。本研究报道了RILP-1在朊病毒病脑组织的差异表达变化,其在朊病毒病的发病机制中的可能作用尚未见报道。
轴浆运输障碍在AD等神经变性病发病机制中日益受到重视。肌动蛋白结合蛋白(Profilin2,PFN2),调节动力功能突触蛋白、动力蛋白1等囊泡运输等[22]。PFN2只特异地存在于大脑,与信号转导、膜运输和突触蛋白、动力蛋白1等囊泡运输等有关配体相互作用。目前对于PFN-2在神经系统中的功能认识,尚不明确。PFN家族广泛参与到神经元分化以及新突触的形成[23]。在大鼠的亨廷顿疾病模型中纹状体中Profilin2的表达增加,Profilin2可能参与神经元退化过程[24]。本研究报道了PFN-2在朊病毒病脑组织的差异表达变化,其在朊病毒病的发病机制中可能发挥的作用尚不清楚。
髓鞘碱性蛋白(Myelin basic protein,MBP)中枢神经系统(CNS)髓鞘的主要蛋白质,位于髓鞘浆膜面,维持CNS髓鞘结构和功能的稳定,具有神经组织特异性,在中枢神经系统自身免疫及炎症研究中具有重要地位。近年来研究发现在阿尔茨海默病皮层中变性的MBP增多,MBP存在于AD淀粉样斑块周围,在AD和多发性硬化等相关研究中已发现,髓鞘破坏与认知功能减退和淀粉样斑块形成有关[25]。尚未见MBP与朊病毒病的相关研究。
血色素β亚单位(Hemoglobin subunit beta, Hbb)在遗传性朊病毒病脑组织中表达下降。Hbb是红细胞携氧蛋白,在氧和能量稳态平衡中发挥重要作用。近年来的研究发现多巴胺能神经元Hbb表达升高、人和动物皮层神经元也有Hbb表达,提示Hbb在神经元及疾病状态的氧化应激中发挥作用[26]。尚未见Hbb 与朊病毒病的相关报道。
近年来iTRAQ方法蛋白质组学研究中应用也比较多,iTRAQ方法高度敏感,常可以发现数百至数千个差异蛋白,需要进一步进行go分析,可以分析出不同通路在疾病中的变化,但不利于生物标志物的筛洗和鉴别。2D-DIGE方法比较蛋白质量的变化重复性更好,定量更加准确,更适合疾病生物标志物和治疗靶点选择相关研究。
本研究对我国经临床、病理及分子生物学方法确诊的3例遗传性朊病毒病尸检脑组织额中回皮质进行了差异蛋白质组研究,结果发现泛素、Gal-1、RyR、PFN2和RILPL-1在遗传性朊病毒病脑组织中表达上调。这些蛋白可能与遗传性朊病毒病发病机制关系更为密切,对朊病毒病生物标志物、发病机制和治疗靶点选择等有较大意义。
[1] Geschwind MD. Prion disease. Continuum (Minneap Minn). 2015,21(6Neuroinfectious Disease): 1612-1638. doi: 10.1212/CON.0000000000000251.
[2] Shi Q, Zhou W, Cen C, et al. The Features of Genetic Prion Diseases Based on Chinese Surveillance Program[J]. PLoS One. 2015; 10(10):e0139552. doi: 10.1371/journal.pone.0139552. eCollection 2015.
[3] Guo YJ, Wang XF, Han J, et al. A Chinese Creutzfeldt-Jakob disease with 7 extra otcarepeats insertion in PRNP gene: PrPScmolecular characteristics and clinical features[J]. Am J Med Sci.2008, 336(6): 519-523. doi: 10.1097/MAJ.0b013e3181643e50.
[4] Shi Q, Zhang BY, Gao C, et al.The diversities of PrPSc distributions and pathologic changes in various brain regions from a Chinese patient with G114V genetic CJD[J]. Neuropathology, 2012,32(1), 51-59. doi: 10.1111/j.1440-1789.2011.01237.
[5] Shi XH, Han J, Zhang J, et al. Clinical, histopathological, and genetic studies in a family with fatal familial insomnia [J]. Infect Genet Evol, 2010,10(2), 292-297. doi: 10.1016/j.meegid.2010.01.007.
[6] Sakaguchi M, Shingo T, Shimazaki T, et al. A carbohydrate-binding protein, Galectin-1, promotes proliferation of adult neural stem cells [J]. Proc Natl Acad Sci USA,2006,103(18): 7112-7117. doi:10.1073/pnas.0508793103.
[7] Ishibashia S, Kuroiwac T, Sakaguchid M, et al. Galectin-1 regulates neurogenesis in the subventricular zone and promotes functional recovery after stroke [J]. Exp Neurol,2007,(2): 302-313. doi:10.1016/j.expneurol.2007.06.024.
[8] Sakaguchi1 M, Arruda-Carvalho M, Kang NH, et al. Impaired spatial and contextual memory formation in galectin-1 deficient mice [J]. Mol Brain, 2011, Sep 1; 4: 33-42. doi:10.1186/1756-6606-4-33.
[9] Guo YJ, Shi Q, Yang XD, et al. Increases of Galectin-1 and its S-nitrosylated form in the brain tissues of scrapie infected rodent models and human prion diseases [J]. Mol Neurobiol,2016 May 23. [Epub ahead of print]: doi 10.1007/s12035-016-9923-1.
[10] Peng W, Shen H, Wu J, et al. Structural basis for the gating mechanism of the type 2 ryanodine receptor RyR2 [J]. Science,2016, 21:354(6310). pii: aah5324. Epub 2016 Sep 22: doi: 10.1126/science.aah5324.
[11] Kemmerling U, Muoz P, Müller M, et al. Calcium release by ryanodine receptors mediates hydrogen peroxide-induced activation of ERK and CREB phosphorylation in N2a cells and hippocampal neurons [J]. Cell Calcium, 2007,41(5): 491-502. doi:10.1016/j.ceca.2006.10.001.
[12] Galeotti N, Quattrone A, Vivoli E, et al. Different involvement of type 1, 2, and 3 ryanodine receptors in memory processes [J]. Learn Mem,2008,15(5):315-323. doi:10.1101/lm.929008.
[13] Paula-Lima A, Adasme Ta, San Martin C, et al. Amyloid β-Peptide Oligomers Stimulate RyR-Mediated Ca 2+ Release Inducing Mitochondrial Fragmentation in Hippocampal Neurons and Prevent RyR-Mediated Dendritic Spine Remodeling Produced by BDNF [J]. Antioxid Redox Signal, 2011,14(7): 1209-1223. doi:10.1089/ars.2010.3287.
[14] Payne AJ, Gerdes BC, Naumchuk Y, et al. Presenilins regulate the cellular activity of ryanodine receptors differentially through isotype-specific N-terminal cysteines [J]. Exp Neurol, 2013,250 Dec; 143-150. doi:10.1016/j.expneurol.2013.09.001.
[15] Koran MEI, Hohman TJ, Thornton-Wells TA. Genetic interactions found between calcium channel genes modulate amyloid load measured by positron emission tomography [J]. Hum Genet, 2014,133(1):85-93. doi:10.1007/s00439-013-1354-8.
[16] Hopp SC, D'Angelo HM, Royer SE et al. Differential rescue of spatial memory deficits in aged rats by Ltype voltage dependent calcium channel and ryanodine receptor antagonism [J]. Neuroscience, 2014,7(280):10-18. doi: 10.1016/j.neuroscience.2014.09.007.
[17] Liang L, Wei H. Dantrolene, A Treatment for Alzheimer's Disease [J]. Alzheimer Dis Assoc Disord,2015,29(1): 1-5. doi:10.1097/WAD.0000000000000076.
[18] Lehnart SE, Mongillo M, Bellinger A, et al. Leaky Ca2+ release channel/ ryanodine receptor 2 causes seizures and sudden cardiac death in mice [J]. J Clin Invest, 2008,118(6):2230-2245. doi:10.1172/JCI35346.
[19] Atkin G, Pauloson H. Ubiquitin pathways in neurodegenerative disease [J]. Front Mol Neurosci,2014, 8(7):63. doi: 10.3389/fnmol.2014.00063. eCollection 2014.
[20] Zheng Q, Huang T, Zhang L, et al. Dysregulation of Ubiquitin-Proteasome System in Neurodegenerative Diseases [J]. Front Aging Neurosci,2016,15(8):303. doi: 10.3389/fnagi.2016.00303. eCollection 2016.
[21] De Luca M, CogliL, Progida C. RILP regulates vacuolar ATPase through interaction with the V1G1 subunit [J]. J Cell Sci,2014,12(Pt 12): 2697-2708. doi: 10.1242/jcs.175323
[22] Gareus R, Di Nardo A, Rybin V, et al. Mouse profilin 2 regulates endocytosis and competes with SH3 ligand binding to dynamin 1 [J]. J Biol Chem,2006,281(5): 2803-2811. doi:10.1074/jbc.M503528200.
[23] Medioni C, Ramialison M, Ephrussi A, et al. Imp Promotes Axonal Remodeling by Regulating profilin mRNA during Brain Development [J]. Current Biology, 2014,24(7): 793-800. doi:10.1016/j.cub.2014.02.038.
[24] Chakraborty J, Pandey M, et al. Profilin-2 increased expression and its altered interaction with β-actin in the striatum of 3-nitropropionic acid-induced Huntington’s disease in rats [J]. Neuroscience,2014, 5(281):216-228. doi: 10.1016/j.neuroscience.2014.09.035.
[25] Zhan XH, Gickling JC, Ander BP, et al. Myelin basic protein associates with AβPP, Aβ1-42, and amyloid plaques in cortex of alzheimer’s disease brain [J]. J Alzheimers Dis,2015,44(4): 1213-1229. doi:10.3233/JAD-142013.
[26] Adav SS1,2, Gallart-Palau X3, Tan KH, et al. Dementia-linked amyloidosis is associated with brain protein deamidation as revealed by proteomic profiling of human brain tissues. Mol Brain, 2016,19(9): 20. doi: 10.1186/s13041-016-0200-z.
(本文编辑:陈培莉)
Differential proteomic analysis of human genetic prion disease patients in frontal lobe tissues
Guo Yanjun, Shi Qi, Zhang Baoyun, Li Jianle, Wang Luning, Zhang Honghong, Hu Yazhuo, Han Zhitao, Zhao Weiqin, Wang Dexin, Dong Xiaoping, Wu Shuang
Department of Neurology, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China (Guo YJ, Li JL, Zhao WQ, Wang DX); National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China (Shi Q, Zhang BY, Dong XP); Department of Geriatric Neurology,PLA General Hospital, Beijing 100853, China (Wang LN, Zhang HH, Hu YZ, Han ZT); College of Biochemical Engineering Beijing Union University, Beijing Key Laboratory of Biomass Waster Resoure Utilization, Beijing 100023, China(Wu S)
Guo Yanjun,Email:littleguo_1999@163.com@163.com;Wu Shuang,Email:wushuang007@aliyun.com
Objective To search for biomarkers for human familial prion disease. Methods Two-dimensional differential gel electrophoresis (2D-DIGE) proteomic analysis has been performed in frontal lobe tissues of 3 patients suffering from human familial prion disease (PrP) and 3 age-and sex-matched patients suffering from sudden death due to heart failure without neurological disease. Results The maps revealed 14 polypeptide chains differentially modulated in the PrP samples, among those, 7 could be identified upon digestion and MALDI-TOF/MS analysis, of which 6 appeared to be up-regulated, 1 being down-regulated. Conclusions We highlight Galectin-1(Gal-1), ryanodine receptor 2 (RyR2), ubiquitin, Rab-interacting lysosomes protein-like protein 1 (RILPL-1) profillin 2 (PFN2), in the differential map. These proteins are related to neurogenesis, the clearance of misfolded proteins, stasis of calium channel, myoclonus and so on. These proteins are potential biomarkers or targets for treatment of prion disease.
Prion disease; Proteomics; Fluorescence two-dimensional Differential gel electrophoresis (2D-DIGE);Biomarker
郭燕军,Email:littleguo_1999@163.com;武双,Email:wushuang007@aliyun.com
10.3760/cma.j.issn.1003-9279.2017.03.002
朊病毒病;蛋白质组学;荧光双向差异凝胶蛋白电泳;生物标志物
国家自然科学基金(81301032)
2017-02-25)

