瑞士乳杆菌MG9-2微胶囊的制备工艺优化及其性能分析
宋娇娇,包秋华,王亚利,尚一娜,霍麒文,张晓宁,陈 境,李明慧,王俊国*
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室,农业部奶制品加工重点实验室,内蒙古 呼和浩特 010018)
瑞士乳杆菌MG9-2微胶囊的制备工艺优化及其性能分析
宋娇娇,包秋华,王亚利,尚一娜,霍麒文,张晓宁,陈 境,李明慧,王俊国*
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室,农业部奶制品加工重点实验室,内蒙古 呼和浩特 010018)
以乳蛋白为壁材,利用内源乳化法制备瑞士乳杆菌MG9-2微胶囊,对其进行工艺优化,并比较添加不同钙盐作为交联剂(CaCl2和CaCO3)对微胶囊性能的影响。结果显示制备瑞士乳杆菌MG9-2微胶囊的最佳工艺参数为:乳化搅拌速率800 r/min、水油比1∶10、脱脂乳质量浓度0.35 g/mL、钙盐浓度1.5 mol/L。在此条件下以CaCO3、CaCl2为交联剂制得MG9-2微胶囊的包埋率分别为(78.4±3.6)%和(75.7±4.9)%,无显著性差异。但与CaCl2为交联剂制得的MG9-2微胶囊相比,CaCO3制得的微胶囊粒径较小,表面较致密、形状较规则、分散性较好,且具有较好的肠液释放性和耐胃酸性。结果表明,以CaCO3为交联剂在室温制备瑞士乳杆菌MG9-2微胶囊的工艺简单且性能较好。
微胶囊;瑞士乳杆菌MG9-2;CaCl2;CaCO3
微胶囊包埋技术已被广泛用来提高益生菌在不利环境中的存活率[1-3]。其中壁材和包埋方法的选择对保护益生菌起着至关重要的作用。因蛋白质形成的凝胶具有可控的通透性和较高的凝胶强度,使其形成的微胶囊具有很好的抵抗不利环境的能力[4-5],因此蛋白质用作益生菌的包埋壁材越来越受到人们的重视。牛乳蛋白本身可作为营养物质以及其具有较好的酸碱缓冲能力,使其成为蛋白质壁材的优良材料。牛乳蛋白是安全、营养、口感良好的乳源原料[6],具有良好的可溶性、乳化性、成膜性、缓冲能力,在一定条件下,乳中的蛋白质能够自我缔合或与其他金属离子及小分子结合[7-9];此外,牛乳蛋白作为包埋壁材还有一个潜在的好处,即在消化酶的作用下可以分解产生大量的生物活性肽,为机体提供有益作用[10-11]。因此,将牛乳蛋白作为益生菌的包埋壁材具有优良的应用价值。
利用微胶囊包埋益生菌的方法很多,乳化法因其操作容易,设备简单,很容易按比例控制乳化量,并且制备的微胶囊颗粒粒径较小,故常用于益生菌微胶囊的制备。乳化法根据制备过程跟原理的不同分为外源乳化法和内源乳化法,外源乳化法是将壁材溶液与菌液混合,加入到油中乳化,待形成均匀的W/O乳化液,加入离子态的交联剂(如CaCl2),使壁材彼此交联并固化从而形成微胶囊。而内源乳化法是将壁材和难溶性的交联剂(不溶性钙盐,如CaCO3)混悬液先分散到油相中形成W/O型乳化液,通过加入酸引发难溶钙盐中Ca2+的解离,在乳化液滴内部使壁材交联并固化生成凝胶颗粒。相对于外源乳化法,内源乳化法制备的微胶囊直径易于控制,且颗粒较小,分布均匀。
Heidebach等[12]开发了一种新型内源乳化方法,以凝乳酶裂解的乳蛋白片段为壁材,并以可溶性钙盐CaCl2作为交联剂制备益生菌微胶囊。但此方法在制备微胶囊过程中,需要低温裂解,升温交联,工艺流程相对复杂,不易掌控,不适合规模化生产。
为了简化工艺流程,本研究尝试用CaCO3作为交联剂,在常温利用内源乳化法制备益生菌微胶囊。为此,本研究以Heidebach等[12]的方法为对照,在优化微胶囊制备工艺的基础上,对比分析两种不同钙盐交联剂(CaCl2和CaCO3)制得的微胶囊在包埋率、粒径大小及分布、微胶囊表面及微结构、在不利环境下对菌体的保护作用等方面的差异,旨在探究一种更加适用于制备益生菌微胶囊的方法。
1 材料与方法
1.1 材料与试剂
瑞士乳杆菌MG9-2(Lactobacillus helveticus MG9-2)内蒙古农业大学乳品生物技术与工程教育部重点实验室。
脱脂乳粉 恒天然有限公司;葵花油 金龙鱼食用油有限公司;凝乳酶(1 070 U/mL)、胃蛋白酶(3 000 U/mg)、胰蛋白酶(2 500 U/mg) 北京博奥拓达科技有限公司;CaCl2、CaCO3、冰醋酸 国药控股股份有限公司;MRS液体培基、MRS琼脂培养基 英国Oxoid试剂公司。
1.2 仪器与设备
RH basic1型磁力搅拌器 德国IKA公司;DM2000型显微镜 德国徕卡公司;SEM-SU8010型扫描电镜 日本日立公司;MLS-3750型灭菌锅、STAC-S45F型恒温培养箱 日本三洋公司;KDC-1044型低速离心机 安徽中佳科仪有限公司;超低温冰箱 中国海尔集团公司;pH计 瑞士Mettler Toledo公司。
1.3 方法
1.3.1 菌种培养
将瑞士乳杆菌MG9-2接种于MRS液体培养基,活化3 代后,在3 000 r/min条件下离心10 min,收集菌泥,重悬于灭菌水中得到浓缩菌液,使此浓缩菌液的菌密度约109CFU/mL,混匀后用MRS琼脂培养基倾注培养,对该浓缩菌液进行精确计数。
1.3.2 瑞士乳杆菌MG9-2微胶囊的制备工艺优化
1.3.2.1 瑞士乳杆菌MG9-2微胶囊的制备
CaCl2交联微胶囊的制备参照Heidebach等[12]的方法:将30 g菌乳混合液置于冰浴中,加入400 μL凝乳酶恒定速率搅拌(500 r/min)以降解酪蛋白,待降解完全后,再加入180 μL不同浓度的CaCl2溶液,保持恒速搅拌,使之混合均匀后,吸取10 g此混合液加入到预冷的葵花油中,继续恒速搅拌,此阶段需严格控制温度(低于5 ℃),待体系形成均匀的W/O乳状液后,提高体系温度至40 ℃,此时,乳状液滴立即转变成凝胶颗粒,选择不同的乳化搅拌速率,乳化15 min,离心(1 200 r/min,1 min)、洗涤,去除油相层,收集微胶囊颗粒,贮藏于4 ℃备用。
CaCO3交联微胶囊的制备参照Silva等[13]的方法:将30 g菌乳混合液置于冰浴中,加入400 μL凝乳酶恒定速率搅拌(500 r/min)以降解酪蛋白,待降解完全后,再加入180 μL不同浓度CaCO3悬浊液,继续恒速搅拌,吸取10 g此混合液加入到葵花油中,选择不同的乳化搅拌速率,在常温乳化15 min,待混合物形成均匀的W/O型乳化液,向体系中加入60 μL 8.5mol/L冰醋酸溶液,引发不容性钙盐中Ca2+的完全解离,促使Ca2+在乳液液滴内部与酪蛋白作用生成凝胶颗粒,静置30 min,离心、洗涤,收集凝胶颗粒,贮藏于4 ℃备用。
1.3.2.2 瑞士乳杆菌MG9-2微胶囊制备正交试验优化
在设定相关因素参数为固定值的前提下,分别考察乳化搅拌速率(200、400、600、800、1 000 r/min),水油比(1∶4、1∶6、1∶8、1∶10、1∶12),水相中脱脂乳质量浓度(0.20、0.25、0.30、0.35、0.40 g/mL),钙盐浓度(0.5、1.0、1.5、2.0、2.5 mol/L)对微胶囊的包埋率和粒径的影响,在单因素试验结果的基础上,通过正交分析法确定微胶囊制备的最佳工艺参数。
1.3.3 两种包埋方法对瑞士乳杆菌MG9-2微胶囊性能的影响
1.3.3.1 微胶囊的包埋率测定
模拟肠液的配制:参照Mokarram等[14]的方法,用NaOH溶液将NaCl溶液(8.5 g/L)的pH值调节到8.0,然后按0.1 g/mL加入胰蛋白酶,最后用0.22 μm的膜进行过滤除菌。
称取0.5 g湿微胶囊加入到4.5 mL预热的模拟肠液中,37 ℃、180 r/min条件下温育2.5 h,使菌体完全释放,然后取样梯度稀释,采用倾注法于MRS琼脂培养基,然后在37 ℃培养48 h后活菌计数。包埋率计算公式如下:

式中:微胶囊中活菌数量为每克湿微胶囊的含菌量与收集得到微胶囊总质量的乘积;初始活菌数量为每毫升浓缩菌液的含菌量与加入浓缩菌液总体积的乘积。
1.3.3.2 微胶囊的形态观察及粒径的分析
通过徕卡显微镜观测微胶囊的粒径大小及其分布:取20 μL微胶囊分散液均匀置于载玻片上,观察微胶囊的形态特征,并对载玻片上湿态微胶囊进行随机取样并拍照,通过Leica Qwin软件对60 个随机取样的微胶囊进行粒径分析并测量[15]。另外,用亚甲蓝染液对载玻片上的微胶囊进行染色,进一步观察微胶囊崩解的情况及其所包含菌体的形态。
通过扫描电子显微镜观察微胶囊的超微结构:用双面胶将自然干燥后的微胶囊干粉粘在样品台上,喷金后用扫描电镜观察微胶囊表面结构。
1.3.3.3 微胶囊在模拟肠液中的崩解实验
取0.5 g湿微胶囊,将其分散于4.5 mL预热的模拟肠液中,在37 ℃、180 r/min条件下振荡培养2.5 h,在30、60、90、120、150 min时取样,并按1.3.3.1节方法计算释放到模拟肠液中的活菌数。
1.3.3.4 微胶囊在模拟胃液中的存活实验
模拟胃液的配制:参照Dolly[16]、Rajam等[17]的方法,用浓盐酸将NaCl溶液(8.5 g/L)的pH值调节到2.0,加入3 g/L的胃蛋白酶溶液,最后用0.22 μm的膜进行过滤除菌。分别取0.5 g湿微胶囊和0.5 mL MG9-2浓缩菌液(空白对照),将其分散于预热的4.5 mL模拟胃液中,在37 ℃、180 r/min条件下振荡培养,分别在30、60、90、120、150 min取样,转入预热的模拟肠液中释放,按1.3.3.1节方法进行计数。
1.4 数据统计分析
所有独立实验至少重复3 次,应用SPSS 22.0统计软件对各实验数据进行方差分析和显著性检验;采用Origin 8.5作图。
2 结果与分析
2.1 瑞士乳杆菌MG9-2微胶囊制备工艺的优化
2.1.1 单因素试验结果
2.1.1.1 乳化搅拌速率对微胶囊性能的影响

图1 搅拌速率对微胶囊包埋率和粒径的影响Fig. 1 Effects of stirring speed on microencapsulation efficiency and microcapsule size
在水油比1∶8、脱脂乳质量浓度0.30 g/mL、钙盐浓度1.0 mol/L的条件下,考察乳化搅拌速率分别为200、400、600、800、1 000 r/min时对微胶囊的包埋率和粒径的影响。如图1所示,随着乳化搅拌速率的增加,两种微胶囊包埋率和粒径大小均发生显著变化(P<0.05),与Silva等[13]发现的结果一致。在搅拌速率600、800 r/min时,CaCO3、CaCl2为交联剂制得的微胶囊的包埋率较高,分别为(59.15±3.71)%、(57.87±3.44)%和(56.77±3.74)%、(56.54±3.16)%,CaCO3制得的微胶囊的粒径大小分布于100~120 μm,CaCl2制得的微胶囊粒径大小分布于130~155 μm。
当搅拌速率小于600 r/min时,微胶囊的包埋率较低,推测原因可能是低速的搅拌造成乳化过程较慢且乳化不完全,从而影响微胶囊的生成和粒径的大小;而搅拌速率大于800 r/min时,微胶囊的包埋率随着搅拌速率的增大而下降,其原因可能是搅拌速率过大时,强大作用力对微胶囊结构产生破坏,进而减小微胶囊的包埋率和粒径。
2.1.1.2 水油比对微胶囊性能的影响
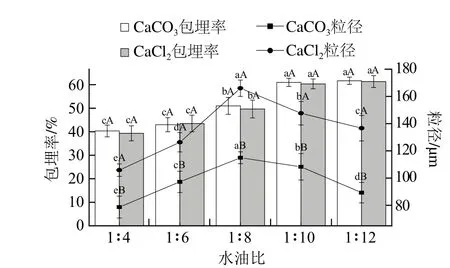
图2 水油比对微胶囊包埋率和粒径的影响Fig. 2 Effects of water-oil-ratio on microencapsulation efficiency and microcapsule size
在乳化搅拌速率800 r/min、脱脂乳质量浓度0.30 g/mL、钙盐浓度1.0 mol/L的条件下,考察水油比分别为1∶4、1∶6、1∶8、1∶10、1∶12时对微胶囊的包埋率和粒径的影响。由图2可知,随着油比例的增加,两种微胶囊的包埋率均显著升高(P<0.05),相反,微胶囊的粒径则随之减小。当水油比在1∶10和1∶12时,CaCO3、CaCl2为交联剂制得的两种微胶囊的包埋率处于同一显著水平,分别在59%~63%和58%~63%之间,此时,在水油比为1∶12时,微胶囊在电子显微镜下观察形态不规则(图3),水油比为1∶10时,两种微胶囊的呈球形。

图3 微胶囊在电子显微镜下的形态Fig. 3 Electron microscope image of microcapsules
在油比例较低时,在显微镜下观察到制得的微胶囊囊壁较薄,随着搅拌、离心、洗涤等外界机械力的作用容易破裂,因此,微胶囊的包埋率较低但粒径较小,且形态较规则;当水油比在1∶12时,微胶囊的包埋率相对较高,粒径相对于在1∶10时的粒径较小,但其形态不规则,推测原因可能是由于单位乳化剂中的微胶囊含量较高,在搅拌的过程中球形颗粒相互挤压,使微胶囊的形态受到了一定的影响。
2.1.1.3 脱脂乳质量浓度对微胶囊性能的影响
在乳化搅拌速率800 r/min、水油比1∶8、钙盐浓度1.0 mol/L的条件下,考察脱脂乳质量浓度分别为0.20、0.25、0.30、0.35、0.40 g/mL时对微胶囊的包埋率和粒径的影响。由图4可知,壁材的质量浓度对微胶囊的包埋率和粒径有着重要的影响(P<0.05)。随脱脂乳质量浓度增加,两种微胶囊包埋率均呈先上升后下降的趋势,在脱脂乳质量浓度达到0.35 g/mL时,CaCO3、CaCl2微胶囊的包埋率均达到最高值,分别为(66.02±3.46)%和(65.07±2.02)%;两种微胶囊的粒径均随脱脂乳的浓度增加呈急剧上升趋势。Liu Xianqiao等[18]发现当低浓度海藻酸钠包埋时微胶囊的包埋率很低,很难形成球形,随着海藻酸钠浓度升高,微胶囊的包埋率显著升高,且形成的粒径较大。
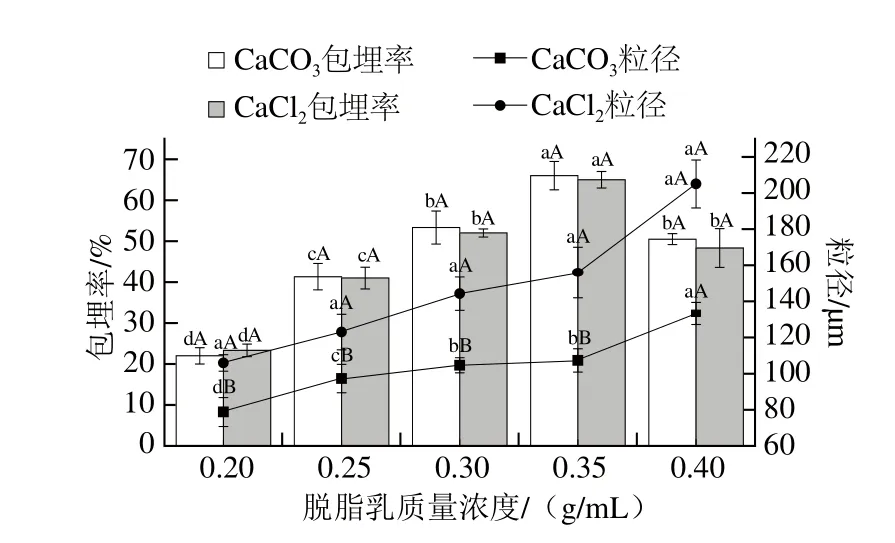
图4 脱脂乳质量浓度对微胶囊包埋率和粒径的影响Fig. 4 Effects of skim milk concentration on microencapsulation efficiency and microcapsule size
当脱脂乳质量浓度小于0.25 g/mL时,此时乳蛋白含量过少,在溶液中浓度太低,与钙离子的交联难度大,菌株不能被完全包埋。同时,两种微胶囊的质地均较细腻松散,在离心洗涤除去油脂时微胶囊结构易破坏,平板计数结果发现离心洗涤液中有大量游离瑞士乳杆菌
MG9-2,因此,两种微胶囊的包埋率均相对较低;而随着脱脂乳质量浓度的升高,乳化形成的蛋白质片段相互缔合,形成的微胶囊壁材强度增大,囊壁增厚,包埋率增高;当脱脂乳质量浓度达到0.35 g/mL时,再增加脱脂乳质量浓度,即蛋白质量浓度增高的同时,黏度也随之增加,在油相中分散较困难,易形成较大的蛋白网状结构,使得凝胶过早形成,从而形成多孔、粒径大而不均一的凝胶颗粒,在显微镜下观察到部分微胶囊相互黏连,形态不规则。为了不影响食品的感官特性,应严格控制壁材用量。
2.1.1.4 钙盐浓度对微胶囊性能的影响
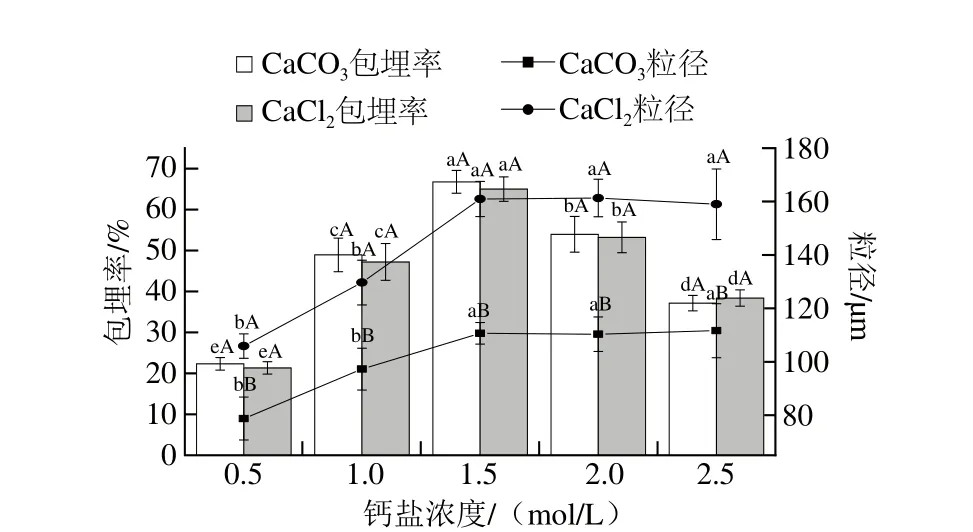
图5 钙盐浓度对微胶囊包埋率和粒径的影响Fig. 5 Effects of calcium salt concentration on microencapsulation efficiency and microcapsule size
在乳化搅拌速率800 r/min、水油比1∶8、脱脂乳质量浓度0.30 g/mL的条件下,考察钙盐浓度分别为0.5、1.0、1.5、2.0、2.5 mol/L时对微胶囊的包埋率和粒径的影响。如图5所示,不同钙盐浓度对微胶囊的包埋率有着极为重要的影响,而对微胶囊粒径的影响较小。随钙盐浓度的增加,两种微胶囊的包埋率均发生显著变化(P<0.05),当钙盐浓度为1.5 mol/L,两种微胶囊的包埋率显著高于其他组(P<0.05),此时,CaCO3、CaCl2微胶囊的包埋率分别为(66.77±2.80)%和(65.00±3.10)%。许多研究也证实钙盐诱导凝胶形成的凝胶体系稳定[19-20]。原因可能是Ca2+自身化合价较高,使得其屏蔽蛋白质分子间静电力的作用较大,此外,Ca2+可在带负电荷的蛋白质分子之间形成盐桥,最终导致的Ca2+凝胶能力强于类型盐离子的凝胶能力[21]。
当钙盐浓度较低时,不利于Ca2+和脱脂乳的完全交联,从而影响凝胶的效果,降低了MG9-2微胶囊的包埋率;相反,适当增加Ca2+的浓度,其诱导形成凝胶的脆性、硬度也随之增加[22-23],能显著提高MG9-2微胶囊的形成,然而当钙盐浓度大于2.0 mol/L时,两种微胶囊的包埋率显著降低(P<0.05),原因是Ca2+浓度过高有可能会导致渗透压升高,而高渗透压对益生菌有致死作用[24]。
2.1.2 正交试验结果
在单因素试验的基础上,选择乳化搅拌速率(400、600、800 r/min)、水油比(1∶6、1∶8、1∶10)、脱脂乳质量浓度(0.25、0.30、0.35 g/mL)、钙盐浓度(1.0、1.5、2.0 mol/L)因素进行正交试验,以微胶囊的包埋率和粒径为评价指标确定最佳工艺条件。MG9-2微胶囊工艺条件优化设计与结果见表1和表2。

表1 CaCO3为交联剂制备微胶囊工艺优化L9(34)的正交试验结果Table 1 Orthogonal array design L9(34) together with experimental results for optimization of microencapsulation with CaCO3

表2 CaCl42为交联剂制备微胶囊工艺优化L9(3)的正交试验结果Table 2 Orthogonal array design L49(3) together with experimental results for optimization of microencapsulation with CaCl 2
包埋率是评价微胶囊的重要指标,因为保持益生菌在微胶囊中的活性对其实现益生功效十分重要。同时,粒径大小决定微胶囊能否直接应用于食品中,由于微胶囊的粒径大小会影响食品的品质和口感,且形状又决定了其在食品中的流动性,故只有当益生菌微胶囊的粒径较小、形状较规则时,食品的品质才不会受到影响[25-26]。
由表1和表2可知,影响两种微胶囊包埋率因素的主次顺序均为脱脂乳质量浓度(C)>钙盐浓度(D)>水油比(B)>搅拌速率(A),因此,以包埋率为评价指标,两种微胶囊最佳的工艺组合水平为A2B3C3D2;影响两种微胶囊粒径大小因素的主次顺序均为搅拌速率(A)>脱脂乳质量浓度(C)>水油比(B)>钙盐浓度(D),以粒径大小为评价指标,两种微胶囊最佳的工艺组合水平为A3B2C1D1。根据正交试验的综合平衡法,以包埋率为主要的评价指标,且考虑微胶囊粒径大小的因素,确定两种微胶囊最佳的工艺参数为乳化搅拌速率800 r/min、水油比1∶10、脱脂乳质量浓度0.35 g/mL、钙盐浓度1.5 mol/L,在此条件下以CaCO3、CaCl2为交联剂制得的微胶囊包埋率分别为(78.4±3.6)%和(75.7±4.9)%,均显著高于其他组(P<0.05)。两种微胶囊制备的最佳工艺参数均一致,可能是两种方法制备微胶囊的过程中凝乳酶的活力及其添加量、壁材和乳化油等重要条件均完全相同。
2.2 两种微胶囊的包埋率比较
包埋率是评价微胶囊的重要指标,结果显示, 以CaCO3为交联剂制得的MG9-2微胶囊的包埋率为(78.4±3.6)%,以CaCl2为交联剂制得的MG9-2微胶囊的包埋率为(75.7±4.9)%,两种方法制得微胶囊的包埋率均较高,无显著性差异。许多研究也证实Ca2+凝胶能力较强[27-28],其机理是蛋白质在热诱导条件下,使其分子中的疏水基团暴露,形成的蛋白质凝聚物依靠彼此之间的静电排斥力作用,形成稳定的分散体系。而盐离子的加入,通常可以通过屏蔽电子或者特殊离子的疏水相互作用而使蛋白质凝聚物聚集最终形成凝胶。钙离子除了上述作用外,可以与蛋白质凝聚物所带的负离子基团作用,在蛋白质之间通过钙离子形成盐桥,进而形成稳定的凝胶体系。
不同钙盐(CaCO3和CaCl2)交联剂诱导凝胶的方式不同,CaCl2为交联剂制得微胶囊是基于温度诱导而形成凝胶,因为κ-酪蛋白在低温可被凝乳酶裂解,但在低温酪蛋白不能与Ca2+交联形成凝胶,当温度升高至18~20 ℃时,会形成凝胶颗粒将MG9-2包埋,但此方法需要低温裂解,再升温交联,工艺流程过于复杂,不易掌控。而CaCO3制得微胶囊是基于酸诱导瞬间形成的,是由于将水溶性酸添加到油相中,可使得有机酸立即分配到水相中,从而瞬间降低液滴pH值,引发不溶性钙盐中Ca2+在W/O型乳液液滴内部释放,并与酪蛋白交联快速形成凝胶颗粒,将MG9-2包埋于微胶囊内部,此方法在室温即可反应形成凝胶颗粒,工艺操作简单,容易控制。
2.3 两种微胶囊的粒径及分布比较
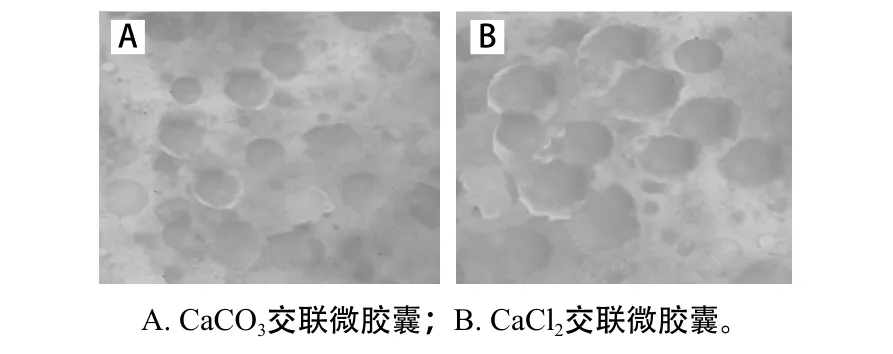
图6 两种微胶囊在光学显微镜下的形态Fig. 6 Optical images of two different microcapsules

图7 两种微胶囊的粒径分布Fig. 7 Mean size distributions of two different microcapsules
粒径大小及其分布对微胶囊能否直接应用于食品至关重要。本研究使用徕卡显微镜测定了两种微胶囊的粒径大小及其分布,结果显示,CaCl2为交联剂制得的微胶囊的平均粒径为(152.37±10.19) μm,而CaCO3为交联剂制得的微胶囊的平均粒径较小为(102.38±6.23)μm;在图6光学显微镜下也可观察到CaCO3微胶囊的粒径较小,且分散性较好,而CaCl2微胶囊的粒径较较大,容易聚集;由图7可知,以CaCl2为交联剂得到的MG9-2微胶囊粒径分布较广,75%的颗粒分布于120~160 μm,而以CaCO3为交联剂得到的MG9-2微胶囊粒径分布相对较窄,80%的颗粒分布于90~120 μm。
在乳化法中,壁材含量、水油比、搅拌速率等是控制微胶囊的粒径及其分布的重要参数[29-30]。但在本实验中,这些因素参数在这两种制备微胶囊方法均相同,故两种微胶囊的粒径及其分布之间的差异主要是两种钙盐诱导的方式不同造成的。对CaCl2微胶囊来说,低温时可溶性CaCl2已均匀地分散于乳状液中,与酪蛋白充分接触,当温度升高,Ca2+不仅在乳状液内部进行交联,同时也将两个或多个颗粒交联在一起,故以CaCl2为交联剂得到的MG9-2微胶囊常聚集在一起,粒径较大,分散性不好[31];Esquisabelr等[32]研究了微胶囊粒径大小与油脂黏度间的关系,得出的结论黏度越大,微胶囊粒径越小。此方法的凝胶是在40 ℃条件下形成的,随着温度的升高,油脂的黏度降低,可能会引起凝胶颗粒的生成较大。而CaCO3微胶囊是由于冰醋酸引发不容性钙盐中Ca2+在W/O型乳液液滴内部释放,并与酪蛋白交联而形成的,故CaCO3微胶囊的粒径主要取决于分散相之间的平衡及凝胶颗粒的表面张力,因此,以CaCO3为交联剂得到的MG9-2微胶囊粒径更小,分散性更好[33],此方法制得的益生菌微胶囊更适合添加于食品中。
2.4 两种微胶囊表观形态的比较
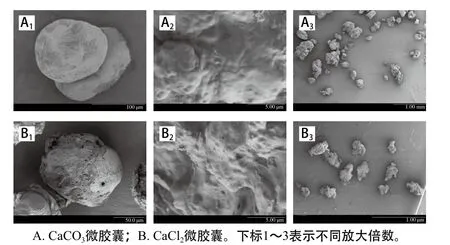
图8 两种微胶囊的扫描电镜图Fig. 8 SEM images of two different microcapsules
图8 为两种微胶囊经亚甲蓝染色后的形态,可以看到两种微胶囊中均有大量的菌体存在,证实了MG9-2被包埋于微胶囊中。CaCO3微胶囊呈均匀球形,表面较致密,光滑(图8A1和8A2),CaCl2微胶囊呈球性较差,且微胶囊表面疏松多孔(图8B1和8B2),此外,CaCO3微胶囊球状规则,分布均匀(图8A3),CaCl2微胶囊不规则的聚集体随处可见(图8B3)。
CaCl2微胶囊制备过程中,可溶性钙盐CaCl2不仅在乳状液内部进行交联,同时也将两个或多个颗粒交联在一起,因此形成的凝胶颗粒容易凝聚(图8B3),且凝胶颗粒受力不均匀,造成MG9-2微胶囊形状不规则,结构疏松[34]。相反,冰醋酸瞬间引发CaCO3中Ca2+在W/O型乳液液滴内部释放,并与酪蛋白在乳液液滴内部交联,故形成的微胶囊粒径更小、更均匀、分散性更好。因此,以CaCO3为交联剂制得的MG9-2微胶囊呈均匀球状,且结构更加致密、粒径更小、分散性更好,故CaCO3微胶囊更适合添加至食品中。
2.5 两种微胶囊在模拟肠液中释放性的比较

图9 瑞士乳杆菌MG9-2微胶囊崩解图Fig. 9 Disintegration of microcapsules
两种微胶囊在模拟肠液中不同时间的崩解情况如图9所示,经亚甲蓝染色观察可知微胶囊崩解过程中,牛乳蛋白壁材在模拟肠液中逐步分解,蛋白质逐渐分解成网状交联的小片段,最终将瑞士乳杆菌MG9-2释放完全。由图9A2和9B2可知,微胶囊在模拟肠液中30 min时,大部分CaCO3为交联剂制得的微胶囊完成崩解,此时只有一小部分CaCl2为交联剂制得微胶囊崩解完成。

图10 瑞士乳杆菌MG9-2微胶囊在模拟肠液中的释放性Fig. 10 Release characteristics of encapsulated L. helveticus MG9-2 in simulated intestinal fluid (SIF)
由图10可知,两种钙盐制得的微胶囊均可在90 min内完全释放,CaCO3为交联剂制得的微胶囊70%的菌体是在30 min内释放的;而CaCl2微胶囊在30 min时仅释放40%的菌体,故表明CaCO3微胶囊的肠液释放性明显较好。Annan等[35]比较了不同乳化方法对益生菌在模肠液中释放性的影响,结果发现,相比于内源乳化法方法,外源乳化法方法制备得到的微胶囊容易成簇聚集,在模拟肠液中释放的时间较长。因此推测,两种微胶囊在肠液中释放速度的差异主要是由于微胶囊粒径大小及微结构的不同。本研究中,CaCO3微胶囊比CaCl2微胶囊粒径较小、分布较均匀、分散性较好,肠液与微胶囊接触的比表面积较大,酶的作用空间较大[36],故肠液释放性较好,更有利于瑞士乳杆菌MG9-2在肠道中的生长和定植。
2.6 两种微胶囊在模拟胃液中存活性的比较

图11 瑞士乳杆菌MG9-2微胶囊在模拟胃液中的存活性Fig. 11 Survival of encapsulated L. helveticus MG9-2 in simulated gastric fluid (SGF)
由图11可知,瑞士乳杆菌MG9-2菌株的耐胃酸性较差,在pH 2.0的模拟胃液中处理150 min,活菌数减少了2(lg(CFU/g))。这与许多研究一致,Heidebach等[12]将Lactobacillus paracasei F19在pH 2.5的模拟胃液中60 min后,菌的活性几乎全部丧失。而将MG9-2包埋于以脱脂乳为壁材的微胶囊中可以显著提高其在模拟胃液中的存活率(P<0.05),且两种方法制得的微胶囊在模拟胃液中处理150 min后,活菌数均高于8.0(lg(CFU/g))。推测微胶囊较强的耐胃酸性可能是由于脱脂乳的缓冲作用和微胶囊表面的低渗透性,该结论与许多研究一致,在邹强等[37]的分别以乳清蛋白和海藻酸钠包埋Bifidobacterium bifidum F-35,结果发现乳清蛋白微胶囊具有较好的耐胃酸性,这是由于乳清蛋白分子具有许多碱性的氨基酸残基,所以在偏中性的环境中,乳清蛋白具有较高的缓冲能力,在双歧杆菌微胶囊内部,这些氨基酸残基能够中和渗透进入的H+,从而维持一个pH值偏中性的内部环境,保持双歧杆菌的活性。Doherty等[38]以乳清蛋白包埋益生菌,在模拟胃液3 h中益生菌微胶囊表现出较高的耐胃酸性,他认为微胶囊较强的耐胃酸性主要由于乳清蛋白良好的缓冲作用;Heidebach等[12]发现将以酪蛋白包埋Bifidobacterium lactis Bb12,在pH 2.5的模拟胃液中处理90 min后,能够将B. lactis Bb12的存活率提高2 个对数值。
由图11可知,CaCO3微胶囊在模拟胃液中处理150 min后MG9-2活菌数降至8.419 (lg(CFU/g)),而CaCl2微胶囊在模拟胃液中处理150 min后活菌数降至8.034(lg(CFU/g)),且CaCl2微胶囊中的活菌数在30 min时开始显著下降,而CaCO3微胶囊的活菌数在90 min后才开始显著下降,因此,可以认为CaCO3微胶囊保护MG9-2抵御胃酸环境的性能显著优于CaCl2微胶囊。其原因可能是两种微胶囊表面结构之间的差异(图8),CaCl2微胶囊表面较疏松多孔,胃液容易渗入破坏菌体;而CaCO3微胶囊表面较为致密光滑,能较好地抵御胃液的渗透,更好地保护被包埋的瑞士乳杆菌MG9-2。
3 结 论
本实验以CaCO3和CaCl2为交联剂分别交联乳蛋白,利用内源乳化法制备瑞士乳杆菌MG9-2微胶囊,以正交试验确定MG9-2微胶囊制备的最佳工艺参数:乳化搅拌速率800 r/min、水油比1∶10、脱脂乳质量浓度0.35 g/mL、钙盐浓度1.5 mol/L。
研究表明,钙盐及其诱导交联方法的不同显著影响微胶囊的性能,以CaCO3、CaCl2为交联剂制得MG9-2微胶囊的包埋率分别为(78.4±3.6)%和(75.7±4.9)%,两种微胶囊的包埋率无显著性差异;以CaCO3为交联剂制得的MG9-2微胶囊粒径(102.38±6.23)μm较CaCl2微胶囊粒径(152.37±10.19)μm小,其表面更加致密、形状更规则、分散性更好;在模拟肠液中,CaCO3和CaCl2两种交联剂制得的微胶囊均可在90 min内完全释放,CaCO3为交联剂制得的微胶囊70%的菌体即可在30 min内释放完全,而CaCl2微胶囊在30 min时仅释放40%的菌体;CaCO3微胶囊在模拟胃液中处理150 min后,LIP-1活菌数降至8.419(lg(CFU/g)),而CaCl2微胶囊在同样条件下处理150 min后活菌数降至8.034(lg(CFU/g))。因此,以CaCO3为交联剂经酸诱导制得的MG9-2微胶囊性能较好;且此方法在室温即可形成凝胶,制备过程简单、工艺容易控制,该研究为益生菌微胶囊制备提供参考。
[1] GOMEZ-MASCARAQUE L G, MORFIN R C, P☒REZ-MASI☒ R, et al. Optimization of electrospraying conditions for the microencapsulation of probiotics and evaluation of their resistance during storage and in vitro digestion[J]. LWT-Food Science and Technology, 2016, 69: 438-446. DOI:10.1016/j.lwt.2016.01.071.
[2] ETCHEPARE M D A, RADDATZ G C, FLORES ☒ M D M, et al. Effect of resistant starch and chitosan on survival of Lactobacillus acidophilus, microencapsulated with sodium alginate[J]. LWTFood Science and Technology, 2016, 65: 511-517. DOI:10.1016/ j.lwt.2015.08.039.
[3] HOMAYOUNI A, AZIZI A, EHSANI M R, et al. Effect of microencapsulation and resistant starch on the probiotic survival and sensory properties of synbiotic ice cream[J]. Food Chemistry, 2008, 111(1): 50-55. DOI:10.1016/j.foodchem.2008.03.036.
[4] 邹强. 双歧杆菌微胶囊的研究[D]. 无锡: 江南大学, 2012: 12-15.
[5] GUNASEKARAN S, XIAO L, OULD ELEYA M. Whey protein concentrate hydrogels as bioactive carriers[J]. Journal of Applied Polymer Science, 2006, 99(5): 2470-2476. DOI:10.1002/app.22838.
[6] LIVNEY Y D. Milk proteins as vehicles for bioactives[J]. Current Opinion in Colloid & Interface Science, 2010, 15(1): 73-83. DOI:10.1016/j.cocis.2009.11.002.
[7] DOHERTY S B, GEE V L, ROSS R P, et al. Development and characterisation of whey protein micro-beads as potential matrices for probiotic protection[J]. Food Hydrocolloids, 2011, 25(6): 1604-1617. DOI:10.1016/j.foodhyd.2010.12.012.
[8] EL-SALAM M H A, EL-SHIBINY S. Formation and potential uses of milk proteins as nano delivery vehicles for nutraceuticals: a review[J]. International Journal of Dairy Technology, 2012, 65(1): 13-21. DOI:10.1111/j.1471-0307.2011.00737.x.
[9] DOHERTY S B, AUTY M A, STANTON C, et al. Survival of entrapped Lactobacillus rhamnosus GG in whey protein micro-beads during simulated ex vivo gastro-intestinal transit[J]. International Dairy Journal, 2012, 22(1): 31-43. DOI:10.1016/ j.idairyj.2011.06.009.
[10] KILARA A, PANYAM D. Peptides from milk proteins and their properties[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(6): 607-633. DOI:10.1080/10408690390251138.
[11] KORHONEN H, PIHLANTO A. Food-derived bioactive peptidesopportunities for designing future foods[J]. Current Pharmaceutical Design, 2003, 9(16): 1297-1308. DOI:10.2174/1381612033454892.
[12] HEIDEBACH T, F☒RST P, KULOZIK U. Microencapsulation of probiotic cells by means of rennet-gelation of milk proteins[J]. Food Hydrocolloids, 2009, 23(7): 1670-1677. DOI:10.1016/j.foodhyd.2009.01.006.
[13] SILVA C M, RIBEIRO A J, FIGUEIREDO M, et al. Microencapsulation of hemoglobin in chitosan-coated alginate microspheres prepared by emulsification/internal gelation[J]. The AAPS Journal, 2005, 7(4): E903-E913. DOI:10.1208/aapsj070488.
[14] MOKARRAM R R, MORTAZAVI S A, NAJAFI M B H, et al. The influence of multi stage alginate coating on survivability of potential probiotic bacteria in simulated gastric and intestinal juice[J]. Food Research International, 2009, 42(8): 1040-1045. DOI:10.1016/ j.foodres.2009.04.023.
[15] KRASAEKOOPT W, BHANDARI B, DEETH H. The influence of coating materials on some properties of alginate beads and survivability of microencapsulated probiotic bacteria[J]. International Dairy Journal, 2004, 14(8): 737-743. DOI:10.1016/j.idairyj.2004.01.004.
[16] DOLLY P, ANISHAPARVIN A, JOSEPH G S, et al. Microencapsulation of Lactobacillus plantarum (MTCC 5422) by spray-freeze-drying method and evaluation of survival in simulated gastrointestinal conditions[J]. Journal of Microencapsulation, 2011, 28(6): 568-574. DOI:10.3109/02652048.2011.599435.
[17] RAJAM R, KARTHIK P, PARTHASARATHI S, et al. Effect of whey protein-alginate wall systems on survival of microencapsulated Lactobacillus plantarum in simulated gastrointestinal conditions[J]. Journal of Functional Foods, 2012, 4(4): 891-898. DOI:10.1016/ j.jff.2012.06.006.
[18] LIU X Q, MA Z Y, XING J M, et al. Preparation and characterization of amino-silane modified superparamagnetic silica nanospheres[J]. Journal of Magnetism and Magnetic Materials, 2004, 270(1): 1-6. DOI:10.1016/j.jmmm.2003.07.006.
[19] SU R, ZHU X L, FAN D D, et al. Encapsulation of probiotic Bifidobacterium longum BIOMA 5920 with alginate-human-like collagen and evaluation of survival in simulated gastrointestinal conditions[J]. International Journal of Biological Macromolecules, 2011, 49(5): 979-984. DOI:10.1016/j.ijbiomac.2011.08.018.
[20] REID A A, CHAMPAGNE C P, GARDNER N, et al. Survival in food systems of Lactobacillus rhamnosus R011 microentrapped in whey protein gel particles[J]. Journal of Food Science, 2007, 72(1): M031-M037. DOI:10.1111/j.1750-3841.2006.00222.x.
[21] BRYANT C M, MCCLEMENTS D J. Optimizing preparation conditions for heat-denatured whey protein solutions to be used as cold-gelling ingredients[J]. Journal of Food Science, 2000, 65(2): 259-263. DOI:10.1111/j.1365-2621.2000.tb15990.x.
[22] GOULAS T K, GOULAS A K, TZORTZIS G, et al. Molecular cloning and comparative analysis of four β-galactosidase genes from Bifidobacterium bifidum NCIMB41171[J]. Applied Microbiology and Biotechnology, 2007, 76(6): 1365-1372. DOI:10.1007/ s00253-007-1099-1.
[23] HU J M, LI H, CAO L X, et al. Molecular cloning and characterization of the gene encoding cold-active β-galactosidase from a psychrotrophic and halotolerant Planococcus sp. L4[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2217-2224. DOI:10.1021/jf062910r.
[24] XAVIER M F, LOPES T J, QUADRI M G N, et al. Extraction of red cabbage anthocyanins: optimization of the operation conditions of the column process[J]. Brazilian Archives of Biology and Technology, 2008, 51(1): 143-152. DOI:10.1590/S1516-89132008000100018.
[25] NAG A, HAN K S, SINGH H. Microencapsulation of probiotic bacteria using pH-induced gelation of sodium caseinate and gellan gum[J]. International Dairy Journal, 2011, 21(4): 247-253. DOI:10.1016/j.idairyj.2010.11.002.
[26] MCMASTER L D, KOKOTT S A. Micro-encapsulation of Bifidobacterium lactis for incorporation into soft foods[J]. World Journal of Microbiology and Biotechnology, 2005, 21(5): 723-728. DOI:10.1007/s11274-004-4798-0.
[27] MARANGONI A G, BARBUT S, MCGAULEY S E, et al. On the structure of particulate gels-the case of salt-induced cold gelation of heat-denatured whey protein isolate[J]. Food Hydrocolloids, 2000, 14(1): 61-74. DOI:10.1016/S0268-005X(99)00046-6.
[28] SHAMEKHI F, SHUHAIMI M, ARIFF A, et al. Cell viability of microencapsulated Bifidobacterium animalis subsp. lactis under freezedrying, storage and gastrointestinal tract simulation conditions[J]. Folia Microbiologica, 2013, 58(2): 91-101. DOI:10.1007/s12223-012-0183-9.
[29] MORTAZAVIAN A M, EHSANI M R, AZIZI A, et al. Viability of calcium-alginate-microencapsulated probiotic bacteria in Iranian yogurt drink (Doogh) during refrigerated storage and under simulated gastrointestinal conditions[J]. Australian Journal of Dairy Technology, 2008, 63(1): 25.
[30] SILVA C M, RIBEIRO A J, FIGUEIREDO M, et al. Microencapsulation of hemoglobin in chitosan-coated alginate microspheres prepared by emulsification/internal gelation[J]. The AAPS Journal, 2005, 7(4): E903-E913. DOI:10.1208/aapsj070488.
[31] SILVA C M, RIBEIRO A J, FIGUEIREDO I V, et al. Alginate microspheres prepared by internal gelation: development and effect on insulin stability[J]. International Journal of Pharmaceutics, 2006, 311(1): 1-10. DOI:10.1016/j.ijpharm.2005.10.050.
[32] ESQUISABELR A, HERN☒ANDEZ M, IGARTUAA M, et al. Production of BCG alginate-PLL microcapsules by emulsification/ internal gelation[J]. Journal of Microencapsulation, 1997, 14(5): 627-638. DOI:10.3109/0265204970900 6815.
[33] CHAN L W, LEE H Y, HENG P W S. Mechanisms of external and internal gelation and their impact on the functions of alginate as a coat and delivery system[J]. Carbohydrate Polymers, 2006, 63(2): 176-187. DOI:10.1016/j.carbpol.2005.07.033.
[34] MUTHUKUMARASAMY P, ALLAN-WOJTAS P, HOLLEY R A. Stability of Lactobacillus reuteri in different types of microcapsules[J]. Journal of Food Science, 2006, 71(1): M20-M24. DOI:10.1111/j.1365-2621.2006.tb12395.x.
[35] ANNAN N T, BORZA A D, HANSEN L T. Encapsulation in alginatecoated gelatin microspheres improves survival of the probiotic Bifidobacterium adolescentis 15703T during exposure to simulated gastro-intestinal conditions[J]. Food Research International, 2008, 41(2): 184-193. DOI:10.1016/j.foodres.2007.11.001.
[36] CHEN L, SUBIRADE M. Alginate-whey protein granular microspheres as oral delivery vehicles for bioactive compounds[J]. Biomaterials, 2006, 27(26): 4646-4654. DOI:10.1016/ j.biomaterials.2006.04.037.
[37] 邹强, 梁华忠, 龚春雪, 等. 海藻酸钠和乳清蛋白作为益生菌包埋壁材的比较[J]. 食品科学, 2014, 35(15): 207-211. DOI:10.7506/ spkx1002-6630-201415042.
[38] DOHERTY S B, GEE V L, ROSS R P, et al. Development and characterisation of whey protein micro-beads as potential matrices for probiotic protection[J]. Food Hydrocolloids, 2011, 25(6): 1604-1617. DOI:10.1016/j.foodhyd.2010.12.012.
Optimization of Preparation Process and Properties of Microcapsules Containing Lactobacillus helveticus MG9-2
SONG Jiaojiao, BAO Qiuhua, WANG Yali, SHANG Yina, HUO Qiwen, ZHANG Xiaoning, CHEN Jing, LI Minghui, WANG Junguo*
(Key Laboratory of Dairy Biotechnology and Engineering, Ministry of Education, Key Laboratory of Dairy Processing, Ministry of Agriculture, Inner Mongolia Agricultural University, Hohhot 010018, China)
Lactobacillus helveticus MG9-2 was microencapsulated with milk protein as wall material by means of emulsification/internal gelation. The preparation process was optimized, and the effect of different calcium salts (CaCO3and CaCl2) as crosslinking agents on microencapsulation efficiency was investigated. The results showed that the optimal process parameters were as follows: stirring speed, 800 r/min; water-to-oil ratio, 1:10; concentration of skim milk, 0.35 g/mL; and concentration of calcium salt, 1.5 mol/L. Under these conditions, the microencapsulation efficiency (ME) of viable cells with CaCO3and CaCl2were (78.4 ± 3.6)% and (75.7 ± 4.9)%, respectively, with no significant difference being observed between them. Microcapsules prepared with CaCO3were smaller in size than those prepared with CaCO3, exhibiting a more compact surface, and a more regular spherical shape and a narrower size distribution and displaying a better resistance to intestinal release and gastric acid. The findings demonstrated that microcapsules with improved properties could be prepared more simply using CaCO3as crosslinking agent than CaCl2.
microencapsulation; Lactobacillus helveticus MG9-2; CaCl2; CaCO3
10.7506/spkx1002-6630-201714008
TS252
A
1002-6630(2017)14-0049-09
宋娇娇, 包秋华, 王亚利, 等. 瑞士乳杆菌MG9-2微胶囊的制备工艺优化及其性能分析[J]. 食品科学, 2017, 38(14): 49-57.
10.7506/spkx1002-6630-201714008. http://www.spkx.net.cn SONG Jiaojiao, BAO Qiuhua, WANG Yali, et al. Optimization of preparation process and properties of microcapsules containing Lactobacillus helveticus MG9-2[J]. Food Science, 2017, 38(14): 49-57. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201714008. http://www.spkx.net.cn
2016-09-13
国家自然科学基金地区科学基金项目(31160315;31660456);国家自然科学基金青年科学基金项目(31301516);内蒙古自然科学基金项目(2015MS0306);中国科学院西部之光人才培养项目
宋娇娇(1991—),女,硕士研究生,研究方向为乳品微生物。E-mail:15661136791@163.com
*通信作者:王俊国(1970—),男,教授,博士,研究方向为乳品工艺学。E-mail:junguo379@aliyun.com

