维生素D受体对内毒素感染小鼠肺组织肾素-血管紧张素系统的影响
徐樱溪,赵 晴,孙 灿,车千红,付 瑜,丁 丁,孔 娟
·论著·
维生素D受体对内毒素感染小鼠肺组织肾素-血管紧张素系统的影响
徐樱溪,赵 晴,孙 灿,车千红,付 瑜,丁 丁,孔 娟*
目的 研究维生素D受体(Vitamin D receptor,VDR)对内毒素感染小鼠肺组织肾素-血管紧张素系统的影响。方法 随机选取15只C57BL/6源性的野生小鼠(WT组)和15只VDR敲除小鼠(KO组),予LPS腹腔注射并分别于注射前及注射后8、16 h各组随机选取5只小鼠,比较两组小鼠一般状态的变化;实时定量PCR测定两组小鼠肺组织中血管紧张素原(AGT)、肾素(Renin)、肾素受体(ReninR)、血管紧张素转化酶(ACE)、血管紧张素Ⅱ(AngⅡ)、血管紧张素Ⅱ-1型受体(AT1R)mRNA的表达水平及支气管肺泡灌洗液中AngⅡ水平及Renin活性变化情况。结果 一般状态比较,注射LPS后,两组小鼠均出现不良反应,KO组较WT组不良反应症状明显。LPS注射前,KO组肺组织中ACE、AngⅡ的mRNA表达水平较WT组升高(P<0.05),LPS注射后8、16 h时,KO组肺组织中Renin、ACE、AngⅡ、AT1R水平及肺泡灌洗液中AngⅡ水平、Renin活性均明显高于WT组(P<0.01),LPS注射16 h时,KO组AGT水平明显高于WT组(P<0.01)。结论 维生素D受体在内毒素感染时抑制肺组织中肾素-血管紧张素系统的激活,进而对肺组织起到保护作用。
维生素D受体;内毒素;肾素-血管紧张素系统
0 引言
维生素D受体(Vitamin D receptor,VDR)属于核受体超家族成员之一,主要参与机体钙磷代谢平衡的调节,也通过调控基因转录和表达,影响相应蛋白质的合成发挥其重要作用。VDR广泛存在于各种组织和器官中,与活化的1,25(OH)维生素D结合,调节下游信号系统,从而在抑制炎性反应、免疫调控、抗纤维化、抑制肿瘤等多个方面发挥积极的作用[1-5]。目前相关研究表明,维生素D与COPD[6-7]、哮喘[8]、结核病[9]、急性肺损伤(Acute lung injury,ALI)和急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)[10-13]等许多肺部疾病相关,然而其相关机制仍不清楚。
肾素-血管紧张素系统(Renin-angiotensin system,RAS)是由血管紧张素原(Angiotensinogen,AGT)、血管紧张素Ⅰ(Angiotensin Ⅰ,AngⅠ)、血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)、肾素(Renin)和血管紧张素转化酶(Angiotensin-converting enzyme,ACE)等一系列成分构成,其中AGT与Renin结合转化为AngⅠ,ACE将AngⅠ转化为AngⅡ,AngⅡ是RAS的主要效应蛋白,与受体结合发挥相应作用。这个系统的经典功能是通过AngⅡ与受体结合调节血压和水钠平衡,近年来发现,RAS参与调节机体的炎症、免疫、凋亡、组织修复、生殖发育、神经传导等多种生理活动[14-17],也参与了肺动脉高压、肺纤维化、肺血栓栓塞,特别是ALI/ARDS等肺部疾病的发生和发展[18],因此,RAS是机体的重要调节系统。有研究也已经关注到VDR对RAS中的肾素和AngⅡ在肺损伤时变化的影响[19],但VDR信号系统在内毒素对肺组织诱发炎症反应时RAS中的各个成分的变化情况,目前还没有系统的研究报道。
本研究将内毒素感染VDR受体敲除鼠和野生鼠的RAS各个成分的变化情况进行对比,以探讨内毒素感染时VDR对肺组织RAS的影响,为进一步研究维生素D及其信号系统对肺组织的影响提供理论依据。
1 材料与方法
1.1 实验动物及处理方法 随机选取15只C57BL/6源性的野生小鼠(WT组)和15只VDR敲除小鼠(KO组),体重20~25 g,性别不限,室温饲养。WT组饲料为普通动物饲料,自由饮水进食,KO组为了防止低血钙发生,给予高钙饮食(Harlan Teklad TD96348:20%乳糖,2%钙,1.25%磷),2~3月龄时予LPS以15 mg/kg腹腔注射并各组随机选取5只小鼠,分别于注射前及注射后8、16 h处死取材。
1.2 各组小鼠肺组织RAS成分测定 应用实时定量PCR法测定两组小鼠LPS注射前及注射后8、16 h肺组织中AGT、Renin、ReninR、ACE、AngⅡ、AT1R mRNA的表达水平。将小鼠肺组织提出后,用TRizol法按照试剂说明书提取总RNA,用美国Invitrogen公司的反转录试剂盒将RNA反转录成cDNA。使用Primer 3.0设计合成特异性引物(表1)。
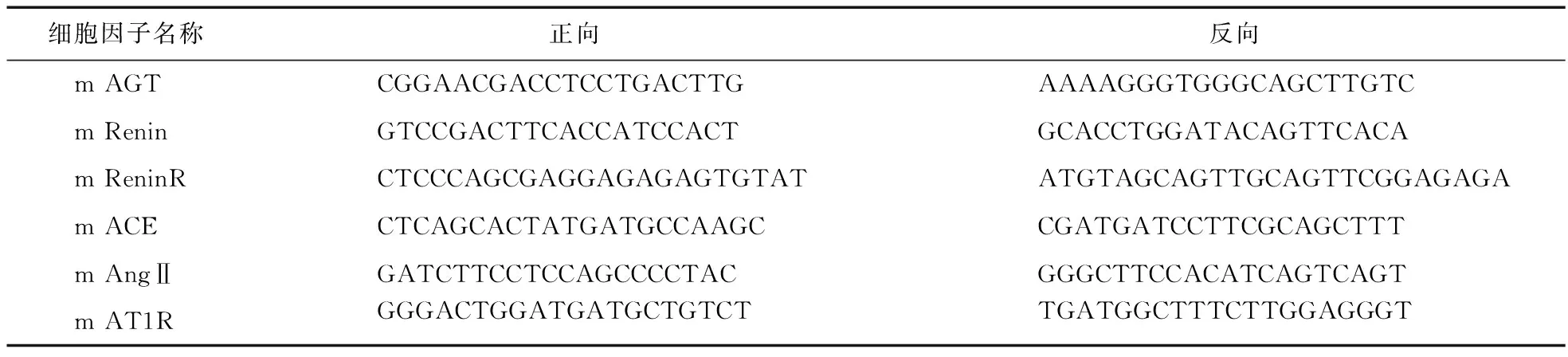
表1 RAS引物序列
1.3 支气管肺泡灌洗液中AngⅡ测定 将小鼠颈椎脱臼致死,切开颈部暴露气管,置管,以PBS液0.8 mL/只进行支气管肺泡灌洗2次,回收灌洗液1.4 mL,应用酶联免疫吸附试验(ELISA)法测定灌洗液,使用Human/Mouse/Rat Angiotensin Ⅱ Enzyme Immunoassay Kit (Ray Biotech,Inc),按照试剂说明测定支气管肺泡灌洗液中血管紧张素Ⅱ的浓度。
1.4 支气管肺泡灌洗液中肾素活性测定 将小鼠颈椎脱臼致死,切开颈部暴露气管,置管,以PBS缓冲液0.8 mL/只进行支气管肺泡灌洗2次,回收灌洗液1.4 mL,应用荧光法Sensolyte 520 Mouse Renin Assay Kit (AnaSpec,Inc),按照试剂说明测定支气管肺泡灌洗液中肾素活性。
1.5 统计学处理 应用SPSS 17.0软件对实验数据进行统计学分析。各组之间均数的比较符合正态分布具有方差齐性选用方差分析。检验水准为双侧α=0.05。
2 实验结果
2.1 各组小鼠一般状态比较 WT组小鼠注射LPS 4 h后,10只小鼠开始逐渐出现皮肤潮湿,倦怠,活动能力下降,进食及进水量进行性下降,呼吸深大。KO组小鼠注射LPS 2 h后,10只小鼠开始逐渐出现皮肤潮湿,倦怠,活动能力明显下降,不能正常行走,进食及进水量进行性下降,腹泻明显,呼吸深大;14 h后出现呼吸困难。注射16 h内WT组及KO组小鼠均无死亡发生。
2.2 各组小鼠肺组织中RAS各成分比较 LPS注射前,KO组肺组织中ACE、AngⅡ的mRNA表达水平较WT组升高(P<0.05);LPS注射后8、16 h,KO组肺组织中Renin、ACE、AngⅡ、AT1R水平均明显高于WT组(P<0.01)。LPS注射后8 h,KO组肺组织中AGT与WT组比较差异无统计学意义(P>0.05),而16 h时KO组肺组织中AGT水平明显高于WT组(P<0.01)。LPS注射前及注射后8、16 h时,WT组与KO组肺组织中ReninR水平比较差异均无统计学意义(P>0.05)。见图1。
2.3 各组小鼠支气管肺泡灌洗液中AngⅡ比较 处理前两组小鼠支气管肺泡灌洗液中AngⅡ含量比较差异无统计学意义(P>0.05),注射LPS 8、16 h后,KO组小鼠肺泡灌洗液AngⅡ含量较WT组明显升高(P<0.01)。见图2。
2.4 各组小鼠支气管肺泡灌洗液中肾素活性比较 处理前两组小鼠支气管肺泡灌洗液中肾素活性比较差异无统计学意义(P>0.05),注射LPS 8、16 h后,KO组小鼠支气管肺泡灌洗液中肾素活性较WT组明显升高(P<0.01)。见图3。
3 讨论
RAS是机体重要的调节系统,对肺组织细胞的生长、凋亡起着重要的调节作用,其在内毒素所致肺组织感染中的作用也日益受到关注。内毒素感染时,各种损伤刺激因素可直接或间接地通过其他细胞因子改变肺组织RAS各成分活性,同时RAS各成分的变化情况又可反作用于肺组织,进一步影响炎症感染的转归[20-21],因此,肺组织中RAS各成分的变化情况对肺组织的影响尤为重要。

图1 各组小鼠肺组织中RAS比较
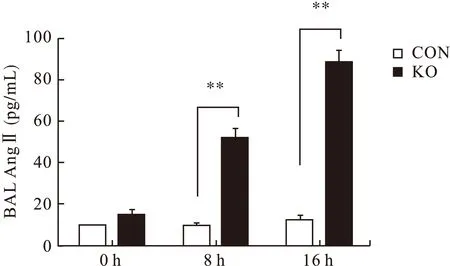
图2 各组小鼠肺泡灌洗液中AngⅡ比较

图3 各组小鼠肺泡灌洗液中肾素活性比较
本研究中,基础状态下测定KO组及WT组小鼠肺组织RAS各成分的情况发现,VDR敲除小鼠肺组织ACE及AngⅡ水平高于野生小鼠。AngⅡ能够通过AT1R直接作用或通过TGF-β通路激活结缔组织生长因子(CTGF)等促炎因子[22]诱发炎症反应。ACE及AngⅡ生产增多也能刺激血管组织胶原生成及基质重构,减少弹力蛋白合成,抑制血管内部一氧化氮(NO)信号通路传导,对血管产生进一步损伤[23]。在基础状态下,RAS中ACE及AngⅡ的升高可能提示VDR敲除小鼠较普通野生小鼠更易发生肺部炎症感染及肺组织内皮血管的损伤。
针对两组小鼠一般状态的比较我们发现,内毒素感染后KO组小鼠深大呼吸的出现较WT组更早,且KO组小鼠出现了明显的呼吸困难。国外研究发现,内毒素感染后VDR敲除鼠72 h后全部出现死亡,而正常对照组在96 h仍有60%存活[19]。本研究中VDR敲除小鼠没有出现死亡,可能与本研究观察时间较短有关。两组小鼠一般状态的改变提示内毒素感染对VDR敲除鼠的不良影响更为严重。
本研究结果显示,在内毒素感染前、感染后8 h,VDR敲除鼠肺组织中AGT含量与正常野生鼠之间并无明显差异,感染后16 h,两组小鼠肺组织AGT含量出现显著差异。AGT的启动子区含有NF-κB结合序列,故其转录受到NF-κB的调控,VDR信号传导可通过阻断NF-κB活化从而使AGT的表达减弱[24]。VDR敲除小鼠NF-κB活化增强,但在早期并未明显影响AGT的变化,随着感染进一步加重,AngⅡ迅速升高,进一步激活NF-κB,对AGT形成正反馈,使VDR敲除鼠肺组织AGT表达较野生小鼠明显增加。内毒素感染后8、16 h,肺组织中Renin含量出现明显上升,且KO组较WT组上升更为显著。由于肺组织中ACE含量较多,AngⅠ转化为AngⅡ速度非常快,肺组织AngⅠ含量非常少而难以测定,所以本研究中未对AngⅠ进行监测。Renin与ReninR结合后可诱导其自身活化,并促使AGT向AngⅠ、Ⅱ转化,即AngⅡ依赖性信号途径,而ReninR本身不发挥生物学效应。但随着研究的深入,有报道,ReninR还能激活细胞内非AngⅡ依赖性信号途径,其本身在介导病理损伤也中发挥重要作用[25],而本研究发现,内毒素感染后,肺组织ReninR未见明显上升,且KO组与WT组小鼠肺组织含量也无显著差异,考虑可能由于观察时间较短,ReninR尚未激活,或者与VDR对其影响较小有关。对于VDR敲除小鼠,ReninR在内毒素感染后肺组织的变化情况还需要更多的研究进一步探讨,以明确其变化及机制。肺组织毛细血管是合成释放ACE的主要部位,ACE的检测可作为肺组织内皮损伤的早期指标,本研究发现,虽然在基础状态下两组小鼠肺组织中ACE、AngⅡ水平差异有统计学意义,但内毒素感染后两组小鼠肺组织中ACE、AngⅡ含量差异进一步增加,而且,在内毒素感染16 h时,KO组小鼠肺组织中ACE含量与8 h比较明显上升;而WT组随时间变化,小鼠肺组织中ACE含量无明显变化。考虑ACE的显著增加提示VDR敲除小鼠在内毒素感染早期内皮细胞受损更为严重,且随着感染时间的延长,ACE正反馈调节对肺组织损伤持续加重。平滑肌细胞内多种与炎症密切相关的信号转导通路的激活,可使多种细胞间黏附分子、炎性细胞因子、趋化因子的表达显著增高,提示AngⅡ可能在炎症反应的机制中起着重要的作用,ALI时肺组织和血浆中AngⅡ的浓度表达水平与肺损伤程度呈正相关[26]。本研究发现,在内毒素感染后8、16 h,KO组AT1R较WT组出现明显上升。AngⅡ主要通过与组织细胞特异性受体结合而发挥作用,在肺组织中,AngⅡ的作用主要是由AT1R介导,而VDR的缺失使肺组织AT1R含量增加,进一步加重了肺损伤的程度。内毒素感染后,VDR的缺失导致RAS各成分表达升高,Renin-ACE-AngⅡ-AT1R轴通过多种途径促进肺组织炎症反应。组织水肿和纤维化的发生,形成了正向调节,使RAS进一步活化,对肺损伤起促进作用,使肺损伤症状加重,从而进一步证实VDR在内毒素感染后抑制了RAS发挥相应的生物学效应,从而起到对肺组织的保护作用。
本研究中,LPS腹腔注射8、16 h时,KO组支气管肺泡灌洗液中RAS主要的效应成分AngⅡ和肾素活性较WT组明显升高(P<0.01)。国外有研究发现,VDR敲除小鼠炎症细胞因子及趋化因子水平增高,肺泡上皮紧密连接受到破坏,闭合蛋白及紧密连接蛋白ZO-1表达下降,可使其表现出更严重的肺部炎性损伤[27]。也有研究发现,LPS诱导血管生成素-2(Ang-2)表达,从而激活Ang-2-Tie-2信号通路,而VDR信号系统可以通过靶向调节Ang-2-Tie-2-MLCK通路保护肺血管屏障的完整性。VDR敲除小鼠内毒素感染后,支气管肺泡灌洗液中肾素活性明显增加[19],与本研究结果相一致。
综上所述,维生素D受体在内毒素感染小鼠肺组织中抑制了RAS的激活,进一步证明了维生素受体及其信号系统在内毒素感染时对肺组织的保护作用。
[1] Haussler MR,Whitfield GK,Kaneko I,et al.Molecular mechanisms of vitamin D action[J].Calcif Tissue Int,2013,92(2):77-98.
[2] Dáňová K,Klapetková A,Kayserová J,et al.NF-κB,p38 MAPK,ERK1/2,mTOR,STAT3 and increased glycolysis regulate stability of paricalcitol/dexamethasone-generated tolerogenic dendritic cells in the inflammatory environment[J].Oncotarget,2015,6(16):14123-14138.
[3] 熊洋洋,李丹,付瑜,等.维生素D类似物对心肌肥厚的抑制作用[J].医学研究杂志,2015,44(6):31-35.
[4] Wong MS,Leisegang MS,Kruse C,et al.Vitamin D promotes vascular regeneration[J].Circulation,2014,130(12):976-986.
[5] Wang Y,Deb DK,Zhang Z,et al.Vitamin D receptor signaling in podocytes protects against diabetic nephropathy[J].J Am Soc Nephrol,2012,23(12):1977-1986.
[6] Afzal S,Lange P,Bojesen SE,et al.Plasma 25-hydroxyvitamin D,lung function and risk of chronic obstructive pulmonary disease[J].Thorax,2014,69(1):24-31.
[7] Persson LJ,Aanerud M,Hiemstra PS,et al.Chronic obstructive pulmonary disease is associated with low levels of vitamin D[J].PLoS One,2012,7(6):e38934.
[8] Hollams EM,Hart PH,Holt BJ,et al.Vitamin D and atopy and asthma phenotypes in children:a longitudinal cohort study[J].Eur Respir J,2011,38(6):1320-1327.
[9] Wilkinson RJ,Llewelyn M,Toossi Z,et al.Influence of vitamin D deficiency and vitamin D receptor polymorphisms on tuberculosis among Gujarati Asians in west London:a case-control study[J].Lancet,2000,355(9204):618-621.
[10]Rippel C,South M,Butt WW,et al.Vitamin D status in critically ill children[J].Intensive Care Med,2012,38(12):2055-2062.
[11]Parekh D,Dancer RC,Lax S,et al.Vitamin D to prevent acute lung injury following oesophagectomy (VINDALOO):study protocol for a randomised placebo controlled trial[J].Trials,2013,14:100.
[12]Parekh D,Thickett DR,Turner AM.Vitamin D deficiency and acute lung injury[J].Inflamm Allergy Drug Targets,2013,12(4):253-261.
[13]Barnett N,Zhao Z,Koyama T,et al.Vitamin D deficiency and risk of acute lung injury in severe sepsis and severe trauma:a case-control study[J].Ann Intensive Care,2014,4(1):5.
[14]Wang L,de Kloet AD,Pati D,et al.Increasing brain angiotensin converting enzyme 2 activity decreases anxiety-like behavior in male mice by activating central Mas receptors[J].Neuropharmacology,2016,105:114-123.
[15]Park YA,Choi CH,Do IG,et al.Dual targeting of angiotensin receptors (AGTR1 and AGTR2) in epithelial ovarian carcinoma[J].Gynecol Oncol,2014,135(1):108-117.
[16]Goldstein B,Speth RC,Trivedi M.Renin-angiotensin system gene expression and neurodegenerative diseases[J].J Renin Angiotensin Aldosterone Syst,2016,17(3):1-8.
[17]Wranicz J,Szostak-Węgierek D.Health outcomes of vitamin D.Part Ⅱ.Role in prevention of diseases[J].Rocz Panstw Zakl Hig,2014,65(4):273-279.
[18]陈立男,杨秀红.局部肾素-血管紧张素系统稳态失衡与急性肺损伤[J].生理科学进展,2013,44(2):133-137.
[19]Kong J,Zhu X,Shi Y,et al.VDR attenuates acute lung injury by blocking Ang-2-Tie-2 pathway and renin-angiotensin system[J].Mol Endocrinol,2013,27(12):2116-2125.
[20]施海燕,林琳,朱昌来,等.HSPgp96和LPS激活小鼠腹腔巨噬细胞的比较研究[J].细胞与分子免疫学杂志,2007,23(11):1050-1052.
[21]Chen LN,Yang XH,Nissen DH,et al.Dysregulated renin-angiotensin system contributes to acute lung injury caused by hind-limb ischemia-reperfusion in mice[J].Shock,2013,40(5):420-429.
[22]Ito I,Waku T,Aoki M,et al.A nonclassical vitamin D receptor pathway suppresses renal fibrosis[J].J Clin Invest,2013,123(11):4579-4594.
[23]Chen S,Gardner DG.Liganded vitamin D receptor displays anti-hypertrophic activity in the murine heart[J].J Steroid Biochem Mol Biol,2013,136:150-155.
[24]Deb DK,Chen Y,Zhang Z,et al.1,25-Dihydroxyvitamin D3 suppresses high glucose-induced angiotensinogen expression in kidney cells by blocking the NF-{kappa}B pathway[J].Am J Physiol Renal Physiol,2009,296(5):F1212-F1218.
[25]杜然,丁国华,任志龙,等.高糖对小鼠足细胞(原)肾素受体表达的影响[J].医学研究杂志,2013,42(5):63-66.
[26]Shen L,Mo H,Cai L,et al.Losartan prevents sepsis-induced acute lung injury and decreases activation of nuclear factor kappaB and mitogen-activated protein kinases[J].Shock,2009,31(5):500-506.
[27]Shi YY,Liu TJ,Fu JH,et al.Vitamin D/VDR signaling attenuates lipopolysaccharide-induced acute lung injury by maintaining the integrity of the pulmonary epithelial barrier[J].Mol Med Rep,2016,13(2):1186-1194.
Effects of vitamin D receptor on renin-angiotensin system in lung tissue of mice infected by LPS
XU Ying-xi,ZHAO Qing,SUN Can,CHE Qian-hong,FU Yu,DING Ding,KONG Juan*
(Department of Clinical Nutrition,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To study the effects of vitamin D receptor on the renin-angiotensin system in lung tissue of mice infected by LPS.Methods Fifteen C57BL/6 wild-type mice (WT group) and fifteen VDR-knockout mice (KO group) were randomly selected to receive intraperitoneal injection of LPS.Five mice were randomly selected from each group before and at 8,16 hours after injection respectively.The state of mice in two groups were evaluated and recorded.The levels of angiotensin (AGT),renin (Renin),renin receptor (ReninR),angiotensin converting enzyme (ACE),angiotensin Ⅱ (AngⅡ),and angiotensin Ⅱ-type 1 receptor (AT1R) mRNA expression level of the lung tissue,the AngⅡ levels and renin activity of bronchoalveolar lavage fluid were measured.All the experimental data of the two groups were compared.Results With regard to the general state after injection of LPS,both two groups had adverse reactions and adverse reactions of symptom in KO group were more obvious.Before the injection of LPS,the levels of ACE and AngⅡ of the lung tissue in KO group were higher than those of WT group (P<0.05).At 8 h and 16 h after injection of LPS,the levels of renin,ACE,AngⅡ and AT1R of the lung tissue and the AngⅡ levels,Renin activity of bronchoalveolar lavage fluid in KO group were significantly higher than those of WT group (P<0.01).The level of AGT in KO group was significantly higher than that of WT group at 16 h after injection (P<0.01).Conclusion Vitamin D receptors may inhibit the activation of the renin-angiotensin system in lung tissue infected by LPS and protect the lung tissue.
Vitamin D receptor;LPS;Renin-angiotensin system
2016-12-15
中国医科大学附属盛京医院临床营养科,沈阳 110004
国家自然科学基金(81570811);辽宁省攀登学者计划;辽宁省十百千计划
10.14053/j.cnki.ppcr.201705001
*通信作者

