加速溶剂萃取-超高效液相色谱-串联质谱法测定畜禽粪便堆肥过程中磺胺及其代谢产物的残留量
王德全,何思远,宋伟明,刘万毅,孟 哲*
(1.宁夏大学土木与水利工程学院,银川750021;2.宁夏大学化学化工学院,银川750021)
加速溶剂萃取-超高效液相色谱-串联质谱法测定畜禽粪便堆肥过程中磺胺及其代谢产物的残留量
王德全1,何思远1,宋伟明2,刘万毅2,孟 哲2*
(1.宁夏大学土木与水利工程学院,银川750021;2.宁夏大学化学化工学院,银川750021)
畜禽粪便堆肥样品经加速溶剂萃取及Oasis HLB固相萃取柱净化进行色谱分离,以Waters Acquity BEH C18色谱柱为分离柱,以不同体积比的0.1%(体积分数)甲酸甲醇溶液和0.1% (体积分数)甲酸-水溶液的混合液为流动相进行梯度洗脱。质谱分析中,采用电喷雾正离子源多反应监测模式检测。磺胺及其代谢产物在一定的质量浓度范围内与其峰面积呈线性关系,方法的检出限(3S/N)在0.5~5.0μg·L-1之间。以空白样品为基体进行加标回收试验,所得回收率在67.3%~105%之间,测定值的相对标准偏差(n=6)在4.5%~15%之间。
超高效液相色谱-串联质谱法;磺胺;畜禽粪便;堆肥过程;加速溶剂萃取
规模化养殖所造成的污染一直是农村面源污染的重要因素,大部分畜禽养殖场的畜禽粪便不经堆肥等综合处理就直接施于农田,或随污水、雨水进入水体。家禽的耐药性随着抗生素药物的经常性使用而不断地加强,导致用药量不断加大,畜禽排出粪便残留的抗生素及其代谢物或携有抗体基因的抗生素等污染物也随之增加。这些残留的抗生素及其代谢物会被动植物吸收,最终被人们食用而影响人体健康[1-2]。研究表明,在动物体内各类抗生素去除的路径主要是家畜的尿液[3],而尿液吸附在固体的粪便上,因此当前收集的固体肥料为含有抗生素及其代谢物的尿液和粪便混合形成的。堆肥作为一种将粪便资源化的优良传统方法,有效降解或去除畜禽粪便中抗生素的研究已有报道[4-5]。据2009年中国抗生素药物市场结构报告显示,磺胺类药物的使用与其他常用抗生素相比处于较高水平,尤其在畜禽粪便中磺胺甲噁唑的检测率较高[6]。残留的磺胺甲噁唑对土壤微生物及微生物群落均有显著的抑制作用[7]。
由于养殖场在动物生长的不同周期使用的抗生素种类及剂量不同,因此,对粪便中可能残留的多种抗生素及其典型生物标志物的同时测定尤为重要。采用液相色谱-质谱法同时测定磺胺类及其代谢物的研究报道更多集中于动物源食品[8-9],而对动物粪便中磺胺类测定的研究报道较少[4,10-11],尤其对畜禽粪便或堆肥中残留的磺胺类重要生物标志物乙酰代谢物的测定鲜见报道。由于畜禽粪便或堆肥的基质很复杂,残留代谢物的提取及检测难度较大。与传统的样品前处理过程相比,加速溶剂萃取通过提高温度和增加压力来减弱基质与被分析物间的作用力,加快被分析物从基质中解析并快速进入溶剂中,从而提高萃取的效率[12-13]。本工作结合加速溶剂萃取-固相净化的方法处理样品,采用超高效液相色谱-串联质谱法(UHPLC-MS/MS)测定堆肥基质中磺胺类及其代谢产物残留量。
1 试验部分
1.1 仪器与试剂
Waters Acquity Xevo TQ型超高效液相色谱仪,配Waters Xevo TQ三重四极杆质谱仪;Thermo ASETM350型快速溶剂萃取仪:H2100R型台式高速冷冻离心机;RE-2000A型旋转蒸发器;ND100-1型氮吹仪;Waters Oasis HLB固相萃取柱(60 mg/3 mL);0.22μm聚四氟乙烯膜。
磺胺及其代谢物混合标准储备溶液:100 mg· L-1(包括1 000 mg·L-1代谢物),分别称取磺胺嘧啶(SDZ)、磺胺甲基嘧啶(SMR)、磺胺二甲嘧啶(SMZ)、磺胺甲噁唑(SMX)标准品0.01 g和N-乙酰磺胺嘧啶(N-ASDZ)、N-乙酰磺胺甲嘧啶(NASMR)、N-乙酰磺胺二甲嘧啶(N-ASMZ)和N-乙酰磺胺甲噁唑(N-ASMX)标准品0.1 g,用甲醇定容至100 mL。使用时稀释至所需质量浓度,4℃下密封保存,现配现用。
甲醇、乙腈和甲酸均为色谱纯,其他试剂为分析纯,试验用水为三重水。
1.2 仪器工作条件
1)色谱条件Waters Acquity BEH C18色谱柱(50 mm×2.1 mm,1.7μm);柱温40℃;样品池温度10℃,进样量5μL;流量0.4 mL·min-1。流动相A为0.1%(体积分数,下同)甲酸甲醇溶液,B为0.1%(体积分数,下同)甲酸溶液。梯度洗脱程序: 0~3 min时,A为8%;3~4 min时,A由8%升至40%;4~5 min时,A由40%升至100%;5~5.1 min时,A由100%降至8%,保持2 min。
2)质谱条件电喷雾离子源正离子模式(ESI+),离子源温度150℃;毛细管电压3.0 kV;脱溶剂温度500℃;脱溶剂气为氮气,流量900 L· h-1;碰撞气为氦气,流量0.18 mL·min-1。采用多反应监测模式(MRM),扫描时间间隔为0.05 s。其余质谱参数见表1,其中“*”为定量离子。
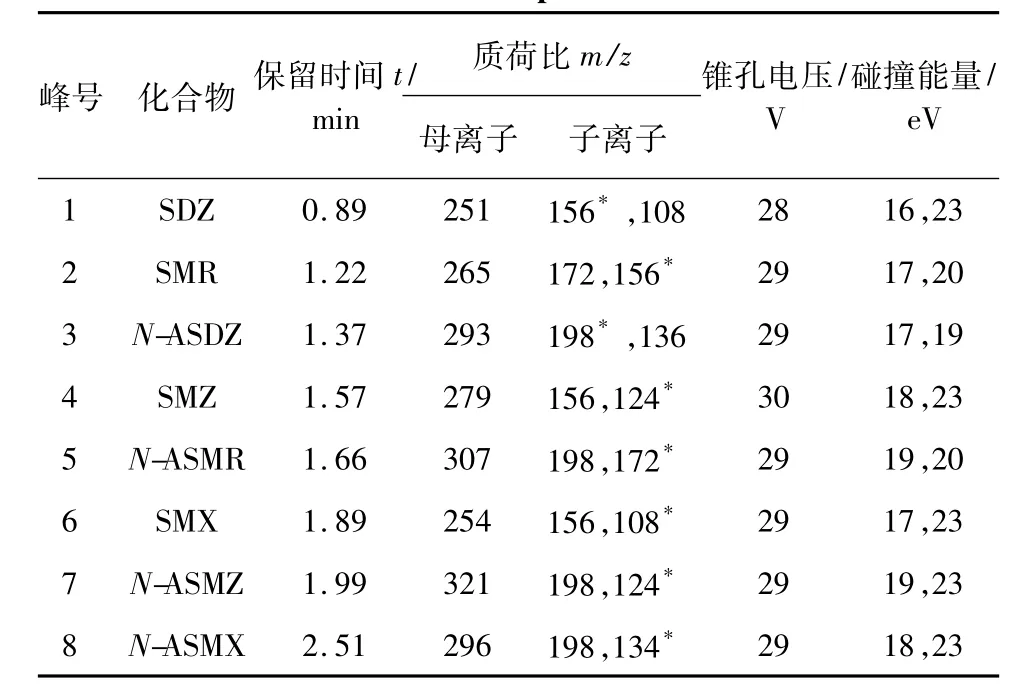
表1 质谱参数Tab.1 MS parameters
1.3 试验方法
1.3.1 堆肥试验
堆肥试验采用自然通风的静止堆肥技术,将6 m3的新鲜猪粪平均分成两堆,体积为3 m×2 m× 1 m。待堆温升至50℃后每隔1 d翻堆一次,进入二次腐熟期后停止翻堆。前25 d为一次堆肥期,第25~50 d为二次堆肥期。
1.3.2 样品采集及预处理
在堆肥的0 d、25 d和50 d分别于3个取样点各取样500 g后在样品袋中混合均匀、阴干。按四分法称取干燥堆肥样品200 g研磨,过0.3 mm (60目)筛,置于-4℃冰柜存放。称取经研磨的堆肥样品4.00 g,加入硅藻土(3~4)g混合均匀后装入22 mL的萃取池;以20%(体积分数,下同)乙腈-50 g·L-1三氯乙酸(100+1)混合液为萃取剂进行快速全自动提取。提取压力10 MPa,提取温度120℃,静态提取时间5 min,淋洗体积40%,吹扫时间60 s,循环周期2次。取约40 mL的提取剂于萃取瓶中,加10 mL正己烷除脂(连续3次)后旋转蒸发至近5 mL移入10 mL离心管,在6℃以10 000 r·min-1转速离心20 min,上层清液转移至已经活化的Oasis HLB固相萃取柱净化,用水淋洗,用0.1%甲酸甲醇溶液洗脱,洗脱液氮吹至近干后,用50%(体积分数,下同)甲醇溶液溶解,过0.22μm微孔滤膜,转移至自动进样瓶,在仪器工作条件下进行分析。
2 结果与讨论
2.1 色谱行为
50μg·L-1(含500μg·L-1代谢物)的8种化合物混合标准溶液的总离子流色谱图见图1。
峰号1~8所对应的化合物同表1
图1混合标准溶液的总离子流色谱图
Fig.1 TIC chromatogram of mixed standard solution
2.2 仪器工作条件的选择
酸性的乙腈和甲醇溶液作为流动相均适合用于各种抗生素的检测。试验选择以0.1%甲酸溶液和0.1%甲酸甲醇溶液作为流动相,流量为0.4 mL· min-1,8种化合物可在3 min内获得很好的分离。
对比8种化合物在混合标准溶液和在基质匹配混合标准溶液中的保留时间和相关质谱参数,结果表明:保留时间的误差小于±0.05 min,质谱参数相符,但基质对待测化合物离子化的信号有影响,尤其对代谢产物离子化的信号有较大抑制作用。因此,试验采用基质匹配混合标准溶液既能有效地减少基质效应的影响,又能改善基质带来的分析误差。
2.3 加速溶剂萃取条件的选择
试验考察了萃取温度(100,120,140℃)和提取剂[20%乙腈溶液、50%乙腈溶液、20%乙腈-50 g· L-1三氯乙酸(100+1)混合液、20%乙腈-100 g· L-1三氯乙酸(100+1)混合液]对测定的影响。结果表明:相较之提取剂对目标化合物的提取回收率的影响,提取温度的影响较小,故试验选择萃取温度为120℃。在该萃取温度下,比较了不同的提取剂对8种磺胺类及其代谢产物的提取效率,见图2。

图2 萃取剂对回收率的影响Fig.2 Effect of extraction solvent on values of recovery
由图2可知:以20%乙腈溶液为提取剂对8种化合物的提取回收率在40%~65%之间,高于50%乙腈溶液为提取剂的提取回收率;但远低于以20%乙腈-50 g·L-1三氯乙酸(100+1)混合液为提取剂的提取率(78%~96%)。试验表明:三氯乙酸的添加有利于化合物的提取,但以20%乙腈-100 g·L-1三氯乙酸(100+1)混合液为提取剂对8种化合物的提取率在60%~84%之间,其中N-ASDZ和NASMX的回收率低于70%。综合考虑,加速溶剂萃取的最佳条件:提取压力10 MPa,提取温度120℃,提取剂20%乙腈-50 g·L-1三氯乙酸(100+1)混合液,提取循环周期2次和静态提取时间5 min。
2.4 标准曲线和检出限
分别配制基质匹配混合标准溶液系列,按仪器工作条件进行测定。结果表明:8种化合物在一定的质量浓度范围内与其峰面积呈线性关系,线性范围、基质匹配线性回归方程和相关系数见表2。
以定量离子对3倍信噪比和10倍信噪比的响应值计算方法的检出限(3S/N)和方法的测定下限(10S/N),其结果见表2。

表2 线性范围、线性回归方程、相关系数、检出限和测定下限Tab.2 Linearity ranges,linear regression equations,correlation coefficients,detection limits and lower limits of determination
2.5 回收试验
按试验方法分别对3个空白样品进行加标回收试验,每个加标样品平行测定6次,其结果见表3。

表3 精密度和回收率试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
2.6 堆肥过程中磺胺类及其代谢产物残留量的变化
依据欧洲共同体委员会制定2002/657/EC决议,对0,25,50 d的堆肥样品中阳性化合物进行确认,堆肥0 d、25 d和50 d提取样品的总离子流色谱图见图3。
基于该方法建立的基质匹配标准曲线,对堆肥样品中已被确认的目标化合物进行测定,其结果见图4。
由图4可知:在堆肥处理初期的样品中检测到多种磺胺类抗生素,其中SMZ和SMX的检出率和残留量较高,检出率为100%,残留量在26~45.5μg·kg-1之间,高于文献[4,10-11]中报道的残留量(20μg·kg-1以内)。SDZ的检出率及残留量最低。粪肥样品中同时检测出多种磺胺类化合物,很可能是因为抗生素制剂不纯或畜禽养殖场存在抗生素的污染。具有抗微生物活性的乙酰磺胺代谢物同样在动物的粪肥中存在,而且含量较高,尤其是N-ASMZ和N-ASMX的检出率高达100%,残留量为104.2~156μg·kg-1,所有粪肥样品中未检出N-ASDZ。畜禽粪便样品中存在含量较高的活性代谢物不容忽视,因为具有活性的乙酰磺胺类代谢物的总残留量远远超过了土壤中抗生素生态毒害效应的触发值(100μg·kg-1)[14]。在25 d堆肥处理的样品中发现乙酰代谢物N-ASMZ和N-ASMX的残留量显著下降,但其相应母体磺胺类抗生素的残留量略有增加,表明乙酰磺胺代谢物可去乙酰化转化成母体化合物[14]。在堆肥处理50 d的样品中,乙酰磺胺代谢物和母体磺胺类化合物的残留量呈缓慢下降趋势。以上结果说明在堆肥处理过程中,动物粪便中残留的磺胺类及其高含量的乙酰磺胺代谢物在推挤过程中可能降解或去除,为加快其降解速率有必要对堆肥化处理工艺加以进一步的改进。
本工作对堆肥样品中8种磺胺类及其代谢产物进行加速溶剂提取;同时考虑到堆肥样品的复杂性、保护色谱柱的必要性,以及堆肥样品中残留抗生素的含量很低等因素,提取液需进一步的净化和浓缩,故采用固相萃取净化处理,建立了一种有效可靠的同时测定畜禽粪便和堆肥样品中抗生素及其代谢物残留量的UHPLC/MS/MS定量分析方法。该方法有效地监测出堆肥过程中多种磺胺及其乙酰磺胺代谢产物的残留量。给出畜禽粪便堆肥过程中磺胺类及其乙酰代谢物残留量的降解趋势,为堆肥处理能否降低或避免农田土壤的二次污染等问题提供理论依据。

图3 不同堆肥阶段的样品的总离子源色谱图Fig.3 TIC chromatograms of the sample at different composting stages
[1]吴根义,廖新俤,贺德春,等.我国畜禽养殖污染防治现状及对策[J].农业环境科学学报,2014,33(7): 1261-1264.
[2]SILVEIRA E,FREITAS A R,ANTUNES P,et al.Cotransfer of resistance to high concentrations of copper and first-line antibiotics among enterococcus from differentorigins(humans,animals,the environment and foods)and clonal lineages[J].The Journal of Antimicrobial Chemotherapy,2014,69(4):899-906.
[3]DE LIGUORO M,POLTRONIERI C,CAPOLONGO F,et al.Use of sulfadimethoxine in intensive calf farming: evaluation of transfer to stable manure and soil[J].Chemosphere,2007,68:671-676.
[4]HO Y B,ZAKARIA M P,LATIF P A,et al.Degradation of veterinary antibiotics and hormone during broiler manure composting[J].Bioresource Technology,2013,131:476-484.
[5]王桂珍,李兆君,张树清,等.土霉素在鸡粪好氧堆肥过程中的降解及其对相关参数的影响[J].环境科学,2013,34(2):795-803.
[6]AUST M O,GODLINSKI F,TRAVIS G R,et al.Distribution of sulfamethazine,chlortetracycline and tylosin in manure and soil of Canadian feedlots after subtherapeutic use in cattle[J].Environmental Pollution,2008,156 (3):1243-1251.

图4 不同堆肥阶段的样品中磺胺及其代谢产物的测定结果Fig.4 Determination results of sulfonamides and their metabolites in the samples at different composting stages
[7]杨玖,谷洁,张友旺,等.磺胺甲噁唑对堆肥过程中酶活性及微生物群落功能多样性的影响[J].环境科学学报,2014,34(4):965-972.
[8]LI H,SUN H W,ZHANG J X,et al.Highly sensitive and simultaneous determination of sixteen sulphonamide antibiotics,four acetyled metabolites and trimethoprim in meat by rapid resolution liquid chromatography-tandem mass spectrometry[J].Food Control,2013,31:359-365.
[9]MENG Z,SHI Z H,LIANG S X,et al.Residues investigation of fluoroquinolones and sulfonamides and their metabolites in bovine milk by quantification and confirmation using ultra-performance liquid chromatography-tandem mass spectrometry[J].Food Chemistry,2015,174: 597-605.
[10]BERENDSEN B J A,WEGH R S,MEMELINK J,et al.The analysis of animalfeces as a toolto monitor antibiotic usage[J].Talanta,2015,132:258-268.
[11]李艳霞,李帷,张雪莲,等.固相萃取-高效液相色谱法同时检测畜禽粪便中14种兽药抗生素[J].分析化学,2012,40(2):213-217.
[12]NAYAK B,DAHMOUNE F,MOUSSI K,et al.Comparison of microwave,ultrasound and accelerated-assisted solvent extraction for recovery of polyphenols from Citrus sinensis peels[J].Food Chemistry,2015,187: 507-516.
[13]SAHA S,WALIA S,KUNDU A,et al.Optimal extraction and fingerprinting of carotenoids by accelerated solvent extraction and liquid chromatography with tandem mass spectrometry[J].Food Chemistry,2015,177: 369-375.
[14]KARCI A,BALCIO LU I A.Investigation of the tetracycline,sulfonamide,and fluoroquinolone antimicrobial compounds in animal manure and agricultural soil in Turkey[J].Science of the Total Environment,2009,407(16):4652-4664.
ASE-UHPLC-MS/MS Determination of Residual Amounts of Sulfonamides and Their Metabolites in Livestock Manure During Its Composting Course
WANG Dequan1,HE Siyuan1,SONG Weiming2,LIU Wanyi2,MENG Zhe2*
(1.College of Civil Engineering and Water Conservancy,Ningxia University,Yinchuan 750021,China; 2.College of Chemistry and Chemical Engineering,Ningxia University,Yinchuan 750021,China)
The sample of composted livestock manure was treated with ASE and the extract obtained was purified by passing through Oasis HLB-SPE column.The purified extract was then separated by HPLC using.Waters Acquity BEH C18chromatographic column as stationary phase,and mixtures of 0.1%(φ)formic acid-methanol solution and 0.1%(φ) formic acid-H2O solution with various ratios as mobile phase in gradient elution.ESI+and multi-reactions monitoring were adopted in MS/MS.Linear relationships between values of peak area and mass concentration of the sulfonamides and their metabolites were kept in definite ranges.Detection limits(3S/N)found were ranged from 0.5 to 5.0μg·L-1.On the base of blank sample,test for recovery was made by standard addition method,values of recovery found were in the range of67.3%-105%,with RSD's(n=6)in the range of4.5%-15%.
UHPLC-MS/MS;sulfonamides;livestock manure;composting course;ASE
O657.63
A
1001-4020(2017)05-0532-06
10.11973/lhjy-hx201705008
2016-05-12
科技部十二五科技支撑项目(2011467017);村镇环境综合整治重大科技工程(2012BAJ21B00)
王德全(1968-),男,宁夏银川人,副教授,研究方向为农村环境综合整治和资源化利用技术集成与示范
*通信联系人。meng_z@nxu.edu.cn

