EphA2在结直肠癌细胞中的生物学功能及其信号调控机制
菅志远,沈先锋,方 程,高 义
1. 十堰市太和医院(湖北医药学院附属医院) 肝胆胰外科诊疗中心,湖北 十堰 442000;2. 武汉大学中南医院 循证与转化医学中心,武汉 430071
EphA2在结直肠癌细胞中的生物学功能及其信号调控机制
菅志远1,沈先锋1,方 程2,高 义1
1. 十堰市太和医院(湖北医药学院附属医院) 肝胆胰外科诊疗中心,湖北 十堰 442000;2. 武汉大学中南医院 循证与转化医学中心,武汉 430071
〔目的〕探讨EphA2在结直肠癌细胞中的生物学功能及其信号调控机制。〔方法〕qRT-PCR法检测EphA2在结直肠癌细胞系中的表达情况,筛选得到表达量较高细胞株系,利用siRNA沉默该细胞系中EphA2的表达,利用MTT、Transwell、Western blot、qRT-PCR法检测细胞生物学功能变化及Wnt/β-catenin信号通路相关基因及蛋白的表达变化。〔结果〕在人结肠癌细胞HCT116、HT29和SW480中筛选得到EphA2高表达细胞HCT116,构建载体EphA2-siRNA并成功转染细胞HCT116。MTT、Transwell法检测结果显示,与对照组相比,EphA2-siRNA组中细胞的增殖、侵袭和迁移能力明显受到抑制,差异具有统计学意义(P<0.05)。qRT-PCR和westernblot分析表明,与对照组相比,EphA2-siRNA组中Wnt/β-catenin信号通路相关蛋白E-cadherin、TCF-4、β-catenin和p-GSK-3βSer9的表达量均呈现下降趋势,差异具有统计学意义(P<0.05)。〔结论〕 结直肠癌细胞中EphA2的表达与结直肠癌的进展和侵袭转移密切相关,EphA2可能通过调控Wnt/β-catenin信号通路影响结直肠癌的进展。
EphA2;Wnt/β-catenin信号通路;结直肠癌
结直肠癌是一种常见的消化系统恶性肿瘤。近几年,结直肠癌的发病率和死亡率呈上升趋势,严重威胁着人们的健康[1]。外科手术治疗、放疗、化疗等综合治疗措施的应用使结直肠癌的治愈率有了很大提高,但癌细胞远处转移仍然导致大多数患者复发、死亡[2]。Eph基因家族,具有受体酷氨酸激酶的活性,在对肿瘤细胞生长、增殖、转移等相关的信号转导通路的调控过程中起到关键性的作用[3]。EphA2是Eph家族中的一员,研究[4]发现,该基因在多种肿瘤中高表达,并与肿瘤的转移和患者的预后密切相关。本研究通过检测EphA2在结直肠癌细胞系中的表达情况,利用siRNA沉默结直肠癌细胞EphA2的表达,检测细胞生物学功能变化及Wnt/β-catenin信号通路相关基因及蛋白的表达变化,阐述EphA2可能通过调控Wnt/β-catenin信号通路影响结直肠癌的进展。
1 材料与方法
1.1 细胞株与药物
结直肠癌细胞系HCT116、HT29、SW480购自中国科学院上海细胞生物所;1640培养基、LipofectamineTM2000以及siRNA购于美国Therm公司;MTT试剂、抗EphA2单抗以及二抗购自美国Sigma公司;Transwell小室购自美国Corning公司;CO2培养箱和SYNGENE凝胶成像系统购自美国Therm公司;7700型实时荧光定量PCR仪购自美国Applied Biosystems公司。
1.2 细胞株及培养
结直肠癌细胞系HCT116、HT29、SW480,培养于含体积分数10%的胎牛血清1640培养基中,并置于37 ℃、体积分数为5%的CO2培养箱中培养;1~2 d更换培养基,2~4 d用体积分数为0.25%的胰酶消化传代培养。
1.3 细胞转染
将生长状态良好的对数生长期HCT116细胞消化稀释,将稀释后的siRNA与LipofectamineTM2000混合,室温静置20 min,使之充分混匀;将上述混合液加入6孔板,即维持siRNA转染浓度50 mmol/L,轻轻晃动培养板,充分混匀,6 h后更换培养液,继续培养48 h。
1.4 qRT-PCR检测EphA2 mRNA的表达
北方欠发达地区由于水资源短缺,工农业生产受到影响,如甘肃石羊河流域的农田大面积无法耕种,煤化工等耗水产业不能就近布局。南方部分欠发达省份的一些地区受水污染影响,农田无法耕种,“癌症村”出现,城市不得不舍近求远寻找新水源。可见,欠发达地区经济社会发展受到的水资源制约也日趋明显。
收集对数期细胞,提取总RNA,合成cDNA, 使用ABI 7900HTSequence Detection System进行PCR反应,数据应用2-ΔΔCt分析。内参基因为GAPDH。
1.5 MTT法检测细胞增殖
接种细胞,调整细胞浓度1×104/mL,每孔吸取200 μL加入96孔板;放入CO2孵箱中常规培养,每天更换培养液1次;按实验既定时间点,分别培养至24、48、72 h后弃去培养液,PBS洗涤,每孔加入MTT溶液20 μL,37 ℃孵育4 h;吸弃孔内培养液,每孔加入150 μL DMSO,避光振荡10 min,充分溶解紫色结晶物;酶联免疫检测仪处测定各孔OD值,波长设置为450 nm。
1.6 Western blot 检测各受体蛋白的表达
收集对数期生长细胞,破碎细胞提取蛋白,SDS-PAGE电泳,转膜,封闭,依次加一抗、二抗孵育洗膜,成像仪检测结果。具体实验方法参照已发表文章[5]。
1.7 Transwell检测细胞的侵袭和迁移能力
1.8 统计学分析
定量变量用mean±SD表示,组间比较采用t检验或非参数检验。P<0.05表示差异有统计学意义。分析EphA2对结直肠癌细胞HCT116的增殖、侵袭和迁移的影响,比较各受体蛋白、mRNA表达的影响。
2 结果
2.1EphA2在HCT116细胞中高表达
使用qRT-PCR检测EphA2在人结肠癌细胞HCT116、HT29和SW480中的表达。结果显示,在HCT116中EphA2mRNA的表达水平高于其他细胞(图1)。因此,选择HCT116细胞进行研究。

图1 EphA2在各结直肠癌细胞系中的表达情况
2.2 干扰EphA2表达抑制HCT116细胞的增殖
在HCT116细胞中转染siRNA,干扰EphA2表达,并用MTT检测对细胞增殖的影响,结果显示,与对照组相比,EphA2-siRNA组中细胞的增殖受到抑制,且差异显著(P<0.05),见图2。

图2 EphA2不同表达量对于细胞增殖能力的影响
2.3 干扰EphA2 抑制HCT116细胞的侵袭和迁移能力
为了评价EphA2对结直肠癌细胞侵袭及迁移能力的影响,我们分别进行了铺或不铺Matrigel的Transwell实验。发现,转染EphA2-siRNA的HCT116细胞转移至小室下层的细胞数显著少于对照组,差异明显(P<0.05),见图3。表明干扰EphA2的表达可以抑制HCT116细胞的侵袭和迁移能力。
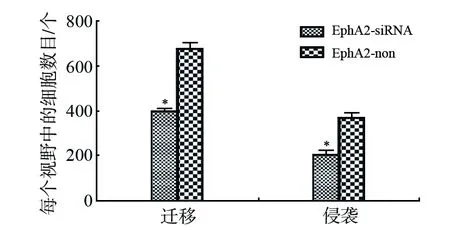
图3 EphA2对结直肠癌细胞侵袭和迁移能力的影响
2.4EphA2-siRNA对Wnt/β-catenin通路中E-cadherin、TCF-4及β-catenin表达的影响
利用qRT-PCR和westernblot实验分别检测EphA2-siRNA组、EphA2-non组和Blank(空白)组中E-cadherin、TCF-4及β-catenin蛋白的表达情况。qRT-PCR结果显示,与对照组相比,EphA2-siRNA组中3种mRNA的表达均下降,且结果差异显著(P<0.05),见图4。
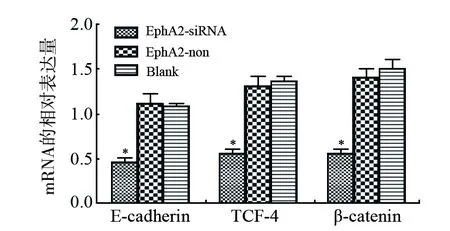
图4 不同表达量的EphA2对Wnt/β-catenin通路中3种蛋白表达量的影响
Westernblot结果也一样,跟对照组相比3种蛋白的表达均有所下降,见表1。

表1 western blot 实验检测3种蛋白条带强弱百分比(%)
2.5EphA2-siRNA对HCT116细胞GSK-3β和磷酸化GSK-3βSer9表达变化的影响
采用westernblot方法分别检测GSK-3β和磷酸化p-GSK-3βSer9蛋白表达情况。结果显示,EphA2-siRNA组,EphA2-non组和Blank(空白)3组中,GSK-3β蛋白条带亮度无明显差别;而p-GSK-3βSer9蛋白条带亮度有明显差异 ,与对照组相比,p-GSK-3βSer9在EphA2-siRNA组的表达水平下降。见表2。

表2 western blot 检测GSK-3β、p-GSK-3βSer9 蛋白条带强弱百分比(%)
3 讨论
随着生活习惯及生存环境的变化,癌症发病率持续增高,结直肠癌作为一种常见的消化道肿瘤,已经严重威胁到人类的健康[6]。根据世界卫生组织近年的研究报告,2012年全球约有136万人被确诊为结直肠癌,其数量之大使结直肠癌在恶性肿瘤中排名前3位,仅次于肺癌和乳腺癌。此外,统计结果[7]显示,约有69万结直肠癌患者死亡,位居所有恶性肿瘤第4位。更令人担忧的是,结直肠癌在全球的发病率及死亡率不断攀升,且发病的地域分布也存在很大差异。据统计,结直肠癌在我国的发病率也呈逐年递增的趋势,严重威胁着人类的生命安全,给社会造成了极大的压力。随着科学技术的飞速发展,已经有很多先进的技术可以应用到癌症的治疗当中,其中主要包括了手术治疗、化学药物治疗以及放射性疗法。虽然这些方法也被应用到结直肠癌的治疗中,但是,目前此疾病的预后仍不乐观[8]。因此,对于疾病发生和发展相关的分子及分子机制的研究,对于进一步探究结直肠癌的治疗靶位点以及完善发展此疾病的治疗方法具有重要的意义。
EphA2属于目前已知的受体酪氨酸激酶(RTKs)最大亚族Eph基因家族,具有重要的受体酪氨酸激酶活性,因此参与了众多的细胞生物学过程[9]。在癌症细胞中,Christiansen等[3]发现,Eph基因在肿瘤细胞的生长、分化、增殖和迁移等过程中具有重要作用,参与了某些癌症的发生及发展过程。Cui等[10]研究表明,EphA2高表达于很多上皮来源的肿瘤中,并且可以在一定程度上影响肿瘤的转移以及癌症预后。在胃癌相关研究中,癌症样品检测到了表达量显著增加的EphA2基因,并通过体外细胞实验证明了高表达的EphA2可以通过Wnt/β-catenin信号通路促进胃癌细胞的上皮间质转化[11]。对于结直肠癌,已有研究[12]证明EphA2可以作为有效的癌症预后标志物。然而,EphA2在结直肠癌的生物学作用以及其发挥作用的机制研究尚不清楚。
本研究针对目前EphA2在癌症中的研究成果,旨在进一步分析该基因在结直肠癌中的生物学功能以及潜在的信号调控机制。通过在结直肠癌细胞系中的研究,我们发现抑制EphA2的表达量可以显著降低癌细胞的增殖能力。此外,Transwell实验结果证明,抑制结直肠癌细胞EphA2的表达,细胞的侵袭和迁移同时也一定程度上有所降低。以上结果说明,EphA2参与了结直肠癌细胞的增殖、侵袭和迁移的生物学过程,对癌症的发生和发展具有重要的作用。同时,我们实验还进一步探究了EphA2发挥作用潜在的生物学机制。通过使用qRT-PCR以及westernblot法对相关信号通路蛋白表达量的分析,我们证明了EphA2极有可能是通过Wnt/β-catenin信号通路影响结直肠癌细胞的生长和发展,从而参与到癌症的进程当中。
综合以上研究结果,我们证明了EphA2基因参与了结直肠癌细胞的增殖、侵袭和迁移几个生物学过程,并且通过潜在的Wnt/β-catenin信号通路途径在结直肠癌的发生和发展过程发挥重要的生物学功能。
[1]FerlayJ,Soerjomataram,DikshitR,etal.Cancerincidenceandmortalityworldwide:sources,methodsandmajorpatternsinGLOBOCAN2012 [J].IntJCancer, 2015, 136(5):E359-E386.
[2]SignoriniL,DelbueS,FerranteP,etal.Reviewontheimmunotherapystrategiesagainstmetastaticcolorectalcarcinoma[J].Immunotherapy, 2016, 8(10):1245-1261.
[3]ChristiansenJJ,RajasekaranAK.Reassessingepithelialtomesenchymaltransitionasaprerequisiteforcarcinomainvasionandmetastasis[J].CancerRes, 2006, 66(17):8319-8326.
[5]LiY,HeY,QiuZ,etal.CRTC2andPROM1expressioninnon-smallcelllungcancer:analysisbyWesternblotandimmunohistochemistry[J].TumourBiol, 2014, 35(12):11719-11726.
[6]JemalA,SiegelR,WardE,etal.Cancerstatistics, 2006 [J].CACancerJClin, 2006, 56(2):106-130.
[7]SiegelR,DesantisC,JemalA.Colorectalcancerstatistics, 2014 [J].CACancerJClin, 2014, 64(2):104-217.
[8]TohmeS,GoswamiJ,HanK,etal.MinimallyInvasiveResectionofColorectalCancerLiverMetastasesLeadstoanEarlierInitiationofChemotherapyComparedtoOpenSurgery[J].JGastrointestSurg, 2015, 19(12):2199-2206.
[9]FoxBP,KandpalRP.AparadigmshiftinEPHreceptorinteraction:biologicalrelevanceofEPHB6interactionwithEPHA2andEPHB2inbreastcarcinomacelllines[J].CancerGenomicsProteomics, 2011, 8(4):185-193.
[10]CuiXD,LeeMJ,YuGR,etal.EFNA1ligandanditsreceptorEphA2:potentialbiomarkersforhepatocellularcarcinoma[J].IntJCancer, 2010, 126(4):940-949.
[11]HuangJ,XiaoD,LiG,etal.EphA2promotesepithelial-mesenchymaltransitionthroughtheWnt/β-cateninpathwayingastriccancercells[J].Oncogene, 2014, 33(21):2737-2747.
[12]DunnePD,DasguptaS,BlayneyJK,etal.EphA2ExpressionIsaKeyDriverofMigrationandInvasionandaPoorPrognosticMarkerinColorectalCancer[J].ClinCancerRes, 2016, 22(1):230-242.
[责任编辑 时 红]
Biological Functions and Regulatory Mechanisms of EphA2 in Colorectal Carcinoma
JIAN Zhiyuan1, SHEN Xianfeng1, FANG Cheng2, GAO Yi1
1. Department of Hepatopancreatobiliary Surgery, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China; 2. Center for Evidence-Based and Translational Medicine, Zhongnan Hospital of Wuhan University, Wuhan 430071, China.
〔Objective〕To investigate the biological function and mechanism of EphA2 in colorectal cancer. 〔Methods〕The expression of EphA2 in colorectal cancer cell lines were detected by qRT-PCR, screened one cell lines with higher EphA2 expression. Silenced the expression of EphA2 in the cell line which we screened by siRNA technology.〔Results〕The results of MTT and Transwell analysis showed that inhibition of the EphA2 expression could suppress the proliferation, invasion and metastasis of the colorectal carcinoma cells (allP<0.05).AccordingtoqRTPCRandwesternblot,theexpressionofrelatedcrucialproteinofWnt/βcateninpathway,includingE-cadherin,TCF-4andβcatenin,andp-GSK-3βSer9weresignificantdecreasedintheEphA2-siRNAgroup(P<0.05forall). 〔Conclusion〕EphA2 was involved in the development of colorectal carcinoma, and it might participate the tumor progression mediated by Wnt/β catenin pathway.
EphA2; Wnt/β catenin signal path; colorectal carcinoma
1672-7606(2017)02-0115-04
2017-02-21
湖北省教育厅科学研究计划重点项目(D20152012)
菅志远(1975-),男,河南襄城人,博士,主任医师,教授,硕士生导师,研究方向:消化道肿瘤基础和临床研究。
R735.3
A

