质子放射治疗的现状与展望*
刘玉连 赵徵鑫 张文艺 焦 玲*
质子放射治疗的现状与展望*
刘玉连①赵徵鑫①张文艺①焦 玲①*
肿瘤放射治疗的基本准则是给予肿瘤最大剂量,同时最大程度保护周围正常组织器官。理论上,由于质子束穿过物质形成Bragg峰的物理特性和优越的放射生物学特性[相对生物学效应(RBE)比光子高10%左右],质子束在治疗靶区处剂量大量快速沉积,而临近和远离肿瘤的正常组织接受的剂量很少,优于传统的光子治疗。与质子物理特性相同的重离子C,相对生物效应更高,对肿瘤杀伤作用更大,但其对技术、设备、资金和人员等要求更加严格,性价比较质子弱。质子虽不失为一种理想的治疗方式,但由于其RBE的不确定性、对位置要求的敏感性以及技术发展的局限性等,使得质子的潜能不能很好的呈现到临床应用中。为此,就质子放射治疗的物理特性、生物特性、与其他治疗方式的对比、设备技术现状、局限性及展望作一综述,更好地了解质子治疗的特点、优势及不足,为未来的研究提供参考。
质子;放射治疗;光子;碳离子;相对生物学效应;Bragg峰
放射治疗是治疗肿瘤的主要手段之一,保护周围正常组织的同时,给予肿瘤最大杀伤剂量。目前,临床上作为主流治疗方式的光子治疗已进入瓶颈期,存在已久却因多种原因而未能充分发展的质子放射治疗重新获得各界学者的青睐。质子束具有独特的物理特性和优越的放射生物学特性,优于传统的光子治疗。但其相对生物学效应(relative biological effectiveness,RBE)值的不确定性、对位置要求的敏感性以及技术发展的局限性等,使得质子的潜能未很好的呈现到临床应用中。为此,就质子放射治疗的物理特性、生物特性、与其他治疗方式的对比、设备技术现状、局限性及展望进行综述,以便更好地了解质子治疗的优势及不足。
1 质子治疗简史
1946年,哈佛大学的Wilson[1]最先提出质子具有应用于肿瘤放射治疗的潜力,从理论上介绍了质子如何治疗局部肿瘤。1954年,第一例患者在加利福尼亚大学的Berkley实验室接受质子治疗,所使用的是同步回旋加速器[2]。1973年,在美国学者Goitein和Suit的领导下,一个关于质子治疗不同部位肿瘤的项目在哈佛回旋加速器实验室(harvard cyclotron laboratory)开展[3]。1990年,美国洛玛琳达大学医学中心(loma linda university medical center)安装了第一台医用质子治疗设备,此设备能够通过等中心机架从不同方向发射质子束[4]。随后,在2006年,MD Anderson癌症中心安装了第一台具有扫描束功能的质子治疗设备,也是世界上第一台可实现二维扫描束功能的设备[5]。此后,全球涌现越来越多的质子治疗设备。
2 质子特性
相对于X射线和γ等光子射线,质子具有一定的质量,且带正电,与重离子统称为粒子治疗。当给予质子足够能量(70~250 MeV),穿过物质,质子束速度会随着深度的增加而减慢,能量损失率(linear energy transfer,LET)则随速度的降低而增加,当能量全部耗尽,质子束就会突然停下来。这个剂量沉积过程产生了质子剂量-深度特征曲线,即布拉格曲线(如图1所示)[5]。

图1 200 MeV质子束剂量-深度曲线图
曲线的最高点即是剂量最高点,称为布拉格峰(Bragg peak),峰的深度是质子束的照射范围,深度大小很大程度上取决于质子的初始能量。质子穿过介质,到达肿瘤前正常组织接受的剂量十分少,剂量在肿瘤靶区内大量沉积,到达肿瘤之后剂量迅速下降,超出肿瘤靶区范围的剂量很少,可以忽略不计,故肿瘤后侧的正常组织几乎不受剂量影响。当然,过程中也会产生旁散射,但超出质子束界限的射线会迅速跌落。未经调制的质子束产生的布拉格峰非常窄小,不能完整地覆盖肿瘤靶区,为了满足临床上的需要,可以通过使用不同能量的质子束,叠加拓展布拉格峰的宽度至设定的数值。这种方式势必会增加肿瘤前方正常组织的剂量,但相比光子,依然减少很多。
在生物学上,质子的RBE为1.1,这个常值是通过大量实验得出的平均值,然而,过去的实验存在很多的不确定性,越来越多的学者认为,在所有情况下,都直接将质子的RBE假设为常值1.1是不妥当的,很有可能影响质子治疗的效果。事实上,由于LET不同、单次剂量不同以及组织不同等,质子的RBE是变化的。在入口区域,其很可能接近1.0,随着深度的增加,RBE会增加,深处RBE可能>1.1,在射程末端达到最大值。
入射到人体或者模型中的单能质子束分布呈一个狭窄的高斯函数,波束的横向尺寸用高斯函数的半波全宽(full width at half maximum,FWHM)或δ表示。较小的FWHM可以提供更尖锐窄小的半影和更优的剂量分布。在空气中,高能的质子铅笔束(pencil beams)的FWHM比低能的更小,根据不同机型提供的最高能量(220~250 MeV),可实现的最小FWHM在7~12 mm范围内变动。当铅笔束射入人体或膜体时,FWHM则逐渐增加,尤其是靠近质子束射程末端(如图2所示)[5]。

图2 单能222 MeV质子小光束在水膜体中的剂量分布
图2是一个射程为30.5 cm的单能质子束在水模体中的剂量分布,质子能量为222 MeV。在水模体入口端,FWHM约为13 mm,射程末端则为30 mm左右。射程最后的高剂量区经常被称为“爆点”,而“爆点”的大小影响半影的大小及剂量的最优化分布。
3 质子放射治疗与其他放射治疗方式的对比
3.1 质子放射治疗与光子放射治疗
3.1.1 物理特性
目前,临床上肿瘤放射治疗大多数采用4~18 MV的光子治疗,尽管全球的质子设备不断增加,但不足1%的患者采用质子等粒子放射治疗。光子射束进入人体最初时,累积剂量不断增加,达到一个最大值,然后呈指数下降(如图1所示)。光子束从进入人体至离开,一直在沉积剂量。因此,肿瘤部位前后的正常组织要接受很大的剂量,增加了正常组织的毒性。而质子独特的“布拉格峰”特性,质子有效较低了肿瘤周围正常组织的受照剂量。
3.1.2 生物效应
经过大量的体外和动物实验得出结论:质子的生物效应比光子高10%左右,即RBE为1.1。因此,质子对肿瘤的杀伤效果更优。然而,加上其独特的物理特性,使得质子治疗对位置和运动更加敏感(如肺),位置的偏移可能使剂量最高点覆盖到正常组织上,因此造成的生物损伤必然也比光子强烈。为达到既定的生物效应,质子治疗计划制作更复杂于光子。
3.1.3 主要技术
近年来,随着放射物理学、放射生物学、剂量学、计算机技术及影像技术迅速发展,开启了肿瘤的精确治疗时代。为最大程度保护正常组织和重要器官,降低不良反应,光子治疗技术迅猛发展。目前,光子治疗技术主要包括三维适形放射治疗(three dimensional conformal radiotherapy,3D-CRT)、适形调强放射治疗(intensity modulation radiated therapy,IMRT)、立体定向放射治疗(stereotactic radiosurgery/radiotherapy,SRS/SRT)、螺旋断层放射治疗(tomotherapy,TOMO)以及图像引导放射治疗(image guide radiation therapy,IGRT)等[6-7]。到目前为止,大多数质子治疗中心采用固定技术(passive technique),通过调制器、准直器和补偿器等获得质子扩展布拉格峰(spread-out Bragg peak,SOBP)。固定射线传递技术,制作治疗计划相对简单,对运动靶区的敏感性较弱。然而,射线入口处的剂量要比动态技术(active technique)高,从而增加了继发性肿瘤发生的风险。动态技术应用于点扫描(spot scanning)或多叶扫描(raster scanning)。用不同能级的能量,结合点扫描技术,可以进行调强质子治疗(intensitymodulated proton therapy,IMPT)。IMPT不需要限光筒或补偿器等,节约了制作或更换辅助工具的时间,也节省了患者等待治疗的时间和花费。
IMRT和IMPT技术设计理念相同,可通过动态多叶等手段实现照射靶区剂量不均匀化和个体化。对于形状不规则的肿瘤或凹型环绕正常组织的,两种治疗方式具有独特优势。技术上,IMPT比IMRT的要求更高,对设置的改变、分次间解剖结构变化和分次内运动也更加敏感。
3.1.4 经济效益比
质子放射治疗的经济效益差,这是被业界公认的。质子放射治疗设备的投入巨大,运营和维修保养费用也十分昂贵,一个放射治疗中心的造价相当于数十台X射线放射治疗的直线加速器。即便收取高额的治疗费用(一般是光子治疗费用的2倍或以上),但由于患者数量的限制,短期内不可能收回投入。因此,质子放射治疗的经济效益比远远不如X射线[8]。
3.2 质子放射治疗与碳离子放射治疗
放射物理和放射生物学研究表明,在众多重离子中,碳离子比较适合人类肿瘤的治疗。碳离子射线除了与质子有相同的物理剂量分布之外,还具有更强的放射杀伤效应。碳离子对抗拒光子治疗的肿瘤细胞,杀伤效应是光子的2~3倍[9-12]。
3.2.1 物理特性
碳离子与质子的物理特性相同,但重离子的剂量半影(剂量中心轴到射野边缘的宽度,即剂量从80%减小到20%的区域宽度)比质子更小[13]。
3.2.2 生物特性对比
一般而言,带电粒子质量越大,在射入介质过程中能量损失的速度越快。因此,碳离子的LET要高于质子[14]。正如3.1.2中所述,临床上质子束的RBE与光子相近。国际辐射单位与测量委员会(international commission on Radiation Units and Measurement,ICRU)建议质子RBE值为1.1。碳离子RBE值在3~5范围内变动[15]。因此,碳离子是高LET射线,对肿瘤和正常组织结构都同样具有较强的杀伤效应。
此外,增加单次治疗的剂量,可以减小肿瘤和正常组织的RBE值,且肿瘤减小比正常组织慢[13]。因此大分割技术常用于碳离子治疗,增加肿瘤接受剂量的同时,最大程度保护危及器官,极大缩短了治疗的总时间[16]。
3.2.3 临床适应症
质子治疗主要适应症:①不可切除或不完全切除的局部侵犯性肿瘤,靠近重要的正常组织结构,如眼黑色素瘤、低级别的颅底和椎体肉瘤、某些耳鼻喉肿瘤(如腺样囊性肿瘤);②对辐射耐受性差的肿瘤,主要是儿科恶性肿瘤等。而重离子治疗,主要是碳离子,最受公认的适应症是:不可手术的、对辐射高度抵制的且大量乏氧细胞存在的肿瘤,如黏膜恶性黑色素瘤、高级别的骨和软组织肉瘤和胰腺癌等[17-20]。
无论是质子还是重离子治疗,相对光子其适应症都相当局限,甚至有些疾病争议很大(前列腺癌的重离子治疗),需要更多的临床随机试验或者大型多机构回顾数据整合,来提供更有力的证据[21-22]。
4 质子及重离子治疗全球分布现状
据国际粒子治疗协作委员会(The Particle Therapy Cooperative Group,PTCOG)官网上数据显示,截止到2015年12月,全球大约有58家粒子放射治疗中心正在运行,质子和碳离子治疗中心分别占86%和5%,二者兼有的治疗中心占9%。此外,全球已有超过150,000名患者接受了重粒子治疗,其中质子治疗超过130,000。详细列出各国粒子治疗的种类和患者例数等以及目前已经停止运营的粒子治疗机构的数据,表明各国在粒子治疗上长期努力的尝试和改进(见表1)。
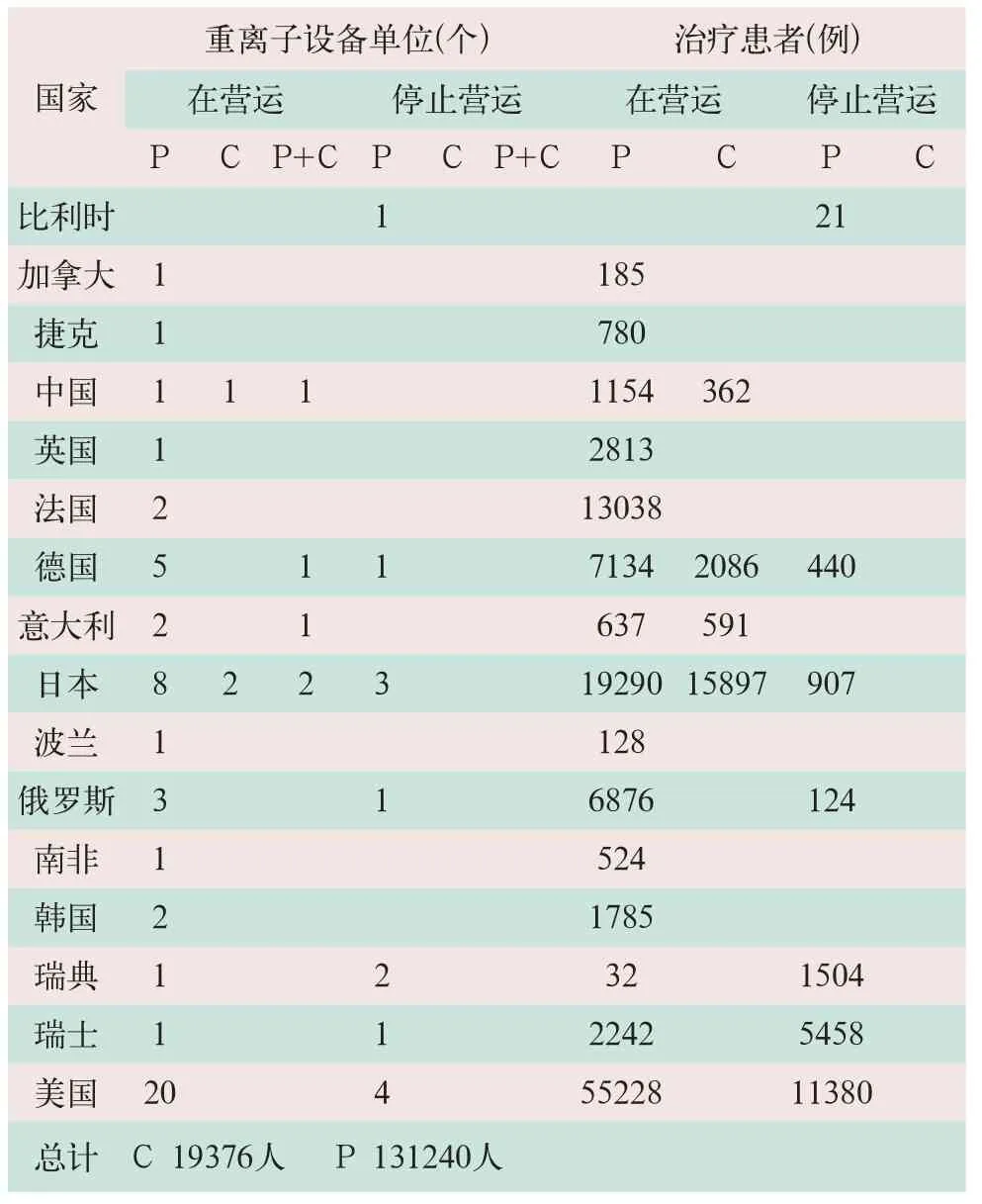
表1 世界粒子治疗分布
5 质子放射治疗的局限性与挑战
质子放射治疗并不是一个全新的技术,而是由于高昂的建设、运行及维护等费用,限制了相关研究和发展。此外,质子剂量分布,尤其是IMPT,对设置的变化、分次间的解剖结构变化和分次内的运动高度敏感。从物理特性角度来说,质子能够减少靶区之外的剂量沉积,从而降低整体剂量。另一方面,由于质子的散射特性,其具有较大的半影,远离靶区的正常组织会接受很低的剂量照射,而靠近靶区的正常组织则会接受到稍高的剂量[5]。然而,可以通过减小限光器具的孔径或者“爆点”的大小来减小半影,进而解决这个问题,但有效性有限,期待随着科技的发展,这方面的技术能够快速发展,惠及肿瘤患者的治疗。
质子RBE值的不确定性。RBE在随着射线的射入人体深度的增加而变大,变化的RBE就会影响射束射程的大小,临床上常使用1.1这个固定值算出来的射程或大或小于实际的射程[23-24]。由于RBE的不确定性,质子放射治疗难以广泛应用于临床,同时担忧其潜在的迟发反应。
对于扫描束技术,“爆点”越小对剂量分布控制越好。目前,质子治疗系统“爆点”大小可实现5 mm(最高能量220 MeV)到14 mm(最低能量70 MeV),但此尺寸还是过大,不能有效控制剂量分布。在IMPT治疗中,为实现预设大小的SOBP,需要能量转换,这就意味着,一个3~4野的IMPT计划,需要5~6 min来转换能量,增加了治疗的时间。有些肿瘤的放射治疗,如肺、呼吸运动是不能忽视的一个棘手问题,临床上经常使用呼吸门控技术来减少其带来的影响,然而在质子治疗中,这种技术较少被应用[5]。呼吸门控技术虽然可以有效减少呼吸运动带来的弊端,但是治疗时间极大延长,增加了患者的痛苦。
因此,作为结果,上述提到的各种缺陷可能会导致患者实际接受到的剂量分布与理论上的不同,这很可能会减少质子治疗的真正潜力的实现,并可能导致与剂量分布相关的不良反应。幸运的是,随着许多质子治疗中心的成立,研究解决质子治疗的不确定性和局限性正在加速。此外,缺少质子和重离子治疗获益的确定性证据,临床上采用粒子治疗的疾病数据基本来自于小型的回顾性研究,证据等级较低,需要前瞻性随机试验或多机构合作的大数据统计来确切证明粒子治疗的优越性[25-28]。
6 总结与展望
质子束穿过物质形成独特的剂量-深度曲线,即Bragg曲线,经过调制,将SOBP覆盖在肿瘤靶区上,周边的正常组织得以最大程度的保护。优越的生物特性,使得质子对肿瘤杀伤作用更大,尤其对于治疗有重要组织器官包绕的肿瘤,显示出较大的优越性。因此,质子治疗具有穿透性能强、剂量分布好、局部剂量高、旁散射少以及半影小等特征。但相对于光子治疗,质子仍然是一个在发展中的技术,尚未完全成熟,亟需进一步的提高。
随着研究的深入,科技的进步,无论是设备的造价,还是减少能量转换时间、减少旁散射以及优化RBE值等技术问题,都将会逐步解决。除了有先进的质子放射治疗设备外,更重要的是有一支受过良好教育、训练有素的技术团队。无论是放射治疗医生、物理师及剂量师,还是设备工程师,都需要学习和掌握新的知识。此外,对于患者而言,更期待质子重离子治疗费用能够纳入医保,建立完善的保险体系,支持质子技术的发展,减轻患者的经济负担。坚信随着研究的深入,质子治疗势必在不久的将来成为肿瘤放射治疗的一种主流方式。
[1]Wilson RR.Radiological use of fast proton[J]. Radiology,1946,47(5):487-491.
[2]Lawrence JH,Tobias CA,Born JL,et al. Pituitary irradiation with high-energy proton beams:a preliminary report[J].Cancer research,1958,18(2):121-134.
[3]Suit HD,Goitein M,Tepper J,et al.Explorotory study of proton radiation therapy using large field techniques and fractionated dose schedules[J].Cancer,1975,35(6):1646-1657.
[4]Coutrakon G,Hubbard J,Johanning J,et al. A performance study of the Loma Linda proton medical accelerator[J].Med Phys,1994,21(11):1691-701.
[5]Mohan R,Grosshans D.Proton therapy-Present and future[J].Adv Drug Deliv Rev,2017,109:26-44.
[6]康静波.肿瘤精确放射治疗的技术进展与临床应用[J].转化医学杂志,2016,5(2):65-69.
[7]颜桂明,陈国付,张飞燕.肿瘤精确放疗技术进展[J].医学理论与实践,2015,28(2):164-166.
[8]王谨,陈明.质子及重离子治疗肿瘤的现状及研究进展[J].中华放射医学与防护杂志,2016,36(8):616-620.
[9]蒋国梁.质子和重离子放疗在中国[J].中华放射医学与防护杂志,2016,36(8):561-563.
[10]吉喆,姜玉良,王俊杰,等.质子放疗的临床应用研究进展[J].西部医学,2016,28(4):580-585.
[11]张伟,王贞丽,郭申波,等.肿瘤放疗前沿:质子线治疗系统[J].中国医疗器械信息,2014,20(4):29-31.
[12]王贵勤.γ刀、X刀和粒子刀三种放射治疗技术的比较[J].中国医疗设备,2008,23(9):127-128.
[13]Uhl M,Herfarth K,Debus J.Comparing the use of Protons and Carbon Ions for Treatment[J]. Cancer J,2014,20(6):433-439.
[14]Grun R,Friedrich T,Elsasser T,et al.Impact of enhancements in the local effect model(LEM) on the predicted RBE-weighted target dose distribution in carbon ion therapy[J].Phys Med Biol,2012,57(22):7261-7274.
[15]Schulz-Ertner D,Tsujii H.Particle radiation therapy using proton and heavier ion beams[J]. J Clin Oncol,2007,25(8):953-964.
[16]Carabe A,Moteabbed M,Depauw N,et al. Rang uncertainty in proton therapy due to variable biological effectiveness[J].Phys Med Biol,2012,57(5):1159-1172.
[17]Habrand JL,Datchary J,Alapetite C,et al. Update of clinical programs with particles in radiation oncology 2008-2012[J].Cancer,2013,17(2013):400-406.
[18]Suit H,DeLaney T,Goldberg S,et al.Proton vs carbon ion beams in the definitive radiation treatment of cancer patients[J].Radiother Oncol,2010,95(1):13-22.
[19]赵徵鑫,翟贺争,张文艺,等.质子重离子治疗肿瘤的进展[J].国际放射医学核医学杂志,2016,40(5):384-388.
[20]胡惠清.肿瘤治疗的新进展-质子治疗[J].中国医学装备,2004,1(1):51-52.
[21]Okada T,Kamada T,Tsuji H,et al.Carbon ion radiotherapy:clinical experences at National Institute of Radiological Science(NIRS)[J].J Radiat Res,2010,51(4):355-364.
[22]Kamada T,Tsujii H,Blakely EA,et al.Carbon ion radiotherapy in japan:an assessment of 20 years of clinical experience[J].Lancet Oncol,2015,16(2):e93-e100.
[23]Grun R,Friedrich T,Kramer M,et al.Physical and biological factors determining the effective proton range[J].Med Phys,2013,40(11):111716.
[24]刘世耀.谈谈粒子治疗的发展与挑战[J].中华放射医学与防护杂志,2016,36(8):564-566.
[25]Durante M.New challenges in high-energy particle radiobiology[J].Br J Radiol,2014,87(1035):20130626.
[26]Schlaff CD,Krauze A,Belard A,et al.Bring the heavy:carbon ion therapy in the radiobiological and clinical contex[J].Radiation Oncology,2014,9(1):88.
[27]Tsujii H,Mizoe JE,Kamada T,et al.Overview of clinical experiences on carbon ion radiotherapy at NIRS[J].Radiother Oncol,2004,73(Suppl 2):S41-S49.
[28]Feuvret L,Calugaru V,Ferrand R.Current use and prospects for hadron therapy in 2015[J]. Cancer,2015,19(6-7):519-525.
The current situation and prospect of proton radiotherapy/LIU Yu-lian, ZHAO Zheng-xin, ZHANG Wen-yi, et al//China Medical Equipment,2017,14(7):139-143.
The basic criterion of radiotherapy for tumor is to implement maximum radiation dose for tumor tissue but the normal tissue should be protected in maximum extent. The physical property of passing through substance and forming Bragg curve and superior radiobiological characteristics (relative biological effectiveness of proton is 10% higher than that of photon) of proton beam can ensure fast deposition of the dose of a large number of proton beam in therapy target region, and the normal tissue of near and far away from the tumor receives few dose. Therefore, it is superior than photon therapy. On the other hand, the heavy ion C has the similar physical property with proton and its RBE and killing effect are higher than that of proton, while it has more stringent requirement for technique, equipment, fund and personnel ability. Therefore, its cost performance is lower than that of proton. Although proton therapy is a ideal therapy mode, its uncertainty in RBE, sensibility for position and limitation in technique lead to its potential couldn't be appeared in clinical application. In this review, the physical property, biological characteristics, the comparison with other radiotherapy, the current situation of equipment and technique, limitation and prospect of proton radiotherapy are summarized and reviewed can contribute to understand the peculiarities, advantages and defects of proton radiotherapy and provide reference for further research in future.
Proton; Radiotherapy; Photon; C ion; Relative biological effectiveness (RBE); Bragg peak
Institute of Radiation Medicine, Chinese Academy of Medical Sciences & Peking Union Medicine College, Tianjin 300192, China.
刘玉连,女,(1988- ),硕士研究生,助理工程师。北京协和医学院中国医学科学院放射医学研究所,研究方向:放射物理。
2017-04-05
10.3969/J.ISSN.1672-8270.2017.07.036
1672-8270(2017)07-0139-05
R815.2
A
天津市自然科学基金(16JCZDJC36100)“核医学诊疗中医患人员及周围环境的辐射防护研究”
①北京协和医学院 中国医学科学院放射医学研究所 天津 300192
*通讯作者:jiaoling@irm-cams.ac.cn

