CO2与异丁烷、1-丁烯汽液平衡数据的测定与关联
王浩人,李东风
(中国石化 北京化工研究院,北京 100013)
CO2与异丁烷、1-丁烯汽液平衡数据的测定与关联
王浩人,李东风
(中国石化 北京化工研究院,北京 100013)
采用高压汽液相平衡装置,用静态法测定了263.15,273.15,283.15,293.15,303.15 K下CO2-异丁烷和CO2-1-丁烯二组分物系的汽液平衡数据,并采用Peng-Robinson方程对平衡数据进行了关联。实验结果表明,测得的二组分物系的汽液平衡数据通过了热力学一致性检验,拟合计算得到的CO2-异丁烷和CO2-1-丁烯的二元交互作用参数分别为0.126 076和0.133 844。CO2-异丁烷和CO2-1-丁烯二组分物系气相摩尔分数的计算值和实验值的平均偏差分别为0.778 4%和0.820 2%。
CO2-异丁烷物系;CO2-1-丁烯物系;高压汽液相平衡
乙烯作为一种基础原料,在石化行业中起着重要的作用,国内需求量很大。在乙烯的生产过程中,因消耗大量昂贵的轻质油,使得原料成本占生产成品的比重较大。而在石油精炼过程中,会产生大量的干气,它们通常含有一定量的乙烯气体。因石油资源的日益枯竭和我国乙烯需求量的不断增高,通过有效回收利用成本较低的炼厂干气,可改善原料结构,节省乙烯生产成本[1]。
在石油化学工业中同样也涉及很多高压过程,如天然气和石油的开采,炼厂干气的回收和超临界萃取技术的应用等。在这些过程中,特别是与汽液分离相关的过程中,单元操作的设计、工艺过程的优化、生产装置的评估都离不开高压汽液平衡数据,而准确的高压汽液平衡数据通常需要通过实验测定。
中国石化北京化工研究院开发了回收炼厂干气中乙烯的浅冷油吸收工艺[2],采用C4馏分和汽油馏分为吸收剂回收乙烯,工艺的核心单元——C4吸收-解吸单元需要在高压下进行操作,它的设计和优化需要可靠的高压汽液平衡数据。在油吸收工艺中,从炼厂干气中回收的C2提浓气中含有H2O和CO2等微量物质,张旸等[3]对H2O与C4汽液平衡数据进行了测定;其中的CO2与水生成碳酸,能腐蚀设备,影响装置正常运行,并且CO2可使加氢催化剂失活[4]。目前,国内外对CO2和C4的汽液平衡数据的测定不太全面[5-6],因此测定CO2和C4在高压下的汽液平衡数据具有重要意义。
本工作采用高压汽液平衡装置,用静态法测定了不同温度下CO2-异丁烷、CO2-1-丁烯的汽液相平衡数据,并进行了热力学一致性检验,采用Peng-Robinson方程对平衡数据进行了关联。
1 实验部分
1.1 试剂
异丁烷、1-丁烯:纯度大于等于99.99%,海瑞通达气体科技有限公司;CO2:纯度大于等于99.99%,北京环宇京辉京城气体科技有限公司。
1.2 实验装置
高压汽液平衡实验装置由法国Sanchez Technologies公司制造,主要由温度控制系统、蓝宝石平衡釜、取样系统3部分构成,如图1所示。采用全透明的蓝宝石平衡釜,最高操作压力为20 MPa,容积为200 mL;将蓝宝石平衡釜和取样系统置于恒温空气浴中,并在平衡釜内设置电磁搅拌装置;平衡釜内的活塞可上下移动从而改变平衡釜的体积,能保证取样过程中平衡釜内压力恒定。
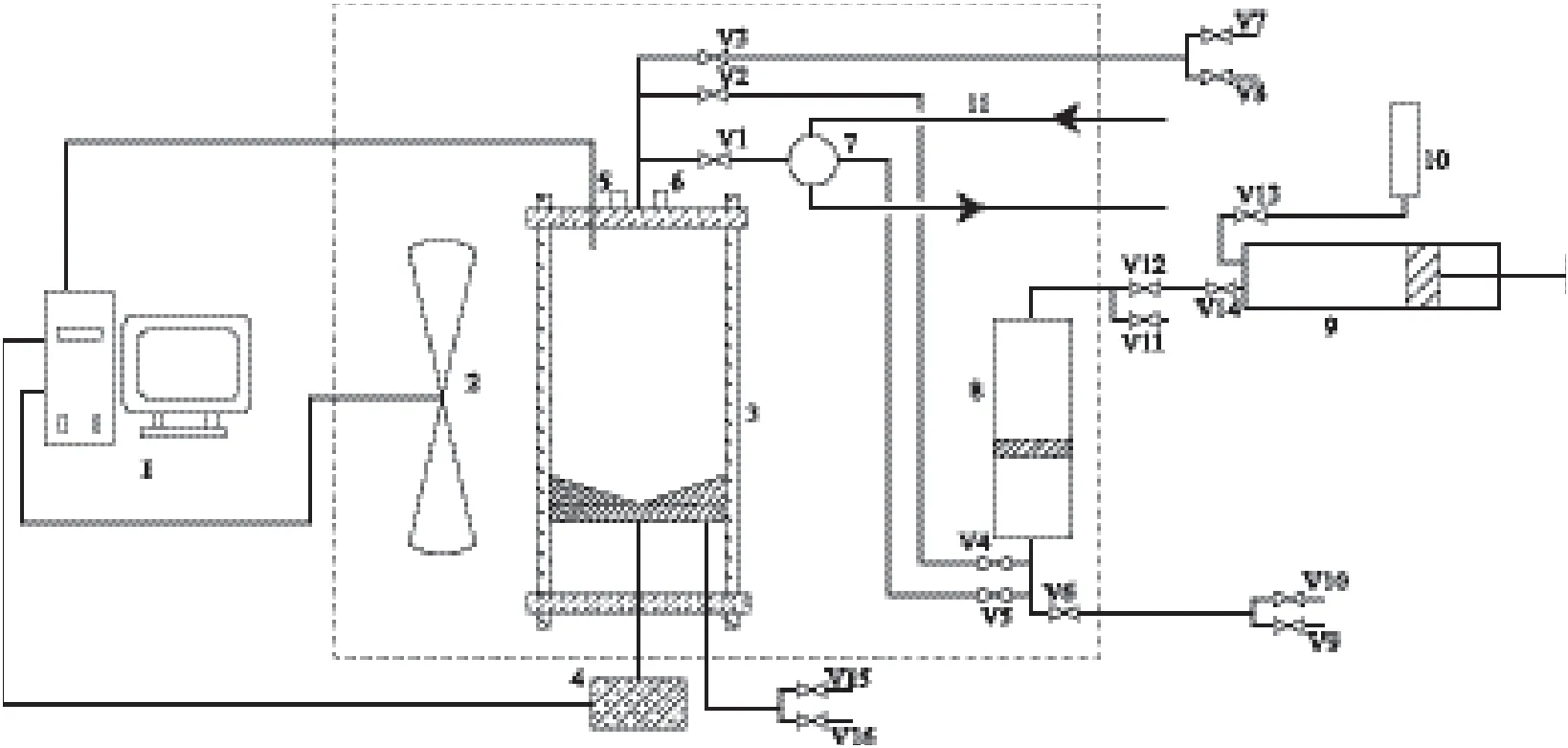
图1 高压汽液平衡实验装置Fig.1 Schematic diagram of high pressure vapor-liquid equilibrium experimental installation.1 Computer;2 Fan;3 Equilibrium still;4 Electric motor;5 Pressure sensor;6 Temperature sensor;7 Four-port valve;8 Transfer bottle;9 Handpump;10 Oil tank;11 Heater band
1.3 实验方法
本实验采用静态分析法,该方法是将所有的待测组分置于一个密闭且抽真空的恒温容器中,不断搅拌使其中的汽液两相达到平衡状态,在平衡过程中,混合物始终在平衡釜内。该方法的优点是平衡体系的密封和耐压问题很容易解决,缺点是在取汽液相试样分析的过程中,会破坏系统的平衡状态,并且所需的平衡时间较长。
在确保装置气密性良好的条件下,对其抽真空,用空气浴降温,打开图1中的阀3和阀7,使CO2和异丁烷、CO2和1-丁烯得以进入平衡釜内;设定好实验温度和平衡釜体积,开动搅拌装置,使试样均匀混合,达到平衡。观察仪表示数,当温度和平衡釜内压力的示数30 min内保持不变时,记录温度和压力数据。
为保证取样时汽液两相组成不受破坏,通过手动泵对转样瓶压力进行调节,使转样瓶的压力和平衡釜内压力保持接近,在恒压模式下,调节平衡釜体积的活塞慢慢上移,打开阀1和阀5使气相和液相试样通过四通阀进入色谱中,取气相试样3~5mL、液相试样3 mL,取样3次,取平均值作为汽液平衡时的组成。
1.4 分析方法
采用安捷伦公司Agilent 7890A型气相色谱仪分析。分析条件:TCD检测,检测器温度为250 ℃,氦气为载气,分流模式进样,HP-PLOT Q色谱柱,柱温为150 ℃,采用面积归一化法定量。
1.5 实验装置的校验
为保证实验装置测温和测压数据的准确性,选取测定了CO2在264.27~293.39 K温度下的饱和蒸气压,并与文献值[7]比较,测定结果见表1和图2。由表1可见,最大相对误差为1.52%,平均相对误差为1.07%。由图2可见,实验值与文献值相一致,装置测温测压具有良好的可靠性。
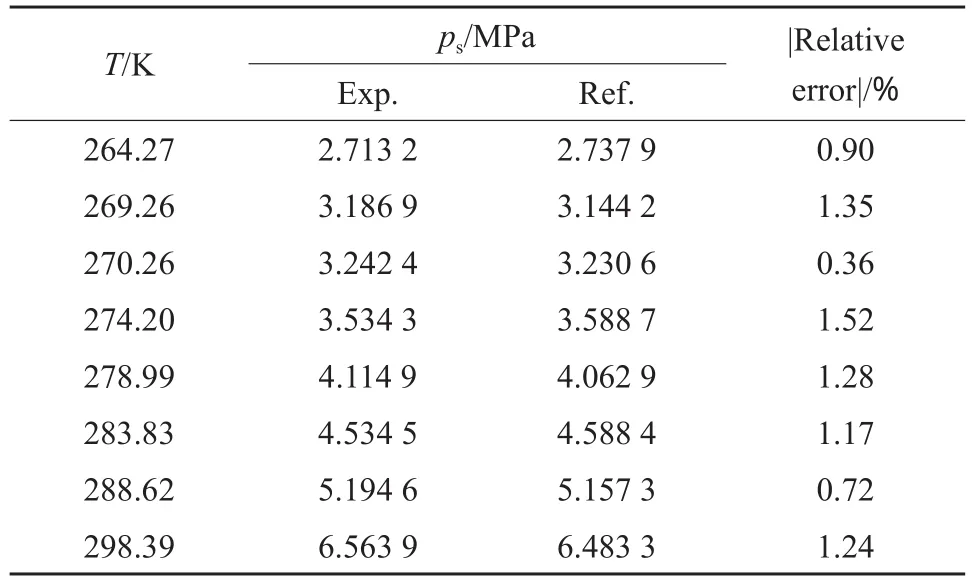
表1 CO2饱和蒸气压测定结果与误差Table 1 Experimental and reference data for the saturated vapor pressure(ps) of CO2and the errors
图2 CO2饱和蒸汽压的实验值与文献值的比较Fig.2 Comparison between the experimental and reference data for the saturated vapor pressure of CO2.
2 结果与讨论
2.1 汽液平衡数据
测定了263.15,273.15,283.15,293.15,303.15 K下CO2-异丁烷二组分物系的汽液平衡数据,实验结果见表2~6。其中,x1代表CO2的液相含量,y1代表CO2的气相含量。
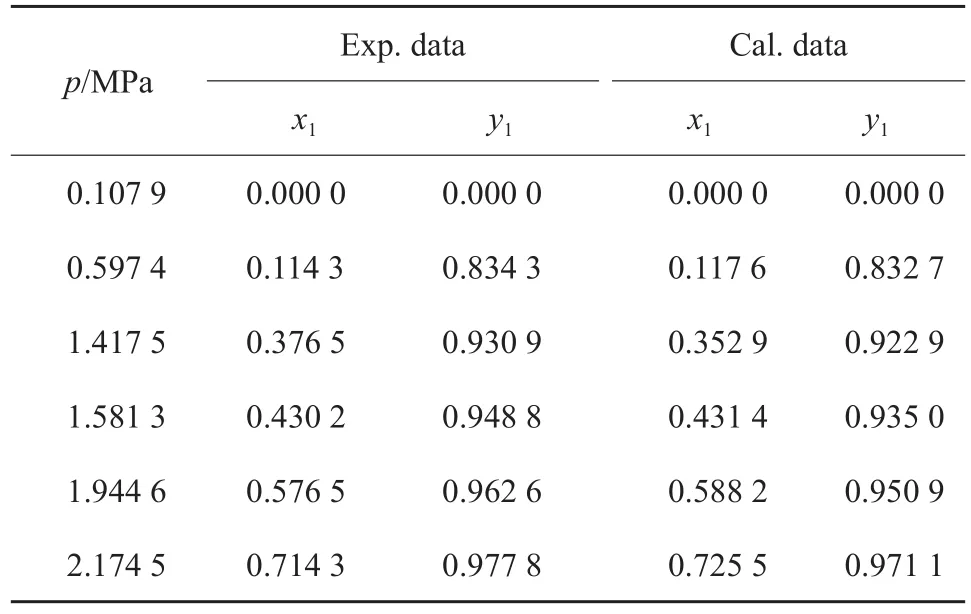
表2 263.15 K 下CO2(1)-异丁烷(2)二组分物系的汽液平衡数据Table 2 Vapor-liquid equilibrium data of the CO2(1)-isobutane(2) binary system at 263.15 K
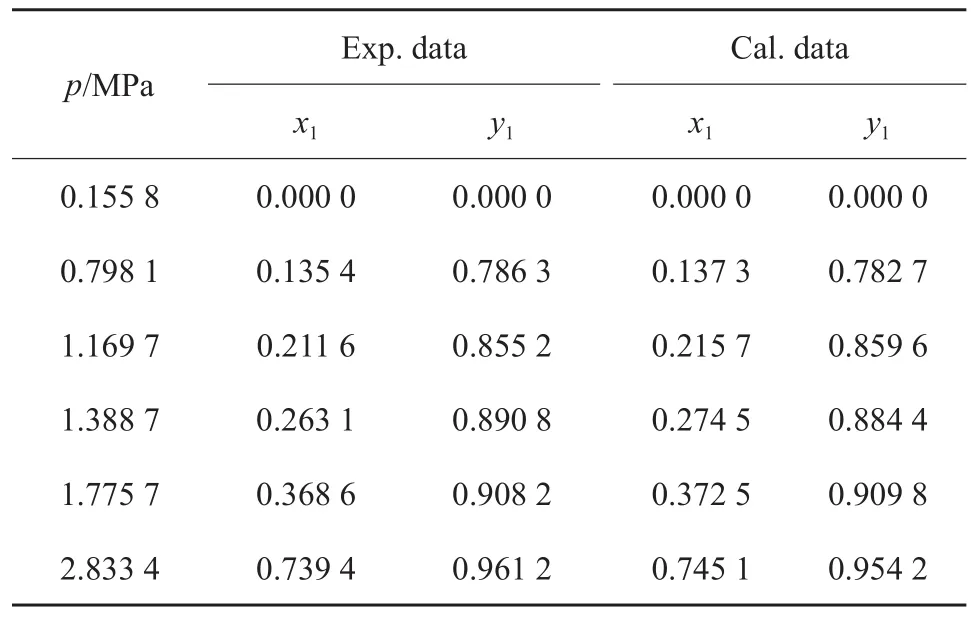
表3 273.15 K 下CO2(1)-异丁烷(2)二组分物系的汽液平衡数据Table 3 Vapor-liquid equilibrium data of the CO2(1)-isobutane(2) binary system at 273.15 K

表4 283.15 K下CO2(1)-异丁烷(2)二组分物系的汽液平衡数据Table 4 Vapor-liquid equilibrium data of the CO2(1)-isobutane(2) binary system at 283.15 K

表5 293.15 K下CO2(1)-异丁烷(2)二组分物系的汽液平衡数据Table 5 Vapor-liquid equilibrium data of the CO2(1)-isobutane(2) binary system at 293.15 K

表6 303.15 K下CO2(1)-异丁烷(2)二组分物系的汽液平衡数据Table 6 Vapor-liquid equilibrium data of the CO2(1)-isobutane(2) binary system at 303.15 K
测定了263.15,273.15,283.15,293.15,303.15 K下CO2-1-丁烯二组分物系的汽液平衡数据,实验结果见表7~11。

表7 263.15 K下CO2(1)-1-丁烯(2)二组分物系的汽液平衡数据Table 7 Vapor-liquid equilibrium data of the CO2(1)-butene(2) binary system at 263.15 K

表8 273.15 K下CO2(1)-1-丁烯(2)二组分物系的汽液平衡数据Table 8 Vapor-liquid equilibrium data of the CO2(1)-butene(2) binary system at 273.15 K
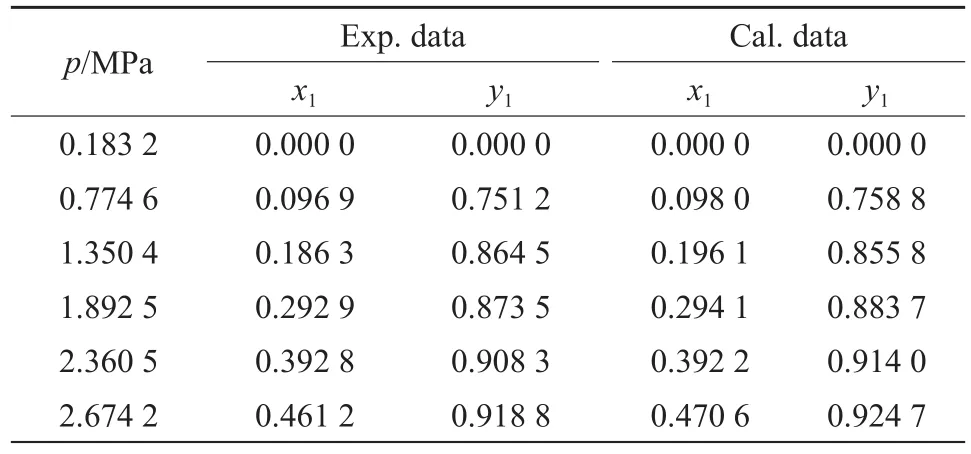
表9 283.15 K下CO2(1)-1-丁烯(2)二组分物系的汽液平衡数据Table 9 Vapor-liquid equilibrium data of the CO2(1)-butene(2) binary system at 283.15 K

表10 293.15 K下CO2(1)-1-丁烯(2)二组分物系的汽液平衡数据Table 10 Vapor-liquid equilibrium data of the CO2(1)-butene(2) binary system at 293.15 K

表11 303.15 K下CO2(1)-1-丁烯(2)二组分物系的汽液平衡数据Table 11 Vapor-liquid equilibrium data of the CO2(1)-butene(2) binary system at 303.15 K
CO2-异丁烷二组分物系在不同温度下平衡时的p-x-y关系图见图3和图4,CO2-1-丁烯二组分物系在不同温度下平衡时的p-x-y关系图见图5和图6,其中点为测试数据,线由Peng-Robinson方程计算得到。

图 3 CO2(1)-异丁烷(2)二组分物系在不同温度下平衡时的p-x1关系图Fig.3 p vs. x1of the CO2(1)-isobutane(2) binary system reaching equilibrium at different temperature.Exp. data:◆ 263.15 K;● 273.15 K;▲ 283.15 K;◆ 293.15 K;■ 303.15 K;— Calculated by means of the Peng-Robinson equation
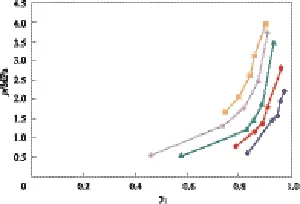
图4 CO2(1)-异丁烷(2)二组分物系在不同温度下平衡时的p-y1关系图Fig.4 p vs. y1of the CO2(1)-isobutane(2) binary system reaching equilibrium at different temperature.Exp. data:◆ 263.15 K;● 273.15 K;▲ 283.15 K;◆ 293.15 K;■ 303.15 K;— Calculated by means of the Peng-Robinson equation
由图3和图4可知,在CO2-异丁烷二组分物系中CO2的汽液相含量与压力和温度有关,压力越大,温度越低,含量越高。因此,为了更好地吸收CO2,C4吸收剂可在高压低温条件下进行吸收。由图5和图6可知,CO2-1-丁烯二组分物系的情况与CO2-异丁烷二组分物系相似,低温有利于吸收CO2。

图 5 CO2(1)-1-丁烯(2)二组分物系在不同温度下平衡时的p-x1关系图Fig.5 p vs. x1of the CO2(1)-butene(2) binary system reaching equilibrium at different temperature.Exp. data:◆ 263.15 K;● 273.15 K;▲ 283.15 K;◆ 293.15 K;■ 303.15 K;— Calculated by means of the Peng-Robinson equation

图 6 CO2(1)-1-丁烯(2)二组分物系在不同温度下平衡时的p-y1关系图Fig.6 p vs. y1of the CO2(1)-butene(2) binary system reaching equilibrium at different temperature.Exp. data:◆ 263.15 K;● 273.15 K;▲ 283.15 K;◆ 293.15 K;■ 303.15 K;— Calculated by means of the Peng-Robinson equation
2.2 热力学一致性检验
对所测数据进行热力学一致性检验,根据Gibbs-Duhem方程,在4个变量T,p,x,y中,从其中任意3个变量可算出第4个变量的值。计算实验值和计算值的平均绝对偏差,如果平均绝对偏差小于0.01,则认为实验数据符合热力学一致性检验。固定T,p,x变量求y,计算263.15,273.15,283.15,293.15,303.15 K下实验数据的平均绝对偏差︱y1cal-y1exp︱的平均值,对于CO2-异丁烷和CO2-1-丁烯二组分物系,平均值分别为0.008 4,0.004 6,0.005 8,0.006 2,0.007 5和0.004 6,0.003 6,0.007 6,0.007 5,0.007 7,均小于0.01。这表明实验数据通过热力学一致性检验。
根据公式︱y1cal- y1exp︱/ y1cal,计算出CO2-异丁烷和CO2-1-丁烯二组分物系气相计算值和实验值的平均偏差分别为0.778 4%和0.820 2%。
2.3 实验数据的关联
Peng-Robinson方程通过对体积的修正,使该方程在相平衡的计算上具有很好的准确性。Peng-Robinson方程的标准形式如下[8]:

式中参数

式中,kij为Peng-Robinson方程的二元交互作用参数,可通过汽液平衡数据回归得到。在Aspen Plus 8.6中对实验数据进行回归,可得CO2-异丁烷和CO2-1-丁烯的二元交互作用参数,分别为0.126 076和0.133 844。
3 结论
1)在263.15~303.15 K下,采用高压汽液相平衡装置对CO2-异丁烷、CO2-1-丁烯二组分物系进行高压汽液平衡数据测定,实验符合热力学一致性检验。
2)采用Peng-Robinson方程,用Aspen Plus 8.6对实验数据进行回归,得到CO2-异丁烷、CO2-1-丁烯的二元交互作用参数,分别为0.126 076和0.133 844。CO2-异丁烷、CO2-1-丁烯二组分物系气相计算值和实验值的平均偏差分别为0.778 4%和0.820 2%。
3)在一定压力和温度范围内,异丁烷和1-丁烯在低温条件下更易吸收CO2。
符 号 说 明
kijPeng-Robinson方程的二元交互作用参数
p 压力,kPa
pc临界压力,kPa
ps饱和蒸气压,kPa
R 气体常数,J/(mol·K)
T 温度,K
Tc临界温度,K
Tr对比温度
V 摩尔体积,L/mol
x 液相摩尔分数
y 气相摩尔分数
ω 偏心因子
[1] 冷桂玲,田原宇,乔英云,等. 炼厂干气的综合应用技术[J].天然气化工,2011,36(6):71-75.
[2] 中国石油化工股份有限公司北京化工研究院. 一种采用油吸收分离炼厂干气的装置及方法:103087772 A[P].2015-05-08.
[3] 张旸,李东风,杨元一. 微量水-碳四二组分物系汽液平衡数据的测定与关联[J].石油化工,2013,42(10):1130-1136.
[4] 王泽尧. 炼油厂干气杂质处理及回收方法浅论[J].乙烯工业,2007,19(3):12-14.
[5] Younghun K,Petri U K,Juha-Pekka P,et al. Isothermal vapour-liquid equilibrium measurements for six binary systems of C4hydrocarbons+2-propanone[J].Fluid Phase Equilib,2004,226:173-181.
[6] José M S F,Ralf D,Stephanie P. High-pressure fluid-phase equilibria:Experimental methods and systems investigated(2005-2008)[J].Fluid Phase Equilib,2011,300:1-69.
[7] Qazi N,Khalik M S,Lau K K. Measurement of isothermal(vapor & liquid) equilibria(VLE) for binary(CH4& CO2)from T = (240. 35 to 293. 15) K and CO2rich synthetic natural gas systems from T = (248. 15 to 279. 15) K[J].J Nat Gas Sci Eng,2015,27:158-167.
[8] Guo Hao,Gong Maoqiong,Dong Xueqiang,et al. A static analytical apparatus for vapor pressures and (vapor+liquid)phase equilibrium measurements with an internal stirrer and view windows[J].J Chem Thermodyn,2014,76(76):116-123.
(编辑 王 萍)
Measurements and correlations for vapor-liquid equilibrium data of CO2-isobutane and CO2-butene binary systems
Wang Haoren,Li Dongfeng
(Sinopec Beijing Research Institute of Chemical Industry,Beijing 100013,China)
In the recovery of ethylene in ref i nery dry gas with cold oil,high pressure vapor-liquid equilibrium data were needed by the simulation and optimization of the process. The concentrated gas contained H2O,CO2and other components,especially CO2,which could corrode the equipments. The high pressure vapor-liquid equilibrium data for the CO2-isobutane binary system and the CO2-1-butene binary system were measured at 263.15,273.15,283.15,293.15 and 303.15 K in high pressure vapor-liquid equilibrium installation. The experimental data could meet the demand of the thermodynamic consistency test. The data were correlated by means of the Peng-Robinson equation. The interactive parameters for the CO2-isobutane and CO2-1-butene binary systems were calculated,and were 0.126 076 and 0.133 844 respectively. The average deviations between the experimental and calculated data for the CO2-isobutane and CO2-1-butene binary systems were 0.778 4% and 0.820 2%,respectively.
CO2-isobutane system;CO2-1-butene system;high pressure vapor-liquid equilibrium
1000-8144(2017)01-0056-06
TQ 013.1
A
10.3969/j.issn.1000-8144.2017.01.008
2016-07-30;[修改稿日期]2016-11-17。
王浩人(1992—),女,辽宁省辽阳市人,硕士生,电话 15117966396,电邮 15117966396@163.com。联系人:李东风,电话 010-59202905,电邮 lidf.bjhy@sinopec.com。

