草甘膦对草地早熟禾愈伤组织生长及生理指标的影响
李慧萍,徐海鹏,金 宁,金小煜,牛奎举,马晖玲
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃农业大学 园艺学院,甘肃 兰州 730070)
草甘膦对草地早熟禾愈伤组织生长及生理指标的影响
李慧萍1,徐海鹏1,金 宁2,金小煜1,牛奎举1,马晖玲1
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃农业大学 园艺学院,甘肃 兰州 730070)
以草地早熟禾午夜Ⅱ号愈伤组织为试验材料,采用间接接种的方法在草甘膦浓度为0、0.02、0.04、0.06、0.08和0.10 mmol/L的MS培养基上继代培养。20 d后对愈伤组织进行存活率、相对生长率、褐化情况、电导率、丙二醛、可溶性蛋白、游离脯氨酸含量和抗氧化酶(SOD,POD和CAT)活性的测定。结果表明:愈伤组织的存活率随草甘膦浓度的增大而逐渐下降,相对生长率呈先上升后下降的趋势。电导率、游离脯氨酸含量及SOD,POD和CAT活性呈先上升后下降的趋势,临界点处的草甘膦浓度为0.04 mmol/L。丙二醛和可溶性蛋白的临界点草甘膦浓度是0.06 mmol/L。说明草地早熟禾午夜Ⅱ号愈伤组织可耐受较小浓度的草甘膦(<0.04 mmol/L)。
草甘膦;草地早熟禾;愈伤组织;生理指标
近年来,伴随我国经济的迅速发展,草地绿化越来越受到政府和市民的关注。我国西北地区气候冷凉,杂草众多,草坪草在长势、草龄、抗寒、抗除草剂等方面存在较多问题,不容乐观[1],所以我国西北地区的草坪寿命普遍较短。
草甘磷是由美国孟山都公司研制开发的一种广谱性和非选择性除草剂,其除草活性很强[2],在田间使用时具有广谱、高效,对人畜安全和无环境污染等优点[3-5],不会影响土壤的菌落结构,能有效去除多年生杂草,对优质草种种苗的生长具有广泛的使用价值。在草坪管理中使用草甘膦,具有清除杂草,增加经济效益,美化环境的作用。
用离体方法来筛选抗除草剂突变体的研究愈来愈受到育种工作者的重视,体细胞无性系变异及其筛选已应用到多种农作物[6-7]。现已得到了番茄、胡萝卜、小麦[8]、油菜[9]、棉花等多种作物的抗除草剂细胞系,部分已诱导培养成再生植株[6-7,10]。在草坪草上,Heckart等[11]通过对海滨雀稗愈伤组织进行定向筛选,获得了具有稀禾定(Sethoxydim)抗性的再生植株。以草地早熟禾午夜Ⅱ号愈伤组织为试验材料,通过测定其愈伤组织在不同浓度草甘膦下的生长及生理生化指标,分析不同浓度草甘膦处理下午夜Ⅱ号愈伤组织生理响应效果,以期为抗草甘膦突变体的筛选奠定基础。
1 材料和方法
1.1 愈伤组织的诱导及继代培养
以草地早熟禾(Poapratensis)午夜Ⅱ号的种子为试验材料,按文献[12]的方法高压灭菌后接种在诱导培养基上,诱导培养基成分为:MS+2,4-D(1 mg/L)+6-BA(0.3 mg/L)+3%蔗糖+0.7%琼脂,50 d后将诱导出的愈伤组织转入继代培养基,继代培养基同诱导培养基,此后每隔25~30 d继代1次,每次继代时去掉水渍化和褐化的愈伤组织。
1.2 草甘膦处理
经5~6次继代培养后,挑选生长均匀、快速且疏松的愈伤组织接种于含不同浓度草甘膦(0.02、0.04、0.06、0.08、0.10 mmol/L)的MS培养基上,并在121℃,101.1 kPa压力下高温高压灭菌26 min[13]。以草甘膦浓度0 mmol/L为空白对照,每个浓度设置3个重复。每皿接种25块愈伤组织,并且称取愈伤鲜重,处理20 d,取样进行相关生理指标及生长情况的测定。
草地早熟禾午夜Ⅱ号愈伤组织相对生长率=(草甘膦处理20 d后愈伤组织重量-未处理前愈伤组织重量)/未处理前愈伤组织重量×100%。
1.3 生理指标的测定
采用电导仪法测定电导率;采用硫代巴比妥酸比色法测丙二醛含量[14]。采用考马斯亮蓝G-250染色法测可溶性蛋白含量[15];采用茚三酮比色法测定游离脯氨酸含量;采用氮蓝四唑(NBT)光化学还原反应法测SOD活性;采用氧化愈创木酚比色测POD活性;采用紫外分光光度法测CAT活性[16]。为使所测不同生理指标的材料所处状态一致,将每次用过后剩余的愈伤组织及时放入液氮中冷冻保存。
1.4 数据处理
对所有数据采用SPSS 19.0进行单因素方差分析,数据结果采用标准误和平均值表示,使用Excel 2010软件进行处理及制图。
2 结果与分析
2.1 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织生长的影响
不同浓度草甘膦处理后愈伤组织的生长情况各不相同。与对照相比,高浓度的草甘膦处理对愈伤组织生长的抑制效果比较强。在草甘膦浓度为0.02 mmol/L,愈伤组织的生长效果最好,但随草甘膦浓度的继续增大,愈伤组织的生长受到抑制作用,且程度随草甘膦浓度的增大而增强。当草甘膦浓度>0.06 mmol/L,相对生长率变小(表1)。
愈伤组织在不含草甘磷的培养基上长势最好,愈伤组织明显增殖,并且产生了大量新鲜的愈伤组织。而在加有草甘膦的培养基上随着草甘膦浓度的逐渐增加,长势越来越差,存活率也愈来愈低。当草甘膦浓度达到0.08 mmol/L时,愈伤组织存活率仅为草甘膦浓度为0.06 mmol/L的一半,但却为对照组的0.14倍。试验结果表明,在对照及低草甘膦浓度处理下愈伤组织有新愈伤长出,但随着草甘膦浓度的增大,愈伤组织长出新愈伤的能力越来越低(表2)。
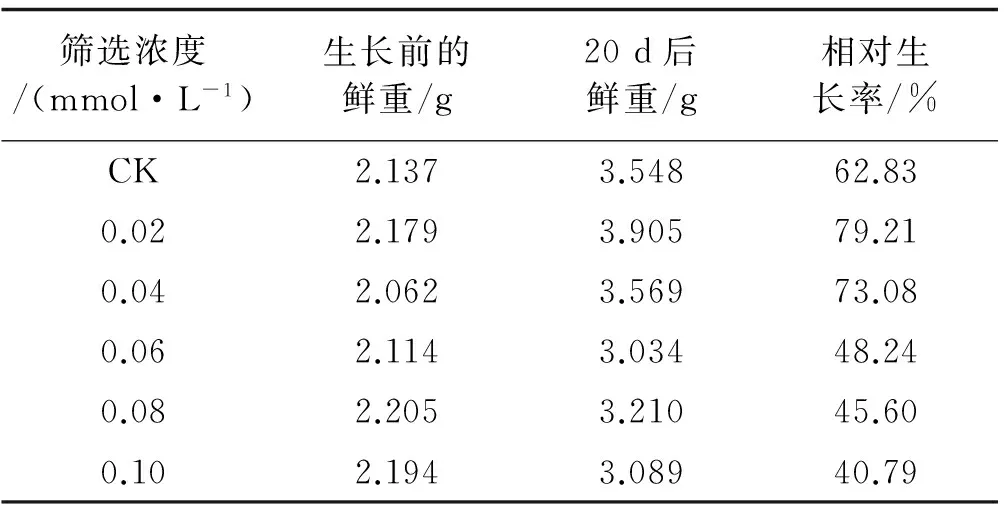
表1 不同浓度草甘膦处理下愈伤组织的相对生长率Table 1 Effect of different concentrations of glyphosate on relative growth rate of callus
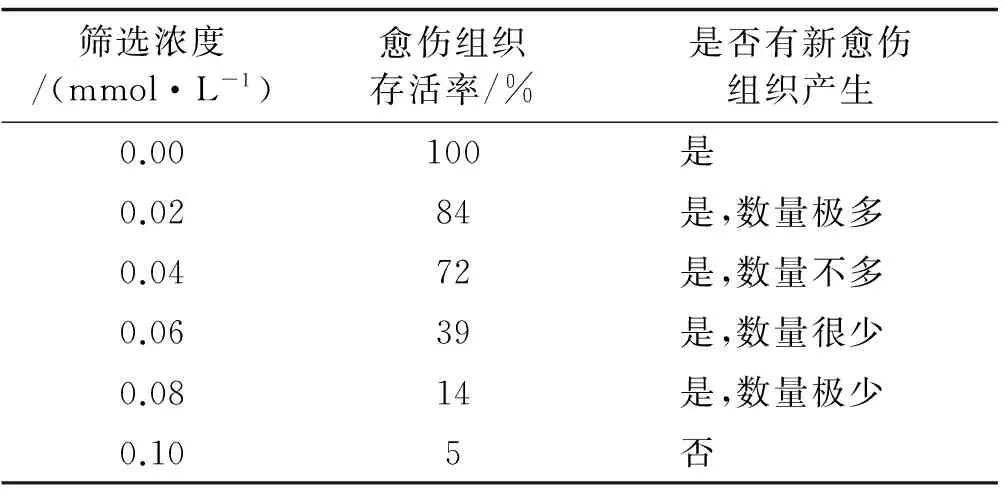
表2 不同浓度草甘膦处理下愈伤组织生长Table 2 Effect of different concentrations of glyphosate on callus growth
草地早熟禾午夜Ⅱ号愈伤组织接种到不同浓度的草甘膦培养基上,统计培养1、2周其愈伤组织的褐化状况。随着草甘膦浓度的增加和培养时间的增加,愈伤组织的褐化情况也越来越严重。当草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,培养1周愈伤组织的褐化情况分别为对照组的2.5倍、4.5倍、5.5倍、7倍、8倍,培养2周愈伤组织的褐化情况分别为对照组的3.7倍、6.3倍、7.3倍、8倍、8倍(表3)。

表3 不同浓度草甘膦愈伤组织的褐化Table 3 Effect of different concentrations of glyphosate on callus browning rate
2.2 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织细胞膜相对透性的影响
电解质外渗反映了逆境胁迫下细胞膜透性增强的程度。并反映了愈伤组织在不同浓度的草甘膦处理下所对应电导率的大小。随着草甘膦浓度的逐渐增加,愈伤组织的电导率值呈先上升后下降的趋势,最后低于对照。当草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,愈伤组织的电导率值分别为对照组的1.11倍、1.23倍、1.07倍、0.97倍、0.93倍。且与对照相比均具有显著性差异(P<0.05)。当草甘膦浓度>0.08 mmol/L时,电导率值基本趋于稳定(图1)。
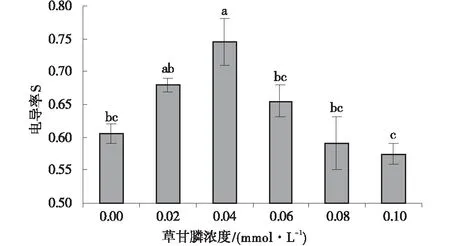
图1 不同浓度草甘膦处理下愈伤组织细胞膜 相对透性Fig.1 Effect of different concentrations of glyphosate on the conductivity of callus
2.3 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织丙二醛含量的影响
丙二醛含量的变化随草甘膦浓度的增加呈先上升后下降的趋势。当草甘膦浓度为0.06 mmol/L时,其丙二醛含量达到了峰值,为1.16 μmol/g FW。与对照相比,丙二醛含量在草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时分别为对照的1.02倍、1.04倍、1.03倍、1.00倍、0.99倍。当草甘膦浓度高于0.08 mmol/L时,丙二醛含量低于对照组(图2)。
2.4 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织游离脯氨酸的影响
随着草甘膦浓度的逐渐增加,所测愈伤组织中游离脯氨酸的含量呈先上升后下降的趋势,但都高于对照组。当草甘膦浓度<0.04 mmol/L时,其游离脯氨酸的含量上升趋势较快(图3)。当草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,愈伤组织游离脯氨酸含量分别为对照组的1.26倍、3.79倍、3.43倍、2.74倍、1.95倍。

图2 不同浓度草甘膦处理下愈伤组织丙二醛的含量Fig.2 Effect of different concentrations of glyphosate on malondialdehyde content of callus
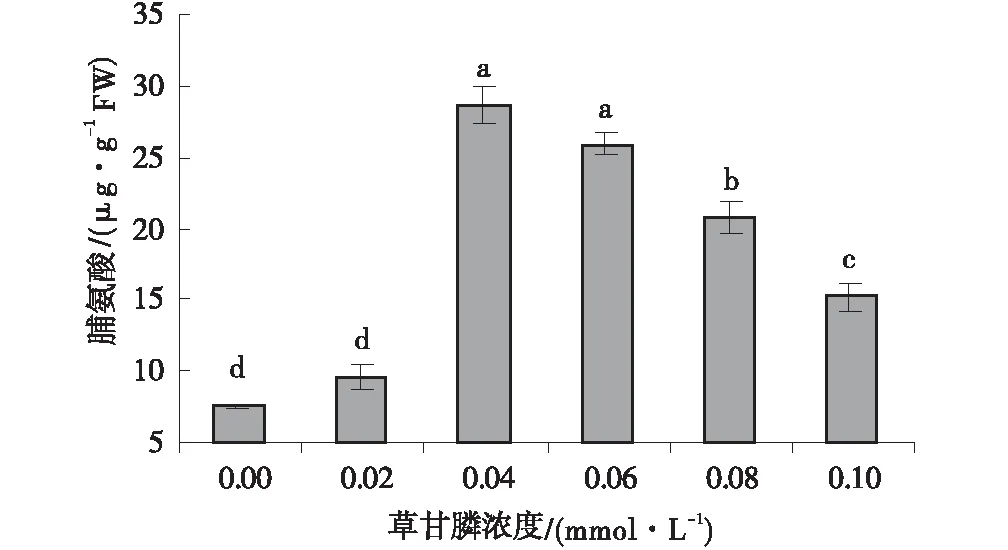
图3 不同浓度草甘膦处理下愈伤组织 游离脯氨酸的含量Fig.3 Effect of different concentrations of glyphosate on free proline content of callus
2.5 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织可溶性蛋白的影响
随草甘膦浓度的逐渐增加,不同浓度的草甘磷对愈伤组织合成可溶性蛋白的影响不同。不同浓度草甘膦处理下愈伤组织可溶性蛋白含量呈先上升后下降的趋势,且分别为对照组的1.06倍、 1.19倍、1.20倍、1.14倍、1.11倍(图4),与对照相比可溶性蛋白含量的变化基本趋于稳定。
2.6 不同浓度梯度下的草甘膦对午夜Ⅱ号愈伤组织抗氧化酶活性的影响
随着草甘膦浓度的逐渐增加,不同浓度处理下愈伤组织SOD的活性各不相同。当草甘膦浓度<0.04 mmol/L时,其愈伤组织SOD的活性随草甘膦浓度的增加上升趋势较明显(图5)。当草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,愈伤组织的SOD活性分别为对照组的1.01倍、1.04倍、1.01倍、1.01倍、0.99倍。当草甘膦浓度为0.10 mmol/L时,愈伤组织SOD的活性变化与对照差异不显著(P>0.05)。
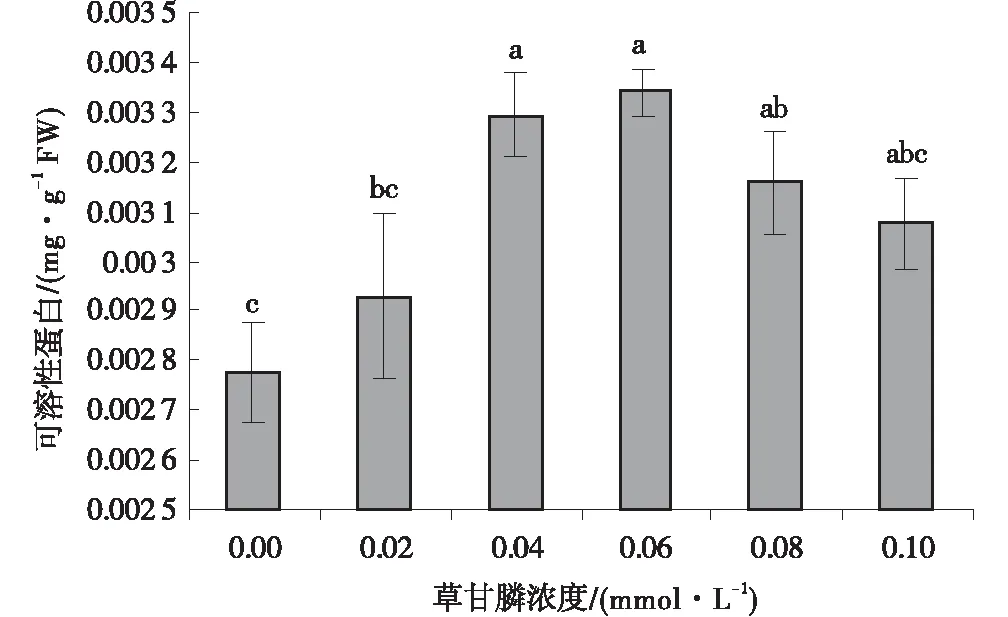
图4 不同浓度草甘膦处理下愈伤组织的 可溶性蛋白含量Fig.4 Effect of different concentrations of glyphosate on soluble protein content of callus
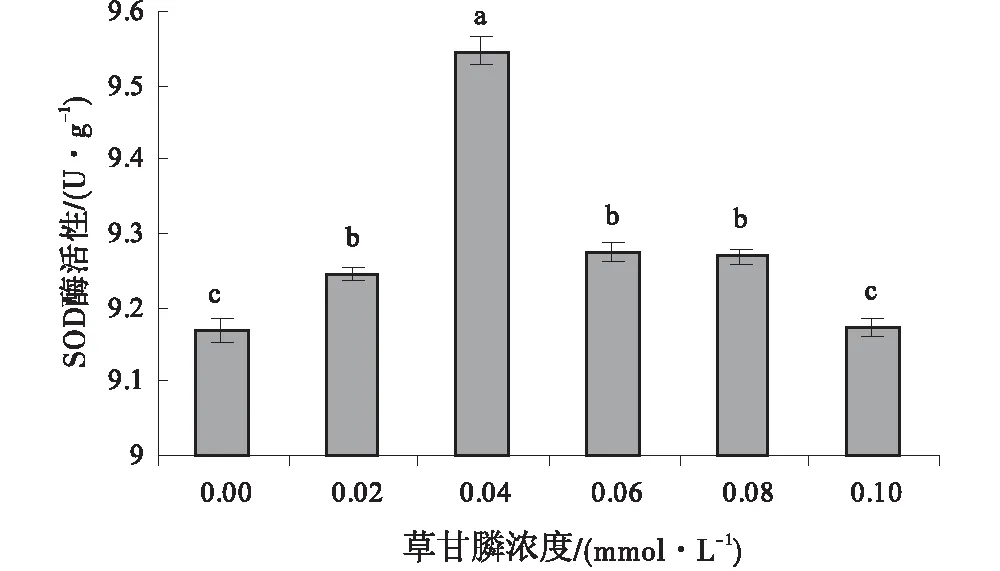
图5 不同浓度草甘膦处理下愈伤组织的SOD活性Fig.5 Effect of different concentrations of glyphosate on SOD activity of callus
与对照相比,不同浓度的草甘膦处理后愈伤组织的POD活性均高于对照组(图6)。愈伤组织的POD活性在草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,分别为对照的1.36倍、1.72倍、1.45倍、1.14倍、1.12倍。当草甘膦浓度0.04 mmol/L时,其POD活性最高。
随着草甘膦浓度逐渐增加,不同浓度处理下愈伤组织CAT活性高低各不相同。草甘膦浓度为0.02、0.04、0.06、0.08、0.10 mmol/L时,愈伤组织CAT活性分别为对照组的1.05倍、1.13倍、1.04倍、0.47倍、0.44倍。当草甘膦浓度>0.08 mmol/L时,愈伤组织CAT活性都低于对照组,与对照相比其CAT活性维持在一定的水平,其活性变化基本趋于稳定(图7)。
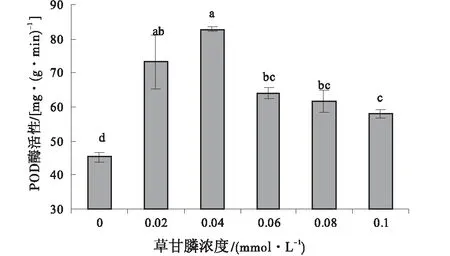
图6 不同浓度草甘膦处理下愈伤组织的POD活性Fig.6 Effect of different concentrations of glyphosate on POD activity of callus
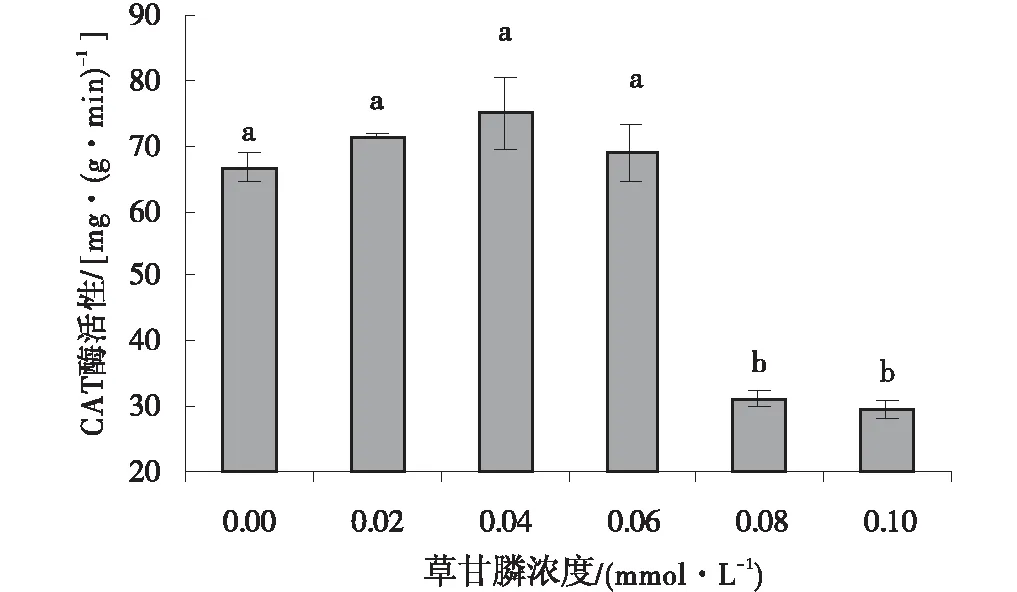
图7 不同浓度草甘膦处理下愈伤组织 的CAT活性Fig.7 Effect of different concentrations of glyphosate on CAT activity of callus
3 讨论
3.1 不同浓度梯度下草甘膦对愈伤组织的生长的影响
通过对愈伤组织相对生长率的测定,发现不同浓度草甘膦对愈伤组织细胞的分裂生长有不同程度的抑制作用[10]。试验研究表明,低浓度草甘膦(<0.04 mmol/L)对愈伤组织的生长有促进作用,0.04 mmol/L草甘膦处理对愈伤组织的增重效果最显著。高浓度(>0.06 mmol/L)对愈伤组织的生长有明显的抑制作用,并且随着筛选浓度和继代时间的逐渐增加,愈伤组织的生长减缓,水渍化现象和褐化现象也愈来愈严重,在高浓度0.10 mmol/L下继代2周后,愈伤组织甚至部分变成黑色。说明了午夜Ⅱ号愈伤组织对低浓度的草甘膦(0.04 mmol/L)有一定的抵抗能力和耐受能力,在高浓度的草甘膦胁迫下,其生理活性丧失。
3.2 不同浓度梯度下的草甘膦对愈伤组织膜系统的损坏程度的影响
受细胞膜保护,隔离在细胞内的电解质在细胞膜受到伤害时会外泄,电解质激增会破坏细胞膜保护,植物受到逆境胁迫时细胞内代谢平衡被破坏,有利于自由基产生,过量自由基会引发或加剧膜质过氧化作用,植物膜质过氧化的产物造成生物膜系统的损伤,严重时会导致植物细胞的死亡[17-18]。丙二醛是膜脂过氧化的最终产物,能够抑制细胞保护酶的活性并降低抗氧化物的含量[19]。因此,常把电导率及丙二醛作为反映膜脂过氧化程度的指标。研究表明,随着草甘膦浓度的增大,愈伤组织电导率及丙二醛含量呈先上升后下降的趋势,说明愈伤组织可适应低浓度的草甘膦胁迫,在高浓度处理下,随着胁迫浓度的增加,愈伤组织的生理活性逐渐衰退甚至丧失,因而愈伤组织膜系统的受损程度没有继续增加。
3.3 不同浓度梯度的草甘膦对愈伤组织渗透调解物质的影响
脯氨酸、可溶性蛋白是植物体内的主要渗透调解物,能增加膜脂浓度,降低细胞冰点,防止细胞过度脱水,维持蛋白质水合度,从而减轻渗透胁迫对细胞的伤害[19]。蛋白质是植物体内重要的有机物质,通过蛋白质含量的测定,可反映出植物体生长代谢的强弱,也可通过蛋白质含量的多少反映植物光合作用能力的大小[20]。不同浓度的草甘膦对愈伤组织的渗透调解能力也有影响,其趋势是先上升后下降。上升是因为愈伤组织能耐受较低浓度的草甘膦胁迫,所以其生长代谢能力也逐渐增强,愈伤组织通过增强渗透能力来保持水势力。高浓度草甘膦处理下其渗透调解能力及生长代谢能力减弱,说明高浓度的草甘膦会使愈伤组织的生理活性降低甚至丧失。
3.4 不同浓度梯度的草甘膦对愈伤组织抗氧化酶活性的影响
SOD是膜脂过氧化防御系统的主要保护酶,其活性强弱与植物的抗氧化能力密切相关,该酶能够清除超氧阴离子自由基,同时也是植物抗氧化系统的第一道防线[21]。测定植物内SOD活性可以判断植物器官组织细胞的损伤程度,预防生物体免受超氧阴离子自由基损伤。过氧化氢酶也是植物体内一种重要的活性氧,通过其活性的变化情况也可以推测活性氧产生的情况。作为植物对不良环境胁迫相应的敏感指标之一,POD对多种生理功能起到保护作用,它可以清除植物体内大量活性氧并阻止植物体内自由基对生物大分子的质膜的破坏,能减轻细胞由于质膜过氧化作用而引起的伤害[17]。其值高低决定了植物对干旱,盐碱,重金属,低温,紫外线等逆境胁迫的抵抗能力。不同草甘膦浓度处理下,SOD,POD和CAT活性总体呈先上升后下降的趋势。酶活性上升可能是愈伤组织在低浓度草甘膦处理下增加酶活性以此来适应不良环境。当草甘膦浓度超过0.06 mmol/L时,其酶活性呈下降趋势,可能是酶合成速率低于其分解速率,也可能是高浓度胁迫使愈伤组织丧失了其生理活性。
4 结论
通过对草甘膦胁迫下草地早熟禾午夜Ⅱ号愈伤组织的生长、抗氧化和渗透性调节能力的分析,发现0.04 mmol/L草甘膦胁迫可显著提高草地早熟禾午夜Ⅱ号愈伤的电导率、丙二醛、可溶性蛋白、游离脯氨酸含量和抗氧化酶SOD,POD和CAT的活性,而当草甘膦浓度>0.06 mmol/L时,其电导率、丙二醛、可溶性蛋白、游离脯氨酸含量以及SOD,POD和CAT活性均呈现降低趋势。说明午夜Ⅱ号愈伤组织可以耐受0.04 mmol/L草甘膦胁迫。因此,在筛选抗草甘膦除草剂突变体时,其草甘膦浓度应不低于0.04 mmol/L。此条件可为离体筛选草地早熟禾抗草甘膦突变体和草地早熟禾抗草甘膦新品种提供科学理论依据。
[1] 孙宾成.东北高寒地区抗草甘膦大豆栽培技术研究[D].北京:中国农业科学院,2012.
[2] 迪林飞达.草甘膦可溶性固体剂型应用技术[M].北京:中国农业出版社,2005.
[3] 张恩让,程智慧.大蒜抗草甘磷愈伤组织变异系的选择研究[J].西北农林科技大学学报(自然科学版),2003,31(3):69-72.
[4] Hart M M,Powell J R,Gμlden R H,etal.Separating the effect of crop from herbicide on soil microbial commol/Lμnities in glyphosate-resistant corn[J].Pedobiologia,2009,52(4):253-262.
[5] 刘媛.草甘膦废水的除磷研究[D].杭州:浙江大学,2014.
[6] 刁现民,孙敬三.植物体细胞无性系变异的细胞学和分子生物学研究进展[J].植物学通报,1999,16(4):372-377.
[7] 张磊.几种草坪草转基因及体细胞无性变异的研究[D].合肥:安徽农业大学,2005.
[8] 魏松红,纪明山,王英姿,等.应用诱变法筛选抗草甘膦小麦植株初步研究[J].现代农药,2006,5(3):42-43,46.
[9] 柳寒.油菜抗草甘膦除草剂资源的鉴定及筛选[D].武汉:华中农业大学,2011.
[10] 李卫国.棉花抗草甘膦体细胞无性系变异筛选技术研究[D].武汉:华中农业大学,2008.
[11] Heckart D L,Parrott W A,Raymer P L.Obtaining sethoxydim resistance in seashore paspalmmol/L[J].Crop science,2010,50(6):2632-2640.
[12] 俞玲,马晖玲.甘肃陇西野生草地早熟禾植株的再生体系[J].草业科学,2014(6):1063-1069.
[13] 李卫国.棉花抗草甘膦体细胞无性系变异筛选技术研究[D].武汉:华中农业大学,2008.
[14] 徐炜,陈志宏,师尚礼,等.45℃贮藏对超干处理披碱草种子生理生化特性的影响[J].草原与草坪,2011,31(1):42-46.
[15] 张锁科,马晖玲.3个草地早熟禾品种分蘖期的生理特性变化[J].草原与草坪,2014(6):74-77.
[16] 田晓艳,刘延吉,张蕾,等.盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J].草原与草坪,2009(6):11-14.
[17] 王连敏,王立志.苗期低温对玉米体内脯氨酸,电导率及光合作用的影响[J].中国农业气象,1999,20(2):28-30.
[18] 陈少裕.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯,1991,27(2):84-90.
[19] 杨春祥,李宪利,高东升,等.低温胁迫对油桃花器官膜脂过氧化和保护酶活性的影响[J].果树学报,2005,22(1):69-71.
[20] 安志装,王校常,施卫明,等.重金属与营养元素交互作用的植物生理效应[J].土壤与环境,2002,11(4):392-396.
[21] 陈锡莲.二萜化合物LeμkameninE 对拟南芥愈伤组织PLD 的调控作用研究[D].兰州:西北师范大学,2013.
Effect of glyphosate on growth and physiological index of kentucky bluegrass callus
LI Hui-ping1,XU Hai-peng1,JIN Ning2,JIN Xiao-yuv1,NIU Kui-ju1,MA Hui-ling1
(1.CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China;2.HorticulturalCollege,GansuAgriculturalUniversity,Lanzhou730070,China)
The callus of kentucky bluegrasses (midnight Ⅱ) was cultured on MS medium which contained different concentrations of glyphosate (0,0.02,0.04,0.06,0.08 and 0.10 mmol/L).After 20 days,the callus was exploited for measuring physiological indexes (survival rate,relative growth rate,brown case,electrical conductivity,contents of MDA,soluble protein,free proline,SOD,POD and CAT).The result showed that the survival rate of the callus gradually decreased with the increase of glyphosate,but the relative growth rate increased first and then decreased.0.04 mmol/L of glyphosate concentration was the turning point.While MDA and soluble protein of critical concentrations of glyphosate was 0.06 mmol/L.The tolerable concentration of glyphosate was 0.04 mmol/L.
glyphosate;kentucky bluegrass;callus;physiological index
2016-04-18;
2016-11-02
甘肃农业大学大学生科研训练计划(SRTP)项目(20150225),甘肃农业大学国家级大学生创新创业训练计划项目(201510733001),国家自然科学基金“草地早熟禾种间体细胞杂交的研究(31160482)”资助
李慧萍(1994-),女,甘肃武威人。 E-mail:1529711658@qq.com 马晖玲为通讯作者。
S 688.4
A
1009-5500(2017)03-0042-06

