血清尿酸与风湿性心脏病患者心房颤动的关系
燕朝均,于凤旭,廖 斌
·临床经验·
血清尿酸与风湿性心脏病患者心房颤动的关系
燕朝均,于凤旭,廖 斌
目的 通过分析风湿性心脏病(风心病)合并心房颤动(房颤)患者的血清尿酸水平(尿酸),探讨血清尿酸水平与风湿性心脏病患者心房颤动的关系。 方法 回顾性分析334例住院的风湿性心脏病患者,根据有无房颤分为风心病房颤组(240例)、风心病窦性心律组(94例),比较2组的一般资料、临床资料、心脏彩超数据。 结果 风心病伴房颤组的血清尿酸、肌酐、尿素、左心房内径(LAD)均明显高于风心病窦性心律组(P<0.05),白蛋白、高密度脂蛋白胆固醇、总胆固醇、性别比例、左心室射血分数(LVEF)均明显低于风心病窦性心律组(P<0.05)。逐步logistic回归分析矫正了尿酸、肌酐、尿素、LAD、性别比例、白蛋白、高密度脂蛋白胆固醇、总胆固醇及LVEF的影响后,尿酸(OR:1.008;95%CI:1.004~1.012;P<0.001)、肌酐(OR:1.038;95%CI:1.008~1.070;P=0.012)、左心房内径(OR:1.040;95%CI:1.006~1.075;P=0.019)、左心室射血分数(OR:0.952;95%CI:0.909~0.998;P=0.040 )与风心病患者房颤的发生显著相关。 结论 血清尿酸水平升高是风湿性心脏病患者心房颤动发生的高危险因素,重视早期控制尿酸水平,对预防心房重塑及房颤的发生和发展有一定的临床指导作用。
血清尿酸;风湿性心脏病;心房颤动
心房颤动(房颤)是临床上最常见的心律失常,具有较高的发病率[1]、致残率和死亡率[2],已成为全球公共的健康问题[3],对房颤危险因素的监测和治疗显得十分重要。房颤的发病机制至今仍未明确,可能和分子遗传学、心房电重构、结构重构、自主神经系统等因素相关。最近研究发现,氧化应激和炎症激活可能是房颤的发病机制之一[4-6]。研究表明血清尿酸通过氧化应激和炎症激活参与心血管疾病的发生、发展,是心血管疾病的危险因素[7],也是高血压、心力衰竭、冠心病及心房颤动发生或者死亡的独立高危因素[8-12]。目前国内外关于尿酸和房颤关系的研究主要集中于非瓣膜性心血管疾病,尿酸和瓣膜性心脏病的研究甚少。风湿性心脏病(风心病)是一种自身免疫系统性疾病,因风湿热导致心脏瓣膜及其附属结构的异常或者功能异常,主要累及二尖瓣及主动脉瓣;同时发生心房颤动时,伴发心房血栓、脑卒中事件明显增多,使致残率及死亡率明显增加,严重危害患者的身心健康和生活质量,影响瓣膜病的发展和预后。本文就血清尿酸和风心病患者房颤之间的关系进行研究,并探讨房颤发生的可能机制及干预手段。
1 资料与方法
1.1 对象 收集2014年4月至2016年11月我院胸心外科风心病住院患者资料,结合心脏彩超及术后病理组织学检查确诊为风心病。排除标准:合并冠心病、先天性心脏病;创伤性心脏瓣膜病、感染性心脏瓣膜病、甲状腺功能亢进性心脏病、肺源性心脏病;左心室射血分数(left ventricular ejection fraction,LVEF)≤40%、合并高血压病、糖尿病;既往心脏手术、肿瘤、心肌病、肾炎、肾功能衰竭、炎症性疾病及痛风病史。符合条件的风心病患者334例,男89例,女245例,其中风心病房颤组240例(男79例,女161例),风心病窦性心律组94例(男10例,女84例)。
1.2 研究指标
1.2.1 实验室检查 术前隔夜禁食12h以上静脉血,测白蛋白、球蛋白、三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白、尿素、血清尿酸、肌酐、C反应蛋白、抗链球菌溶血素O、类风湿因子、纤维蛋白原及白细胞计数。
1.2.2 心律失常检查 所有患者经Holter监测并自动分析记录或十二导联心电图检查记录房颤的发生情况。1.2.3 心脏彩超 患者取左侧卧位平静呼吸,按常规从胸骨左缘切面及心尖四腔切面测量左心室收缩末期左心房内径(LAD)、左心室射血分数(LVEF)、左心室舒张末期内径(LVEDD)、心室间隔舒张末期厚度(IVS)、左心室后壁舒张末期厚度(LVPW)。
1.2.4 用药情况 结合病历资料及住院医师详细询问用药史,记录利尿剂、地高辛、β受体阻滞剂、他汀类药物使用情况。

2 结 果
2.1 一般情况比较 2组患者的年龄、球蛋白、三酰甘油、低密度脂蛋白胆固醇、C反应蛋白、抗链球菌溶血素O、类风湿因子、白细胞计数及纤维蛋白原差异均无统计学意义(P>0.05);风心病房颤组的尿酸、肌酐、尿素均明显高于风心病窦性心律组(P<0.05),白蛋白、高密度脂蛋白胆固醇、总胆固醇、性别比例均明显低于风心病窦性心律组(P<0.05)。见表1。
2.2 超声心动图各项指标比较 风心病房颤组的左房内径(LAD)明显高于风心病窦性心律组(P=0.001),左心室射血分数(LVEF)明显低于风心病窦性心律组(P=0.030)。见表2。
2.3 用药情况比较 2组患者在利尿剂、地高辛、β受体阻滞剂及他汀类药物使用情况上差异均无统计学意义(P>0.05)。见表3。
2.4 风心病患者房颤影响因素的逐步logistic回归分析 以研究对象有无房颤为因变量,以尿酸、肌酐、尿素、白蛋白、高密度脂蛋白胆固醇、总胆固醇、女性比例、LAD、LVEF为自变量做logistic回归分析后显示,患者的尿酸、肌酐、LAD、LVEF与风心病患者房颤的发生显著相关。见表4。
表1 334例风湿性心脏病患者的一般情况比较

项目风心病房颤组(n=240)风心病窦性心律组(n=94)χ2/t值P值年龄(岁)48 46±7 5348 31±8 40-0 1510 880女性[n(%)]161(65 70)84(89 40)17 151<0 001白蛋白(g/L)41 04±4 1042 91±4 953 2610 001球蛋白(g/L)28 05±4 5028 53±4 660 8550 394总胆固醇(mmol/L)4 10±1 084 42±1 032 5710 011三酰甘油(mmol/L)1 30±0 621 43±0 741 5830 116高密度脂蛋白(mmol/L)1 09±0 341 35±0 375 813<0 001低密度脂蛋白(mmol/L)2 64±0 932 71±0 770 7180 473尿素(μmol/L)6 10±1 975 46±1 56-3 0940 020尿酸(μmol/L)428 44±116 12325 93±75 64-9 474<0 001肌酐(μmol/L)70 04±14 1159 54±9 87-7 684<0 001C反应蛋白(mg/L)5 21±9 903 19±4 91-2 4740 140抗链球菌溶血素O(IU/ml)79 19±87 8473 55±63 87-0 6490 517类风湿因子(IU/ml)10 96±20 269 15±11 60-1 0170 310白细胞计数(×109/L)6 76±1 886 20±1 65-2 6960 080纤维蛋白原(mmol/L)3 08±1 002 95±0 78-1 2390 217
表2 334例风湿性心脏病患者的超声心动图各项指标比较

心脏彩超数据风心病房颤组(n=240)风心病窦性心律组(n=94)t值P值LAD(mm)55 20±7 7351 60±9 52-3 2740 001LVPW(mm)8 72±1 118 89±1 111 2780 203IVST(mm)9 09±1 299 31±1 481 2680 207LVEDD(mm)50 21±6 4149 96±7 27-0 2930 770LVEF(%)55 66±6 3958 15±6 973 0040 030
表3 334例风湿性心脏病患者的用药情况比较[n(%)]

用药情况风心病房颤组(n=240)风心病窦性心律组(n=94)χ2值P值利尿剂106(44 2)34(36 2)1 7740 218地高辛29(12 1)8(8 5)0 8750 440β受体阻滞剂90(37 5)34(36 2)0 0510 900他汀类74(30 8)21(22 3)2 3940 139
表4 风心病患者房颤影响因素的逐步logistic回归分析

因素偏回归系数标准误OR值(95%CI)χ2值P值尿酸0 0080 0201 008(1 004~1 012)16 406<0 001肌酐0 0380 0151 038(1 008~1 070)6 2680 012LAD0 0390 0171 040(1 006~1 075)5 4740 019LVEF-0 0490 0240 952(0 909~0 998)4 2390 040
2.5 风心病患者尿酸与尿素的相关性分析 风心病房颤患者,随着尿酸水平升高,尿素有升高趋势,经检验,Spearman相关系数为0.186,双侧检验概率P=0.073,尿酸与尿素的相关性较差,见图1。风心病窦性心律患者,随着尿酸水平升高,尿素有升高趋势,经检验,Spearman相关系数为0.438,双侧检验概率P<0.001,尿酸与尿素中度相关,见图2。

图1 风心病房颤组的尿酸与尿素的散点分布图

图2 风心病窦性心律组的尿酸与尿素的散点分布图
2.6 风心病患者尿酸与肌酐的相关性分析 风心病房颤患者,随着尿酸水平升高,肌酐有升高趋势,经检验,Spearman相关系数为0.418,双侧检验概率P<0.001,尿酸与肌酐中度相关,见图3。风心病窦性心律患者,随着尿酸水平升高,肌酐有升高趋势,经检验,Spearman相关系数为0.445,双侧检验概率P<0.001,尿酸与肌酐中度相关,见图4。
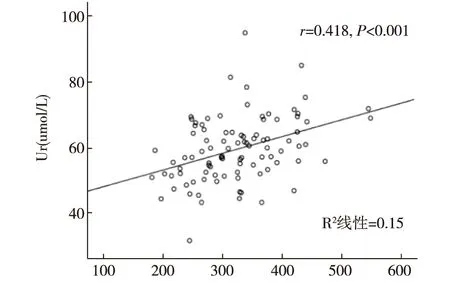
图3 风心病房颤组的尿酸与肌酐的散点分布图

图4 风心病窦性心律组的尿酸与肌酐的散点分布图
3 讨 论
尿酸水平和体内炎症反应和氧化应激标志物呈正相关,且血尿酸水平可反应心房组织水平黄嘌呤氧化酶 (xanthine oxidase,XO)激活和活性氧簇水平升高,而炎症和氧化应激是房颤发生、发展的重要机制,因此炎症和氧化应激可能是两者联系的核心环节。在心房颤动患者体内可检测到高浓度的XO[9],它的激活可导致体内活性氧簇产生增加,参与心房重构和心房颤动的发生、发展。在快速心房起搏猪的模型中,心房快速起搏可导致左心耳NADPH氧化酶及XO活性增高,以XO抑制剂(别嘌呤醇)处理后,过氧化物产生显著减少[13]。
目前研究认为,血清尿酸是高血压、心力衰竭、冠心病及心房颤动发生或者死亡的独立高危因素。Bombelli等[8]对2045例受试者随访16年,研究表明血清尿酸能独立的预测高血压的发生、长期的心血管病死亡率及全因死亡率。与单纯性心力衰竭患者比较,心力衰竭合并房颤患者血清尿酸水平明显升高,且与房颤的发生独立相关[9]。Ndrepepa等[10]对8149例经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的稳定型冠状动脉粥样硬化性心脏病(coronary atherosclerosis heart disease,CAD)患者1年的随访研究,提出血尿酸升高是PCI术后稳定型CAD 1年死亡率的独立预测因子。
我国学者认为,风心病是房颤发生、发展的独立危险因素[14]。血清尿酸在风心病患者房颤中的研究较少,国内学者认为血清尿酸可能引起心房扩张、心房重构,进而促进风心病房颤的发生和发展。目前对血清尿酸和房颤的研究多以非瓣膜性房颤为研究对象,可能因为瓣膜性疾病本身可致氧化应激,导致心房结构重构和电重构,对房颤的发生、发展及尿酸水平存在影响,故本研究以风心病为研究对象,排除瓣膜性疾病本身对心房肌的影响,探讨尿酸在风心病患者中的意义。
本研究结果显示,在风心病患者中房颤的发生与尿酸升高、肌酐升高、LAD扩大、LVEF降低显著相关,其中尿酸与房颤相关性最显著。
尿酸是嘌呤在人体内最终的代谢产物,嘌呤水解脱氨生成次黄嘌呤或黄嘌呤,次黄嘌呤进一步氧化生成黄嘌呤,黄嘌呤再氧化生成尿酸,后两步不可逆的氧化过程都是由XO催化,可见 XO是机体尿酸生成的关键酶。机体在缺血、血氧或损失的情况下,XO活性增高,尿酸合成量增加。XO利用氧分子生成超氧化物自由基,氧自由基的增多可损害线粒体、溶酶体的功能,进而加剧氧化应激和炎症反应[15]。氧化应激和炎症均参与了房颤的发生和维持[4-6],尿酸水平敏感的反应了心房的氧化应激水平。2011年美国一项大规模前瞻性队列研究ARIC研究[12]入选了年龄45~64岁无AF病史的社区人群15382名,随访18年,发现血尿酸水平升高(>7 mg/dL)人群房颤发生风险显著高于血尿酸水平正常者(<5 mg/dL)(HR=1.74,P<0.001),基线血尿酸水平是房颤发生的独立危险因素,且这种相关关系在黑人和女性人群中更加明显。Nyrnes等[11]对6308例进行了11年的随访研究发现,基线水平的尿酸与房颤的发生独立相关,本研究结果显示尿酸升高和风心病患者房颤的发生显著相关,与该报道结果类似。
房颤时心房有效收缩作用消失,心房收缩期对左心室充盈的贡献显著减少或者消失,致左心室充盈量下降,心排血量减少,LVEF下降。本研究结果也得出LVEF降低与风心病患者房颤的发生显著相关。
房颤本身可引起心脏结构和功能的改变,导致心肌细胞肥大、糖原积累、排列方向紊乱、肌纤维溶解、肌浆网碎裂、线粒体增大等一系列病理改变,最终导致心房增大。2002年Koide等[16]报道了LAD≥40 mm,预测阵发性房颤转为持续性房颤的敏感性为60%,特异性为76%。2004年Parkash等[17]发现LAD和慢性房颤进展有关。2005年Wozakowska-Kapon[18]的研究发现,LAD的扩大和房颤相关,即是房颤的原因,也是房颤的结果。本研究结果显示LAD扩大和风心病患者房颤的发生显著相关和上述研究结果类似。
鉴于本研究仅为回顾性研究及样本量的限制,尚需大样本、多临床中心的临床研究进一步深入研究风心病、房颤及尿酸之间的因果关系。综上所述,本研究提示,在风心病人群中,尿酸水平升高是房颤发生的高危险因素,但不一定会导致明显的心脏结构改变,也许在早期仅表现为心房肌的重塑。但这些结果可以帮助临床医师更谨慎的对待风心病合并尿酸升高的患者,重视早期控制尿酸水平,可能对预防心房重塑及房颤的发生和发展有一定的临床指导作用。
[1] Iguchi Y,Kimura K,Aoki J,etal.Prevalence of atrial fibrillation in community-dwelling Japanese aged 40 years or older in Japan: analysis of 41,436 non-employee residents in Kurashiki-city [J]. Circ J,2008,72(6):909-913.
[2] Numa S,Hirai T,Nakagawa K,etal.Hyperuricemia and transesophageal echocardiographic thromboembolic risk in patients with atrial fibrillation at clinically low-intermediate risk [J]. Circ J,2014,78(7):1600-1605.
[3] Ferrari R,Bertini M,Blomstrom-Lundqvist C,etal.An update on atrial fibrillation in 2014: From pathophysiology to treatment [J]. Int J Cardiol,2016,203(1):22-29.
[4] 易 茜,蹇 朝,李 勇,等.氧化应激标志物在房颤患者心房结构重构中的变化及意义 [J]. 第三军医大学学报,2015,37(1):55-59.
[5] Hu YF,Chen YJ,Lin YJ,etal.Inflammation and the pathogenesis of atrial fibrillation [J]. Nat Rev Cardiol,2015,12(4):230-243.
[6] Harada M,Van Wagoner DR,Nattel S.Role of inflammation in atrial fibrillation pathophysiology and management [J]. Circ J,2015,79(3):495-502.
[7] Feig DI,Kang DH,Johnson RJ. Uric acid and cardiovascular risk [J]. N Engl J Med,2008,359(17):1811-1821.
[8] Bombelli M, Ronchi I, Volpe M,etal. Prognostic value of serum uric acid: new-onset in and out-of-office hypertension and long-term mortality [J]. J Hypertens, 2014,32(6):1237-1244.
[9] Tekin G,Tekin YK,Erbay AR,etal.Serum uric acid levels are associated with atrial fibrillation in patients with ischemic heart failure [J]. Angiology,2013,64(4):300-303.
[10] Ndrepepa G, Braun S, King L,etal. Association of uric acid with mortality in patients with stable coronary artery disease [J]. Metabolism, 2012,61(12):1780-1786.
[11] Nyrnes A,Toft I,Mathiesen EB,etal.Uric acid is associated with future atrial fibrillation: an 11-year follow-up of 6308 men and women--the Tromso Study [J]. Europace,2014,16(3):320-326.
[12] Tamariz L, Agarwal S, Soliman EZ,etal. Association of serum uric acid with incident atrial fibrillation (from the Atherosclerosis Risk in Communities [ARIC] study) [J]. Am J Cardiol, 2011,108(9):1272-1276.
[13] Dudley SC,Hoch NE,McCann LA,etal.Atrial fibrillation increases production of superoxide by the left atrium and left atrial appendage: role of the NADPH and xanthine oxidases [J]. Circ J,2005,112(9):1266-1273.
[14] Liu Y,Liu H,Dong L,etal.Prevalence of atrial fibrillation in hospitalized patients over 40 years old: ten-year data from the People’s Hospital of Peking University [J]. Acta Cardiol,2010,65(2):221-224.
[15] Letsas KP, Korantzopoulos P, Filippatos GS,etal.Uric acid elevation in atrial fibrillation [J]. Hellenic J Cardiol,2010,51(3):209-213.
[16] Koide Y,Yotsukura M,Sakata K,etal.Investigation of the predictors of transition to persistent atrial fibrillation in patients with paroxysmal atrial fibrillation [J]. Clin Cardiol,2002,25(2):69-75.
[17] Parkash R,Green MS,Kerr CR,etal.The association of left atrial size and occurrence of atrial fibrillation: a prospective cohort study from the Canadian Registry of Atrial Fibrillation [J]. Am Heart J,2004,148(4):649-654.
[18] Wozakowska-Kapon B.Changes in left atrial size in patients with persistent atrial fibrillation: a prospective echocardiographic study with a 5-year follow-up period [J]. Int J Cardiol,2005,101(1):47-52.
(本文编辑:叶华珍)
四川省科技厅项目(Z14018)
646000泸州,西南医科大学附属医院胸心外科
廖 斌,E-mail:LiaoBindr@tom.com
燕朝均,于凤旭,廖 斌.血清尿酸与风湿性心脏病患者心房颤动的关系[J].东南国防医药,2017,19(3): 293-297.
R605;R453;
B
1672-271X(2017)03-0293-05
10.3969/j.issn.1672-271X.2017.03.018
2017-02-15;
2017-03-23)

