阿戈美拉汀联合坦度螺酮对老年抑郁症患者血清NE、5-HT水平的影响
宁征远,谢姗姗,李 健, 戴 茜,陈 硕
·论 著·
阿戈美拉汀联合坦度螺酮对老年抑郁症患者血清NE、5-HT水平的影响
宁征远1,谢姗姗1,李 健1, 戴 茜1,陈 硕2
目的 观察阿戈美拉汀联合坦度螺酮对老年抑郁症患者血清去甲肾上腺素(NE)、五羟色胺(5-HT)的影响,探讨其对抑郁症的临床疗效。 方法 100例抑郁症患者按照随机数字表法分为观察组50例、对照组50例,对照组给予坦度螺酮口服,观察组在对照组基础上加服阿戈美拉汀。治疗前、治疗8周后分别进行汉密尔顿抑郁量表(HAMD)评分,检测血清NE、5-HT表达水平。 结果 治疗前2组患者HAMD评分及血清NE、5-HT水平比较,差异无统计学意义(P>0.05)。治疗8周后,观察组比对照组HAMD评分明显降低(P<0.05),血清NE、5-HT水平均明显升高(P<0.05)。 结论 阿戈美拉汀联合坦度螺酮可明显升高老年抑郁症患者血清NE、5-HT水平,降低HAMD评分,显著改善抑郁症状。
阿戈美拉汀;坦度螺酮;抑郁症;去甲肾上腺素;五羟色胺
抑郁症是精神科常见疾病,临床上常表现为情绪低落、注意力不集中、睡眠障碍、乏力、厌食等症状,具有发病率高、治疗时间长、疗效差等特点[1]。研究发现去甲肾上腺素(NE)、5-羟色胺(5-HT)水平与抑郁症发病密切相关[2]。本研究采用阿戈美拉汀联合坦度螺酮治疗老年抑郁症,观察其血清NE、5-HT变化,探讨其对老年抑郁症的临床疗效。
1 资料与方法
1.1 研究对象 选择2016年1-6月河北省第六人民医院门诊及住院的100例老年抑郁症患者,所有患者均无家族遗传史。按随机数字表法将患者分为2组,观察组50例,对照组50例,均符合《中国精神障碍分类与诊断标准(修订本)》第3版[3]抑郁症的诊断标准;汉密尔顿抑郁量表(HAMD)评分≥8分;排除自身免疫性疾病、有自杀行为及其他过激行为患者。本研究已经过本院伦理委员会批准(批准号:20151124),患者知情同意并签署知情同意书。2组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
表1 各组老年抑郁症患者基线资料比较

组别n性别(男/女)年龄(岁)身高(cm)体质量(kg)病程(年)合并症(n)高血压糖尿病高脂血症脑血管病对照组5029/2165 28±11 69165 35±5 7870 17±8 518 21±3 488212817观察组5031/1965 30±11 84165 18±5 2471 28±8 688 19±3 519192921
1.2 治疗方法 2组患者治疗前均停服抗抑郁药物至少2周,降压药、降糖药、降脂药物不停服。对照组患者给予坦度螺酮口服(商品名律康,四川科瑞德制药有限公司,批号1308116)10 mg,3次/d,观察组在对照组基础上加服阿戈美拉汀(商品名维度新,法国施维雅药厂,批号C14200170758)25 mg,每晚1次。2组均持续治疗8周后统计疗效。
1.3 临床观察指标 2组患者分别于治疗前、治疗8周后空腹抽血10 mL,静置30 min后以2000 r/min离心30 min,取上清保存于-20 ℃冰箱备用。NE、5-HT测定采用ELISA法(试剂盒均购自广东虹业抗体科技有限公司),按试剂盒说明书步骤进行操作。
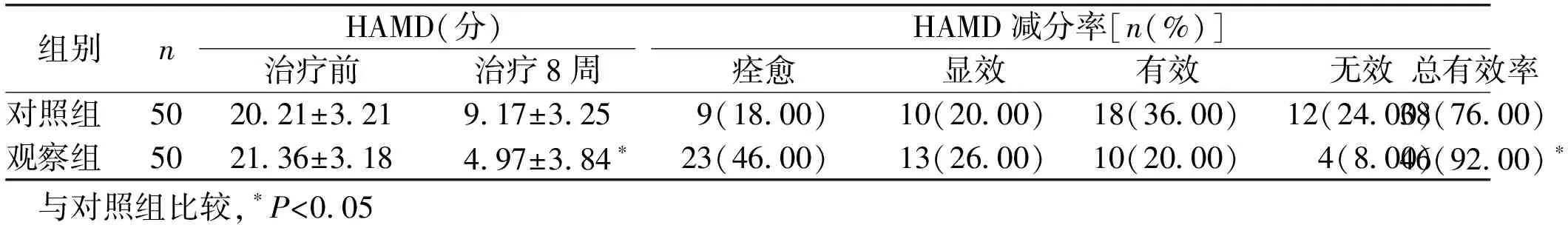
1.4 疗效判定标准[4]观察治疗前后2组患者HAMD减分率变化,评定临床疗效。HAMD减分率=(治疗前HAMD评分-治疗后HAMD评分)/治疗前HAMD评分×100%。痊愈:减分率>75%;显效:减分率为75%~50%;有效:减分率25%~49%;无效:减分率<25%。



组别nNE(pg/mL)5⁃HT(ng/mL)治疗前治疗8周治疗前治疗8周对照组5095 23±35 16115 25±54 3142 36±8 23125 13±24 31观察组5096 33±36 29138 81±53 64∗41 94±9 11154 27±24 65∗与对照组比较,∗P<0 05

组别nHAMD(分)HAMD减分率[n(%)]治疗前治疗8周痊愈显效有效无效总有效率对照组5020 21±3 219 17±3 259(18 00)10(20 00)18(36 00)12(24 00)38(76 00)观察组5021 36±3 184 97±3 84∗23(46 00)13(26 00)10(20 00)4(8 00)46(92 00)∗与对照组比较,∗P<0 05
2 结 果
2.1 血清NE、5-HT水平比较 治疗前2组血清NE、5-HT水平比较,差异无统计学意义(P>0.05)。治疗8周后,观察组血清NE、5-HT水平比对照组明显升高(P<0.05)。见表2。
2.2 疗效比较 治疗前2组患者HAMD评分比较差异无统计学意义(P>0.05)。治疗8周后观察组HAMD评分比对照组明显下降(P<0.05)。2组HAMD减分率比较,观察组总有效率优于对照组(P<0.05),见表3。
3 讨 论
抑郁症常常以情绪低落、愉快感丧失、精力不集中、疲倦等为临床表现,严重影响患者的日常生活,发病率呈逐年上升趋势。据世界卫生组织统计,全球大约有3.4亿抑郁症患者,预计2020年有可能成为继心血管疾病后的第二大疾病[5]。目前我国保守统计约有3000多万人罹患抑郁症,由于对疾病本身的认识不足,超过一半人得不到及时、有效治疗,每年约15%的抑郁症患者死于自杀[6]。大脑中5-HT和NE之间的不平衡会导致抑郁症的发生,出现情绪低落、动力下降以及食欲和性欲改变等,国内外大量研究表明,抑郁症患者脑内5-HT、NE水平低于正常人,故增加5-HT、NE等中枢单胺类神经递质的水平可以有效治疗抑郁症[7]。
阿戈美拉汀是褪黑素受体激动剂,夜间褪黑素分泌最旺盛,并且褪黑素受体最为敏感,抑郁症患者多数存在入睡困难、早醒或睡眠节律的改变,动物试验已证实阿戈美拉汀具有与褪黑素类似的调节睡眠的作用[8]。目前临床上一些选择性5-HT再摄取抑制剂米氮平、米安舍林等虽然有促进睡眠、改善睡眠的治疗作用,但有白天困倦、宿睡的不良反应,从而使临床应用受到一定限制[9]。阿戈美拉汀具有独特的药理机制即调节睡眠觉醒周期,调节睡眠节律及生物钟,增加睡眠时间,减少觉醒次数,因而阿戈美拉汀在临睡前服用效果最佳,尤其适用于老年人[10]。同时又是5-羟色胺受体拮抗剂,提高脑内多巴胺及去甲肾上腺素的水平及神经传递,改善抑郁状态,对性功能的各项心理与躯体症状评定均优于其他5-羟色胺受体拮抗剂[11]。坦度螺酮是一种选择性作用于5-HT1A受体的抗焦虑药,下调突触前膜自身受体密度,但不影响突触间隙浓度,保持5-HT与其受体平衡达到持久稳定的抗抑郁作用[12],还能抑制下丘脑刺激及电休克应激负荷,引起血浆肾素活性升高,抑制食欲增加及防止胃溃疡的发生[13]。
本研究结果显示:观察组比对照组血清5-HT、NE水平显著升高,汉密尔顿抑郁量表评分降低、减分率升高,提示阿戈美拉汀联合坦度螺酮能明显改善老年抑郁症患者临床症状,临床疗效优于单用坦度螺酮。相关动物研究发现,阿戈美拉汀抗抑郁的机制可能与增加海马部位神经元的可塑性及神经元增生有关,应用阿戈美拉汀治疗抑郁症大鼠,3周后发现大鼠海马腹侧齿状回细胞增生及神经元再生,继续药物干预治疗,大鼠海马腹侧整个齿状回区域均出现细胞增生及神经元再生,表明阿戈美拉汀可不同程度地增加海马的神经再生,从而产生新的颗粒细胞[14]。多项临床研究也证实阿戈美拉汀具有明显的抗抑郁作用,且起效较快,对抑郁以及伴随的焦虑症状均有较好的疗效[15]。本研究发现阿戈美拉汀联合坦度螺酮应用能迅速发挥抗抑郁作用,同时还能改善睡眠,减少觉醒次数,有较好的安全性和耐受性,对老年抑郁症患者尤其适合。治疗过程中2组患者不良反应均较轻微,未做特殊处理,随着治疗时间的延长不良反应逐渐减少甚至消失,未出现病例脱落情况。
综上所述,阿戈美拉汀联合坦度螺酮可明显改善抑郁症患者的临床症状,且治愈率较单纯应用坦度螺酮提高,安全可靠,值得临床推广。
[1] 王 眷,黄树明.抑郁症发病机制研究进展[J]. 医学研究生学报,2014,27(12):1332-1336.
[2] 李 辉,张会凯,刘丽娟.柴附解郁方联合米氮平对肝郁气结型抑郁症患者血清NE、5-HT水平的影响[J]. 河南中医,2016,36(11):1984-1985.
[3] 中华医学会精神科分会.中国精神障碍分类与诊断标准[M].3版.济南:山东科学技术出版社,2001:32-39.
[4] 赵 峥,潘 苗,张三强,等.文拉法辛联合米氮平治疗难治性老年抑郁症的疗效及安全性[J]. 中国老年学杂志,2013,33(10):2249-2251.
[5] 张明园.精神科评定量表手册[M].长沙:湖南科学技术出版社,1993:27-28.
[6] 朱羞阳,佟 洋,李驰荣.选择性5-羟色胺再摄取抑制剂与奥氮平联合治疗难治性抑郁症的临床疗效[J]. 东南国防医药,2013,15(2):125-127.
[7] Nelson JC,Hollander SB,Betzel J,etal. Mirtazapine orally disintegrating tablets in depressed nursing home residents 85 years of age and older[J]. Int J Geriatr Psychiatry,2006,21(9):898- 901.
[8] 田 丽.阿戈美拉汀的临床应用研究进展[J]. 神经疾病与精神卫生,2014,14(2):202-204.
[9] 戴雯姬,司天梅.阿戈美拉汀的药理机制及临床疗效[J]. 中国心理卫生杂志,2012,26(3):193-198.
[10] 么宪伟,李滟岚.坦度螺酮联合阿戈美拉汀治疗老年性卒中后抑郁的临床研究[J]. 分子影像学,2014,37(2):71-73.
[11] 夏传红.阿戈美拉汀与帕罗西汀治疗首发抑郁症对照研究[J]. 山东医学高等专科学校学报,2017,39(1):40-42.
[12] 张 伟.枸橼酸坦度螺酮治疗伴焦虑症状的抑郁障碍临床观察[J]. 齐齐哈尔医学院学报,2015,36(13):1895-1896.
[13] 吴 杰,费锦锋.坦度螺酮治疗伴有焦虑症状抑郁症患者的疗效分析[J]. 牡丹江医学院学报,2015,36(4):37-38.
[14] 郭 敏,朱利平,白文霞,等.阿戈美拉汀对SD大鼠的长期毒性评价研究[J]. 毒理学杂志,2013,27(1):68-71.
[15] 侯连凤.阿戈美拉汀治疗抑郁症患者的临床疗效与安全问题[J]. 中国民康医学,2016,28(13):29-30.
(本文编辑:叶华珍; 英文编辑:王建东)
The effect of agomelatine combined with tandospirone on the expression of NE,5-HT in the elder patients with depression
NING Zheng-yuan1,XIE Shan-shan1,LI Jian1, DAI Qian1,CHEN Shuo2
(1.FirstDepartmentofPsychology,theSixthPeople’sHospitalofHebei,Baoding071000,Hebei,China;2.FemaleAnorectal,thePeople’sHospitalofTianjin,Tianjin300162,China)
Objective To observe the effect of agomelatine combined with tandospirone on the expression of NE, 5-HT in the elder patients with depression, and explore the therapeutic efficiency. Methods 100 patients with depression were randomly divided into control group (50 cases) and study group (50 cases). The control group were given tandospirone, oral. The study group were given Agomelatine and Tandospirone, oral. Before and after treatment for 8 weeks, the Hamilton depression scale ( HAMD) score were used to establish the therapeutic efficiency separately, and the serum NE, 5-HT were detected in the elder patients with depression. Results Before treatment, there was no statistical significance in HAMD score, serum depression NE and 5-HT (P>0.05). After treatment for 8 weeks, compare with the control group, HAMD score were decreased(P<0.05), and serum NE, 5-HT were increased(P<0.05). Conclusion Agomelatine combined with tandospirone can significantly decreased HAMD score, and increased serum NE, 5-HT level, obviously improve the depression symptoms in the elder patients with depression.
Agomelatine; Tandospirone; Postpartum depression; NE; 5-HT
1.071000保定,河北省第六人民医院普通精神一科;2.300162天津,天津人民医院女子肛肠科
宁征远,谢姗姗,李 健,等.阿戈美拉汀联合坦度螺酮对老年抑郁症患者血清NE、5-HT水平的影响[J].东南国防医药,2017,19(3): 251-253.
R749.053
A
1672-271X(2017)03-0251-03
10.3969/j.issn.1672-271X.2017.03.007
2017-02-01;
2017-04-18)

