锑对土壤跳虫(Folsomiacandida)的毒性效应
林祥龙, 孙在金, 陈卫玉, 姚 娜, 赵 龙, 赵淑婷, 侯 红*
1.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 2.大同市环境监测站, 山西 大同 037002 3.江西省环境保护科学研究院, 江西 南昌 330039 4.云南农业大学, 云南 昆明 650000
锑对土壤跳虫(Folsomiacandida)的毒性效应
林祥龙1, 孙在金1, 陈卫玉2, 姚 娜3, 赵 龙1, 赵淑婷4, 侯 红1*
1.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 2.大同市环境监测站, 山西 大同 037002 3.江西省环境保护科学研究院, 江西 南昌 330039 4.云南农业大学, 云南 昆明 650000
为了解Sb(锑)对土壤无脊椎动物的毒性效应及对比不同类型土壤中Sb毒性的差异,选取死亡率、逃避率、繁殖数三组个体水平的评价指标研究了3种典型土壤(海伦黑土、祁阳红壤、北京潮土)中外源添加Sb对模式生物——跳虫(Folsomiacandida)的急性毒性和慢性毒性效应. 结果表明,基于实测w(Sb总)求得的上述3种土壤中Sb影响跳虫逃避的2 d-EC50(EC50为半数效应浓度)分别为298、>431〔高于土壤中最高w(Sb总)〕和132 mg/kg;影响跳虫死亡的7 d-LC50(LC50为半数致死浓度)分别为 3 352、4 007、2 105 mg/kg;影响跳虫死亡的28 d-LC50分别为 2 271、1 865、703 mg/kg,影响跳虫繁殖的28 d-EC50分别为 1 799、1 323、307 mg/kg. 由上述毒性阈值大小可知,跳虫逃避率的敏感性高于死亡率和繁殖数的敏感性,不同土壤中Sb对跳虫的毒性大小具有显著差异,北京潮土中Sb对跳虫的毒性与海伦黑土、祁阳红壤相比最大差别接近6倍,表明不同土壤理化性质对Sb生态毒性效应具有显著影响. 但基于w(Sb水提)求得的上述3种土壤中Sb的毒性阈值差异减小,说明水提态Sb与其毒性具有显著相关性,可以较好地解释不同土壤间Sb毒性的差异. 该研究结果可为建立我国土壤中Sb的毒性预测模型及制订Sb的质量标准值提供依据.
Sb; 水提态锑; 土壤类型; 白符跳; 急性毒性; 慢性毒性; 毒性差异
Abstract: Despite growing concern about the potential adverse effects of elevated antimony concentrations in soil, hardly any toxicity data are available for terrestrial invertebrates. To explore the toxicity of antimony to soil invertebrates and compare toxicity differences among different types of soil, the acute and chronic toxicity of antimony toFolsomiacandidawere assessed in three typical soils (i.e., Hailun isohumosol, Qiyang ferrosol and Beijing primosol) using mortality, avoidance and reproduction as evaluation endpoints. The 2-day EC50(i.e., concentration causing 50% toxic effect) values expressed in measured total antimony concentrations for the avoidance ofF.candidawere 298, >400 (i.e., avoidance rate did not reach 50% at the highest concentration) and 132 mg/kg, respectively. The 7-day LC50(i.e., median lethal concentration) values for the mortality ofF.candidawere 3352, 4007 and 2105 mg/kg, respectively. The 28-day LC50values for the mortality ofF.candidawere 2271, 1865 and 703 mg/kg, respectively. The 28-day EC50values for the reproduction ofF.candidawere 1799, 1323 and 307 mg/kg, respectively. The results showed that avoidance was a more sensitive endpoint than reproduction and mortality, and the toxic effect of antimony onF.candidasignificantly varied with soil types. The toxicity of antimony in Beijing primosol was maximally nearly six times higher than that of in Hailun isohumosol and Qiyang ferrosol, indicating the distinct impact of soil physicochemical properties on the toxic effect of antimony. But the differences of LC50or EC50values expressed in water-extracted antimony concentrations among the three soils decreased, indicating that the water-extracted antimony consisted with the toxicity of antimony obviously and could explain the toxicity variations among the three soils. The study can provide the basis for establishing a prediction model of antimony toxicity as well as formulating the quality standard value of antimony in soil.
Keywords: antimony; water-extracted antimony; soil types;F.candida; acute toxicity; chronic toxicity; toxicity differences
Sb(锑)是与砷同一主族的类金属元素,世界上Sb的产量要远高于砷,阻燃剂、刹车片、子弹壳等含Sb产品在生产生活中得到广泛应用[1]. 土壤中w(Sb)通常低于1 mg/kg,世界卫生组织(WHO)[2]建议的土壤最高w(Sb)不超过35 mg/kg,但由人类活动(燃烧化石燃料、冶炼金属和焚烧废物和污泥等)所造成的土壤Sb污染已越来越严重. 研究[3]显示,射击场附近的表层土壤中Sb的浓度和可移动性都要高于Pb. 作为世界上Sb产量最大的国家,我国一些Sb矿开采和冶炼区域的土壤中w(Sb)最高达11.8 g/kg[4]. Sb的环境化学行为虽不同于镉、铜、铅、锌等重金属,但作为生物非必需元素对生物也有着毒害作用[5],欧盟(EU)和美国国家环境保护局(US EPA)将Sb及Sb的化合物列为优先控制的污染物[6].
土壤环境质量标准是土壤污染风险评价和环境管理的基础[7],由于缺乏基于生态效应的毒性阈值,我国目前制定的《农用地土壤环境质量标准(征求意见稿)》中土壤Sb的标准倍受争议. 随着对Sb污染的广泛关注,国内外有关Sb对土壤生态受体毒性效应的研究逐渐增多,然而主要集中在Sb对微生物和植物[8-9]的毒害效应方面. 关于Sb对土壤无脊椎动物毒性效应的研究,只有Kuperman等[10-11]评价了Sb对蚯蚓(Eiseniafetida、Enchytraeuscrypticus)、跳虫(Folsomiacandida)的毒性,梁淑轩等[12]研究了Sb对蚯蚓体内金属硫蛋白的影响. 并且现有研究只选用了单一种类的自然土壤或人工土壤,事实上由于不同类型土壤的理化性质(有机质、pH、CEC、质地、铁锰铝含量等)各异,重金属的生态毒性有着显著不同. Peggy等[13]研究发现,22种不同土壤中铜对跳虫繁殖的EC50变化范围为45.4~2 270 mg/kg;Pauline等[14]研究表明,有机质含量高的土壤中锌对跳虫的毒性显著降低. 此外,受试生物本身在不同土壤中生活习性和生存状况也有差别. 因此在进行土壤中重金属生态毒性效应研究和确定其毒性阈值时,需考虑土壤理化性质的影响[15-16].
跳虫作为土壤无脊椎动物群落中的优势物种,是土壤环境的重要指示生物,其中白符跳(Folsomiacandida)由于其具有生长周期短、繁殖快、操作简便、评价指标多等优势,被ISO(国际标准化组织)规定为土壤生态风险评估的模式生物[17-18]. 与其他无脊椎动物相比,跳虫对污染物相对更敏感,如抑菌灵对赤子爱胜蚓的LC50>1 000 mg/kg, 而对白符跳的LC50仅为0.072 mg/kg[18];铅影响赤子爱胜蚓繁殖的EC10为 1 100 mg/kg,而对白符跳的EC10为520 mg/kg[19]. 跳虫已被广泛应用于重金属的生态毒性研究,如Menta等[20]研究发现,土壤中w(Cd)为50 mg/kg时就能使跳虫成虫存活率和幼虫繁殖数发生显著性变化;Son等[21]研究结果表明,跳虫对重金属镉、汞和铅的EC50分别为60、0.23和428 mg/kg.
该研究以跳虫为受试生物,参照ISO标准方法指南[22-23],从个体水平以死亡率、繁殖数、逃避率为评价指标,选用我国3种理化性质差异明显的土壤(海伦黑土、祁阳红壤、北京潮土),研究土壤外源添加Sb对跳虫的生态毒性,并比较Sb在不同土壤类型间的毒性差异,以期为土壤Sb质量标准的制订提供参考.
1 材料与方法
1.1 供试土壤
试验所用的3种未被Sb污染的土壤分别采自黑龙江海伦、湖南祁阳、北京朝阳的表层土(0~20 cm)(依次简称海伦黑土、祁阳红壤和北京潮土). 供试土壤使用前在室内自然条件下风干,剔除植物根系及石块后,过2 mm筛,测定土壤理化性质(见表1). 具体测定方法:pH采用电极法测定;w(有机质)采用重铬酸钾氧化法[24]测定;CEC(阳离子交换量)采用非缓冲硫脲银法[25]测定;土壤质地采用激光粒度仪测定;土壤经湿式消解法(HF-HClO4-HNO3)前处理后,采用ICP-OES(RIS Advantage)测定w(总铁)、w(总锰)、w(总铝);土壤经草酸铵和草酸缓冲溶液提取后,采用ICP-MS(Agilent 7500)测定w(非晶质氧化铁)、w(非晶质氧化锰)、w(非晶质氧化铝)[26].
1.2 供试跳虫
供试跳虫由中国科学院南京土壤所提供,参照ISO 11267[23],饲养在培养皿(90 mm×13 mm)中,培养皿底部铺有约0.5 cm厚的培养基(活性炭与熟石膏质量比为1∶9,加去离子水搅拌均匀,待其凝固成形后放置3 d后使用). 采用干酵母作为跳虫的食物,使用人工气候箱控制饲养条件,温度为(20±1)℃,光照与黑暗比为16 h∶8 h(光照强度为400~800 lx),空气湿度为75%. 每3 d打开盖子补足空气,必要时为培养基补充适量去离子水,加入适量食物,及时清除培养基表面的发霉的食物残渣和死亡的跳虫尸体,保持培养基表面清洁湿润,每2个月更换一次培养基.

表1 供试土壤基本理化性质
为降低跳虫虫龄和个体大小差异对试验的影响,试验前跳虫需进行同龄化培养. 参照ISO 11267[23],将培养皿中150~200只成虫移入新制培养皿中,加入少量干酵母(约5 mg),在人工气候箱中培养. 等到跳虫在培养基表面产卵并孵化出幼虫后,移走成虫,3 d后将幼虫转移到新培养皿中培养,继续培养7~9 d后可用于正式试验. 同龄化期间培养条件与饲养条件相同.
1.3 土壤外源Sb添加
土壤中外源Sb以酒石酸锑钾(C8H4K2O12Sb2·3H2O,优级纯)水溶液的方式进行添加. 急性逃避试验中土壤w(Sb总)设为0、50、100、200、400 mg/kg;急性存活试验中土壤w(Sb总)设为0、800、1 200、1 600、2 400、4 800 mg/kg;慢性试验中土壤w(Sb总)设为0、100、200、400、800、1 200、1 600、2 400 mg/kg. 充分搅拌均匀后,于温室中对添加Sb的土壤进行一周的老化,老化期间添加去离子水保持50%~55%的最大可持水量.
1.4 土壤中w(Sb水提)及w(Sb总)测定
采取土样,风干过2 mm筛后称取2 g土壤样品置于50 mL塑料离心管中,加入20 mL去离子水,在25 ℃和60 r/min条件下振荡2 h后,于 4 000 r/min条件下离心10 min,上清液用0.45 μm的醋酸纤维滤膜过滤[27],用ICP-MS测定滤液中Sb的含量. 同时称取过0.25 mm筛的0.1 g土样,加入HF-HClO4-HNO3(2∶1∶3)消解后过滤,用ICP-OES测定滤液中Sb的含量[28]. 测定过程中用国家一级标准物质(GBW-07410)作为质控.
1.5 跳虫毒理试验
1.5.1 急性毒性试验
急性逃避试验用的圆柱形玻璃杯用塑料隔板分隔为两部分,分别加入30 g老化后湿润的污染土壤和清洁对照土壤,将隔板取出,在玻璃杯的中心位置加入20只10~12 d大小的跳虫,每浓度设4个重复,盖上玻璃杯盖子,在人工气候箱中培养,培养条件同跳虫饲养条件. 培养48 h后取出玻璃杯,加入隔板,将两部分土壤分别取出,用水浮法(活的跳虫会浮在水面上)对跳虫数量进行计数. 逃避率计算公式[29]:
x=nc/N×100%
式中:x为逃避率,%;nc为对照土壤中跳虫数量,只;N为加入土壤中的跳虫总数,只.
急性存活试验的方法为称取30 g湿土于有机玻璃杯,加入10只10~12 d大小的跳虫,每浓度设4个重复,加盖后放在人工气候箱中培养7 d,培养过程中不添加酵母,其他培养条件同跳虫饲养条件. 培养结束后,用水浮法对存活的跳虫进行计数.
1.5.2 慢性毒性试验
称取30 g湿土于有机玻璃杯,加入10只10~12 d 大小的跳虫,试验组处理设4个重复,对照组为6个重复,加入5 mg干酵母,盖上盖子后放在人工气候箱中培养28 d,培养条件同跳虫饲养条件. 一周开盖通气3次,并补充少量去离子水和干酵母,培养结束后,用水浮法对成虫和繁殖的幼虫数量进行计数.
1.6 数据处理
采用Logistic方程[30]拟合土壤w(Sb)和跳虫毒性效应,根据拟合曲线计算LC50和EC50. 采用SPSS 11.5 进行数据的分析与比较,采用OriginPro 8.5进行绘图.
2 结果与分析
2.1 土壤中实测w(Sb总)和w(Sb水提)
土壤质控样品中测得的w(Sb总)与参考值误差在6%以内,说明测得的w(Sb总)是可信的. 如图1所示,海伦黑土、祁阳红壤和北京潮土中实测w(Sb总) 与理论值有着很好的一致性,回收率分别为90%~115%(平均值为103%)、93%~111%(平均值为106%)和89%~120%(平均值为112%). 该研究中毒性阈值的计算基于土壤实测w(Sb总).
3种土壤中w(Sbg加,w(Sb总)为 4 800 mg/kg时海伦黑土、祁阳红壤和北京潮土中最大w(Sb水提)分别达到183、80、301 mg/kg. 不同土壤中各浓度Sb的水提态比例差异明显:海伦黑土中w(Sb水提)为2.3%~3.6%(平均值为2.7%);祁阳红壤中w(Sb水提)为0.3%~1.6%(平均值为0.6%);北京潮土中w(Sb水提)为6.5%~9.6%(平均值为8.1%).
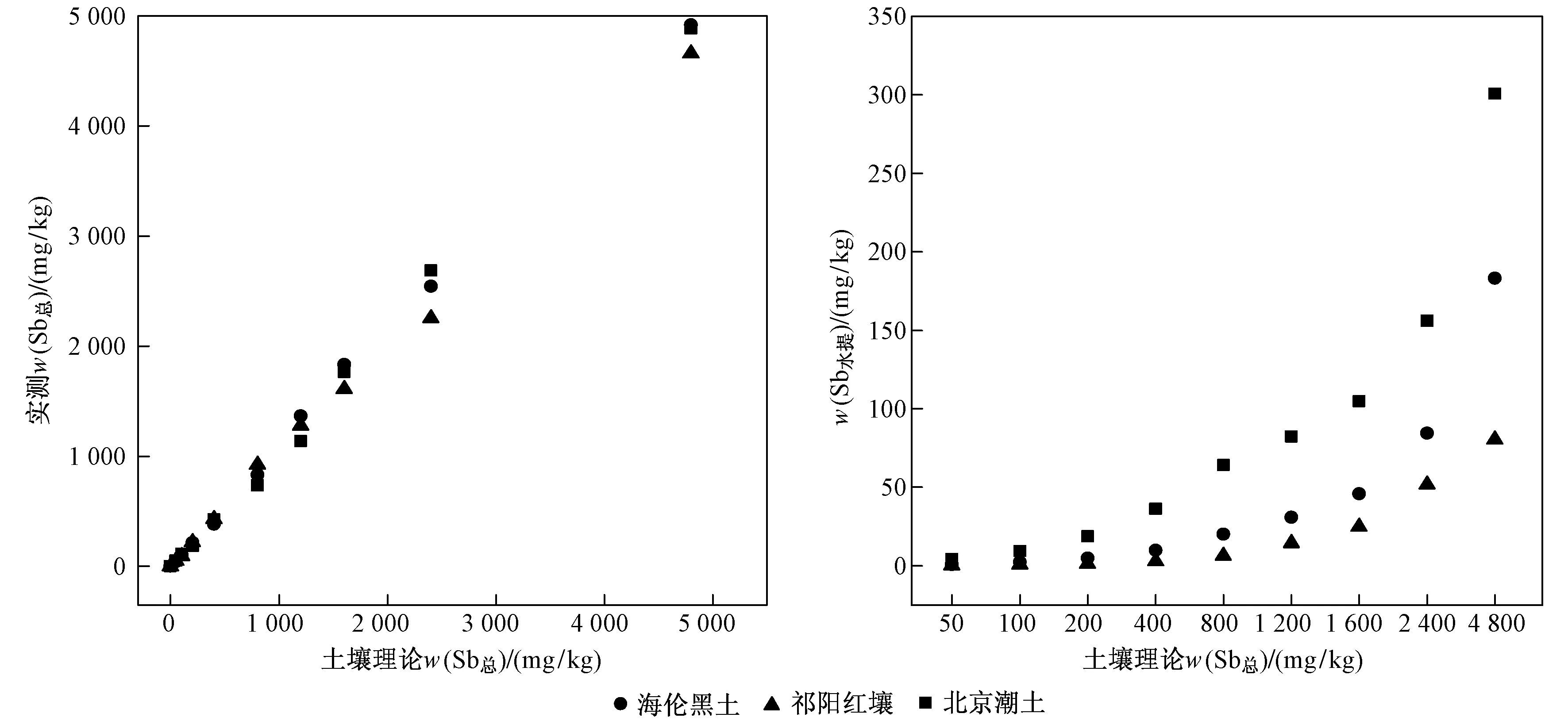
图1 3种土壤中w(Sb总)和w(Sb水提)Fig.1 The concentrations of total antimony and water-extracted antimony in three soils
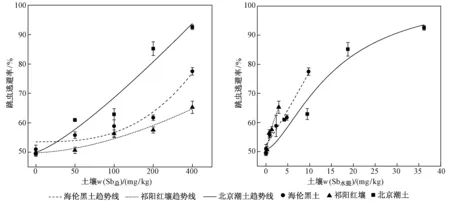
图2 跳虫逃避率与土壤w(Sb总)和w(Sb水提)的剂量-效应关系Fig.2 Dose response curves of the avoidance behavior of F. candida between soil total Sb and water-extracted Sb
2.2 Sb对跳虫的急性毒性效应
急性逃避试验过程中在不同Sb浓度处理的土壤中未发现死亡和失踪的跳虫个体,符合ISO规定要求(即死亡或失踪率小于10%)[22]. 如图2所示,在三种对照组土壤中跳虫分布比较均匀,虽然随着土壤w(Sb总)提高,整体而言跳虫的逃避率逐渐增大,但跳虫在北京潮土中的最高逃避率显著高于海伦黑土和祁阳红壤中的逃避率(P<0.05). 经计算,海伦黑土、北京潮土中基于实测w(Sb总)求得的Sb对跳虫逃避行为的EC50(见表2)分别为298、132 mg/kg,基于w(Sb水提)求得的EC50分别为8.4、14.3 mg/kg,祁阳红壤中EC50值高于设置的最高w(Sb).
暴露7 d后对照组土壤中跳虫死亡率均小于20%,从而保证了试验的有效性. 如图3所示,跳虫存活数量在3种土壤中随着w(Sb总)或w(Sb水提)提高而减少,并且试验中发现在高浓度土壤中其应激性反应明显减弱. 海伦黑土和祁阳红壤中w(Sb总)范围为800~1 600 mg/kg和w(Sb水提)范围分别为20.1~45.8 mg/kg和6.4~24.5 mg/kg时,跳虫存活率均在85%以上,w(Sb总)达 2 400 mg/kg和w(Sb水提)分别达84.4和51.8 mg/kg后两种土壤中跳虫存活率开始显著降低(P<0.05). 北京潮土中跳虫最高死亡率达到100%,其存活数与Sb浓度间表现出最明显的剂量-效应关系. 经计算,海伦黑土、祁阳红壤和北京潮土中基于实测w(Sb总)求得的Sb对跳虫死亡的LC50(见表2)分别为 3 352、4 007、2 105 mg/kg,基于w(Sb水提)求得的LC50分别为107.9、79.1、153.8 mg/kg.

表2 基于w(Sb总) 实测值和w(Sb水提)求得的Sb对跳虫毒性的LC50和EC50
注:括号内数值为95%置信区间;1)所设浓度范围内逃避率未达到50%.
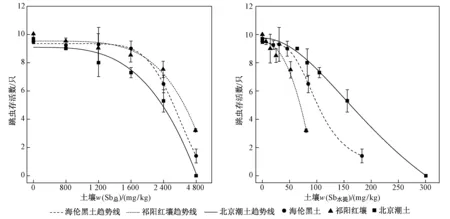
图3 暴露7 d后跳虫存活数与土壤w(Sb总)和w(Sb水提)的剂量-效应关系Fig.3 Dose response curves of the 7 d-survival of F. candida between soil total Sb and water-extracted Sb
2.3 Sb对跳虫的慢性毒性效应
28 d的暴露后对照组土壤中成虫存活率均高于80%,符合ISO关于试验有效性的标准. 如图4所示,海伦黑土、祁阳红壤、北京潮土中w(Sb总)分别为 1 600、800、200 mg/kg和w(Sb水提)分别为45.7、6.5、18.7 mg/kg时,与对照组相比,成虫存活率开始出现明显降低(P<0.05). 海伦黑土、祁阳红壤中成虫最高死亡率分别为87%和70%,而北京潮土中成虫最高死亡率接近100%. 经计算,海伦黑土、祁阳红壤和北京潮土中基于实测w(Sb总)求得的Sb对跳虫死亡的LC50(见表2)分别为 2 271、1 865、703 mg/kg,基于w(Sb水提)求得的LC50分别为61.1、35.5、54.9 mg/kg.
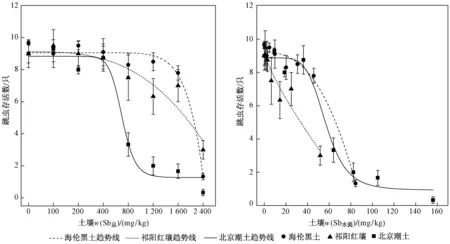
图4 暴露28d后跳虫存活数与土壤w(Sb总)和w(Sb水提)的剂量-效应关系Fig.4 Dose response curves of the 28 d-survival of F.candida between soil total Sb and water-extracted Sb
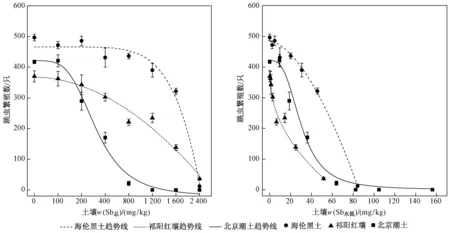
图5 跳虫繁殖数与土壤w(Sb总)和w(Sb水提)的剂量-效应关系Fig.5 Dose response curves of the juveniles of F. candida between soil total Sb and water-extracted Sb
对照组土壤中繁殖的幼虫数均高于100只,符合ISO关于试验有效性的标准. 如图5所示,幼虫数量与w(Sb)之间表现出明显的剂量-效应关系,并且随着成虫数量的减少而降低. 海伦黑土、祁阳红壤和北京潮土中w(Sb总)分别为800、400、200 mg/kg,w(Sb水提)分别为20.1、2.9、18.7 mg/kg时,与对照组相比,跳虫繁殖开始受到明显抑制(P<0.05). 海伦黑土、祁阳红壤中w(Sb总)均为 2 400 mg/kg,北京潮土中w(Sb总)为800 mg/kg时,跳虫几乎不再繁殖,幼虫数分别仅为对照组的2%、9%和5%. 经计算,海伦黑土、祁阳红壤和北京潮土中基于实测w(Sb总)求得的Sb对跳虫繁殖的EC50(见表2)分别为 1 799、1 323、307 mg/kg,基于w(Sb水提)求得的EC50分别为56.1、17.8、25.4 mg/kg.
3 讨论
跳虫的急性逃避和急性存活试验快速而且灵敏,作为预试验可为慢性毒性试验提供依据和参考[31]. Ponge等[32]研究发现某些污染物虽然对跳虫的毒性不大,却能引起它的逃避行为. 李晓勇等[33]研究发现跳虫总体上表现出对Cu污染明显的逃避行为,并且在3 d的暴露下跳虫死亡率和w(Cu)显著正相关. 该研究发现跳虫对Sb具有较强的敏感性,能对土壤中远低于LC50的w(Sb)产生逃避反应,但Sb的急性致死毒性较低,跳虫死亡率的灵敏度远低于逃避行为(见表2),这与文献[34]所研究铅、镉等对跳虫毒性的发现一致,原因是跳虫能灵敏的感知环境中的毒物胁迫并逃离至更适宜生存的地方[31],虽然急性存活试验中不添加食物,跳虫在食用与锑络合的有机质后会中毒死亡,但是由于Sb较低的毒性和土壤w(Sb)较低时,会有部分跳虫逃避到玻璃瓶侧壁上,以致7 d后仍有很多跳虫不会死亡,只有暴露于较高w(Sb)的土壤中跳虫运动能力很快丧失或受到严重削弱,致使其中毒死亡.
跳虫慢性毒性试验从成虫存活数和幼虫繁殖数两个指标评价Sb生态毒性,更符合实际情况,并且暴露周期长达28 d,即使暂时逃避到玻璃瓶侧壁上的成虫也会进入土壤中觅食. 由毒性阈值(见表2)可知慢性试验中跳虫繁殖对Sb的敏感性高于成虫死亡的,与有关其他污染物的研究结果一致,如Pauline等[14]发现,土壤w(Zn)达到1 600 mg/kg时,跳虫成虫存活依然未受到影响,而w(Zn)为356 mg/kg时对跳虫繁殖的抑制率达到50%,这可能与跳虫遇到胁迫时往往会通过放弃生殖繁衍来优先适应环境,维持自身存活的生理特征有关[35].
具有不同理化性质的土壤中重金属的环境行为(吸附、迁移、转化等)不同,使其在不同土壤中的毒性差异明显[36-37]. 该研究结果表明,无论是急性和慢性试验,w(Sb总)相同时,北京潮土中Sb均表现出对跳虫最强的毒性,在所设浓度范围内,祁阳红壤中Sb未使跳虫逃避率达50%,对跳虫急性死亡的毒性也最小. 这是因为跳虫除了经口摄入重金属外还主要通过接触土壤溶液中的重金属而产生暴露[38],该研究选用的海伦黑土中较高的有机质、祁阳红壤中较高的铁铝及黏粒成分和较低的pH使Sb极易与土壤结合[26,39-43],降低Sb在土壤水溶液中的分配比(见图1),从而减少对跳虫的毒害. Kuperman等[10]得出的硫酸锑〔Sb2(SO4)3〕对跳虫繁殖的EC50为169 mg/kg,比北京潮土中的EC50(307 mg/kg)还要低,虽然其受试化学品本身的毒性不同于该试验中酒石酸锑钾(C8H4K2O12Sb2·3H2O),但也与其选用了对Sb吸附性差的有机质、黏粒含量较低的土壤有关. 利用Logistic曲线对土壤w(Sb水提)与跳虫生理指标的毒性反应进行拟合后发现,二者存在明显的剂量-效应关系,而且基于w(Sb水提)求得的三种土壤中毒性阈值之间的差异减小,如北京潮土中基于w(Sb水提)求得的Sb对跳虫繁殖的EC50(见表2)与海伦黑土、祁阳红壤中的差别仅分别为2.2和1.4倍,而基于w(Sb总)求得的EC50与上述两种土壤中的差别分别达到5.9、4.3倍,这进一步说明w(Sb水提)在对跳虫的毒性影响上起重要作用,能表征Sb生物有效性,可以较好的解释三种土壤中Sb毒性的差异.
虽然祁阳红壤水溶液中w(Sb)显著低于海伦黑土中的(P<0.01),但基于w(Sb总)求得的EC50值(见表2)却小于海伦黑土中的(P<0.05). 这是因为跳虫适宜生存于有机质丰富的土壤中,但pH较低和高黏性的土壤对跳虫生长与繁殖有一定限制作用[44-45]. 该研究中祁阳红壤pH为4.81,接近跳虫适应范围边缘,黏粒含量高达55.2%,影响土壤中空气流通,并且慢性毒性试验中跳虫暴露周期长达28 d,所以黏粒含量和pH可能共同导致了海伦黑土中跳虫对Sb较低的敏感性.
4 结论
a) 由海伦黑土、祁阳红壤、北京潮土中Sb毒性阈值大小可知,跳虫的3种评价终点对Sb的敏感性由高到低分别为逃避率、死亡率、繁殖数.
b) 北京潮土中Sb表现出对跳虫最强的毒性,与海伦黑土、祁阳红壤中Sb毒性相比,毒性差别最大接近6倍,表明在进行土壤Sb生态毒性效应研究和确定其毒性阈值时需考虑理化性质的影响.
c) 土壤水提态Sb能表征Sb生物有效性,在对跳虫的毒性影响上起重要作用,可以较好地解释海伦黑土、祁阳红壤、北京潮土中Sb毒性的显著差异,另外土壤性质本身对跳虫生存的影响也是重要原因. 但由于该研究选取的土壤类型较少,只是定性分析得出土壤pH、有机质、铁锰铝等对Sb毒性有较大影响,而要定量确定影响Sb毒性的主因子,后续研究中则需选取更多的土壤类型.
[1] JOHNSON C A,MOENCH H,WERSIN P,etal.Solubility of antimony and other elements in samples taken from shooting ranges[J].Journal of Environmental Quality,2005,34(1):248- 254.
[2] CHANG A C,PAN G,PAGE A L,etal.Developing human health-related chemical guidelines for reclaimed waste water and sewage sludge applications in agriculture[R].Geneva:World Health Organization,2002.
[3] BLASER P,PANNATIER E G,WALTHER T L.The base saturationin acidified Swiss forest soils on calcareous and non-calcareous parent material.a pH-base saturation anomaly[J].Journal of Plant Nutrition Soil Science,2008,171(2):155- 162.
[4] HE Mengchang,WANG Xiangqin,WU Fengchang,etal.Antimony pollution in China[J].Science of the Total Environment,2012,421/422(3):41- 50.
[5] FENG Renwei,WEI Chaoyang,TU Shuxin,etal.The uptake and detoxification of antimony by plants:a review[J].Environmental and Experimental Botany,2013,96:28- 34.
[6] CUI X D,WANG Y J,HOCKMANN K,etal.Effect of iron plaque on antimony uptake by rice(OryzasativaL.)[J].Environmental Pollution,2015,204(S1):133- 140.
[7] 秦晓鹏,上官宇先,赵龙,等.利用CXTFIT-VZCOMML模型推导基于保护地下水的Sb的土壤环境基准[J].环境科学研究,2016,29(3):376- 381. QIN Xiaopeng,SHANGGUAN Yuxian,ZHAO Long,etal.Derivation of soil environmental criteria of antimony based on groundwater protection using the CXTFIT-VZCOMML model[J].Research of Environmental Sciences,2016,29(3):376- 381.
[8] AN Y J,KIM M.Effect of antimony on the microbial growth and the activities of soil enzymes[J].Chemosphere,2008,74(5):654- 659.
[9] ANTOINE P,MUHAMMAD S,NATHALIE S,etal.Antimony bioavailability:knowledge and research perspectives for sustainable agricultures[J].Journal of Hazardous Materials,2015,289:219- 234.
[10] KUPERMAN R G,CHECKAI R T,SIMINI M,etal.Toxicity benchmarks for antimony,barium and beryllium determined using reproduction endpoints forFolsomiacandida,EiseniafetidaandEnchytraeuscrypticus[J].Environmental Toxicology and Chemistry,2006,25(3):754- 762.
[11] BAEKY W,LEE W M,JEONG S W,etal.Ecological effects of soil antimony on the crop plant growth and earthworm activity[J].Environmental Earth Sciences,2013,71(2):895- 900.
[12] 梁淑轩,王凯,耿梦娇,等.土壤中添加Sb(Ⅲ)对赤子爱胜蚓金属硫蛋白的影响[J].环境污染和保护科学学报,2013,2(2):31- 36. LIANG Shuxuan,WANG Kai,GENG Mengjiao,etal.Effect of adding antimony pollution on metallothionein ofEiseniafetidain soil[J].Scientific Journal of Environment Pollution and Protection,2013,2(2):31- 36.
[13] PEGGY C,KOEN L,HILDE V E,etal.Influence of soil properties on copper toxicity for two soil invertebrates[J].Environmental Toxicology and Chemistry,2008,27(8):1748- 1755.
[14] PAULINE L,WAALEWIJN K,SVENJA R,etal.Effect of soil organic matter content and pH on the toxicity of ZnO nanoparticles toFolsomiacandida[J].Ecotoxicology and Environmental Safety,2014,32(10):2349- 2355.
[15] HEGGELUND L R,DIEZORTIZ M,LOFTS S,etal.Soil pH effects on the comparative toxicity of dissolved zinc,non-nano and nano ZnO to the earthwormEiseniafetida[J].Nanotoxicology,2014,8(5):559- 572.
[16] ELS S,CORNELIS A M.Effects of soil type,prepercolation and aging on bioaccumulation and toxicity of zinc for the springtailFolsomiacandida[J].Environmental Toxicology and Chemistry,1998,17(6):1132- 1141.
[17] 许杰,柯欣,宋静,等.弹尾目昆虫在土壤重金属污染生态风险评估中的应用[J].土壤学报,2007,44(3):544- 549. XU Jie,KE Xin,SONG Jing,etal.A review of application of springtails in ecological risk assessment of metal contaminated soils[J].Acta Pedologica Sinica,2007,44(3):544- 549.
[18] FOUNTAIN M T,HOPKIN S P.Folsomiacandida(Collembola):a ′standard′ soil arthropod[J].Annual Review of Entomology,2005,50(1):201- 222.
[19] ERIK S,KOEN O,SOFIE P,etal.Toxicity in lead salt spiked soils to plants,invertebrates and microbial processes:unraveling effects of acidification,salt stress and ageing reactions[J].Science of the Total Environment,2015,536:223- 231.
[20] MENTA C,MAGGIANI A,VATTUONE Z,etal.Effects of Cd and Pb on the survival and juvenile production ofSinellacoecaandFolsomiacandida[J].European Journal of Soil Biology,2006,42(3):181- 189.
[21] SON J,RYOO M,JUNG J,etal.Effects of cadmium,mercury and lead on the survival and instantaneous rate of increase ofParonychiuruskimi(Collembola)[J].Applied Soil Ecology,2007,35(2):404- 411.
[22] International Organization for Standardization.ISO 17512,Soil quality-avoidance test for testing the quality of soils and effects of chemicals on behavior-part1:test with collembola(Folsomiacandida)[S].Geneva,Switzerland:International Organization for Standardization,2011.
[23] International Organization for Standardization.ISO 11267,Soil quality-inhibition of reproduction of Collembolan(Folsomiacandida)by soil pollutants[S].Geneva,Switzerland:International Organization for Standardization,2014.
[24] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2008:25- 200.
[25] PLEYSIER J L,JUO A S R.A single-extraction method using silver-thiourea for measuring exchangeable cations and effective CEC in soils with variable charges[J].Soil Science,1980,129(4):205- 211.
[26] FAN Jianxin,WANG Yujun,CUI Xiaodan,etal.Sorption isotherms and kinetics of Sb(V)on several Chinese soils with different physicochemical properties[J].Journal of Soils and Sediments,2013,13(2):344- 353.
[27] VOJTECH E,MARTIN M.Antimony availability in highly polluted soils and sediments:a comparison of single extractions[J].Chemosphere,2007,68(3):455- 463.
[28] YAN Zengguang,WANG Beixin,XIE Dongli,etal.Uptake and toxicity of spiked nickel to earthwormEiseniafetidain a range of Chinese soils[J].Environmental Toxicology and Chemistry,2011,30(11):2586- 2593.
[29] BOITEAU G,LYNCH D H,MACKINLEY P.Avoidance tests withFolsomiacandidafor the assessment of copper contamination in agricultural soils[J].Environmental Pollution,2011,159(4):903- 906.
[30] VANEWIJK P H,HOEKSTRA J A.Calculation of the EC50and its confidence interval when subtoxic stimulus is present[J].Ecotoxicology and Environmental Safety,1993,25(1):25- 32.
[31] ALDAYA M M,LORS C,SALMON S,etal.Avoidance bioassays may help to test the ecological significance of soil pollution[J].Environmental Pollution,2006,140(1):173- 180.
[32] PONGE J F,MARCHETTI V.Interaction between humus form and herbicide toxicity to Collembola(Hexapoda)[J].Applied Soil Ecology,2002,20(3):239- 253.
[33] 李晓勇,骆永明,柯欣,等.土壤弹尾目昆虫对铜污染的急性毒理初步研究[J].土壤学报,2011,48(1):197- 201. LI Xiaoyong,LUO Yongming,KE Xin,etal.Acute toxicity of copper pollution toFolsomiacandida(Collembolan)in soil[J].Acta Pedologica Sinica,2011,48(1):197- 201.
[34] LUO Wei,VERWEIJ R A,CORNELIS A M,etal.Assessment of the bioavailability and toxicity of lead polluted soils using a combination of chemical approaches and bioassays with the collembolanFolsomiacandida[J].Journal of Hazardous Materials,2014,280:524- 530.
[35] CHOI W I,NEHER D A,RYOO I M,etal.Life-history trade-offs ofParonychiuruskimi(Lee) populations exposed to paraquat[J].Ecotoxicology and Environmental Safety,2008,69(2):227- 232.
[36] DAOUST C M,BASTIEN C.Influence of soil properties and aging on the toxicity of copper on compost worm and barley[J].Journal of Environmental Quality,2006,35:558- 567.
[37] SANDIFER R D,HOPKIN S P.Effects of pH on the toxicity of cadmium,copper,lead and zinc toFolsomiacandidaWillem,1902(Collembola)in a standard laboratory test system[J].Chemosphere,1996,33(22):2475- 2486.
[38] PEDERSEN M B,GESTEL C A M,ELMEGAARD N.Effects of copper on reproduction of two Collembolan species exposed through soil,food and water[J].Environmental Toxicology and Chemistry,2000,19(10):2579- 2588.
[39] CAI Yongbing,MI Yuting,ZHANG Hua.Kinetic modeling of antimony(III) oxidation and sorption in soils[J].Journal of Hazardous Materials,2016,316:102- 109.
[40] MITSUNOBU S,TAKAHASHI Y,TERADA Y,etal.Antimony(V)incorporation into synthetic ferrihydrite,goethite and natural iron oxyhydroxides[J].Environmental Science & Technology,2010,44(10):3712- 3718.
[41] HOU H,YAO N,LI J N,etal.Migration and leaching risk of extraneous antimony in three representative soils of China:lysimeter and batch experiments[J].Chemosphere,2013,93(9):1980- 1988.
[42] TSERENPIL S H,LIU C Q.Study of antimony(III) binding to soil humic acid from antimony smelting site[J].Microchemical,2011,98(1):15- 20.
[43] 上官宇先,秦晓鹏,赵冬安,等.利用大型土柱自然淋溶条件下研究土壤重金属的迁移及形态转化[J].环境科学研究,2015,28(7):1015- 1024. SHANGGUAN Yuxian,QIN Xiaopeng,ZHAO Dongan,etal.Migration and transformation of heavy metals in soils by lysimeter study with field condition[J].Research of Environmental Sciences,2015,28(7):1015- 1024.
[44] GREENSLADE P,VAUGHAN G T.A comparison of Collembola species for toxicity testing of Australian soils[J].Pedobiologia,2003,47(2):171- 179.
[45] VASICKOVA J,VANA M,KOMPRDOVA K,etal.The variability of standard artificial soils:effects on the survival and reproduction of springtail(Folsomiacandida)and potworm(Enchytraeuscrypticus)[J].Ecotoxicology and Environmental Safety,2015,114:38- 43.
Toxicity Effect of Antimony to Soil-Dwelling Springtail (Folsomiacandida)
LIN Xianglong1, SUN Zaijin1, CHEN Weiyu2, YAO Na3, ZHAO Long1, ZHAO Shuting4, HOU Hong1*
1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China 2.Datong Environmental Monitoring Center, Datong 037002, China 3.Jiangxi Academy of Environmental Sciences, Nanchang 330039, China 4.Yunnan Agricultural University, Kunming 650000, China
2016-11-07
2017-02-20
国家重点研发计划项目(2016YFD0800400)
林祥龙(1991-),男,山东临沂人,m15110038821@163.com.
*责任作者,侯红(1963-),女,山西太原人,研究员,博士,主要从事土壤重金属生物地球化学循环和生态环境效应研究,houhong@craes.org.cn
X53
1001- 6929(2017)07- 1089- 09
A
10.13198/j.issn.1001- 6929.2017.02.12
林祥龙,孙在金,陈卫玉,等.锑对土壤跳虫(Folsomiacandida)的毒性效应[J].环境科学研究,2017,30(7):1089- 1097.
LIN Xianglong,SUN Zaijin,CHEN Weiyu,etal.Toxicity effect of antimony to soil-dwelling springtail (Folsomiacandida)[J].Research of Environmental Sciences,2017,30(7):1089- 1097.

