NO3--N/NH4+-N不同配比下紫花苜蓿氮代谢关键酶及钼、铁元素含量研究
郝 凤,刘晓静,范俊俊
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
NO3--N/NH4+-N不同配比下紫花苜蓿氮代谢关键酶及钼、铁元素含量研究
郝 凤,刘晓静,范俊俊
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
以西北地区广泛种植的优质植物性蛋白饲料紫花苜蓿“甘农3号”为试验材料,在室外防雨网室内,采用盆栽营养液沙培法,在适宜氮素供应水平210 mg·L-1基础上,研究NO3--N和NH4+-N混合的7种配比(NO3--N/NH4+-N分别为12.5/87.5、25/75、37.5/62.5、50/50、62.5/37.5、75/25、87.5/12.5,依次标为1/7、1/3、3/5、5/5、5/3、3/1、7/1)对紫花苜蓿全生育期各部位硝酸还原酶(NR)、固氮酶活性及钼(Mo)、铁(Fe)营养吸收的影响。结果表明:(1) 从部位来看,紫花苜蓿NR活性、Mo含量趋势一致,均表现为:叶>根>茎,而Fe含量则表现为根>叶>茎;不同配比下各部位NR活性均表现为配比中NO3--N比例大时,其活性较高,尤其是生长前期当NO3--N/NH4+-N为7/1时,各部位NR活性均最高;不同配比对根中Mo含量的影响在苗期与NR趋势相近,在NO3--N比例大时达最高。现蕾期与固氮酶活性相同,1/7时最高。成熟期同固氮酶与NR活性,均为5/3时最高;不同配比对根中Fe含量的影响与固氮酶活性变化趋势相一致,苗期均为1/7处理最高,盛花期至成熟期均为5/3处理最高。(2) 从生育期来看,紫花苜蓿全生育期NR和固氮酶活性变化趋势均呈单峰曲线;NR活性在盛花期最高,即盛花期氮代谢能力最强,且各生育期均为配比中NO3--N比例大时NR活性高,氮代谢能力较强;固氮酶活性在结荚期最高,即结荚期根瘤固氮能力最强,且苗期和现蕾期均表现为1/7处理其活性最高,盛花期至成熟期5/3处理活性最高;不同配比对茎和叶中Mo、Fe含量的影响基本相同,现蕾期至盛花期在配比中NH4+-N比例大时含量最高,结荚期至成熟期在配比中NO3--N比例大时含量最高。(3) NR和固氮酶活性相互关系在整个生育期表现不同:在紫花苜蓿生长前期(苗期至现蕾期),NO3--N/NH4+-N=7/1时NR活性最大,1/7处理NR活性最小,而固氮酶活性则相反,二者表现出拮抗关系;在紫花苜蓿生长中、后期(盛花期至成熟期)NR活性与固氮酶活性均在NO3--N/NH4+-N=5/3时达最大值,二者又相互促进。
NO3--N/NH4+-N配比;紫花苜蓿;氮代谢;酶;钼;铁
紫花苜蓿(Medicagosativa)是西北干旱半干旱地区人工种植面积最大的优质多年生豆科牧草[1],由于其独特的氮利用方式成为畜牧业生产中不可或缺的植物蛋白资源[2],尤其对西北生态脆弱区的生态修复和草食畜牧业的发展具有重要意义[3]。紫花苜蓿虽可通过共生固氮利用分子态氮,但根瘤固定的氮素仅占其一生需氮量的50%~60%[4],并不能满足其生长所需,在土壤氮贫瘠的西北地区,尤其在干旱荒漠化地区[5],补充外源氮是生产的必要保证。在以高产优质为目的的生产中,要求外源氮既要满足生产需要又不对共生固氮产生抑制,因此加强自身的氮代谢能力是提高氮素利用效率的重要途径。
紫花苜蓿的氮素同化途径有两种:一是固氮酶把大气中N2还原为氨。固氮酶是固氮生物体内能将空气中的氮还原成氨的生物催化剂,固氮酶活性是衡量固氮效能的重要指标。二是硝酸还原酶(Nitrate reductase,NR)把硝态氮还原为亚硝酸,再由亚硝酸还原为氨。NR是植物体内NO3--N同化步骤中的第一个酶,也是整个同化过程的限速酶,在植物氮代谢中起关键作用[6]。对大部分植物来说,此反应在根、茎和叶中都可进行,通常绿色组织更为活跃[7]。而微量元素钼(Mo)、铁(Fe)是氮代谢关键酶的活化剂,在植物固氮和硝酸还原过程中二者缺一不可,对氮的吸收利用有促进作用[8]。Mo是NR和固氮酶的组成因子,对豆科植物的氮代谢有重要的促进作用,且Mo可以明显提高NR活性,加强氮代谢[9]。Fe直接参与豆科作物共生固氮,是固氮酶、NR、铁氧还原蛋白等含铁蛋白的重要金属组分[10]。对于豆科植物来说,Fe可促进根瘤形成,提高固氮能力,且缺Fe时植物体内NR降低,NO3--N同化受阻[11]。因此,Mo、Fe以及固氮酶和NR是反映植物氮代谢能力的重要指标。
土壤中可供植物直接利用的氮素形态主要是硝态氮(NO3--N)和铵态氮(NH4+-N),其对植物生理代谢过程的影响不同[12]。生长在不同土壤环境中的植物通过长期进化,形成了各自特有的对NO3--N和NH4+-N的喜好,如水田作物水稻喜NH4+-N,而玉米、小麦、白菜等旱地作物则偏好NO3--N,且同一作物在不同的生长阶段对NO3--N和NH4+-N的喜好亦有变化[13]。有研究表明,大多数作物NO3--N与NH4+-N配合施用较单独施用效果好,其最佳配比随作物生育期不同而不同[14]。同是旱地植物的紫花苜蓿,已有研究证实,NO3--N和NH4+-N混合施用较单一NO3--N或NH4+-N更能促进紫花苜蓿的根系生长[15],并促进其氮代谢[16]。另一方面西北地区气候较为干燥,土壤偏碱性的条件下[17],土壤硝化作用强烈而反硝化作用较弱,土壤中易于积累硝态氮[18]。Britto等[19]研究表明,NO3--N和NH4+-N联合供应时,植物吸收NH4+-N产生的根际酸化又可以抵消吸收NO3--N引起的根际碱化。因此,了解NO3--N/NH4+-N配比对紫花苜蓿氮代谢酶及Mo、Fe的影响对加强其自身的氮代谢能力,提高外源氮利用效率有重要作用。为此,本研究采用砂培法以避免土壤氮的干扰,并利用营养液,模拟土壤中可供植物直接吸收利用的两种氮素形态的多种比例,研究不同NO3--N/NH4+-N配比对紫花苜蓿硝酸还原酶(NR)、固氮酶活性及Mo、Fe营养吸收的影响,以期为西北干旱区有效调节紫花苜蓿营养状况及调控其土壤氮营养高效利用提供参考。
1 材料与方法
1.1 试验材料
甘农3号紫花苜蓿和中华根瘤菌(12531)由甘肃农业大学草业学院提供。
1.2 土壤中氮素形态比例的模拟
根据前期试验结果设氮素水平为210 mg·L-1(以纯氮计)[20],将NO3--N和NH4+-N按不同比例混合,以NO3--N所占比例由小到大,NO3--N/NH4+-N分别为12.5/87.5;25/75;37.5/62.5;50/50;62.5/37.5;75/25;87.5/12.5,依次标为1/7、1/3、3/5、5/5、5/3、3/1、7/1,共模拟出土壤中的可供植物直接吸收利用的两种氮素形态(NO3--N和NH4+-N)的7种比例,共7个处理,每处理重复15次,完全随机排列。
1.3 砂培试验
为了更接近田间环境条件,且避免土壤氮的干扰,本试验设在室外防雨网室内,并采用营养液砂培法。营养液以Hoagland无氮植物营养液为基础,利用Ca(NO3)2和(NH4)2SO4配制所需氮素浓度,调节pH值为7。
2014年4月10日,选取颗粒饱满、均一的种子,经95%乙醇灭菌30 s,再用0.1% HgCl2溶液消毒5 min,后用无菌水洗5~6次,最后拿无菌滤纸吸干。选用直径32 cm、高20 cm的花盆,装入经自来水冲洗再用蒸馏水清洗并经过高温(121℃)灭菌的粗砂10 kg。每盆播种100粒,播种初期每日喷浇3次蒸馏水,每次100 mL,直至对生真叶完全展开,每盆保留健壮植株50株。长至3片复叶时,每盆接种根瘤菌液50 mL。为防止盐分积累,每7 d用蒸馏水充分淋洗,再重新加入营养液500 mL,直至取样。
1.4 采样时期的划分
苗期(5月15日):有80%的植株开始分枝时;
现蕾期(6月5日):有15%以上的植株在叶腋间已形成花蕾时;
盛花期(6月25日):有75%左右的分枝开始开花;
结荚期(7月15日):有10%以上的分枝花序已结荚;
成熟期(8月5日):有80%以上的果实成熟。
1.5 指标测定
硝酸还原酶(NR)活性:采用离体法测定[21],称取0.5 g叶片,加4 mL缓冲提取液,冰浴研磨成匀浆。4℃下4 000 r·min-1离心15 min,上清液即酶的粗提液用于NR活性的测定。
固氮酶活性:采用乙炔还原法[22]测定。测定仪器为GC-7890F气相色谱仪,柱温170℃,进样器140℃,FID检测器150℃。气体压力:N2为0.3 MPa,H2为0.08 MPa,空气为0.15 MPa。
C2H4水平(μmol·g-1·h-1)=hx(样品峰面积)×C(标准C2H4水平,μmol·mL-1)/hs(标准C2H4峰面积)×V(反应气体体积)×t(C2H2反应时间,h)×m(瘤重,g)。
钼(Mo)、铁(Fe)含量的测定:选择晴天上午9∶00—10∶00。将紫花苜蓿植株地上部取下,茎叶分开并放入烘箱105℃杀青15 min,65℃~75℃下烘干至恒重后粉碎。称量草粉1 g,用1 mol·L-1盐酸浸提,提取液用原子吸收光谱法测定Mo、Fe元素的含量[23]。
1.6 统计分析
用Excel 2007进行数据处理和图表绘制,并用SPSS 17.0统计软件Duncan法对数据进行多重比较。所有数据以平均值±标准误表示,P<0.05为差异显著。
2 结果与分析
2.1 紫花苜蓿不同生育期硝酸还原酶(NR)活性
氮素水平210 mg·L-1下,NR活性受氮素形态配比的影响很大(图1)。整个生育期NR活性表现为:叶>根>茎。全生育期各配比下NR活性变化趋势均呈单峰曲线,在盛花期时最大,而后迅速下降,成熟期时NR活性均最低,且各部位具有一致的变化趋势。从生育期来看,各生育期NO3--N所占比例大时,NR活性均较高,苗期、现蕾期、盛花期和结荚期处理间差异达显著水平(P<0.05)。苗期NO3--N/NH4+-N为7/1时,NR活性显著高于其它处理(P<0.05);现蕾期NO3--N/NH4+-N为7/1,NR活性最高,但与5/3处理差异不显著(P>0.05);盛花期至成熟期NO3--N/NH4+-N为5/3时,各部位NR活性均最大,但成熟期各处理间差异不显著(P>0.05)。
2.2 紫花苜蓿不同生育期固氮酶活性
整个生育期,各处理下紫花苜蓿的固氮酶活性均随着生育期的推进呈现先增大后减小的变化趋势(表1)。氮素水平210 mg·L-1下,氮素形态配比对紫花苜蓿不同生育期固氮酶活性的影响较大。苗期和现蕾期紫花苜蓿的固氮酶活性表现为:NO3--N/NH4+-N<5/5时,固氮酶活性较高,且最高值出现在1/7处理;盛花期至成熟期NO3--N/NH4+-N配比为5/3时,固氮酶活性最大,在盛花期5/3处理显著高于其它处理(P<0.05) ,结荚期和成熟期5/3和7/1处理差异不显著(P>0.05),但均显著高于其它处理(P<0.05)。由此可见,紫花苜蓿中后期NO3--N/NH4+-N为5/3时,自身固氮能力较强。
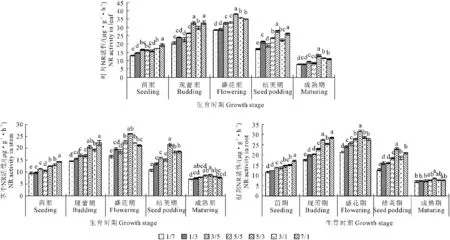
图1 NO3--N/NH4+-N配比对紫花苜蓿不同生育期各部位NR的影响

表1 NO3--N/NH4+-N配比对紫花苜蓿不同生育期固氮酶活性的影响/(μmol·g-1·h-1)
注:表中同列不同小写字母表示差异显著(P<0.05)。
Note: Different lowercase letters in the same column mean significant difference at the 0.05 level.
2.3 紫花苜蓿不同生育期钼(Mo)含量
氮素形态配比对紫花苜蓿各部位中Mo含量的变化影响较大(图2)。不同NO3--N/NH4+-N配比下,紫花苜蓿各部位中Mo含量整体表现为叶>根>茎,三者中Mo含量随着生育期的推进均呈先增加后减小的趋势,均在苗期最低,叶中Mo含量在结荚期最高,茎和根中则在盛花期达到峰值。
苗期,紫花苜蓿各部位中Mo含量均表现为:NO3--N/NH4+-N配比为3/1时显著高于其它处理(P<0.05);现蕾期,NO3--N/NH4+-N<5/5时各部位中Mo含量均较高,且1/7处理显著高于其它处理(P<0.05);盛花期至结荚期,随NO3--N/NH4+-N比例的上升,各部位中Mo含量也发生变化。盛花期,根、茎和叶中Mo含量均在3/5处理下最大,且显著高于其它处理(P<0.05);结荚期,叶和茎中NO3--N/NH4+-N为5/3时Mo含量最高,而根中则3/1处理显著高于其它处理(P<0.05);至成熟期,紫花苜蓿叶、茎中Mo含量减少较多,根中Mo含量仍保持较高水平,且叶和茎中Mo含量在3/1处理时,显著高于其它处理(P<0.05),根中在5/3处理下含量最高。由此可见,在不同氮素形态下,紫花苜蓿前中期NH4+-N更有利于其对Mo营养的吸收,而到后期则相反。
2.4 紫花苜蓿不同生育期铁(Fe)含量
从紫花苜蓿不同生育期对各部位Fe的吸收来看(图3),Fe含量均表现为根>叶>茎。由图3所示,苗期至结荚期叶片中的铁含量整体呈缓慢上升趋势,结荚期至成熟期略有下降。茎中Fe的含量比较稳定,但在结荚期时有所下降。而根部Fe含量在苗期至盛花期快速升高,结荚期有所下降,成熟期时达到峰值。
苗期,叶和茎中Fe含量在NO3--N/NH4+-N为3/1时均显著高于其它处理(P<0.05),根中则为NO3--N/NH4+-N为1/7时最高;现蕾期各部位中Fe含量均在1/3处理达最大值,且显著高于其它处理(P<0.05);盛花期叶和茎中Fe含量在NO3--N/NH4+-N为1/3时最高,而根则在5/3时最高;结荚期叶中Fe含量在NO3--N/NH4+-N为5/5时最高,根和茎中在5/3处理达最大值,且显著高于其它处理(P<0.05);成熟期叶中Fe含量最大值出现在3/1处理,茎中Fe含量在7/1处理下显著高于其它处理(P<0.05),而根中Fe含量则表现为:NO3--N/NH4+-N配比中NO3--N所占比例大的处理积累的Fe含量较多,且在NO3--N/NH4+-N为5/3时最大。
3 讨论与结论
3.1 NO3--N/NH4+-N配比对紫花苜蓿各部位氮代谢的影响
本研究中,不同NO3--N/NH4+-N配比下,紫花苜蓿5个生育期的NR活性均表现为:叶>根>茎,说明叶是紫花苜蓿同化NO3--N的最主要部位,在其它作物的研究中已证实[24]。在不同NO3--N和NH4+-N配比处理下,紫花苜蓿根、茎、叶中NR活性均表现为:配比中NO3--N所占比例大时,其活性较高,尤其是苗期至现蕾期当NO3--N/NH4+-N为7/1时,NR活性最高。黄俊[25]等对白菜的研究也发现NO3--N/NH4+-N不同,叶片内的NR活性差异显著,并在比例为75/25时,NR活性最强。主要是因为NR不仅是氮代谢过程中的限速酶,同时还是一种诱导酶[5],NR可被介质中的NO3-所诱导,其活性取决于介质中NO3-的浓度,且与之呈正相关[26],因此,环境中NO3-的增加可诱导其体内NR活性的提高。

图2 NO3--N/NH4+-N配比对紫花苜蓿不同生育期各部位钼含量的影响
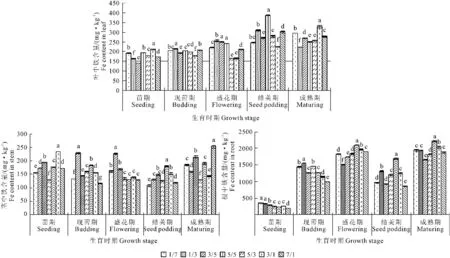
图3 NO3--N/NH4+-N配比对紫花苜蓿不同生育期不同部位铁含量的影响
本研究中紫花苜蓿各部位Mo含量表现为:叶>根>茎,且各部位Mo含量均在苗期最低,吴明才等[27]研究发现大豆各部位Mo含量也均在苗期最低。根中Mo含量的最大值随着生育期的推进出现在不同的NO3--N/NH4+-N配比下,苗期为3/1时最大,现蕾期为1/7时最大,而至成熟期又在5/3处理达最大值,分析认为紫花苜蓿生长初期根瘤尚未形成,根瘤固氮能力较低,对Mo的需求还未与NR形成竞争,因此在苗期NO3--N/NH4+-N配比对根中Mo含量的影响与NR趋势相近,在NO3--N所占比例大时Mo含量达最高。随着生育期的推进,大量根瘤形成,根瘤固氮能力大幅度提高,对Mo的需求量大于NR对其的竞争,因此现蕾期NO3--N/NH4+-N配比对根中Mo含量的影响与固氮酶活性趋势相近,在NH4+-N所占比例大时Mo含量达最高。至生育后期,根瘤老化,根瘤固氮能力开始下降并与NR对Mo的竞争协同共进,因此成熟期NO3--N/NH4+-N配比对根中Mo含量的影响同固氮酶活性与NR,均在NO3--N所占比例大时Mo含量达最高。
Fe是植物体内铁氧还原蛋白的重要组分,直接影响NR活性并参与豆科作物共生固氮。本研究中紫花苜蓿植株Fe含量表现为:根>叶>茎,乔鲜花等[28]研究发现,小麦各器官Fe含量也表现出类似的趋势:根系>叶片>穗轴、颖壳>茎>子粒。本研究还发现,不同NO3--N/NH4+-N配比对紫花苜蓿根中Fe含量的影响与固氮酶活性变化趋势相一致,苗期、盛花期、结荚期和成熟期的最大值均出现在同一NO3--N/NH4+-N配比处理下,表明Fe可影响固氮酶活性大小,Dakora等[29]关于豇豆和大豆的研究也证实,固氮酶活性不仅受外源氮素的影响,而且也受金属元素Mo、Fe的制约。而苗期后根部Fe含量急剧增加,远远大于叶和茎中的含量,可能是由于随着生育期的推进,根系逐渐衰老,活力下降,氧化能力减弱,使得根系周围大量的Fe以Fe3+沉积在根系表面而造成的[30]。
由此,从部位来看,紫花苜蓿NR活性、Mo含量趋势一致,均表现为:叶>根>茎,而Fe含量则表现为根>叶>茎;不同配比下各部位NR活性均表现为配比中NO3--N所占比例大时,其活性较高,尤其是生长前期当NO3--N/NH4+-N为7/1时,各部位NR活性均最高;不同配比对根中Mo含量的影响在苗期与NR趋势相近,在NO3--N所占比例大时达最高。现蕾期与固氮酶活性相同,1/7时最高。成熟期同固氮酶与NR活性,均在5/3时最高;不同配比对根中Fe含量的影响与固氮酶活性变化趋势相一致,苗期均在1/7处理最高,盛花期至成熟期均在5/3处理最高。
3.2 NO3--N/NH4+-N配比对紫花苜蓿各生育期氮代谢的影响
本研究中,紫花苜蓿全生育期各配比下NR活性变化趋势均呈单峰曲线,盛花期活性最高,成熟期最低,且各部位具有一致的变化趋势,说明在紫花苜蓿的5个生育期中,盛花期氮代谢能力最强。刘鹏等[31]研究也发现大豆叶片各生育期NO3--N与NR活性的动态变化相似,以开花期最高、成熟期最低。不同NO3--N/NH4+-N配比处理下,紫花苜蓿NR活性在整个生育期均表现为NO3--N/NH4+-N配比中NO3--N比例高时NR活性较高,这是由于NR作为一种诱导酶,其活性大小与底物(NO3-)的浓度呈正相关,而氮代谢过程中同化的产物NH4+、谷氨酸、谷氨酰胺等则抑制其活性[32]。所以,配比中NO3--N比例大时,促进其NR活性增加,反之,当NH4+-N比例大时,因NH4+也是NO3-还原反应的产物,即氮代谢的同化产物,其反馈抑制作用致使NR活性降低。
本研究中,紫花苜蓿全生育期各配比下固氮酶活性变化趋势均呈单峰曲线,结荚期达最大值,说明在紫花苜蓿的5个生育期中,结荚期根瘤固氮能力最强。且不同NO3--N/NH4+-N配比下,紫花苜蓿的固氮酶活性在苗期和现蕾期均表现为1/7处理最好,说明NH4+-N更有利于根瘤的生长,分析原因是供给NO3--N时主要影响根瘤呼吸速率使根瘤皮层内O2扩散阻抗力增大,根瘤侵染区细胞O2浓度降低,类菌体呼吸和固氮所需氧供应不足,因而导致根瘤活性受到抑制[33]。紫花苜蓿生长至中、后期(盛花期至成熟期),NH4+-N比例较大的处理紫花苜蓿固氮酶活性下降,而5/3处理下表现最好,分析原因可能是大量的NH4+-N来不及利用和转移,NH4+浓度过高导致NH4+盐毒害,不能形成根瘤进而限制固氮酶的合成。本研究采用营养液培养,可提供充足的Mo供紫花苜蓿生长,而Mo可促进植物对NO3--N的吸收与同化,因此,Mo的存在能缓解NO3--N对固氮酶的抑制作用,提高根瘤固氮能力[34]。
在本研究中整个生育期不同配比对茎和叶中Mo、Fe含量的影响基本相同,现蕾期至盛花期表现为:NO3--N/NH4+-N配比中NH4+-N比例大时,Mo和Fe含量达最高;而结荚期至成熟期则表现为:NO3--N/NH4+-N配比中NO3--N比例大时,Mo和Fe含量达最高。分析原因是氮素形态对它们根际pH的影响不同造成的[35],前中期NH4+-N能较快地释放出H+,阴阳离子结合使得Mo和Fe吸收较快,积累量多。结荚期后,大量NO3--N经NR还原成NH4+-N,使得植株中NH4+-N大量积累,故结荚期后表现为NO3--N含量高时Mo和Fe含量反而高。
由此,从生育期来看,紫花苜蓿全生育期NR活性和固氮酶活性变化趋势均呈单峰曲线;NR活性在盛花期最高,即盛花期氮代谢能力最强,且各生育期均为NO3--N/NH4+-N配比中NO3--N比例大时NR活性高,氮代谢能力较强;固氮酶活性在结荚期达最大值,即结荚期根瘤固氮能力最强,且苗期和现蕾期均表现为1/7处理其活性最高,盛花期至成熟期则在5/3处理下活性最高;不同配比对茎和叶中Mo、Fe含量的影响基本相同,现蕾期至盛花期在配比中NH4+-N所占比例大时含量达最高,结荚期至成熟期在配比中NO3--N所占比例大时含量达最高。
3.3 NO3--N/NH4+-N配比下紫花苜蓿NR活性与固氮酶活性的关系
有观点认为NR和固氮酶是一对拮抗酶,它们不仅含有共同的钼辅因子,产生对这种共同因子的竞争,而且对氮素形态的响应不同,前者受NO3--N的诱导和促进,后者受NO3--N的钝化和抑制[36]。但在本研究中,在紫花苜蓿生长前期(苗期至现蕾期),NO3--N/NH4+-N=7/1处理NR活性最大,1/7处理NR活性最小,而固氮酶活性则相反,二者表现出拮抗关系;在紫花苜蓿生长中、后期(盛花期至成熟期)NR活性与固氮酶活性均在NO3--N/NH4+-N=5/3处理达最大值,二者又相互促进。所以,固氮酶与NR之间不都是拮抗关系,在固氮酶活性被外源氮抑制时,与NR之间存在拮抗关系,而固氮酶未受抑制或抑制较轻时,固氮酶与NR之间又可以相互促进、协调氮素营养。
[1] 金风霞,麻冬梅,刘昊焱,等.不同种植年限苜蓿地土壤环境效应的研究[J].干旱地区农业研究,2014,32(2):73-77.
[2] 刘晓静,张进霞,李文卿,等.施肥及刈割对干旱地区紫花苜蓿产量和品质的影响[J].中国沙漠,2014,34(6):1516-1526.
[3] 南丽丽,郁继华,郭全恩.荒漠灌区不同种植年限苜蓿地土壤酶活性的变化研究[J].干旱地区农业研究,2015,33(6):71-76.
[4] 曾昭海,胡跃高,陈文新,等.共生固氮在农牧业上的作用及影响因素研究进展[J].中国生态农业学报,2006,14(4):21-24.
[5] 俞 玲,马晖玲.甘肃几种早熟禾内源激素水平及干旱适应性[J].中国沙漠,2015, 35(1):182-188.
[6] 李从峰,王空军,刘 鹏,等.供氮水平对雄性不育玉米物质生产和氮代谢的影响[J].植物营养与肥料学报,2009,15(1):99-104.
[7] 张华珍,徐恒玉.植物氮素同化过程中相关酶的研究进展[J].北方园艺,2011,(20):180-183.
[8] 王改玲,郝明德,党廷辉,等.黄土高原旱地长期施用微肥对冬小麦产量及氮磷养分吸收的影响[J].西北植物学报,2003,23(8):1402-1405.
[9] 杜应琼,廖新荣,黄志尧,等.硼、钼对花生氮代谢的影响[J].作物学报,2001,27(5):612-616.
[10] Dakora D F. A functional relationship between leghaemogbin and nitrogenase based on novel measurements of the proteins in legume root nodules[J]. Annals of Botany, 1995,75(1):49-54.
[11] 申红芸,熊宏春,郭笑彤,等.植物吸收和转运铁的分子生理机制研究进展[J].植物营养与肥料学报,2011,17(6):1522-1530.
[12] Masclaux-Daubresse C, Daniel-Vedele F, Dechorgnat J, et al. Nitrogen uptake,assimilation and remobilization in plants: challenges for sustainable and productive agriculture[J]. Annals of Botany, 2010,105(7):1141-1157.
[13] 李 凯,郭宇琦,刘楚楠,等.铵硝配比对大豆生长及结瘤固氮的影响[J].中国油料,2014,36(3):349-356.
[14] 刘赵帆,张国斌,郁继华,等.氮肥形态及配比对花椰菜产量、品质和养分吸收的影响[J].应用生态学报,2013,24(7):1923-1930.
[15] 刘晓静,叶 芳,张晓玲.外源氮素形态对紫花苜蓿不同生育期根系特性的影响[J].草业学报,2015,24(6):53-63.
[16] 叶 芳,刘晓静,张进霞.氮素形态对‘甘农3号’苜蓿不同生育期氮代谢的影响[J].草地学报,2015,23(2):285-293.
[17] 郝 凤,刘晓静,张晓磊,等.混合盐碱胁迫对紫花苜蓿苗期氮磷吸收及生理特性的影响[J].中国沙漠,2015,35(5):1268-1274.
[18] Ju X, Lu X, Gao Z, et al. Processes and factors controlling N2O production in an intensively managed low carbon calcareous soil under sub-humid monsoon conditions[J]. Environmental Pollution, 2011,159(4):1007-1016.
[19] Britto DT, Kronzucker HJ. NH4+toxicity in higher plants: Acritical review[J]. Journal of Plant Physiology, 2002,159(6):567-584.
[20] 蒯佳林,刘晓静,李文卿.不同氮素水平对接种根瘤菌紫花苜蓿生长特性的影响[J].草原与草坪,2011,31(3):56-63.
[21] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[22] Hafeez F Y, Malik K A. Manual on Biofertilizer Technology[M]. Pakistan:NIBGE, 2000.
[23] 常新耀,林紫玉,谢红兵,等.原子吸收光谱法测定新乡野生苜蓿中微量元素的含量[J].光谱实验室,2009,26(4):952-954.
[24] Silveira J A G, Matos J C S, Cecatto V M, et al. Nitrate reductase activity, distribution, and response to nitrate in two contrasting Phaseolus species inoculated with Rhizobium spp.[J]. Environmental & Experimental Botany, 2001,46(1):37-46.
[25] 黄 俊,周旭燕,刘 莉.不同铵硝配比对弱光下白菜氮素吸收及相关酶的影响[J].中国生态农业学报,2011,19(4):783-787.
[26] 陈 煜,朱保葛,张 敬,等.不同氮源对大豆硝酸还原酶和谷氨酰胺合成酶活性及蛋白质含量的影响[J].大豆科学,2004,23(2):143-146.
[27] 吴明才,肖昌珍.大豆钼素研究[J].大豆科学,1994,13(3):245-251.
[28] 乔鲜花,汪娟梅,董明蕾,等.喷施铁肥对不同基因型小麦产量和铁吸收的影响[J].麦类作物学报,2012,31(5):959-964.
[29] Dakora D F. A functional relationship between leghaemogbin and nitrogenase based on novel measurements of the proteins in legume root nodules[J]. Annals of Botany, 1995,15:49-54.
[30] 胡 莹,黄益宗,黄艳超,等.不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响[J].农业环境科学学报,2013,3(3):432-437.
[31] 刘 鹏,杨玉爱.硼钼胁迫对大豆叶片硝酸还原酶与硝态氮的影响[J].浙江大学学报(农业与生命科学版),2000,26(2):151-154.
[32] 王 平.不同氮效率类型小麦氮代谢差异及其机理分析[D].山东:山东农业大学,2011.
[33] Denison R F, Layzell D B. Measurement of Iegume nodule respiration and O2 Permeability by noninvasive spectrophotometry of leghemoglobin[J]. Plant Physiology, 1991,96:137-143.
[34] 李文学,韩晓日.低温对缺钼冬小麦幼苗生长的影响Ⅱ.对氮代谢的影响[J].植物营养与肥料学报,2001,7(1):88-92.
[35] 崔驼勇,曹一平,张福锁.氮素形态及HCO3-土对豌豆铁素营养的影响[J].植物营养与肥料学报,2000,6(1):84-90.
[36] 黄志宏,黄维南.杨梅硝酸还原酶活性与根瘤固氮活性的研究[J].热带作物学报,2002,23(1):35-39.
StudyonkeyenzymeactivityinnitrogenmetabolismandthecontentofmolybdenumandironinalfalfaunderdifferentNO3--N/NH4+-Nratio
HAO Feng, LIU Xiao-jing, FAN Jun-jun
(CollegeofGrasslandScience,GansuAgriculturalUniversity/KeyLaboratoryofPrataculturalEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-USCenterforGrazinglandEcosystemSustainability,Lanzhou,Gansu730070,China)
By solution culture method, ‘Gannong No.3’ alfalfa was chosen as the experimental material to explore the effects of NO3--N/NH4+-N ratios(1/7、1/3、3/5、5/5、5/3、3/1、7/1) based on nitrogen supply of 210 mg·L-1on the activity of nitrate reductase(NR) and nitrogenase, and the content of molybdenum(Mo) and iron(Fe) in organs of alfafa during the whole growth period. The results showed that: (1) NR activity and Mo content was consistent:leaf>root>stem, while Fe content was root>leaf>stem. With the proportion of NO3--N increasing, NR activity in each organ became higher. In the early stage, when NO3--N/NH4+-N equaled to 7/1, NR activity was the highest. The influence of different ratio on Mo content in root during seedling stage was similar to NR activity, that is to say, in large proportion of NO3--N it was the highest. During budding stage, the same as nitrogenase activity, in 1/7 it was highest. During mature stage, same as nitrogenase and NR activity, in 5/3 it was highest. The influence of different ratio on Fe content in root was similar to nitrogenase activity, that is to say, it was highest at 1/7 in seedling and 5/3 from full-bloom to mature. (2) NR and nitrogenase activity showed a single-peak curve during the whole growth period, that is to say, NR activity was the highest during full-bloom stage and nitrogenase activity was the highest during podding stage. NR activity was higher under larger proportion of NO3--N in different ratios during the whole growth period. Nitrogenase activity was the highest in 1/7 at seedling and budding, and from full-bloom to mature it was the highest in 5/3. Mo and Fe content in the stem and leaf was consistent, they were the highest for larger proportion of NH4+-N from budding to full-bloom and highest for larger proportion of NO3--N from podding to maturity. (3) Relationship between NR and nitrogenase activity differed in the whole growth period. At the early growth stage (from seeding to budding), NR activity was highest in 7/1 and lowest in 1/7. Nitrogenase activity was in the opposite situation, suggesting that there was an antagonistical relationship between NR and nitrogenase activity. From full-bloom to mature, both NR and nitrogenase activity was highest in 5/3, they accelerated each other.
NO3--N/NH4+-N ratio; alfalfa; nitrogen metabolism; enzyme; molybdenum; iron
1000-7601(2017)03-0190-08doi:10.7606/j.issn.1000-7601.2017.03.30
2016-04-29
:2017-03-15
:国家自然科学基金项目(31460622);公益性行业(农业)科研专项(201403048-8);甘肃省科技支撑项目(1504NKCA003)
郝 凤(1985—),女,黑龙江鹤岗人,博士研究生,研究方向为牧草及草坪草营养生理。 E-mail:haofeng1026@163.com。
刘晓静,E-mail:liuxj@gsau.edu.cn。
N143.1
: A

