不同盐度下施氮量对甜菜生长发育及氮素吸收利用特性的影响
魏显珍,赵 斌,2,武晓燕,2,宋运涛
(1.中华全国供销合作总社天津再生资源研究所, 天津 300191; 2.天津市电子废物资源再生技术工程中心, 天津 300191)
不同盐度下施氮量对甜菜生长发育及氮素吸收利用特性的影响
魏显珍1,赵 斌1,2,武晓燕1,2,宋运涛1
(1.中华全国供销合作总社天津再生资源研究所, 天津 300191; 2.天津市电子废物资源再生技术工程中心, 天津 300191)
本研究以NaCl为盐分模拟不同盐度环境(轻度S1:2.5 g·kg-1;中度S2:5.0 g·kg-1;重度S3:7.5 g·kg-1),研究了施氮对盐环境下甜菜生长发育与氮素吸收利用状况的影响。结果表明:(1) 在实验的三种盐度条件下,在N1(0.3 g·kg-1)~N4(2.4 g·kg-1)的范围内施氮可显著缓解盐胁迫对甜菜造成的伤害或显著增强其在盐胁迫下的生存能力,甜菜在轻度与中度盐胁迫下的最佳施氮量均为N3(1.2 g·kg-1),在重度盐胁迫下的最佳施氮量为N2(0.6 g·kg-1);(2) 在轻、中、重三种盐度下,随着施氮水平(0~2.4 g·kg-1)的提高,甜菜叶片渗透势随之降低,渗透调节能力呈增强趋势;(3) 在各盐度环境下,施氮均可促进甜菜叶片(同化枝)光合色素的合成,增加光合色素含量,从而提高光合效率,同时增强其对盐渍环境的适应能力;(4)在三种盐度下,随着施氮量的增加甜菜氮素生产力与氮肥农学利用效率均呈现出下降的趋势,在N1(0.3 g·kg-1)~N3(1.2 g·kg-1)水平下表现为大幅度下降,并且氮素生产力与氮肥农学利用效率均随着盐度的增加而下降;(5) 在三个盐度环境下,甜菜块根、叶柄、叶的含氮量均随着施氮量(0~2.4 g·kg-1)的增加而升高,且同一施氮水平下甜菜各部位含氮量总体表现为:叶>叶柄>块根;(6) 在轻、中、重三种盐度胁迫下的最高施氮限量分别为1.39、1.33 g·kg-1和1.24 g·kg-1(其最高干物质产量分别为90.09、72.86 g·pot-1和32.47 g·pot-1)。
甜菜;盐胁迫;施氮量;氮素利用率;生长发育;渗透势
据联合国教科文组织和联合国粮食及农业组织的不完全统计,世界盐渍土面积为9.5438×108hm2[1],且盐碱地在全球以每年1.0×106~1.5×106hm2的速度不断增长[2]。中国是世界上盐渍化危害最严重的国家之一,盐渍土主要集中分布于我国西北、华北、东北及沿海地区,总面积约有3 600×104hm2,占全国可利用土地面积的4.88%。我国耕地中盐渍化面积达到920.9×104hm2,占全国耕地面积的6.62%,尤其是西北地区的甘肃、宁夏、新疆等地的耕地盐渍化危害尤为严重[3-4]。盐渍土壤普遍特征是植被覆盖度差、土壤有机质含量低、土壤呈碱性、氮素供应缺乏[5-6],盐渍化土壤主要通过渗透胁迫和离子毒害对植物生长产生危害[7],以及抑制固氮菌和根瘤菌等有益微生物活动,有研究表明当土壤pH值超过8.5时,就会使土壤中许多有效养分变为不能被植物吸收利用的形态[8]。由于盐渍土地的改良利用存在着顽固性、反复性、复杂性和脱盐的不确定性等因素,目前能够有效利用的盐渍土壤资源仍然很少[8-9]。据统计,我国尚有80%左右的盐渍土地资源未得到有效地开发利用[10]。
甜菜(Betavulgaris. L)是双子叶藜科植物,是具有重要经济价值的糖料作物之一,主要在我国西北、东北和华北等干旱和半干旱地区种植,因其抗盐能力较强而成为盐碱地开发利用时重要的轮作作物之一[11]。从目前的文献资料中只能了解到氮素可能是盐碱地区影响植物生长的主要因素之一,或者盐碱地区植物生长的主要限制因子之一可能是盐碱土地本身氮素营养的缺乏[12-15],以及甜菜在氯化钠胁迫下耐盐生理指标的部分研究成果,对于利用施加氮素对甜菜在不同盐度下生长发育情况影响的量化指标还未见报道。因此,为能更好地指导农业生产实际,有必要在前期研究基础上,研究探索不同盐度下的施氮量对甜菜生长发育及氮素吸收特性的影响,旨在进一步探明甜菜在盐渍土壤中生长发育对氮素的需求规律,明确盐碱胁迫对氮代谢和氮素的吸收利用效率影响,为进一步提高甜菜在盐碱地上的生长能力、块根产量和含糖率,扩大盐碱地的开发利用效率提供更多基础数据参考[16]。
1 材料与方法
1.1 材料
试验用沙土采自新疆古尔班通古特沙漠腹地,古尔班通古特沙漠地表沙粒集中值为在50~250 μm的细沙,实验用沙在装盆前均用去离子水反复淋洗过,含氮量为零。供试甜菜品种为“KWS2409”(新疆康地种业提供)。
1.2 方法
试验采用砂培盆栽方法,塑料盆高26.8 cm,口内径25.0 cm,底内径19.5 cm,底部有6个小孔以保证通气性,每盆装风干沙12 kg。试验过程中除氮素营养外,其它养分由缺氮的Hoagland营养液及Arnon微量元素配方供应[17]。选择大小一致、饱满的甜菜种子,播种于准备好的各组盆中,每盆播20粒种子,在人工温室中培养至高7 cm左右时定苗2株。待长高至15 cm左右时(播种后40 d)正式进行处理。处理时盐与氮分5次随水施入盆中,分别在苗期与成熟期进行采样及各项指标的测定。
试验设2个因子:氮素以硝酸铵(NH4NO3,含氮35%)形式加入,根据中国不同地区土壤全氮平均含量(0.6~2.6 g·kg-1)和一般田间施氮量(164 kg·hm-2)[18],本实验以每千克沙子中加入纯N计,设6个水平,即不施氮(N0)、施氮0.3 g·kg-1(N1)、0.6 g·kg-1(N2)、1.2 g·kg-1(N3)、2.4 g·kg-1(N4);盐度以加入NaCl形式调节,根据《新疆灌区土壤盐渍化及改良治理模式》设3个水平,即轻度盐(含NaCl 2.5 g·kg-1,S1)、中度盐(含NaCl 5.0 g·kg-1,S2)、重度盐(含NaCl 7.5 g·kg-1,S3)[8]。总共5×3个处理,每处理重复4次。
1.3 指标测定及分析
1.3.1 生长指标 首先将甜菜植株小心从盆钵中取出,用米尺测量株高。再将根部用去离子水冲洗干净,分别称量其根部与地上部分的质量(即鲜重),然后在105℃下杀青15 min,再在75℃下烘干至恒定后分别称取根部与地上部分的质量(即干重)。
1.3.2 叶片渗透势 取同化枝,用潮湿纱布轻轻擦去表面灰尘,放入洁净的塑料袋中,立即于-30℃下静置3 h以上,以杀死植物细胞。从冰箱中取出材料,融冰后,用剪刀剪碎,放入注射器内,将细胞液压出,置入容积为1 mL的测定管内,塞好,用冰点渗透仪(Osmomat030,Gonotec,德国)测定渗透势,计算公式如下:
ψs=-iCRT
(1)
式中,ψs为溶液的渗透势(MPa);R为气体常数(0.008314 J·mol-1·K-1);T为开氏温度(273+t℃,t为测定时环境温度);C为溶液的质量摩尔深度(mol·kg-1);i为溶液电解质的等渗系数[19]。
1.3.3 光合色素含量 叶绿素和类胡萝卜素含量的测定:称取新鲜的同化枝0.1 g剪碎置于盛有10 mL丙酮∶乙醇等体积混合提取液的试管中,加塞置于黑暗处,于室温(10℃~30℃)下浸提12~24 h,待叶片完全变白后,测定663、645、470 nm处的光密度(OD值),据此计算光合色素的含量[19-20]。
1.3.4 植株含氮量测定及氮素利用率计算 采集待测甜菜样本,将其在75℃下进行烘干,再将植物样品磨碎,用硫酸-高氯酸消煮法对磨碎的样品进行消化,采用半微量凯氏定氮法测定样品全氮量[21]。
用施氮植物干物质产量与施氮量的比值表示氮素生产力;氮肥农学利用率为(施氮植物干物质产量-未施氮干物质产量)/施氮量;氮吸收量为每株植物生物量与植株中氮浓度的乘积;氮素吸收效率为(施氮时植物的氮吸收量-未施氮时植物的氮吸收量)/施氮量。
1.4 数据处理
试验中所获得每处理4个重复的数据均采用SPSS统计软件进行方差分析和显著性检验(Duncan法,α=0.05),图形均采用Origin软件绘制。数据结果以“平均值±标准差”表示。
2 结果与讨论
2.1 不同盐度施氮水平下氮素调控对甜菜生长发育的影响
2.1.1 甜菜地上部及块根干重的变化 在轻、中、重三个盐度环境下,与N0相比N1、N2、N3、N4施氮处理均显著地促进了甜菜地上部干重的增加(如图1a所示)。轻度盐S1与中度盐S2环境下,N0~N3施氮范围内,甜菜地上部干重随施氮量的增加而增加,与N0相比,此时施氮使地上部干重最大分别可达到对照的19.20倍、14.34倍,当施氮量超过N3(1.2 g·kg-1)时地上部干重开始减少,S3盐度环境下,N0~N2施氮范围内,甜菜地上部干重随施氮量的增加而增加,与N0相比,此时施氮使地上部干重最大可达到对照组的10.22倍,当施氮量超过N2时地上部干重开始减少;不同盐度环境、同一施氮水平下甜菜地上部干重还与盐度有一定关系,在N1、N2、N3及N4处理下,甜菜在S1、S2、S3三个盐度环境下的地上部干重均表现为S1>S2>S3。
在轻、中、重三个盐度环境下,施氮对甜菜块根干重也产生显著影响(如图1b所示)。轻度盐S1与中度盐S2盐度环境下,N0~N2施氮范围内,甜菜块根干重随施氮量的增加而增加,与N0相比,此时施氮使块根干重最大分别可达到对照的14.36倍、7.38倍,当施氮量超过N2时块根干重开始减少,重度盐S3盐度环境下,N0~N1施氮范围内,甜菜块根干重随施氮量的增加而增加,与N0相比,此时施氮块根干重最大可达到对照组的6.25倍,当施氮量超过N1时块根干重开始减少;S1、S2、S3三个盐度环境下,同一施氮水平下甜菜块根干重均表现为S1>S2>S3。
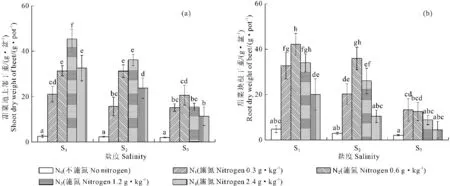
图1 不同盐度施氮水平下甜菜地上部及块根干重的变化
2.1.2 叶片渗透势及渗透调节能力的变化 如图2a所示,在轻、中、重三个盐度环境条件下,N0~N4的施氮范围内随着施氮量的增加甜菜叶片渗透势变化相似,均呈现出下降趋势,在同一施氮水平下,随着盐度的增加叶片渗透势表现出S1>S2>S3,而且这种趋势在高氮条件下表现得更加明显;在S1、S2、S3三个盐度处理条件下,随着施氮量的增加甜菜叶片渗透调节能力均呈现出显著增加趋势,而在同一施氮水平下,随着盐度的增加叶片渗透调节能力并无显著性差异(如图2b所示)。
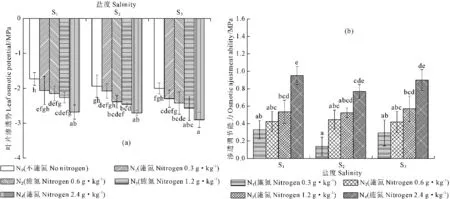
图2 不同盐度施氮水平下甜菜叶片渗透势及渗透调节能力的变化
2.1.3 光合色素的变化 在S1、S2、S3三个盐度处理条件下,各施氮水平均显著增加了甜菜功能叶叶绿素、类胡萝卜素含量及叶绿素a/叶绿素b值,且在N0~N3范围内,叶绿素与类胡萝卜素含量随施氮水平的增加而表现出显著上升,但施氮量超过1.2 g·kg-1后,即使氮素水平成倍增加至2.4 g·kg-1,对叶绿素和类胡萝卜素的影响仍然不显著,甚至在轻度和中度盐环境下叶绿素a/叶绿素b值下降了(如表1所示);同一施氮水平下,随着盐度的增加各光合色素指标表现为S3>S2>S1(表1)。在轻度盐S1条件下,各施氮处理叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量及叶绿素a/叶绿素b值与不施氮相比,最大分别可以达到不施氮时的2.20倍、1.68倍、2.07倍、2.10倍及0.19倍;S2盐环境下,各光合色素指标与不施氮时相比,分别可以达到不施氮时的2.13倍、1.27倍、1.85倍、1.97倍及0.33倍;S3盐环境下,各光合色素指标与不施氮时相比,分别可以达到不施氮时的2.09倍、1.63倍、1.85倍、1.71倍及0.19倍。
2.2 不同盐度施氮水平下氮素调控对甜菜氮素吸收利用的影响
2.2.1 甜菜干物质产量与施氮量的关系 由图3可知,在轻度盐S1、中度盐S2及重度盐S3三个盐度环境下,随施氮量的增加甜菜干物质产量表现出相似的变化趋势,均随施氮量的增加呈现出先升高后下降的趋势,在0~2.4 g·kg-1的施氮范围内,随着盐度的增加干物质产量表现为S1>S2>S3,而且不同盐度环境下施氮所能达到的最高干物质产量及最高施氮限量也不同,分别为S1(最高干物质产量90.09 g·pot-1,最高施氮限量1.39 g·kg-1)、S2(72.86 g·pot-1,1.33 g·kg-1)、S3(32.47 g·pot-1,1.24 g·kg-1)。
2.2.2 甜菜各部位含氮量的变化 由图4可知,S1、S2、S3三个盐度处理条件下,同一施氮水平甜菜各部位含氮量总体表现为叶>叶柄>块根,在N0~N4(2.4 g·kg-1)的施氮范围内,随着施氮量的增加块根、叶柄及叶含氮量均呈现出增加趋势。轻度盐S1与中度盐S2盐度环境下,叶含氮量在整个施氮范围内随施氮量的增加呈现出大幅度上升趋势,与N0相比叶含氮量最高分别可以达到对照的3.97倍、3.62倍,而块根与叶柄含氮量在N0~N3(1.2 g·kg-1)的施氮范围内随施氮量的增加上升幅度较大,当施氮量超过N3(1.2 g·kg-1)时呈现出缓慢增加趋势,块根最高含氮量分别可以达到对照的2.75倍、3.08倍,叶柄含氮量最高分别可以达到对照的3.29倍、3.31倍;在重度盐S3盐度环境下,叶含氮量在N0~N3的施氮范围内随施氮量的增加上升幅度较大,当施氮量超过N3时增加缓慢,此时叶含氮量最大可以达到对照的3.46倍,块根与叶柄含氮量在N0~N2的施氮范围内随施氮量的增加上升幅度较大,当施氮量超过N2时增加较为缓慢,最高含氮量分别可以达到对照的3.60倍、2.75倍。
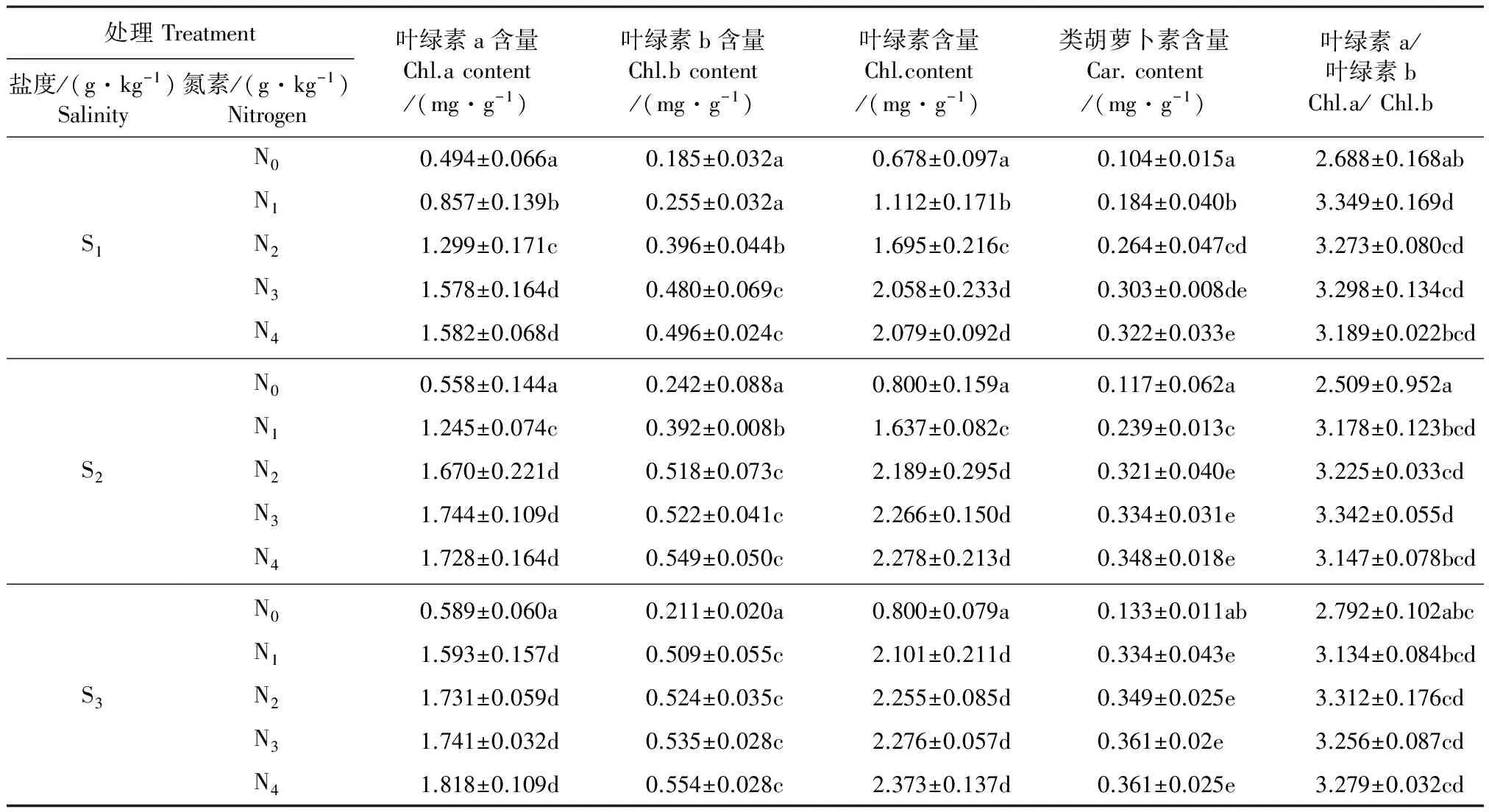
表1 不同施氮水平对盐环境下甜菜叶片光合色素含量的影响

图3 不同盐度施氮水平下甜菜干物质产量的变化
2.2.3 吸氮量及氮素吸收效率的变化 由表2可知,在S1、S2、S3三个盐度环境下,施氮均显著增加了甜菜块根、叶柄、叶及植株的吸氮量,具体来看,轻度盐S1与中度盐S2盐度环境下,N0~N3施氮范围内,块根、叶柄、叶及植株的吸氮量均随施氮量的增加而显著增加,最大分别可达到对照的35.95倍、63.63倍、55.28倍、49.50倍与14.06倍、41.80倍、37.20倍、26.86倍,而当施氮量超过N3时各部位吸氮量开始下降;在重度盐S3盐度环境下,甜菜块根、叶柄、叶及植株的吸氮量在N0~N2的施氮范围内均随施氮量的增加而增加,最大分别可达到对照的14.57倍、24.25倍、28.78倍及23.04倍,而当施氮量超过N2时各部位含氮量开始下降;从表2还可看出,轻度盐S1与中度盐S2盐度环境下,甜菜植株氮素吸收效率均在N2处理下达到最大,而重度盐S3盐度环境下,氮素吸收效率则在N1处理下达到最大。
2.2.4 甜菜氮素生产力及氮肥农学利用效率的变化 由图5可知,S1、S2及S3三个盐度处理条件下,随着施氮量的增加甜菜氮素生产力与氮肥农学利用效率均呈现出下降的趋势,在N1~N3水平下表现为大幅度下降,并且随着盐度的增加氮素生产力与氮肥农学利用效率均表现为S1>S2>S3,而在N3~N4水平下二者呈现出缓慢下降趋势,并且随着盐度的增加氮素生产力与氮肥农学利用也呈现出S1>S2>S3。

图4 不同盐度施氮水平下甜菜各部位含氮量的变化

表2 不同盐度施氮水平下甜菜吸氮量及氮素吸收效率的变化
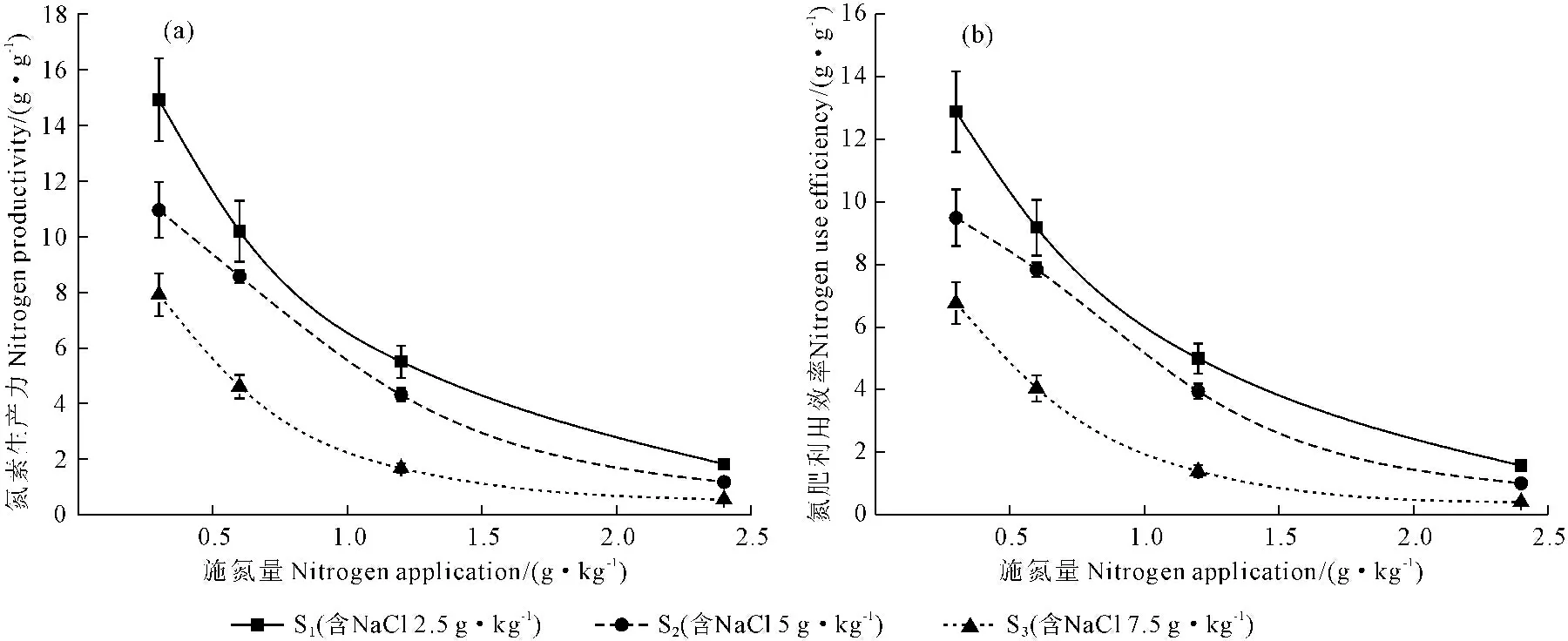
图5 不同盐度施氮水平下甜菜氮素生产力及氮肥农学利用率的变化
3 结论与讨论
氮素是植物体内蛋白质、核酸、磷脂和某些生长激素的重要组成部分,是植物生长发育所需最重要的大量元素之一,其对作物最终产量的贡献为40%~50%[22-24]。有研究指出,增加施氮量虽有助于甜菜干物质量的积累,但过量施加氮肥则对甜菜的含糖率有负面影响[25]。本研究结果表明,在轻度和中度盐胁迫下,当施氮量为0.6 g·kg-1时,甜菜的根冠比达到最大;在重度盐胁迫中,甜菜的根冠比则在施氮量为0.3 g·kg-1水平下达最大。
试验结果中,在轻、中、重三种盐度下,随着施氮水平的提高,叶片渗透势随之降低,叶片的失水状况缓解,即甜菜渗透调节能力呈增强趋势。这充分证明了在盐碱地区施加氮肥有利于提高甜菜对盐胁迫的抵抗能力,施氮可显著提高甜菜的渗透调节能力与耐盐能力。在三个盐度环境下随着施氮量的增加供试甜菜叶片渗透势呈现出下降趋势,这可能是因为施加氮素可促进脯氨酸、可溶性糖、硝酸根离子和钠离子等渗透调节物质的吸收积累,同时限制吸收有毒离子或促使有毒离子外排,从而显著提高耐盐植物的渗透调节能力与耐盐能力[26-28]。而且在高盐高氮的环境下下降幅度明显增大,同时渗透调节能力随施氮量的增加而明显增强,这可能是因为施氮促进了甜菜同化枝或叶片细胞内渗透调节物质的累积,从而增强渗透调节能力,或者高盐高氮的环境下导致细胞失水,细胞内溶质浓度增大,从而使叶片细胞渗透势显著下降。适量的施加氮肥可以提高甜菜的叶绿素含量、光合速率、蒸腾速率和气孔导度,以及提高单位叶面积的RuBP羧化酶的活性等,这些都会使叶片的光合能力和植物体的生理机能增强,从而提高农作物的抗盐能力[29-31]。本试验结果表明,在轻、中、重三种盐度下,各施氮处理下叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量及叶绿素a /叶绿素b值均随着施氮水平的提高而升高,尤其是施氮量在0~1.2 g·kg-1范围内时,叶绿素和类胡萝卜素等指标值上升尤为显著,超过1.2 g·kg-1后指标值增量则不显著。
氮素对作物形态建成、生长发育、产量和品质等起到了至关重要的作用[32-34],所以最佳施氮量的研究对指导农业生产实际有着十分重要的意义。本实验研究结果表明,在轻、中、重三种盐度下,随着施氮量的增加甜菜氮素生产力与氮肥农学利用效率均呈现出下降的趋势,在N1~N3水平下表现为大幅度下降,并且随着盐度的增加氮素生产力与氮肥农学利用效率均表现为S1>S2>S3;在三个盐度处理条件下,随着施氮量(0~2.4 g·kg-1)的增加,甜菜块根、叶柄、叶及植株的含氮量均呈现出增加趋势,且同一施氮水平下甜菜各部位含氮量总体表现为:叶>叶柄>块根;在轻度盐环境下的最高施氮限量1.39 g·kg-1(最高干物质产量为90.09 g·pot-1),中度盐环境下的最高施氮限量1.33 g·kg-1(最高干物质产量72.86 g·pot-1),重度盐胁迫环境下的最高施氮限量1.24 g·kg-1(最高干物质产量32.47 g·pot-1)。另外,氮肥的施用量对甜菜的含糖率也有重要影响[35],所以对于盐胁迫环境下,保证甜菜产量和质量的最佳氮肥施用量还需要进一步的实验研究。
[1] 赵可夫,李法曾,张福锁.中国盐生植物[M].第二版.北京:科学出版社,2013.
[2] Kovda V A. Loss of productive land due to salinization[J]. AMBIO-A Journal of the Human Environment, 1983,12(2):91-93.
[3] 王遵亲.中国盐渍土[M].北京:科学出版社,1993:400-515.
[4] 杨劲松.中国盐渍土研究的发展历程与展望[J].土壤学报,2008,45(5):837-845.
[5] Loveland D G, Ungar I A. The effect of nitrogen fertilization on the production of halophytes in an inland salt marsh[J]. American Midland Naturalist, 1983,109(2):346-354.
[6] 吕真真,刘广明,杨劲松,等.黄河三角洲滨海盐渍土区土壤质量综合评价[J].干旱地区农业研究,2015,33(6):93-97.
[7] Mokded Rabhi, Siwar Ferchichi, Jihène Jouini, et al. Phytodesalination of a salt-affected soil with the halophyteSesuviumportulacastrumL. to arrange in advance the requirements for the successful growth of a glycophytic crop[J]. Bioresource Technology, 2010,101(17):6822-6828.
[8] 乔 木,田长彦,王新平.新疆灌区土壤盐渍化及改良治理模式[M].乌鲁木齐:新疆科学技术出版社,2008.
[9] 杨 真,王宝山.中国盐渍土资源现状及改良利用对策[J].山东农业科学,2015,47(4):125-130.
[10] 俞仁培,陈德明.我国盐渍土资源及其开发利用[J].土壤通报,1999,30(4):158-159.
[11] 陈业婷,李彩凤,赵丽影,等.甜菜耐盐性筛选及其幼苗对盐胁迫的响应[J].植物生理学通讯,2010,46(11):1121-1128.
[12] Wang D, Guo J R, Liu X J, et al. Effects of cultivation strategies on hybrid pennisetum yield in saline soil[J]. Crop Science, 2014,54(6):2772-2781.
[13] Govin J D, Zedler J B. Nitrogen effects onSpartinafolilsaandSalicorniavirainicain the salt marsh at Tijuana estuary, California[J]. Wetlands, 1988,8(8):51-65.
[14] Smart R M, Barko J W. Nitrogen nutrition and salinity tolerance of Distichlis spicata andSpartinaalterniflora[J]. Ecology, 1980,61(3):630-638.
[15] Drake D R, Ungar I A. Effects of salinity, nitrogen, and population density on the survival, growth, and reproduction ofAtriplextriangularis(chenopodiaceae)[J]. American Journal of Botany, 1989,76(8):1125-1135.
[16] Stocking M A. Tropical soils and food security: the next 50 years[J]. Science, 2003,302(5649):1356-1359.
[17] 尹海龙,田长彦,任 婧,等.土壤氮、盐浓度对盐角草(Salicornia Europaea)生长发育及氮素吸收的影响[J].中国沙漠,2014,34(5):1277-1284.
[18] 王界平,田长彦.氮肥对盐角草生长及矿质灰分累积的影响[J].干旱地区农业研究,2011,29(1):102-107.
[19] 郝建军,康宗利,于 洋.植物生理学实验技术[M].北京:化学化工出版社,2006.
[20] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2005.
[21] 董 鸣,王义凤,孔繁志.陆地生物群落调查观测与分析[M].北京:中国标准出版社,1996.
[22] Camargo F A O, Gianello C, Tedesco M J. Soil nitrogen availability evaluated by kinetic mineralization parameters[J]. Communications in Soil Science and Plant Analysis, 2004,35(9):1293-1307.
[23] 李文军,夏永秋,杨晓云,等.施氮和肥料添加剂对水稻产量、氮素吸收转运及利用的影响[J].应用生态学报,2011,22(9):2331-2336.
[24] 陆景陵,胡霭堂.植物营养学[M].北京:高等教育出版社,2006.
[25] 高妙真,蔡伯岩,曲文章.氮素水平对甜菜干物质积累分配和产糖量的影响[J].中国甜菜糖业,1999,25(5):5-9.
[26] 段德玉,刘小京,李存桢,等.N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J].草业学报,2005,14(1):63-68.
[27] 宁建凤,郑青松,刘兆普,等.外源氮对NaCl胁迫下库拉索芦荟生理特性的影响[J].植物营养与肥料学报,2009,14(4):728-733.
[28] 李彩凤,马凤鸣,赵 越,等.氮素形态对甜菜氮糖代谢关键酶活性及相关产物的影响[J].作物学报,2003,29(1):128-132.
[29] 越 鹏,李彩凤,陈业婷,等.氮素水平对甜菜功能叶片光合特性的影响[J].核农学报,2010,24(5):1080-1085.
[30] Siddiqui M H, Mohammad F, Khan M N, et al. Nitrogen in relation to photosynthetic capacity and accumulation of osmoprotectant and nutrients in brassica genotypes grown under salt stress[J]. Agricultural Sciences in China, 2010,9(5):671-680.
[31] 原俊凤,田长彦,冯 固,等.硝态氮对盐胁迫下囊果碱蓬幼苗根系生长和耐盐性的影响[J].植物营养与肥料学报,2009,15(4):953-959.
[32] Skeffingeon M J S, Jeffrey D W. Response ofArmeriamaritima(Mill.)Willd. andPlantagomaritimaL. from an Irish salt marsh to nitrogen and salinity[J]. New Phytologist, 1988,110(3):399-408.
[33] Kudo N, Fujiyama H. Responses of halophyteSalicorniabigeloviito different forms of nitrogen source[J]. Pedosphere, 2010,20(3):311-317.
[34] 董桂春,陈 琛,袁秋梅,等.氮肥处理对氮素高效吸收水稻根系性状及氮肥利用率的影响[J].生态学报,2016,36(3):642-651.
[35] 王玉波,马凤鸣,王庆祥.施肥量对甜菜产量和质量的影响[J].作物杂志,2011,(4):78-81.
Growthofsugarbeetanditsnitrogenuptakeandutilizationinfluencedbynitrogenlevelunderdifferentsalinity
WEI Xian-zhen1, ZHAO Bin1,2, WU Xiao-yan1,2, SONG Yun-tao1
(1.TianjinRecyclableResourcesInstitute,ChinaCO-OP,Tianjin300191,China; 2.TianjinResourcesRecyclingTechnologyofElectronicWasteEngineeringCenter,Tianjin300191,China)
In a pot experiment, sodium chloride was used to imitate three salinity level: mild(S1), medium (S2) and serious(S3) to investigate the effect of nitrogen fertilization on the growth and development, nitrogen uptake and utilization in sugar beet in salt environment. The main results were shown as follows: (1) Nitrogen application (0.3~2.4 g·kg-1) can significantly alleviate the damage caused by salt stress to sugar beet and enhance its ability to survive under salt stress. In mild(S1) and medium(S2) salt concentration, the optimum nitrogen application of sugar beet was 1.2 g·kg-1. In high (S3) salt concentration, the optimum nitrogen application was 0.6 g·kg-1. (2) The osmotic potential of sugar beet leaves decreased with nitrogen application increasing (0~2.4 g·kg-1) in three concentration of NaCl and osmotic adjustment ability showed an trend of increase. (3) Nitrogen application could promote the synthesis of photosynthetic pigments in beet assimilation branches under different salinity, resulting in a high photosynthetic efficiency. (4) Both nitrogen productivity and agronomic nitrogen use efficiency showed a descending trend with nitrogen application increasing in three concentration of NaCl. They dropped dramatically when nitrogen application was 0.3~1.2 g·kg-1. Both nitrogen productivity and nitrogen agronomic efficiency ranked as S1~S2~S3in the same nitrogen level. (5) Nitrogen content in tuber, petiole and leaf of sugar beet increased with nitrogen application increasing (0~2.4 g·kg-1) in three concentration of NaCl. Nitrogen content generally appeared as leaf>petiole>tuber in the same nitrogen level. (6) The upper limit of nitrogen application was 1.39, 1.33 g·kg-1and 1.24 g·kg-1in the S1, S2and S3salinity, and for each of them, the highest yield of sugar beet of 90.09, 72.86 g·pot-1and 32.47 g·pot-1respectively, was harvested.
sugar beet; salt stress; nitrogen fertilizer application level; nitrogen use efficiency; growth and development; osmotic potential
1000-7601(2017)03-0204-08doi:10.7606/j.issn.1000-7601.2017.03.32
2016-04-27
:2017-03-10
:国家星火计划项目(2015GA184003)
魏显珍(1987—),女,内蒙古赤峰人,硕士,主要从事环境污染的生物修复及生态环境修复领域相关的研究。 E-mail: xianzhenwei@163.com。
赵 斌(1981—),男,天津人,助理研究员,主要从事农业废弃物处理等领域相关的研究。 E-mail: rrtjrd@163.com。
S143.1; S566.3
: A

