红肉桃两类花色素苷积累模式与相关基因表达差异
丁体玉,曹珂,方伟超,朱更瑞,陈昌文,王新卫,王力荣
红肉桃两类花色素苷积累模式与相关基因表达差异
丁体玉,曹珂,方伟超,朱更瑞,陈昌文,王新卫,王力荣
(中国农业科学院郑州果树研究所,郑州 450009)
【目的】分析中国主要红肉桃种质呈色类型及分子机理,为红肉桃种质优异基因发掘和分子标记辅助选择育种奠定理论基础。【方法】选择8份红肉桃种质和1份白肉桃种质为试材,分别在花后一个月开始采集样品,以后每隔10 d左右采集一次,至果实成熟期为止;用2%甲酸甲醇提取不同种质果肉的花色素苷,分别测定其在510 nm和700 nm的吸光值;利用实时荧光定量PCR(qRT-PCR)方法,测定与花色素苷合成相关的13个关键结构基因和调节基因的表达水平。【结果】根据果实发育中后期花色素苷含量的变化趋势可将8份红肉桃种质分为2类,一类种质的花色素苷合成高峰出现在果实成熟期(成熟期积累型),如‘郑引82-9’‘大红袍’‘黑布袋’‘红桃’和‘天津水蜜’;另一类种质的花色素苷合成高峰出现在果实发育中期,在成熟期花色素苷含量有所下降(发育中期积累型),如‘哈露红’‘大果黑桃’和‘乌黑鸡肉桃’。在与花色素苷合成相关的结构基因中,和的表达量与成熟期积累型种质的花色素苷含量的变化趋势一致;而发育中期积累型种质,果肉中花色素苷的大量积累与所有结构基因的表达趋势一致。在4个调控基因中,只有的表达水平较高,且表达模式同红肉桃种质两类花色素苷积累模式相似。【结论】根据桃果肉着色规律和花色素苷积累模式,8份红肉桃可以分为成熟期积累型和发育中期积累型种质。和是成熟期积累型种质的关键结构基因,而在供试的所有红肉桃种质花色素苷合成中起关键作用。
红肉桃;花色素苷;花色素苷合成相关基因
0 引言
【研究意义】花色素苷是植物体内的一类次生代谢物质,不仅能够帮助植物自身免受紫外线灼伤和抵御病虫害,还可以吸引昆虫为其授粉。同时,食用富含花色素苷物质的果实对人体健康也有保护和促进作用[1-2],大量的体外研究表明,花色素苷通过其较强的自由基清除作用,而表现出抗炎[3]、保护心血管[4]、抗肿瘤[5]等多种生物活性。红肉桃是桃中富含花色素苷的一种重要类型,其花色素苷含量远高于白肉桃和黄肉桃[6]。Cevallos-Casals等[7]研究发现,红肉桃种质的抗氧化能力与花色素苷含量的相关性达到显著水平。沈志军等[8]通过相关性分析发现,抗氧化能力指标(relative antiradical capacity,RAC;ferric reducing ability of plasma,FRAP)在果皮、果肉和全果中与花色素苷含量的相关性均达到显著水平。因此,随着消费者对果品类型多样化和保健功能关注度的不断增强,富含花色素苷的红肉桃逐渐成为当前国内外功能性水果开发研究的热点[9-10]。【前人研究进展】人们普遍认为红肉桃的果实在成熟期时才大量积累红色素[11-13]。但CHAPARRO等[14]和WERNER等[15]在研究加拿大红肉种质‘Harrow Blood’时发现其果实花色素苷是在花后45—50 d开始积累,而成熟前有所下降。SHEN等[16]研究了中国红肉品种‘WuYueXian’,认为‘WuYueXian’的红肉性状确实不同于‘Harrow Blood’等资源,其花色素苷含量在果实成熟前迅速增加。ZHOU[17]等研究红肉品种‘大红袍’时,同样得出花色素苷是在成熟前10 d开始积累,成熟时达到最大。花色素苷的生物合成是植物类黄酮合成途径的一个重要分支,在拟南芥、矮牵牛、玉米等模式植物中该合成通路已研究的较为清楚。对于该过程中调节结构基因的关键酶,研究者[18-19]认为苯丙氨酸解氨酶(PAL)只是催化合成花色素苷的前提物质,当前体物质充足时,花色素苷的积累将不随PAL活性的变化而变化。LISTER等[20]报道则指出苯基苯乙烯酮黄烷酮异构酶(CHI)活性的上升与苹果果皮中花色素苷含量的增加相一致,然而也有学者认为CHI在着色初期保持高活性,催化生成黄烷酮,在为花色素苷合成提供足够的底物后,其活性逐渐下降,并没有随花色素苷的积累而保持在较高水平[21]。部分学者[22-23]的研究表明,只是在果实接近成熟的转色期表达,表达的强度与花色素苷合成呈正相关,且该基因只在红色果皮中特异表达,在根、芽、种子等部位不表达[24],以上研究结果说明是苹果果皮红色的关键基因之一。除了结构基因外,也有研究表明植物器官的红色发育及花色素苷代谢与MYB转录因子有关,苹果方面的研究[25]认为MYB10转录因子通过调控和的转录进而调控花色素苷的合成,而且MYB10具有与bHLH互作的结构功能域,两者形成转录蛋白复合体共同调控花色素苷的代谢[26]。因此,花色素苷合成的调控通路是十分复杂的,不同植株甚至是果实的不同发育阶段、不同组织部位,其调控花色素苷合成的能力存在差异。【本研究切入点】目前关于红肉桃种质的花色素苷积累模式的研究主要集中在‘Harrrow Blood’[15]和‘WuYueXian’[16]两个红肉桃品种,对中国其他的红肉桃资源[27-30]研究较少。【拟解决的关键问题】利用pH示差法和qRT-PCR技术分别检测中国红肉桃发育过程中花色素苷积累动态和相关基因的表达变化,明确中国红肉桃种质资源花色素苷的积累类型,并从花色素苷积累与合成相关基因的表达层面解析不同类型的调控模式,为红肉桃基因发掘和新品种培育提供参考。
1 材料与方法
试验于2016年在中国农业科学院郑州果树研究所进行。
1.1 试材及其取样
以中国农业科学院郑州果树研究所国家果树种质资源郑州桃圃的8份红肉桃和1份白肉桃作为试验材料(表1)。
选取树势一致的植株,于2016年4—8月期间,选择大小均匀、果形正常、无病虫害的果实,分别在盛花后一个月开始样品的采集,以后每隔10 d左右采集一次(果实转色时期密集采样)。每份种质随机采取5个果实,削去表皮,取中果皮果肉,液氮速冻,保存至-80℃冰箱备用。9份种质果实采样时期见表1。

表1 9份桃种质果实的采样时期
S1—S15代表桃果实采样时期(图1)
S1 to S15 represents the sampling dates (Fig. 1)
1.2 总花色素苷提取及测定
取冷冻保存的果肉样品加液氮并用冷冻研磨机研磨成均匀的粉末,然后取5 g研磨好的果肉粉末,分3次加入8 mL 2%甲酸甲醇,充分混匀后,超声仪提取20 min(常温,40 Hz,100 W),摇床振荡20 min(常温,250 r/min),离心8 min(常温,9 600 r/min),将上清液转到50 mL离心管内,重复提取3次,合并提取液,再次离心(常温,9 600 r/min),最后将所有上清液转到25 mL棕色容量瓶并用2%甲酸甲醇定容,待测。每个样品重复3次。
参照孙婧超等[31]的方法并加以改良,取1 mL上述提取液于两支10 mL试管中,分别加入9 mL 0.2 mol∙L-1KCl(pH 1.0)和0.2 mol∙L-1CH3CO2Na·3H2O(pH 4.5)缓冲液避光平衡20 min后,以2%甲酸甲醇为空白对照,分别于分光光度计510 nm和700 nm下在30 min内测定所有样品吸光度A。
稀释后样品吸光度ΔA按下式进行计算:
ΔA=(A510-A700) pH 1.0–(A510-A700) pH 4.5。
样品花色素苷含量按下式计算:
提取液花色素苷浓度W (mg∙L-1) = [(ΔA× MW) / (ε × 1)] × Df × 1000;
果肉样品花色素苷含量 (mg∙kg-1) = W × 25 / 5。
式中,MW:矢车菊素-3-葡萄糖苷的相对分子质量(449 mg∙mol-1);ε:矢车菊素-3-葡萄糖苷的摩尔消光系数(29 600 L·mol-1·cm-1);Df:稀释因子(样品总的稀释倍数)。
1.3 总RNA的提取及qRT- PCR检测
分别取若干样品,研磨成粉末状,用改良的CTAB法提取样品的总RNA,参照TaKaRa公司DNaseⅠ操作说明消化DNA,琼脂糖凝胶电泳检测其完整性,并用核酸蛋白仪检测RNA浓度和纯度。采用ReverTra qPCR RT(TOYOBO,上海)试剂盒进行反转录,用ddH2O稀释5倍,保存于 -20℃冰箱,备用。引物(表2)由苏州金唯智生物科技有限公司合成,qRT-PCR反应采用ABI公司的Power SYBR Green PCR Master Mix在ViiATM7 Real-time PCR System(Roche,China)上进行。反应体系20 μL,包括:10 μL的SYBR Green PCR Master Mix、2 μL稀释的cDNA、0.3 μL上游引物(10 μmoL∙L-1)、0.3 μL下游引物(10 μmoL∙L-1),ddH2O补至20 μL。每个样品3个重复,反应程序如下:95℃ 5 min;95℃ 15 s,60℃ 15 s,72℃ 15 s,40个循环。
1.4 统计分析
以2为内参基因[32],采用2-△△CT法[33]计算花色素苷合成酶基因的相对表达量[17,34],使用Excel 2010进行数据统计,并制作趋势图。利用R 3.3.1中的‘ggplot’软件绘制热图。

表2 荧光定量PCR所用基因的引物序列
PAL:苯丙氨酸解氨酶;CHS:查尔酮合成酶;CHI:苯基苯乙烯酮黄烷酮异构酶;F3H:黄烷酮-3-羟化酶;F3’H:类黄酮-3’-羟化酶;DFR:二氢黄酮醇-4-还原酶;LDOX:花色素合成酶;UFGT:UDP-葡萄糖类黄酮3-O-糖基转移酶;GST:谷胱甘肽-S-转移酶;:内参基因;:MYB家族转录因子;:bHLH家族转录因子;:WD40家族转录因子;:NAC家族转录因子
PAL: Phenylalanine ammonia lyase ; CHS:Chalcone synthase; CHI: Chalcone isomeras; F3H: Flavanone 3-hydroxylas; F3’H : Flavonoid 3’-hydroxylase; DFR: Dihydroflavonol-4-reductas; LDOX: Leucoanthocyanidin dioxygenase; UFGT: UDPG-flavonoid glucosyltransferase; GST: Glutathione-S-Transferase;: Reference gene;: MYB family transcription factors;: bHLH family transcription factor;: WD40 family transcription factor;: NAC family transcription factor
2 结果
2.1 桃种质果实发育期果肉颜色和总花色素苷含量
从图1可以看出,在整个发育阶段白肉桃‘郑白5-2’果肉颜色由青变白,至成熟时果实也未着色;而所有红肉桃果肉颜色都呈现由绿逐渐转红,但不同品种的转色期则存在差异,如‘郑引82-9’‘天津水蜜’‘红桃’‘大红袍’和‘黑布袋’在果实临近成熟时红色逐渐加深至成熟时达到最红,在着色部位上表现为果肉全红或近表皮果肉呈圈红。而‘大果黑桃’‘哈露红’和‘乌黑鸡肉桃’的果肉颜色在花后60—120 d(即硬核期)时逐渐变红至黑红色,随着果实成熟色泽又变浅,果肉的着色部位集中在中果皮和近表皮果肉上,而近核处果肉不着色。
由于桃果肉的红色主要决定于果实中花色素苷的含量[35],因此,本研究采用pH示差法测定了桃不同发育阶段果肉中花色素苷的含量,作为果肉颜色变化的参考。由图1可知,8份红肉桃种质的花色素苷在整个生育期有2个合成高峰,第1个高峰均开始于盛花期后,盛花后约30 d达最大值,第2个高峰则在不同的红肉桃种质中出现的时期不同。具体为:‘郑引82-9’‘天津水蜜’‘红桃’‘大红袍’和‘黑布袋’分别在其盛花后65 d、98 d、89 d、89 d和89 d花色素苷含量逐渐上升,至成熟时达到第2个合成高峰;‘大果黑桃’‘哈露红’和‘乌黑鸡肉桃’的果肉花色素苷分别在盛花后61 d、61 d和51 d开始升高,至盛花后79 d、89 d和72 d达到第2个合成高峰,之后,随着果实成熟其花色素苷含量有所下降。
综上所述,根据不同红肉桃花色素苷含量在第1个合成高峰后的趋势与果肉着红色的动态变化可以把红肉桃分为两类:一类是成熟期积累型,具体表现为在果实接近成熟时果肉开始着红色,至成熟时花色素苷含量达到最大;二是发育中期积累型,该类果实在盛花后约50 d开始着红色并不断加深,接近成熟时又变浅,花色素苷含量也呈下降的趋势。
2.2 桃种质果实发育期果肉花色素苷合成结构基因的表达分析
由图2可知,对照‘郑白5-2’的、、、、、和在果实发育前期表达量较高,这与其花后51 d前果实中较高的花色素苷含量是一致的(图1-a);在‘郑白5-2’的果实发育中期表达,而在整个果实发育期均不表达。对于成熟期积累型的5份种质来说,基因、、和在除‘天津水蜜’之外的4份种质的果实发育后期表达逐渐升高;而和只在‘郑引82-9’‘大红袍’和‘黑布袋’的果实发育后期有高的表达;仅有基因、和的表达模式与5份红肉桃种质的果实着色规律和花色素苷积累基本一致,即在果实成熟期表达量较高,是该类红肉桃种质花色素苷合成的关键结构基因。而在属于发育中期积累型的3份种质中,9个结构基因均在果实发育的中前期表达水平最高,随后呈下降趋势。
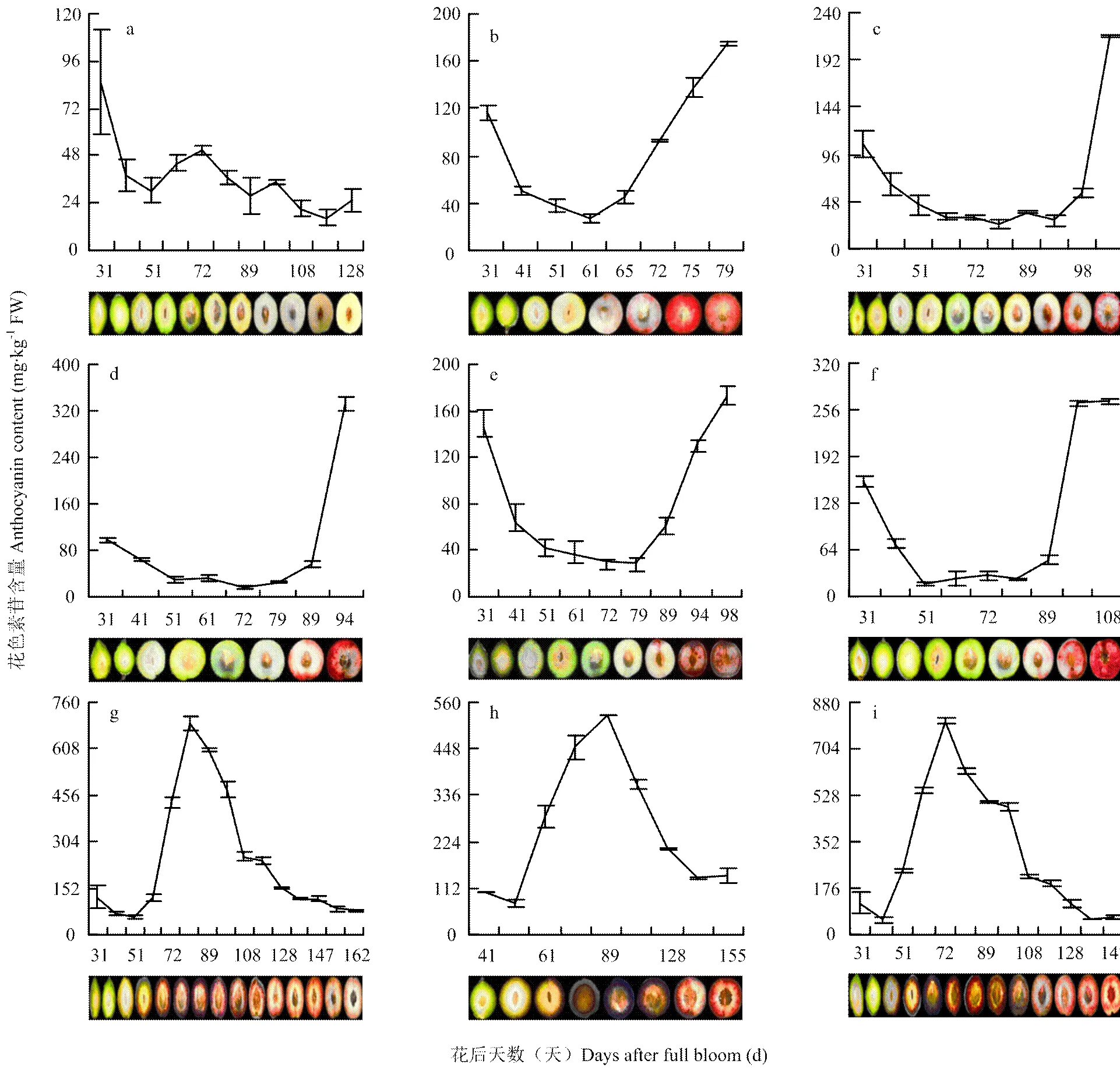
a:郑白5-2;b:郑引82-9;c:天津水蜜;d:红桃;e:大红袍;f:黑布袋;g:大果黑桃;h:哈露红;i:乌黑鸡肉桃 a: Zheng Bai 5-2; b: Zheng Yin 82-9; c: Tianjin Shui Mi; d: Hong Tao; e: Da Hong Pao; f: Hei Bu Dai; g: Da Guo Hei Tao; h: Harrow Blood; i: Wu Hei Ji Rou Tao. 误差用标准差表示 Earror bars show the SE of the mean
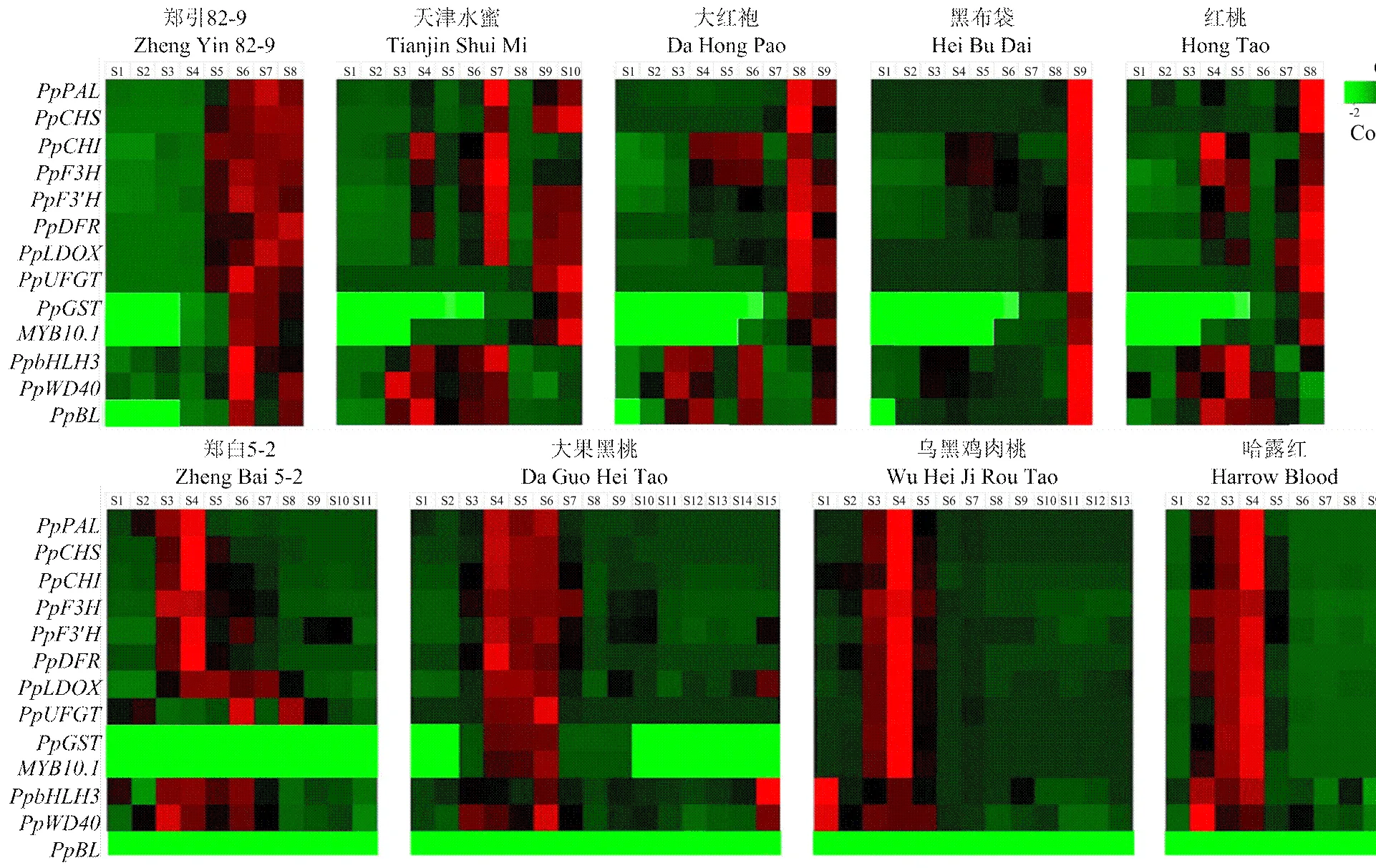
图2 两种红肉桃类型关键基因的相对表达量
2.3 桃种质果实发育期果肉花色素苷合成调节基因的表达分析
为鉴定不同红肉桃种质的花色素苷合成是否受到转录调节,选择在桃上已有报道的花色素苷合成调控转录因子[17]、[36]、[34]和[17],测定其在果实发育过程中的表达变化。由图2可知,在5份成熟期积累型红肉桃种质中,只有的表达与、和的表达趋势一致,而、和仅在‘天津水蜜’‘大红袍’和‘红桃’果实发育前期的某个时期有高表达,与关键结构基因的表达相关性不强。
在3份发育中期积累型种质中,同样只有与关键结构基因表达一致,而在‘大果黑桃’的后期、‘乌黑鸡肉桃’和‘哈露红’的前期表达量较高,在‘乌黑鸡肉桃’和‘哈露红’的果实发育前期同样高表达,在3份红肉桃种质果肉中均未检测到表达。
2.4 不同类型红肉桃花色素苷含量及其相关基因表达量的比较
为了比较不同红肉桃类型种质花色素苷和关键基因绝对含量的差异,如图3所示,选择‘天津水蜜’和‘大果黑桃’分别作为成熟时期积累型和发育中期积累型的代表品种,仍选择‘郑白5-2’为对照种质,其中S1—S3为3个品种的果实发育前期,S4—S6、S4—S10和S4—S7分别为‘天津水蜜’‘大果黑桃’和‘郑白5-2’的果实发育中期(硬核期),S7—S10、S11—S15和S8—S11分别为‘天津水蜜’‘大果黑桃’和‘郑白5-2’的果实发育后期。结果显示,中期积累型种质‘大果黑桃’在花色素苷合成达到峰值时的含量为690.76 mg·kg-1,而成熟期积累型种质‘天津水蜜’在果实发育后期花色素苷合成达到峰值时的含量为216.07 mg·kg-1,仅相当于‘大果黑桃’花色素苷峰值的1/3。在果实发育后期,虽然‘大果黑桃’花色素苷含量下降至79.40 mg·kg-1,低于同期的‘天津水蜜’,但仍高于白肉桃‘郑白5-2’。关键基因、和在中期积累型种质‘大果黑桃’花后61 d高表达,而成熟期积累型种质‘天津水蜜’在果实发育后期表达量同样达到最大。并且在果实发育后期,虽然‘大果黑桃’、和表达量下降,并低于同期的‘天津水蜜’,但仍高于白肉桃‘郑白5-2’。说明‘天津水蜜’和‘大果黑桃’关键基因的表达量规律与其花色素苷合成规律具有一致性。
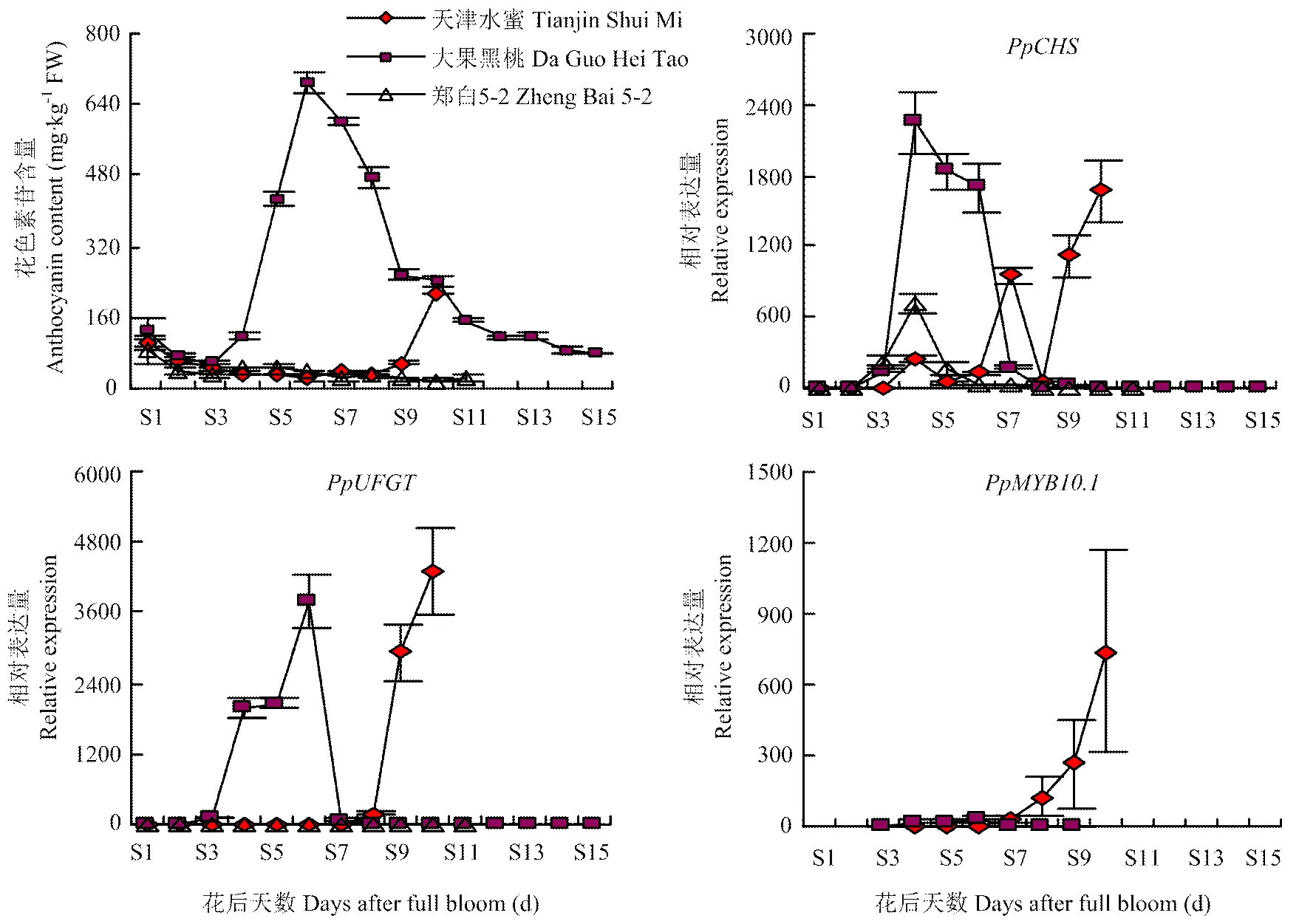
图3 两种红肉类型代表品种花色素苷合成关键基因的表达量与其果实花色素苷含量关系的比较
3 讨论
3.1 红肉桃果肉花色素苷积累的动态变化
CHAPARRO等[14]和WERNER等[15]研究了法国品种‘Harrow Blood’的果肉花色素苷合成规律,认为它与果实发育后期迅速积累花色素苷的种质‘Red English’和‘Indian Blood’不一样,属于发育中期积累型(花后45—50 d)。SHEN等[16]对中国古老的红肉桃资源‘WuYueXian’果肉花色素苷进行测定,发现其花色素苷在果实成熟前期大量积累,属于成熟期积累型。在本研究中,选取了8份具有代表性的红肉桃种质探索红肉桃资源的着色类型,检测结果发现红肉桃果肉花色素苷合成有2个高峰,第1个出现在幼果期,第2个高峰期出现在果实发育中期或者成熟期,该时期随红肉桃种质的不同而不同。根据第2个时期出现的早晚将8份种质分为成熟期积累型(如‘郑引82-9’‘天津水蜜’‘大红袍’‘黑布袋’和‘红桃’)和发育中期积累型(如‘大果黑桃’‘乌黑鸡肉桃’和‘哈露红’)。虽然发育中期积累型种质花色素苷含量在果实成熟期下降,但果肉仍为红色,仍属于红肉桃类型。
在对本研究供试材料的花色素苷进行测定时,发现幼果期花色素苷合成也有1个高峰,该结果与章秋平等[37]在红肉桃品种‘天津水蜜’盛花后25 d果肉中发现的花色素苷合成高峰是一致的。在苹果上,鞠志国等[38]同样认为,苹果果皮中花色素苷在幼果期和成熟期各有1个合成高峰,然而,通过直接观察果肉横切面,笔者却并未在幼果期的果肉中看到明显的红色。分析原因,可能与果实发育早期果肉中存在大量的多酚物质从而干扰了花色素苷的测定有关。在果实发育早期,酚酸类、黄烷3-醇和黄酮醇大量积累,随着果实成熟期含量不断下降[39-40],其对花色素苷测定的影响也将逐渐降低。
3.2和是桃果肉花色素苷合成的关键结构基因
在桃果肉花色素苷代谢通路中,JIAO等[41]通过对红肉桃‘Beijingyixianhong’和‘Heiyoutao’果实进行套袋试验发现,和的表达在去袋后的第3天上调,认为这2个基因是调控花色素苷合成的关键基因。而RAVAGLIA[34]的研究却发现,在油桃‘Stark Red Gold’果肉中仅的表达与花色素苷的积累相关,与BOSS等[42]和KOBAYASHI等[43]研究结果一致。在本研究中,从8份花色素苷积累模型不同的红肉桃中发现、和与果肉花色素苷的积累相关性较强,即这3种基因可能是红肉桃种质花色素苷合成的关键基因。其中,虽然与红色形成有关,但由于其与花色素苷的转运有关,因此并不是严格意义上的花色素苷合成结构基因[44]。
3.3在桃果肉花色素苷合成中起到重要作用
对红肉性状进行连锁分析从而定位数量性状位点(Quantitative trait locus,QTLs),是准确鉴定不同红肉品种花色素苷合成关键调节基因的基础。LIN- WANG等[45]根据苹果克隆了桃,认为第3 连锁群上红肉性状QTLs区段的主效基因就是。GILLEN等[46]利用加拿大的一份红肉桃品种‘Harrow Blood’(在本研究中为‘哈露红’)的杂交群体,将红肉隐性基因定位在第4连锁群顶端,但未进行关键基因的预测。ZHOU等[17]利用‘大红袍’的杂交群体,将第5 连锁群红肉性状QTLs加密到200 kb 的范围内;并在该区间中发现一个(命名为)在红肉和白肉品种中表达差异显著,认为是控制红肉性状的候选基因;随后的瞬时转化烟草和桃果肉试验证实该基因可通过调控位于第3连锁群上的影响花色素苷的合成。综上所述,在不同来源的红肉种质中均有作用,有时是直接有时是间接。在本研究中,也发现仅的表达与8份红肉种质花色素苷的积累趋势一致,而仅在‘郑引82-9’和‘黑布袋’这2份成熟期积累型种质的发育后期有表达,而发育中期积累型的种质中,未检测到的表达。该结果同样说明在调控花色素苷合成的通路中起到了直接或间接的作用。然而,通过表达分析仅能说明该基因是重要的,究竟该基因是否为导致表型出现差异的直接原因,仍需要结合连锁分析和DNA序列差异进行解析。
3.4 两类红肉桃品种的遗传背景分析
为了探究两类红肉桃种质花色素苷合成通路的差异是否与其具有不同的遗传背景有关,查阅了前人对供试红肉桃品种遗传背景分析的有关文献。CAO等[47]基于53对全基因组简单重复序列(simple sequence repeat, SSR)标记对来自6个不同区域的104份种质构建系统发育树,分析中国桃种质的多样性,可将104份种质分为5个群,在本研究所用的8份红肉桃仅有5份种质包含其中,分别为‘天津水蜜’‘黑布袋’‘大果黑桃’‘乌黑鸡肉桃’和‘大红袍’,前4份种质亲缘关系较近,‘大红袍’与它们亲缘关系较远。LI等[48]基于48个多态性高的SSR标记对来自东方和西方的653份种质构建系统发育树,发现‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,其次是‘哈露红’,它们与‘大红袍’的亲缘关系较远,本研究所用的其他种质未知。MICHELETTI 等[49]收集了来自世界各地共1 580份桃种质,基于4 271个单核苷酸多态性(Single Nucleotide Polymorphism,SNP)构建系统发育树,发现‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,其次是‘大红袍’,它们与‘哈露红’的亲缘关系较远,本研究中的其他种质也未涉及到。综上所述,在已有遗传多样性或群体结构分析的研究中,‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,而与‘大红袍’亲缘关系较远。然而,在本研究中,‘天津水蜜’与‘大红袍’表现为花色素苷成熟期积累型,‘乌黑鸡肉桃’却表现为发育中期积累型。因此,通过全基因组分析的遗传多样性或种群结构与通过特定性状调控通路的相似性分析结果间并无绝对的联系。
4 结论
根据桃果肉着色和花色素苷含量的动态变化,8份红肉桃可分为两类:一类为成熟期积累型,如‘郑引82-9’‘大红袍’‘黑布袋’‘红桃’和‘天津水蜜’;一类为发育中期积累型,如‘哈露红’‘大果黑桃’和‘乌黑鸡肉桃’。和是花色素苷成熟期积累型种质的关键结构基因,而在供试的所有红肉桃种质花色素苷合成中起到关键调控作用。
References
[1] KONG J M, CHIA L S, GOH N K, CHIA T F, BROUILLAR D R. Analysis and biological activities of anthocyanins., 2003, 64(5): 923-933.
[2] MARTIN C, BUTELLI E, PETRONI K, TONELLI C. How can research on plants contribute to promoting human health?, 2011, 29(3): 1685-1699.
[3] WANG J, MAZZA G. Inhibitory effects of anthocyanins and other phenolic compounds on nitric oxide production in LPS/IFN activated RAW 264.7 macrophages., 2002, 50(4): 850-857.
[4] XIA X D, LING W H, MA J, XIA M, HOU M J, WANG Q, ZHU H L, TANG Z H. An anthocyanin-rich extract from black rice enhances atherosclerotic plaque stabilization in apolipoprotein E-deficient mice, 2006, 136(8): 2220-2225.
[5] KANG S Y, SEERAM N P, NAIR M G, BOURQUIN L D. Tart cherry anthocyanins inhibit tumor development in ApcMinmice and reduce proliferation of human colon cancer cells., 2003, 94(1): 13-19.
[6] WU X L., PRIOR R L. Systematic identification and characterization of anthocvanins by HPLC -ESI-MS/MS in common foods in the united states: Fruits and Berries., 2005, 53(7): 2589-2599.
[7] CEVALLOS-CASALS B A, BYRNE D, OKIE W R, CISNEROS- ZEVALLOS L. Selecting new peach and plum genotypes rich in phenolic compounds and enhanced functional properties., 2006, 96(2): 273-280.
[8] 沈志军, 马瑞娟, 俞明亮, 许建兰, 蔡志翔, 倪林箭, 颜少宾. 桃三种肉色类型果实抗氧化因子的比较评价. 中国农业科学, 2012, 45(11): 2232-2241.
SHEN Z J, MA R J, YU M L, XU J L, CAI Z X, NI L J, YAN S B. Evaluation of anti-oxidant factors in peach with three types of flesh color., 2012, 45(11): 2232-2241. (in Chinese)
[9] KRIS-ETHERTON P, HECKER K, BONANOME A, COVAL S, BINKOSKI A, KIRSTEN H, GRIEL A, ETHERTON T. Bioactive compounds in foods: Their role in the prevention of cardiovascular disease and cancer., 2002, 113(9): 71-88.
[10] WINKEL-SHIRLEY B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology., 2001, 126(2): 485-493.
[11] BLAKE J S. Progress in peach breeding., 1937, 35: 49-53.
[12] HSIA C L, LUH B S, CHICHESTER C O. Anthocyanin in freestone peaches., 1965, 30(1): 5-12.
[13] VAN BLARICOM L, SENN T. Anthocyanin pigments in freestone peaches grown in the Southeast., 1967, 90(6): 541-545.
[14] CHAPARRO J, WERNER D, WHETTEN R, O’MALLEY D M. Inheritance, genetic interaction, and biochemical characterization of anthocyanin phenotypes in peach., 1995,86(1): 32-38.
[15] WERNER D J, CRELLER M A, CHAPARRO J X. Inheritance of the blood-fleshtrait in peach., 1998, 33(7): 1243-1246.
[16] SHEN Z, CONFOLENT C, LAMBERT P, POËSSEL J, QUILOT- TURION B, YU M, MA R, PASCAL T. Characterization and genetic mapping of a new blood-flesh trait controlled by the single dominant locusin peach., 2013(9): 1435-1446.
[17] ZHOU H, WANG K L, WANG H L, GU C, ANDREW P D, RICHARD V E, HE Y P, Andrew C, Han Y P. Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis bytranscription factors., 2015, 82(1): 105-121.
[18] 原永兵, 刘成连, 鞠志国. 苹果果皮红色形成的机制//园艺学年评. 北京: 科学出版社, 1995: 12-13.
YUAN X B, LIU C L, JU Z G. Mechanism of red formation in apple peel//. Beijing: Science Press, 1995: 12-13. (in Chinese)
[19] JU Z G, YUAN Y B, LIU C L, XIN S H. Relationship among phenylalanine ammonia-lyase activity, simple phenol concentrations and anthocyanin accumulation in apple., 1995, 61: 215-226.
[20] LISTER C E, LANCASTER J E. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars., 1996, 71(3): 313-320.
[21] 张学英. 李果实着色与花色素苷合成机理研究[D]. 杭州: 浙江大学, 2008.
ZHANG X Y. Study on the mechanism of fruit coloring and anthocyanin biosynthesis [D]. Hangzhou: Zhejiang University, 2008. (in Chinese)
[22] JU Z G, LIU C L, YUAN Y B. Activities of chalcone synthase and UDPGaI: Flavonoid-3-O-glycosyl transferase in relation to anthocyanin synthesis in apple., 1995, 63: 175-185.
[23] HONDA C, KOTADA N, WADA M, KONDO S, KOBAYASHI S, SOEJIMA J, ZHANG Z, TSUDA T, MORIGUCHI T. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin., 2002, 40(11): 955-962.
[24] KIM S H, LEE J R, HONG S T, YOO Y K, AN G, KIM S R. Molecular cloning and analysis of anthocyanin biosynthesis genes preferentially expressed in apple skin., 2003, 165(2): 403-413.
[25] ESPLEY R V, HELLENS R P, ALLAN A C. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae., 2010, 10(50): 1471-1488.
[26] 王延玲, 张艳敏, 冯守千, 田长平, 王海波, 刘遵春, 宋杨, 陈学森. 新疆红肉苹果转录因子基因的克隆、序列分析及原核表达. 中国农业科学, 2010, 43(13): 2735-2743.
WANG Y L, ZHANG Y M, FENG S Q, TIAN Z P, WANG H B, LIU Z C, SONG Y, CHEN X S. Cloning, sequence analysis and prokaryotic expression of transcription factorgene in Xinjiang red-meat apple., 2010, 43(13): 2735-2743. (in Chinese)
[27] 汪祖华, 庄恩及. 中国果树志(桃卷). 北京: 中国林业出版社, 2001.
Wang Z H, Zhuang E J.. Beijing: Chinese Forest Press, 2001.(in Chinese)
[28] 王富荣, 何华平, 龚林忠, 王会良, 顾霞, 诸小敏. 湖北地方红肉桃种质资源收集、评价及利用. 湖北农业科学, 2013, 52(15): 3562-3565.
WANG F R, HE H P, GONG L Z, WANG H L, GU X, ZHU X M. Collection, evaluation and breeding utilization of red-flesh peach germplasm resources in Hubei province., 2013, 52(15): 3562-3565. (in Chinese)
[29] 王富荣, 何华平, 龚林忠, 顾霞. 红肉桃种质资源的AFLP分析. 湖北农业科学, 2008, 47(2): 138-141.
WANG F R, HE H P, GONG L Z, GU X. Analysis of genetic relationship of red-flesh peach germplasm resource by AFLP markers., 2008, 47(2): 138-141. (in Chinese)
[30] 贾敬贤. 果树种质资源目录. 北京: 中国农业出版社, 1993.
Jia J X.. Beijing: China Agriculture Press, 1993. (in Chinese)
[31] 孙婧超, 刘玉田, 赵玉平, 欧燕, 庞少华. pH示差法测定蓝莓酒中花色素苷条件的优化. 中国酿造, 2011(11): 171-174.
SUN J C, LIU T Y, ZHAO Y P, OU Y, PANG S H. Determination of anthocyanin in blueberry wine by pH differential method., 2011(11): 171-174. (in Chinese)
[32] TONG Z G, GAO Z H, WANG F, ZHOU J, ZHANG Z. Selection of reliable reference genes for gene expression studies in peach using real-time PCR., 2009, 10(1): 71.
[33] LIVAK K J., SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod., 2001, 25(4): 402-408.
[34] RAVAGLIA D, ESPLEY RV, HENRY-KIRK R A, ANDREOTTI C, ZIOSI V, HELLENS R P, COSTA G, ALLAN A C. Transcriptional regulation of flavonoid biosynthesis in nectarine () by a set of R2R3 MYB transcription factors., 2013, 13(68): 1-14.
[35] FRANCIS F J. Food colorants: Anthocyanins., 1989, 28(4): 273-314.
[36] RAHIM M A, BUSATTO N, TRAINOTTI L. Regulation of anthocyanin biosynthesis in peach fruits., 2014, 240(5): 913-929.
[37] 章秋平, 李疆, 王力荣, 朱更瑞, 方伟超, 曹珂, 陈昌文, 冯义彬. 红肉桃果实发育过程中色素和糖酸含量的变化. 果树学报, 2008, 25(3): 312-315.
ZHANG Q P, LI J, WANG L R, ZHU G R, FANG W C, CAO K, CHEN C W, FENG Y B. Study on the changes of contents of pigments, sugar and acid of blood flesh peach cultivar during fruit development., 2008, 25(3): 312-315. (in Chinese)
[38] 鞠志国, 原永兵, 刘成连, 戴洪义, 战淑敏. 苹果果皮中酚类物质合成规律的研究. 莱阳农学院学报, 1992, 9(3): 222-225.
JU Z G, YUAN Y B, LIU C L, DAI H Y, ZHAN S M. Study on synthesis of phenolic compounds in apple peel., 1992, 9(3): 222-225. (in Chinese)
[39] 周君, 陈宗玲, 张琼, 王红清. 套袋对桃果实成熟过程中酚酸类和类黄酮类物质积累的影响. 园艺学报, 2009, 36(12): 1717-1724.
ZHOU J, CHEN Z L, ZHANG Q, WANG H Q. Effects of bagging on the accumulation of phenolic acids and flavonoids in peach fruits during maturation., 2009, 36(12): 1717-1724. (in Chinese)
[40] Andreotti C, Ravaglia D, Ragaini A, Costa G. Phenolic compounds in peach [(L.) Batsch] cultivars at harvest and during fruit maturation., 2008, 153(1): 11-23.
[41] JIAO Y, MA R J, SHEN Z J, YAN J, YU M L. Gene regulation of anthocyanin biosynthesis in two blood-flesh peach ((L.) Batsch) cultivars during fruit development., 2014, 15(9): 809-819.
[42] BOSS P K, DAVIES C, ROBINSON S P. Expression of anthocyanin biosynthesis pathway genes in red and white grapes., 1996, 32(3): 565-569.
[43] KOBAYASHI S, ISHIMARU M, DING C K, YAKUSHIJI H, GOTO N. Comparison of UDP-glucose: flavonoid 3-O-glucosyltransferase () gene sequences between white grapes () and their sports with red skin., 2001, 160(3): 543-550.
[44] MUELLER L A, GOODMAN C D, SILADY R A, WALBOT V. AN9, a petunia glutathione S-transferase required for anthocyanin sequestration, is a flavonoid-binding protein.,2000, 123(4): 1561-1570.
[45] LIN-WANG K, BOLITHO K, GRAFTON K, KORTSTEE A, KARUNAIRETNAM S, MCGHIE T, ESPLEY R, HELLENS R, ALLAN A. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae., 2010, 10: 50.
[46] GILLEN A M, BLISS F A. Identification and mapping of markers linked to thegene for root-knot nematode resistance in peach., 2005, 130(1): 24-33.
[47] CAO K, WANG L R, ZHU G R, FANG W C, CHEN C W, LUO J. Genetic diversity, linkage disequilibrium, and association mapping analyses of peach () landraces in China.2012, 8(5): 975-990.
[48] LI X W, MENG X Q, JIA H J, YU M L, MA R J, WNAG L R, CAO K, SHEN Z J, NIU L, TIAN J B, CHEN M J, XIE M, ARUS P, GAO Z S, ARANZANA M J. Peach genetic resources: diversity, population structure and linkage disequilibrium., 2013, 14: 84.
[49] MICHELETTI D, DETTORI M T, MICALI S, ARAMINI V, PACHECO I, LINGE C D S, FOSCHI S, BANCHI E, BARRENECHE T, QUILOT-TURION B, LAMBERT P, PASCAL T, IGLESIAS L, CARBÓ J, WANG L R, MA R J, LI X W, GAO Z S, NAZZICARI N, TROGGIO M, BASSI D, ROSSINI L, VERDE I, LAURENS F, ARÚS P, ARANZANA M J. Whole-genome analysis of diversity and SNP-major gene association in peach germplasm., 2015, 10(9): e0136803.
(责任编辑 赵伶俐)
The Difference of Anthocyanin Accumulation Pattern and Related Gene Expression in Two Kinds of Red Flesh Peach
DING TiYu, CAO Ke, FANG WeiChao, ZHU GengRui, CHEN ChangWen, WANG XinWei, WANG LiRong
(Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009)
【Objective】The objective of this experiment is to investigate the coloring mechanism of Chinese red-flesh peach germplasms and lay a theoretical foundation for excellent gene identifying and molecular marker assisted breeding in blood-flesh peach accessions.【Method】Eight red flesh peaches and one white flesh peach were selected as samples. The samples were collected one month after full bloom, and then collected every 10 days until the mature period. The anthocyanin of pulp of different germplasms was extracted with 2% formic acid methanol, determining the absorbance at 510 nm and 700 nm. The expression of 13 key structural genes and regulatory genes associated with anthocyanin synthesis was determined by real-time quantitative PCR (qRT-PCR).【Result】According to the accumulation of anthocyanin at middle-late stages of fruit, eight red-flesh peaches could be divided into two categories. The peak of anthocyanin biosynthesis appeared at mature stage, which was referred to as mature period accumulation type, including Zheng Yin 82-9, Da Hong Pao, Hei Bu Dai, Hong Tao and Tianjin Shui Mi; The peak of anthocyanin synthesis occurred at the middle stage of fruit development, and the content of anthocyanin decreased at mature stage, which was referred to as the mid-developmental accumulation type, including Harrow Blood, Da Guo Hei Tao and Wu Hei Ji Rou Tao. In the structural genes associated with anthocyanin, the expression ofandwas consistent with the trend of the variation of the anthocyanin content of mature period accumulation type germplasms, which were the key speed-limiting genes of these kinds of germplasms. In the mid-developmental accumulation type, the accumulation of anthocyanin in the mesocarp was consistent with the trend of expression of all structural genes.Among the four regulatory genes, only the expression level ofwas high and the expression pattern was similar to the pattern of anthocyanin accumulation in the two types of red flesh germplasms during fruit developmental stages. 【Conclusion】According to the coloring pattern of peach fruit and the pattern of anthocyanin accumulation, eight red-flesh peaches could be divided into two types, namely mature period accumulation type and mid-developmental accumulation type. Thegenes were the key structural genes ofmature period accumulation type accessions, whileplayed a key role in the synthesis of anthocyanin in all red-flesh peach germplasms.
red flesh peach; anthocyanin; anthocyanin synthesis related genes
2017-01-03;接受日期:2017-04-13
国家“863”计划(2013AA102606)、中国农业科学院科技创新工程[CAAS-ASTIP-2015-ZFRI-(01)]
丁体玉,Tel:13083662138;E-mail:1121326300@qq.com。通信作者王力荣,Tel:0371-55906989;E-mail:wlirong2009@sina.com

