猪繁殖与呼吸综合征病毒间接ELISA检测方法的建立
□ 杨若松 祁晓萌 熊雅婷 北京维德维康生物技术有限公司
猪繁殖与呼吸综合征病毒间接ELISA检测方法的建立
□ 杨若松 祁晓萌 熊雅婷 北京维德维康生物技术有限公司
猪繁殖与呼吸综合征(porcine reproductive andrespiratory syndrome,PRRS)又名“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种主要以妊娠母猪严重繁殖障碍以及仔猪呼吸道症状及高死亡率为特征的高度接触性传染病[1]。PRRS于1987年在美国首次发现,1991年荷兰中央兽医研究所首次分离得到病毒,我国在1996年首次报道[2]。
在我国,猪群感染PRRSV后出现混合感染、继发感染的现象非常严重,这与PRRSV的感染机制有关。PRRSV感染机体后以机体免疫系统细胞为靶细胞,从而抑制免疫系统功能,导致其他病原极易乘虚而入。无论感染了传统PRRSV还是高致病性PRRSV,被感染的猪均会表现出猪呼吸障碍等多种症状,临床上多与副猪嗜血杆菌、大肠杆菌、链球菌、支原体等有关。试验证明,高致病性PRRSV感染可以加剧副猪嗜血杆菌感染,引发严重的临床表现[3]。
由于PRRSV可在宿主体内的巨噬细胞中进行复制,导致无症状的持续感染。该病毒通过鼻黏膜和上呼吸道上皮细胞进入宿主体内,并在鼻黏膜、呼吸系统的巨噬细胞以及淋巴组织中进行原发性复制。随后通过血液循环到达继发性复制部位,如大脑、心、肺、胸腺、脾、肝、淋巴结、肾、肾上腺、小肠、睾丸等。病毒可进入易感妊娠母猪体内,跨越胎盘感染胎儿。
PRRS血清学诊断方法是应用最广泛的动物疫病诊断方法。关于PRRSV的血清学诊断,国内外己建立了多种检测PRRSV抗体的方法,主要有免疫过氧化物酶单层实验(immuno peroxidase monolayer assay,IPMA)[4]、间接免疫荧光检测方法(indirect immunoin fluscent assay,IFA)[5]、血清中和试验(Serum Neutralization,SN)[6]以及酶联免疫吸附测定试验(enzyme-linked immunosorbent assay,ELISA)。目前许多国家己把酶联免疫吸附试验作为PRRS日常监测和临床诊断的常规手段,因其抗原用量很少,检测过程依靠仪器自动化,故而适合大规模的快速检测。
核衣壳蛋白N作为PRRSV主要的结构蛋白,具有很强的免疫原性,是该病毒ELISA诊断方法中应用最多的靶抗原[7]。间接ELISA方法是利用酶标记的二抗(辣根过氧化物酶HRP标兔抗猪IgG)以检测与固相PRRSV抗原结合的PRRSV受检抗体,故称为间接法。间接法主要用于对病原体抗体的检测而进行传染病的诊断,此法与直接法类似,区别在于把没有酶标记的一级抗体改用酶标记过的二级抗体去辨识一级抗体来测定抗原量。其优点在于利用二抗可以加强信号,只需通过变换包被的抗原就可利用同一酶标抗抗体建立检测相对应抗体的方法,完成不同的测定分析[8]。由于酶的催化效率很高,故可极大地放大反应效果,从而使测定方法达到很高的敏感度。
1 材料与方法
1.1 材料
重组PRRSV-N蛋白、辣根过氧化物酶(HRP)标记羊抗猪IgG、176份猪血清。
1.2 方法
包括对蛋白质包被浓度、包被缓冲液、封闭液、封闭条件、稀释倍数、作用时间及温度、以及最佳显色时间及温度等指标的确定。
2 方法验证
2.1 特异性试验
用建立的PRRSV-N ELISA检测方法分别检测猪瘟阳性血清、猪伪狂犬病毒阳性血清、猪乙型脑炎病毒阳性血清、猪细小病毒阳性血清。计算S/P值,并对结果进行分析。
2.2 重复性试验
用同批次抗原包被酶标板检测同一份血清抗体来检测板间与板内变异及批间差异,计算同一份检测样本阳性百分率的变异系数(C.V.=S/X×100%,S:标准差,X:算术平均值),以检验板内和板间检测样品的重复性。
2.3 与商品化试剂盒的对比
用本试验建立的PRRSV-N抗体ELISA检测方法对美国IDEXX公司PRRSV抗体间接ELISA试剂盒检测过的179份血清进行检测。
3 实验结果与分析
3.1 蛋白质最佳包被浓度确定的结果
通过对4个浓度包被的酶标板进行实验,结果表明PRRV-N蛋白稀释到1g/mL时,样本的P/N值最大,效果最好。在所建立的ELISA检测方法中,确定包被抗原浓度为1g/mL,实验结果见表1。
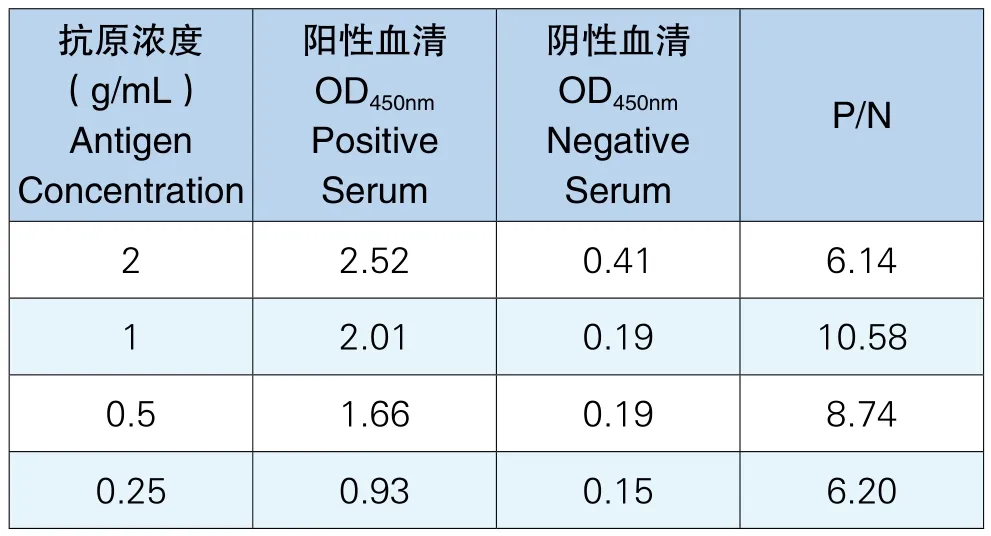
表1 抗原包被浓度测定结果
3.2 最佳包被缓冲液确定的结果
利用3种包被缓冲液包被抗原,通过实验,最终得出0.05moL/L碳酸盐缓冲液的P/N在3种包被缓冲液中最大、最适于本方法中的抗原包被,实验结果见表2。
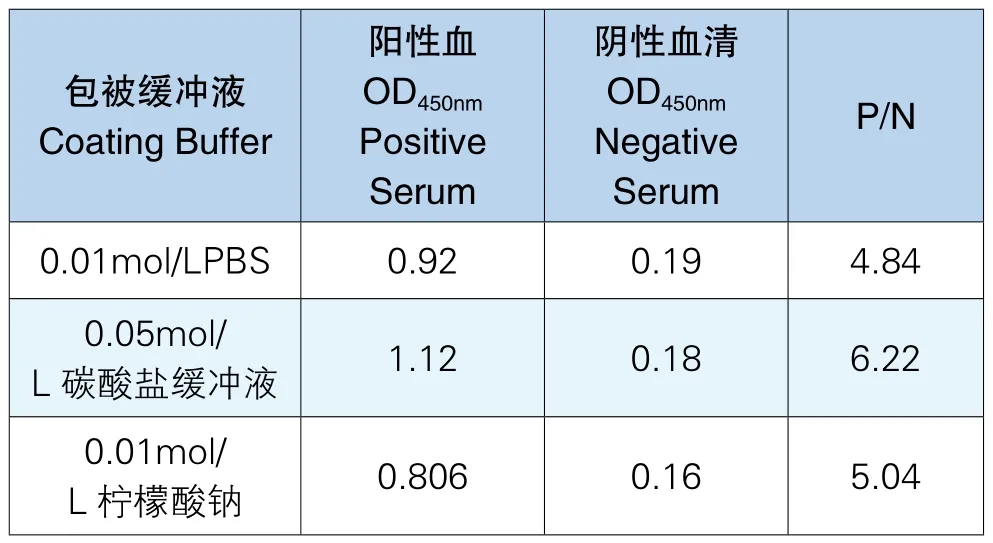
表2 包被缓冲液选择结果
3.3 最佳封闭液确定的结果
通过8种封闭液对包有抗原的酶标板进行封闭,实验最终确定封闭液为5%脱脂乳,P/N值最大且阳性值接近1.0、阴性值小于0.2,实验结果见表3。
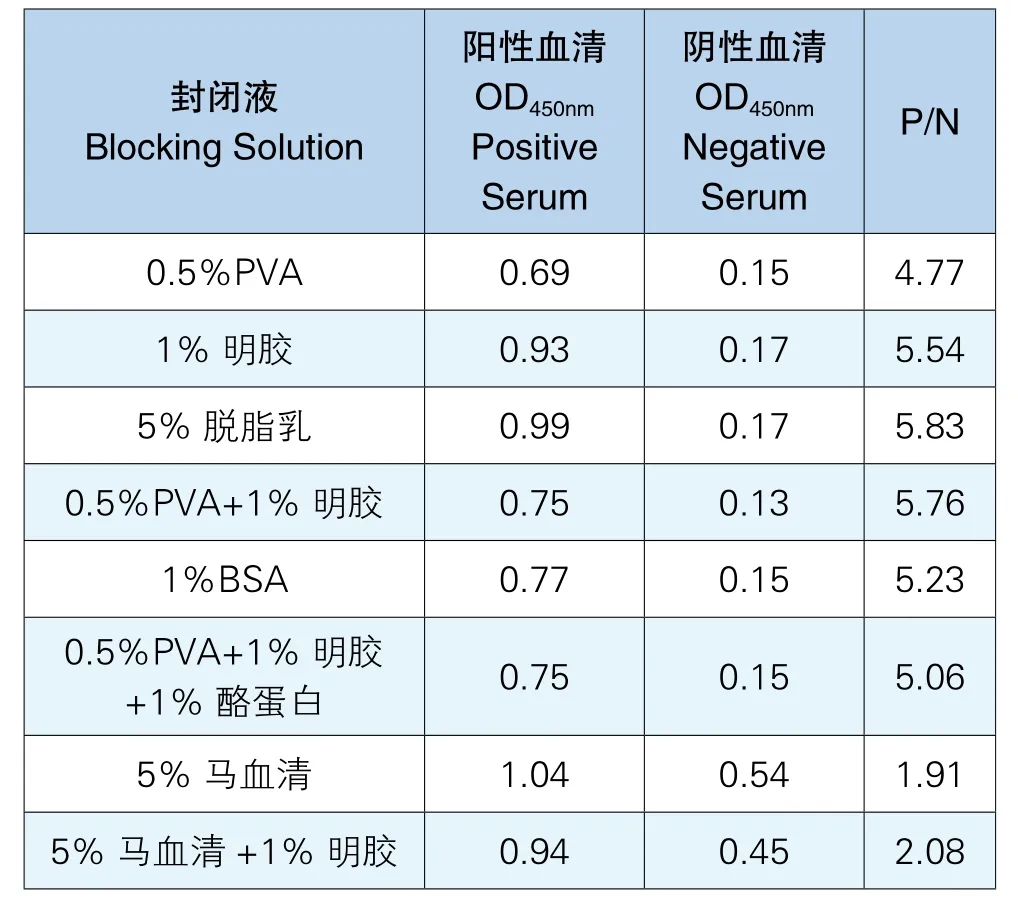
表3 最佳封闭液选择结果
3.4 最佳封闭条件确定的结果
通过在不同温度下封闭,得出实验结果为25℃条件下P/N值最大且阳性血清OD值与阴性血清OD值之差较大,最适合封闭,封闭条件为25℃反应2h,实验结果见表4。
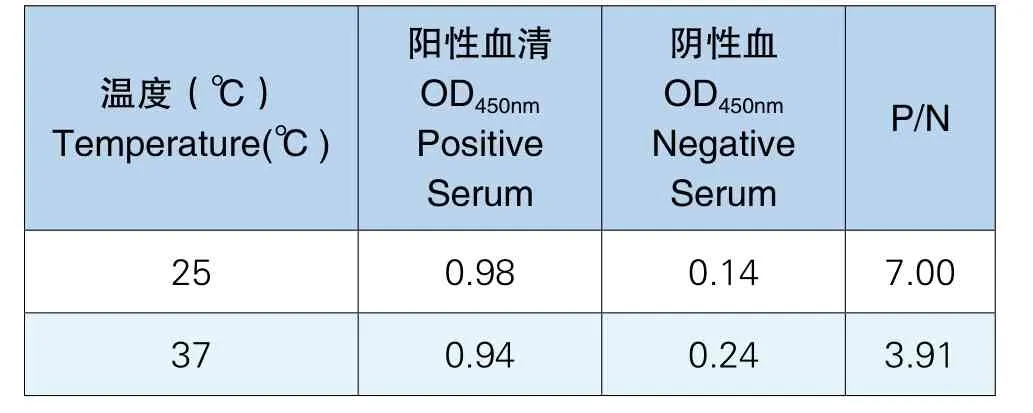
表4 确定封闭条件结果
3.5 被检血清最佳稀释倍数确定的结果
通过倍比稀释的方法对同种血清稀释5个倍数,进行实验,结果表明按照1:40的比例被稀释时样本P/N值最大,被检血清稀释倍数为40倍,实验结果见表5。
3.6 被检血清最佳作用时间及温度确定的结果
通过实验结果可以看出被检血清在25℃反应30min和45min的阴阳性血清OD值和P/N值几乎一样且最高,为了节省实验时间,将被检血清的作用时间及温度定为25℃反应30min,实验结果见下表6。

表5 被检血清稀释倍数确定结果
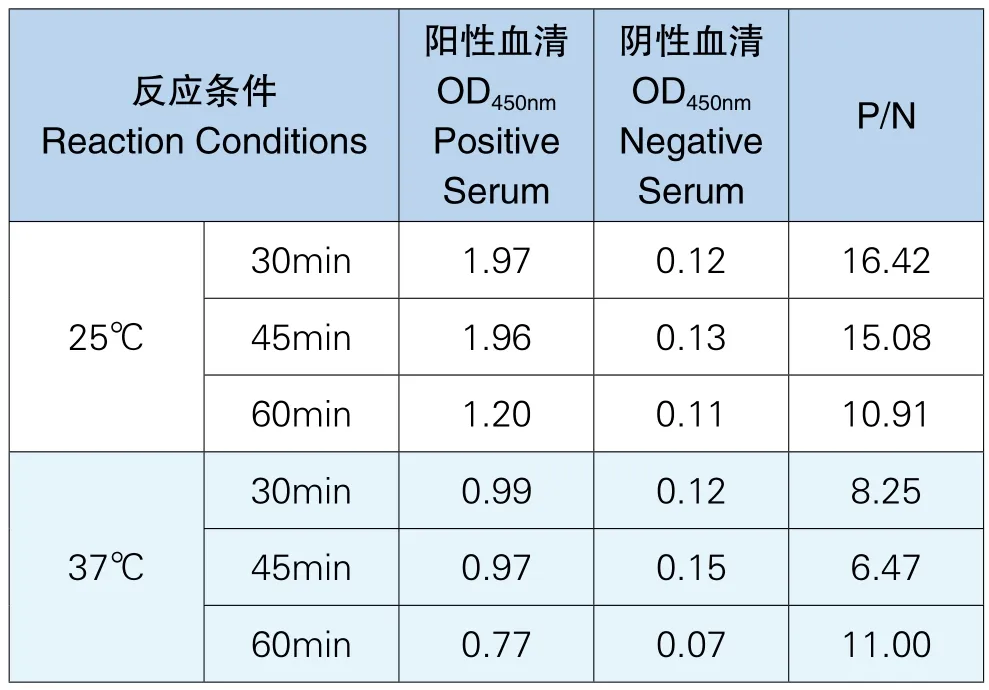
表6 被检血清作用时间及温度结果
3.7 酶标二抗最佳工作浓度确定的结果
通过倍比稀释的方法将羊抗猪稀释为不同浓度的酶标抗体工作液并进行实验,实验确定最佳酶标抗体工作浓度为1:20000稀释,实验结果见表7。

表7 最佳酶标抗体工作浓度的选择结果
3.8 酶标二抗最佳反应时间及温度确定的结果
通过对不同酶标抗体反应时间及温度的测定,试验确定最佳酶标抗体作用时间为25℃反应30min,实验结果见表8。
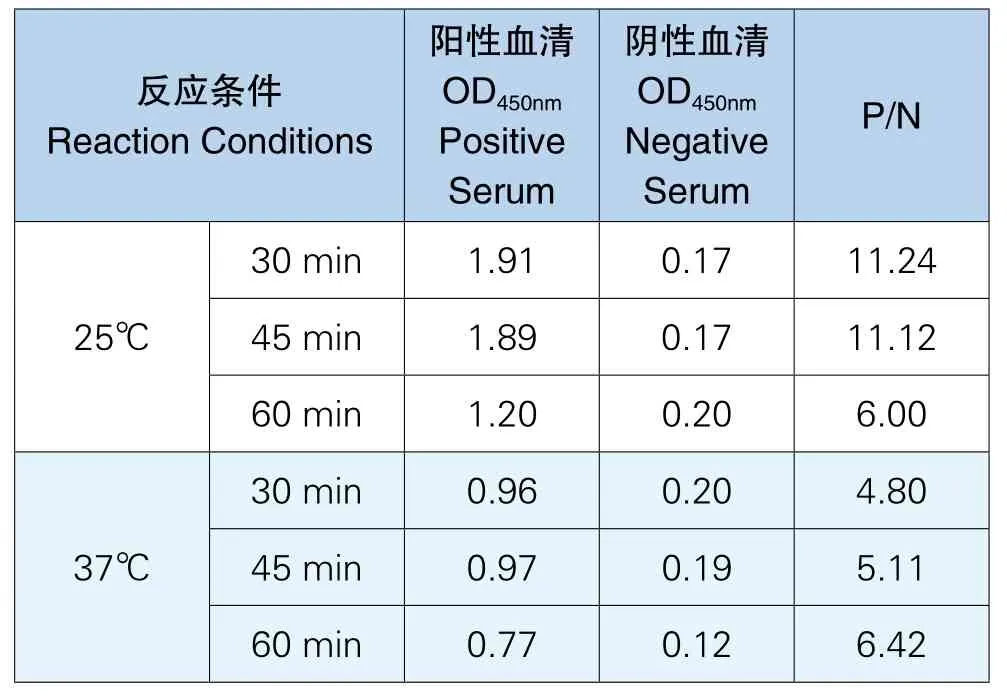
表8 酶标二抗反应时间及温度测定结果
3.9 最佳显色时间及温度确定的结果
通过对不同显色时间温度的测定,试验确定最佳显色条件为25℃显色10min,实验结果见表9。
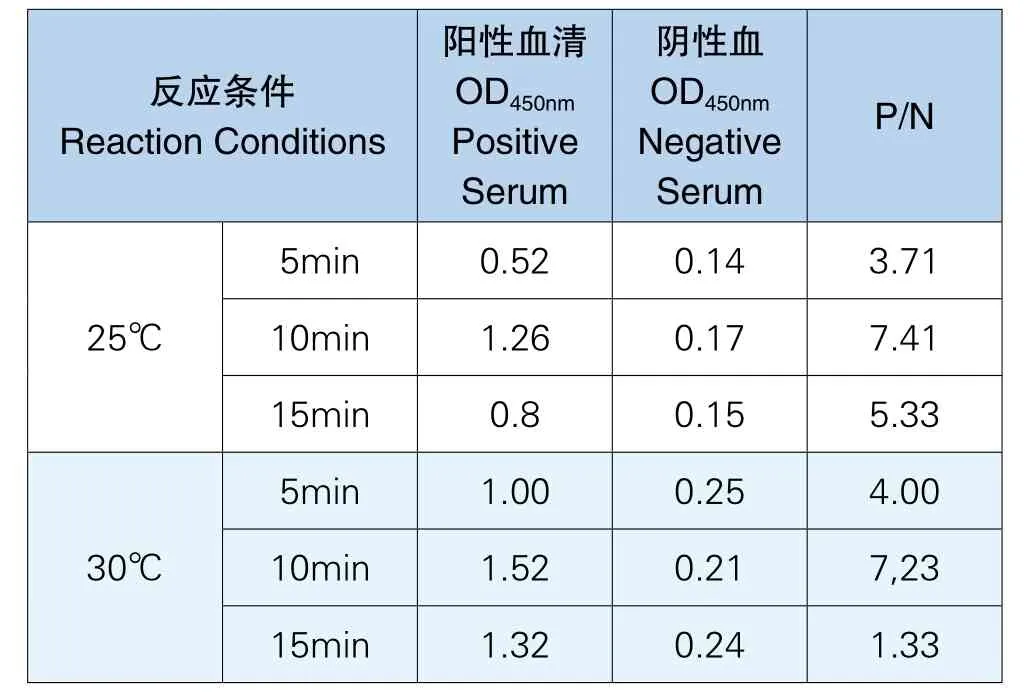
表9 最佳显色时间及温度测定结果
3.10 特异性试验结果
用建立好的ELISA方法检测其他4种常见的猪传染病阳性血清,结果均为阴性,PRRSV-N包被抗原与4种常见的猪传染病阳性血清无交叉反应,表明以重组PRRSV-N蛋白为包被抗原检测PRRSV抗体的间接ELISA拥有良好的特异性,检测结果见表10。
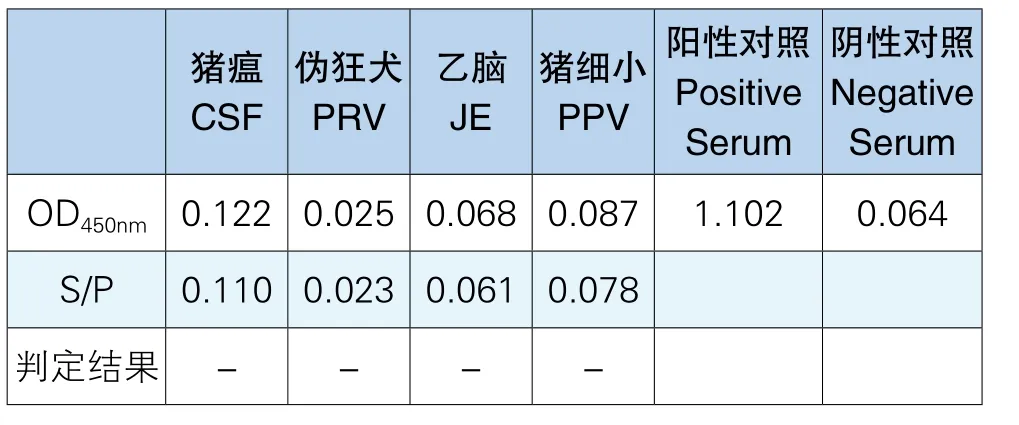
表10 PRRSV-N抗体间接ELISA特异性检测结果
3.11 重复性试验结果
用同批次抗原包被酶标板检测同一份血清抗体来判定板间与板内的变异及批间差异,结果显示:批内板间与板内重复性试验变异系数都在3.22%~7.86%之间;批间变异系数在11.57%,前者小于10%,后者小于20%,表明此间接ELISA检测方法具有较好的重复稳定性。
3.12 间接ELLSA方法与同类商品化试剂盒的对比
通过对建立的PRRSV-N抗体ELISA试剂盒与美国IDEXX-ELISA试剂盒进行实验比较分析,证明PRRSV-N抗体ELISA试剂盒与美国IDEXX-ELISA试剂盒的符合率比较好,总体符合率达到85.22%,敏感性85.83%,特异性83.93%,可用于PRRSV-N抗体的临床检测,比较结果见表11。

表11 PRRSV-N抗体间接ELISA与商品化试剂盒的比较结果
4 讨论
本研究中将PRRSV-N蛋白用0.05moL/L碳酸盐缓冲液稀释到1g/mL后,进行包被(4℃,16h)。用0.5%脱脂乳在25℃条件下进行封闭2h,节省了抗原的使用量,并且在封闭时节约了时间,降低了生产成本。酶标抗体稀释20000倍,在室温(25℃±2℃)下反应30min,较为节省试验时间,并且具有良好的敏感性和特异性。本实验与国外同类型试剂盒检测结果进行对比,阴性符合率为83.93%,阳性符合率为85.83%,总符合率为85.22%。说明本实验建立的猪繁殖与呼吸综合征病毒间接ELISA检测方法具有较好的特异性和灵敏性,为下一步猪繁殖与呼吸综合征试剂盒调试和生产提供了良好的试验基础。
[1] 殷震,刘景华.动物病毒学(第二版)[M].北京:中国科学出版社,1997:1019-1029.
[2] 谭斌,刘长明,危艳武.PRRSV_IPMA抗体检测试剂盒的研制及其应用[J].国兽医科学,2006,36(11):880-884.
[3] 唐娜.PRRSV诊断方法的建立及鲁豫冀地区PRRSV的流行与遗传变异研究[D].长春:吉林大学:2013.
[4] YanlongCong, Zhiqiang Huang, Yixue Sun et al. Development and application of a blocking enzyme-linked immunosorbent assay (ELISA) to differentiate antibodies againstlive and inactivated porcine reproductive and respiratory syndrome virus[J]. Virology, 2013, 444: 310-316.
[5] Helena Denac, Christian Moser, Jon DuriTratschinet a. An indirect ELISA for thedetection of antibodies against porcine reproductive and respiratory syndrome virus using recombinant nucleocapsid protein as antigen [J]. Journal of Virological Methods, 1997, 65: 169-18.
[6] Yoon IJ, Joo HS, Goyal SM and Molitor TW. A modified serum neutralization test for the detectionof
antibody to porcine reproductive and respiratory syndrome virus in swine sera[J]. Journal of Veterinary Diagnostic Investigation, 1994, 6(3): 289-292.
[7] 王云峰,周彦君,仇华吉.应用重组N蛋白-ELISA检测猪繁殖与呼吸综合征抗体的研究[J].中国兽医杂志,2001,37(3):3-6.
[8] 王玉娥,杨汉春,郭鑫.用噬菌体随机肤库分析猪繁殖与呼吸综合征病毒PRRSV-N蛋白单克隆抗体识别的表位[J].农业生物技术学报,2004,12(2):175-178.
[9] 王西西.鉴别PRRS野毒株与TJM-F92疫苗株间接ELISA方法的建立与初步应用[D].北京:中国农业科学院,2016.
[10] 袁宝.猪繁殖与呼吸综合征病毒N蛋白原核表达及其抗体检测方法的建立[D].长春:吉林大学,2007.
[11] 李素平.PRRSV重组N蛋白ELISA检测方法的建立及单克隆抗体的制备[D].郑州:河南农业大学,2009.

