淫羊藿苷对产前应激子代大鼠抗抑郁作用研究
张笑笑,林天炜,张君利,张 琳,谢娟萍,李 晖,朱忠良
(1.西北大学生命科学学院,陕西 西安 710069;2.西安交通大学第一附属医院儿科,陕西 西安 710061)
淫羊藿苷对产前应激子代大鼠抗抑郁作用研究
张笑笑1,林天炜1,张君利1,张 琳1,谢娟萍1,李 晖2,朱忠良1
(1.西北大学生命科学学院,陕西 西安 710069;2.西安交通大学第一附属医院儿科,陕西 西安 710061)
目的 观察淫羊藿苷对产前应激子代抑郁样行为的干预作用,并探究其作用机制。方法 本文采用慢性束缚应激对孕后期母鼠建立抑郁模型,将♂ SD子代大鼠随机分为5组:空白对照组(CON)、产前应激组(PS)、生理盐水组(NS)、淫羊藿苷高剂量组(80 mg·kg-1)、淫羊藿苷低剂量组(40 mg·kg-1)。采用强迫游泳实验和旷场实验对各组大鼠的抑郁样行为进行评价,并通过Western blot测定各组大鼠前额叶皮层区mGluR1、mGluR5、EAAT2蛋白的表达。结果 与CON组相比,PS组子代大鼠挣扎时间和穿越中央格次数减少(P<0.01,P<0.05),表现出明显的抑郁样行为。PS组较CON组前额叶皮层区mGluR1、mGluR5蛋白表达明显升高(P<0.01,P<0.05),而EAAT2蛋白表达明显降低(P<0.05)。与NS组相比,淫羊藿苷高、低剂量组均能明显增加子代大鼠的挣扎时间(P<0.05,P<0.01)和穿越中央格次数(P<0.05)。淫羊藿苷干预后(80 、40 mg·kg-1)均能明显改善前额叶皮层区mGluR1、mGluR5及EAAT2蛋白的表达。结论 淫羊藿苷对产前应激子代大鼠具有明显的抗抑郁作用,其作用机制可能与脑内Ⅰ族mGluRs的调制作用相关。
淫羊藿苷;产前应激;子代大鼠;抗抑郁;ΙmGluRs;EAAT2;机制
抑郁症已引起很多研究者的广泛关注,但抑郁症的发病机制仍不清楚。谷氨酸是一种兴奋性神经递质,参与突触可塑性调控,谷氨酸能系统在抑郁症发生中起到至关重要的作用[1]。而代谢型谷氨酸受体1(mGluR1)和代谢型谷氨酸受体5(mGluR5)是G蛋白偶联受体[2],与焦虑症、抑郁症的发生息息相关[3]。谷氨酸转运体(EAAT2)是一种在前脑、海马、皮层区的星型胶质细胞膜上表达最为丰富的转运体[4],能够清除突触间隙过量的谷氨酸,对消除谷氨酸毒性起到重要的作用[5]。抑郁症属于情感类精神障碍的一种,诱导抑郁症发生的因素很多,其中产前应激在抑郁症的发生和发展起到关键的诱导作用。已有研究证实,产前应激能够增加焦虑症和抑郁症的发生风险[6-7]。目前,针对抑郁症的临床治疗药物主要是选择性5-HT重吸收抑制(SSRIs),然而在临床治疗中发现SSRIs治疗效果缓慢,治疗潜伏期长达4~8周,并且仅使大约40%的抑郁病人痊愈[8]。因此,迫切需要更加有效、快速地治愈抑郁症的新型药物。而淫羊藿苷是从中草药淫羊藿中提取分离得到的一种黄酮类化合物,有动物研究已经证实,淫羊藿苷在社会挫败应激模型和慢性不可预见性应激模型上均表现出抗抑郁作用,其作用机制主要涉及炎性信号因子通路及HPA轴的调节作用等[9-10],但淫羊藿苷对产前束缚应激子代大鼠的抗抑郁作用研究很少,其作用机制也不清楚。本实验通过建立产前束缚应激模型,进一步探究淫羊藿苷对产前应激子代大鼠的抗抑郁作用。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 光学显微镜(麦克奥迪实业集团有限公司);HPLC (Waters);5418R型低温离心机(Bio-Rad公司);微量分光光度仪(Nana Drop公司);化学发光仪(Bio-Rad公司);SDS-PAGE凝胶配置试剂盒(西安赫特生物科技);Rabbit anti-mGluR1(Abcam公司);Rabbit anti-mGluR5(Abcam公司);Rabbit anti-EAAT2 (Abcam公司)。
1.1.2 实验动物 SD大鼠,SPF级,由西安交通大学动物研究中心提供。所有实验动物被饲养于西北大学SPF动物房,动物房温度恒定于22 ℃~26 ℃,湿度恒定于60%左右,每天12 h白昼和12 h黑夜(每天开灯从早8 ∶00到晚20 ∶00)交替,♀♂大鼠分开饲养,在实验前持续饲养1周以适应实验环境,在整个实验过程中动物均可自由进食、饮水。
1.1.3 实验药品 淫羊藿苷,购买于陕西昊辰生物科技有限公司,经HPLC检测,其纯度为98.18%,结果见Fig 1。

Fig 1 High performance liquid chromatography of icariin
1.2 方法
1.2.1 动物分组与给药 ♀♂大鼠按3 ∶1合笼,次日清晨用光学显微镜进行阴道涂片检查,精子阳性被认定为妊娠d 0。孕鼠随后被随机分成对照组和应激组,对照组不进行任何干预,应激组给予束缚应激。孕鼠d 21分娩,子鼠d 21断奶,随机抽取每组8只♂进行实验,每窝选取的子代♂不得多于2只。实验将子代♂分为5组,对照组(CON)、产前应激组(PS)、生理盐水组(NS)、淫羊藿苷高剂量组(ICA 80 mg·kg-1)、淫羊藿苷低剂量组(ICA 40 mg·kg-1)。给药组从子代出生后d 22开始,共灌胃给药35 d。
1.2.2 建模 应激模型装置是一个透明塑料的圆柱状筒,直径为6.8 cm,塑料圆柱筒的长度可根据大鼠的具体尺寸进行调节,并且塑料圆柱筒两端有密集的小孔,有助于动物呼吸。孕鼠于怀孕d 13~20被放置于此装置内,3次/d,每次45 min,每次束缚应激至少间隔2 h。
1.2.3 强迫游泳实验 强迫游泳装置是一圆柱形塑料桶,直径为20 cm,高度为50 cm。桶中水深40 cm左右,以保证大鼠在水中无法触及桶底而强迫挣扎游泳,水温保持在24℃左右。每只大鼠强迫游泳8 min,并用摄像机记录大鼠在水中的挣扎时间。
1.2.4 旷场实验 旷场箱的规格为40 cm×40 cm×25 cm,底部和四壁均被涂成黑色,底部用白色线条分为25个(5×5)均等的方格,旷场箱的中央9个(3×3)方格被认定为中央格。实验开始时,将大鼠放在旷场箱的最中间的方格中,让大鼠在旷场箱中自由活动,并用摄像机记录6 min内大鼠在旷场箱中的活动情况,计算大鼠穿越中央格的次数(至少有3只爪子进入中央区域)和理毛次数(用爪子或舌头梳理自己的毛)。
1.2.5 取材 实验大鼠用10%水合氯醛腹腔注射进行麻醉,在冰上迅速剥离大鼠脑前额叶皮层,于-80℃冰箱保存备用。所有金属器械均需高温高压灭菌。
1.2.6 蛋白样品的制备 将组织称重,用眼科剪将组织剪碎,加入RIPA裂解液(使用前数分钟加入PMSF,使其终浓度为1 mmol·L-1),在冰上充分研磨使其完全透过筛网,冰中静置5 min,待组织充分裂解,置4℃离心机中以12 000 r·min-1离心5~10 min,取上清液。按4 ∶1加入loading buffer,置沸水中变性5 min,于-20℃保存备用。
1.2.7 Western blot 根据SDS-PAGE试剂盒配置凝胶,保持蛋白上样量一致。电泳结束后,根据marker指示目的蛋白所在区域的凝胶,将目的蛋白转到标记好的PVDF膜上,将PVDF膜置于脱脂奶粉中封闭2 h,孵育一抗(mGluR1 1 ∶500,mGluR5 1 ∶1 000,EAAT2 1 ∶2 000),在4℃冰箱过夜。次日,孵育二抗1 h,接着将PVDF膜置于Bio-Rad化学发光仪的暗盒中进行目的蛋白自动显影。最后,用Image J软件对目的蛋白条带进行灰度分析。
2 结果
2.1 淫羊藿苷对产前应激子代大鼠强迫游泳实验中抑郁样行为的影响 与CON组相比,PS诱导子代大鼠在强迫游泳实验中挣扎时间明显减少(P<0.01);而淫羊藿苷灌胃给药后(80、40 mg·kg-1)均能明显延长挣扎时间(P<0.05,P<0.01),ICA(40 mg·kg-1)组较ICA(80 mg·kg-1)组更加明显,见Tab 1。

Tab 1 Effect of icariin on struggling time of FST in prenatally stressed male offsprings(±s,n=8)
**P<0.01vsCON;#P<0.05,##P<0.01vsNS
2.2 淫羊藿苷对产前应激子代大鼠旷场实验中抑郁样行为的影响 与CON组相比,PS组子代大鼠穿越中央格次数较CON组明显减少(P<0.05);淫羊藿苷(80、40 mg·kg-1)灌胃给药后,子代大鼠穿越中央格次数明显增加(P<0.05);各组子代大鼠理毛次数差异无显著性(P>0.05),见Tab 2。

Tab 2 Effect of icariin on depressive-like behavior of OFT in prenatally stressed male offsprings(± s,n=8)
*P<0.05vsCON;#P<0.05vsNS
2.3 淫羊藿苷调节产前应激子代大鼠前额叶皮层区ΙmGluRs及EAAT2蛋白的表达 在前额叶皮层区,PS组较CON组mGluR1、mGluR5蛋白表达明显升高(P<0.01,P<0.05),EAAT2蛋白表达明显降低(P<0.05);淫羊藿苷灌胃给药(80、40 mg·kg-1)均能明显降低产前应激子代大鼠前额叶皮层区mGluR1蛋白表达(P<0.01);与NS组相比,ICA(80 mg·kg-1)组mGluR5蛋白表达明显减少(P<0.05),但EAAT2蛋白表达差异无显著性(P>0.05);而ICA(40 mg·kg-1)组能明显上调前额叶皮层区EAAT2蛋白表达(P<0.05),但对mGluR5蛋白表达差异无统计学意义(P>0.05),见Fig 2~4。
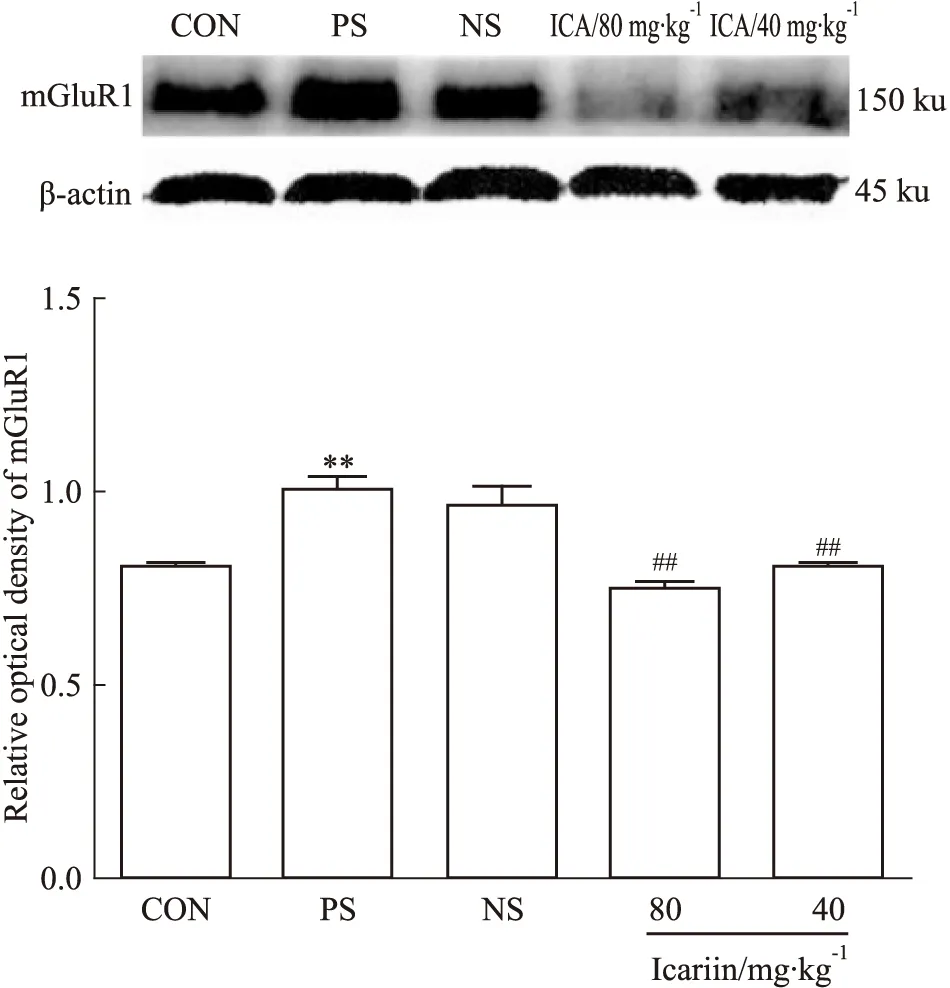
Fig 2 Effect of icariin on mGluR1 protein expression in prefrontal cortex of male offsprings(±s,n=8)
**P<0.01vsCON;##P<0.01vsNS
3 讨论
古医家认为阳气为动力之源,推动人体各种生命活动,包括思维、情志、精神和行动等方面,然肾阳不足,则表现为精神不振、情绪低糜、自卑绝望、嗜睡乏力。而抑郁症则以“不动”为主要特点,因此认为肾阳不足是抑郁症的基本病机[11],肾阳亏虚,当滋补肾阳。淫羊藿性辛苷温,其主要的功效是温肾壮阳。有研究表明,淫羊藿总黄酮能使抑郁模型大鼠脑内β-肾上腺素受体密度明显降低,起到抗抑郁作用[12]。
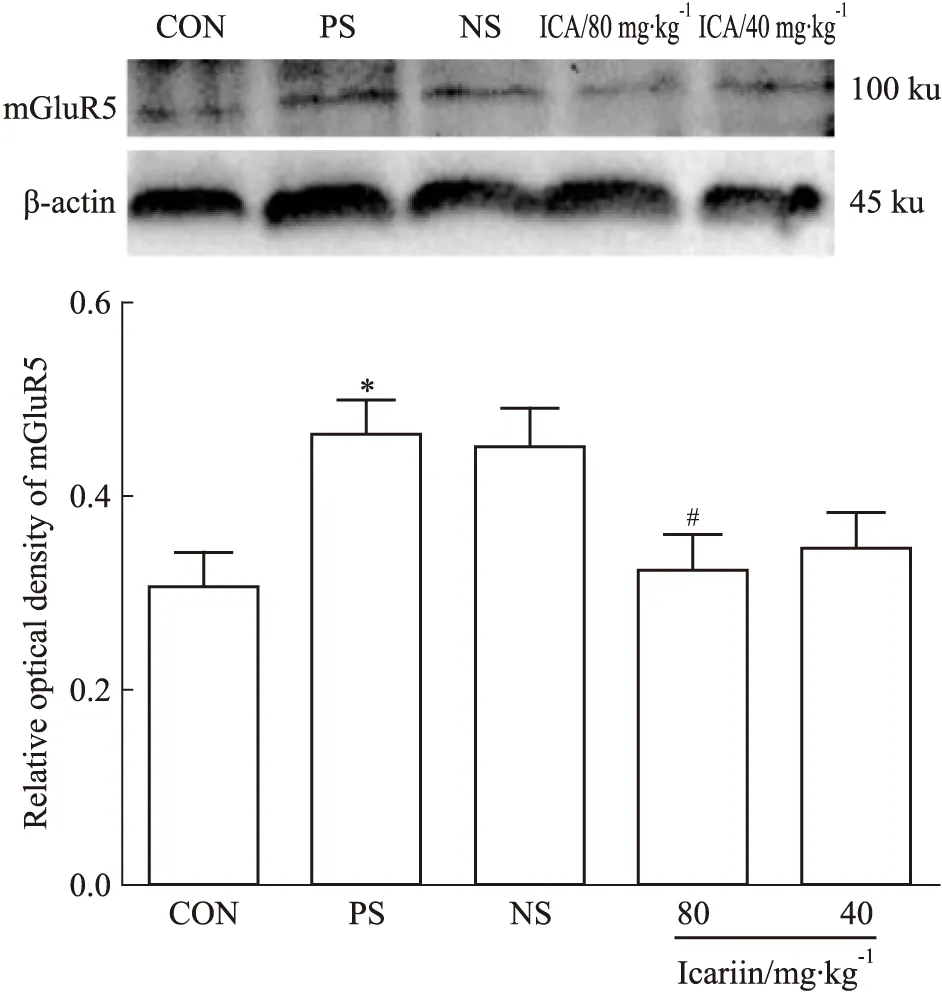
Fig 3 Effect of icariin on mGluR5 protein expression in prefrontal cortex of male offsprings(±s,n=8)
*P<0.05vsCON;#P<0.05vsNS
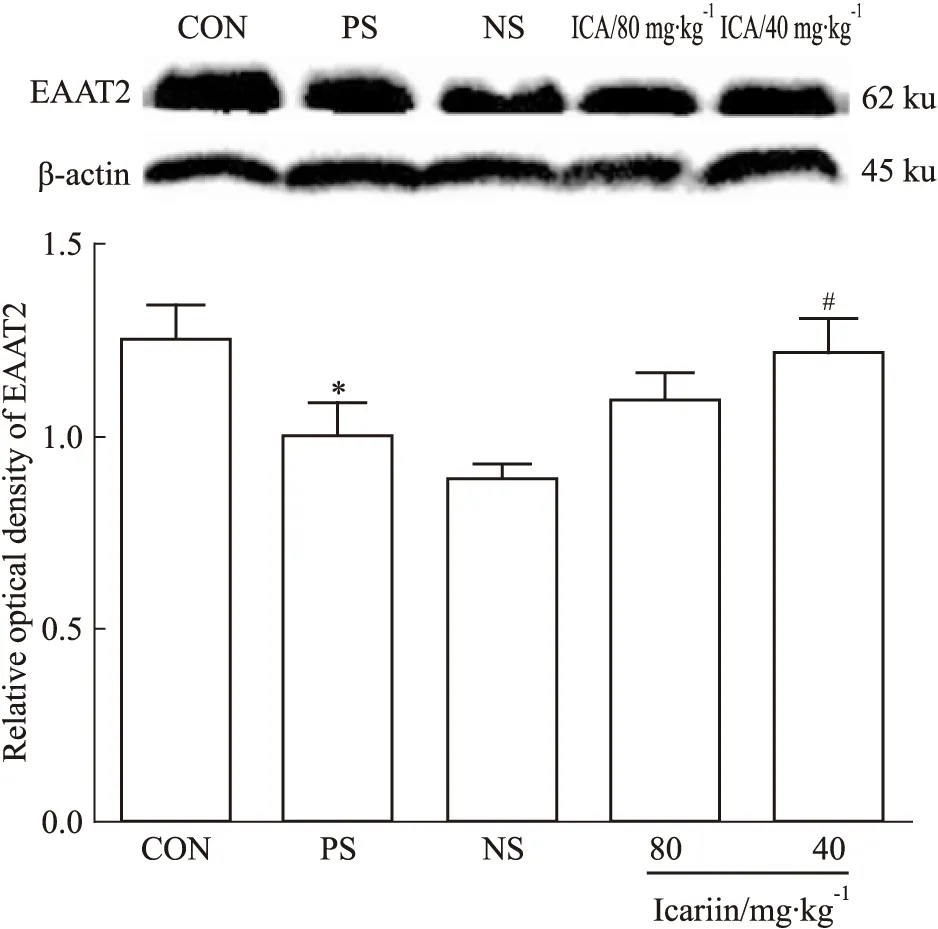
Fig 4 Effect of icariin on EAAT2 protein expression in prefrontal cortex of male offsprings(±s,n=8)
*P<0.05vsCON;#P<0.05vsNS
很多探究PS对抑郁或焦虑样行为影响的动物实验均选用子代♂,本实验也选择子代♂为研究对象,主要是为了避免♀发情期激素的影响。本实验中,PS子代大鼠在强迫游泳实验中挣扎时间减少,旷场实验中穿越中央格次数减少等,预示子代大鼠生活追求淡漠、悲观失望、探究能力减弱,这与抑郁症病人运动迟滞、喜欢避角的症状较为相似。
大量证据已经表明[13],在中枢神经系统中,谷氨酸及谷氨酸受体在抑郁症的发病机制及抗抑郁治疗中起着至关重要的作用。前期研究表明[14],产前应激能明显提高♂子代鼠前额叶皮层区mGluR2/3和mGluR5的表达,而Ⅱ族亲代谢型谷氨酸受体mGluR2/3能通过抑制自身受体减少兴奋性谷氨酸能传递,Ⅰ族亲代谢型谷氨酸受体mGluR1/5位于抑制性中间神经元的终端,Ⅰ族mGluRs表达上调则会增强兴奋性谷氨酸能传递,提高细胞兴奋性[15]。本实验结果表明,产前应激能引起子代♂前额叶皮层区Ⅰ族亲代谢型谷氨酸受体mGluR1、mGluR5表达上调,因此认为,在产前应激子代♂中Ⅰ族mGluRs表达升高很可能是为兴奋性谷氨酸能传递保持长期平衡的一种代偿机制。而淫羊藿苷能明显抑制产前应激子代♂前额叶皮层区Ⅰ族mGluRs的上调,另有很多研究表明,mGluR5受体拮抗剂(比如MPEP、MTEP)具有明显的抗抑郁作用[16],这同时也支持了我们的研究结果。综上所述,淫羊藿苷高、低剂量组能不同程度地改善产前应激子代大鼠的抑郁样行为,调节前额叶皮层区Ι mGluRs和EAAT2蛋白的表达,具有明显的抗抑郁作用。
(致谢:本文实验在陕西省生物医药重点实验室完成,特此致谢!)
[1] 张 兵,李 扬. 针对谷氨酸能系统的抗抑郁药物的研究进展[J]. 中国药理学通报, 2014, 30(9):1197-2000.
[1] Zhang B, Li Y. Research progress of the antidepressants targeting the glutamate receptors[J].ChinPharmacolBull, 2014, 30(9): 1197-2000.
[2] Lauro C. Fractalkine: multiple strategies to counteract glutamate receptors activation leading to neuroprotection[J].NeuralRegenRes, 2015, 10(8): 1214-5.
[3] Harvey B H, Shahid M. Metabotropic and ionotropic glutamate receptors as neurobiological targets in anxiety and stress-related disorders: Focus on pharmacology and preclinical translational models[J].PharmacolBiochemBehav, 2012, 100(4): 775-800.
[4] Zhang X H, Jia N, Zhao X Y, et al. Involvement of pGluR1, EAAT2 and EAAT3 in offspring depression induced by prenatal stress[J].Neuroscience, 2013, 250(8): 333-41.
[5] 陈建新, 姚丽华, 王惠玲, 等. 谷氨酸转运体 EAAT2 在抑郁症发病及治疗中的作用[J]. 中国药理学通报, 2016, 32(7): 894-7.
[5] Chen J X, Yao L H, Wang H L, et al. Roles of glutamate transporter EAAT2 in occurrence and treatment of depression[J].ChinPharmacolBull, 2016, 32(7): 894-7.
[6] King S, Laplante D P. The effects of prenatal maternal stress on children′s cognitive development:Project Ice Storm[J].Stress, 2005, 8(1): 35-45.
[7] Rice F, Jones I, Thapar A. The impact of gestational stress and prenatal growth on emotional problems in offspring: a review[J].ActaPsychiatrScand, 2007, 115(3): 171-83.
[8] Berton O, Nestler E J. New approaches to antidepressant drug discovery: beyond monoamine[J].NatReivNeurosci, 2006, 7(2): 137-51.
[9] Liu B, Xu C, Wu X. et al. Icariin exerts an antidepressant effect in an unpredictable chronic mild stress model of depression in rats and is associated with the regulation of hippocampal neuroinflammation[J].Neuroscience, 2015, 294: 193-205.
[10]Pan Y, Hong Y, Zhang Q Y, et al. Impaired hypothalamic insulin signaling in CUMS rats: Restored by icariin and fluoxetine through inhibiting CRF system[J].Psychoneuroendocrinology, 2013, 38(1): 122-34.
[11]何书芬, 居文政, 胡浩彬, 等. 肾阳虚型抑郁症大鼠模型的建立和评价[J]. 中国药理学通报, 2017, 33(1): 140-3.
[11]He S F, Ju W Z, Hu H B, et al. Establishment and evaluation of animal model of depression rats with kidney-yang deficiency[J].ChinPharmacolBull, 2017, 33(1): 140-3.
[12]吴 芳. 赤芍总苷/淫羊藿总黄酮对实验性抑郁及脑5-HT和β-肾上腺素受体的影响[J].现代预防医学, 2005, 32(7): 744-64.
[12]Wu F. The effect of TSP/TFE on experimental depression,5-HT in brain and β-adrenergic receptor[J].ModPreventMed, 2005, 32(7): 744-64.
[13]Musazzi L, Treccain G, Mallei A, et al. The action of antidepressants on the glutamate system: regulation of glutamate release and glutamate receptors[J].BiolPsychiatry, 2013, 73(12):1180-8.
[14]Yuen E Y, Liu W, Karatsoreos I N. et al. Acute stress enhances glutamatergic transmission in prefrontal cortex and facilitates working memory[J].ProcNatlAcadSciUSA, 2009, 106(30): 14075-9.
[15]Poncer J C, Shinozaki H, Miles R. Dual modulation of synaptic inhibition by distinct metabotropic glutamate receptors in the rat hippocampus[J].JPhysiol, 1995, 485(1): 121-34.
[16]Chaki S, Ago Y, Palucha-paniewiera A, et al. mGlu2/3 and mGlu5 receptors: potential targets for novel antidepressants[J].Neuropharmacology, 2013, 66(3):40-52.
Antidepressant effects of icariin in prenatally stressed offsprings
ZHANG Xiao-xiao1,LIN Tian-wei1,ZHANG Jun-li1, ZHANG Lin1, XIE Juan-ping1, LI Hui2, ZHU Zhong-liang1
(1.CollegeofLifeScience,NorthwestUniversity,Xi′an710069,China; 2.DeptofNeonatology,FirstAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710061,China)
Aim To observe the effects of icariin on depressive-like behavior in prenatally stressed offsprings and explore its mechanism.Methods The model of depression was established by prenatal restraint stress on late pregnant mother, then male offspring rats were randomly divided into five groups of eight: Control, PS model, Saline group(NS), ICA(80 mg·kg-1), ICA(40 mg·kg-1). The effects of icariin on PS-induced depressive-like behaviors in male offsprings were examined by forced swimming test(FST) and open-field test(OFT).Furthermore, the protein expressions of group I metabotropic glutamate receptors(I mGluRs) and excitatory amino acid transporter 2(EAAT2) in prefrontal cortex were detected by Western blot.Results PS group exhibited depressive-like behaviors with decreased struggling time(P<0.01) and center crossing numbers(P<0.05) compared to CON, with increased protein expressions of group I mGluRs(P<0.01,P<0.05) and decreased EAAT2(P<0.05) in prefrontal cortex compared to CON. Treatment with icariin(80 mg·kg-1, 40 mg·kg-1)significantly increased struggling time(P<0.05,P<0.01) and center crossing numbers(P<0.05) in PS-exposed male offspring rats. Treatment with icariin markedly modulated the protein levels of mGluR1, mGluR5 and EAAT2 in prefrontal cortex.Conclusion Icariin has significant antidepressant effects in prenatally stressed rats, and the mechanism might be associated with the modulation of Ⅰ mGluRs.
icariin; prenatal stress; offspring; antidepressant; ΙmGluRs; EAAT2; mechanism
2017-04-11,
2017-05-20
陕西省教育厅重点实验室科学研究计划(No14JS108);陕西省科技项目(No 81671342)
时间:2017-6-7 19:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170607.1904.040.html
10.3969/j.issn.1001-1978.2017.07.020
A
1001-1978(2017)07-0987-05
R-332;R284.1;R322.81;R749.420.531
作者介绍:张笑笑(1991-),女,硕士,研究方向:中药药理学,E-mail:1182553071@qq.com; 朱忠良(1963-),男,博士,教授,博士生导师,研究方向:产前应激与子代行为,通讯作者,Tel:029-88304569,E-mail:zlzhu@mail.xjtu.edu.cn

