黄芪甲苷对甲基乙二醛诱导的人视网膜色素上皮细胞损伤的保护作用研究
周云丰,李 琳,葛争艳,周立东,郭宇洁,金 龙,任 烨,李彦林,孙 兰,许 扬
[1.中国医学科学院&北京协和医学院药用植物研究所,中药(天然药物)创新药物研发北京市重点实验室,北京 100193;2.中国中医科学院西苑医院实验研究中心,北京 100091]
黄芪甲苷对甲基乙二醛诱导的人视网膜色素上皮细胞损伤的保护作用研究
周云丰1,李 琳1,葛争艳2,周立东1,郭宇洁2,金 龙2,任 烨2,李彦林1,孙 兰1,许 扬1
[1.中国医学科学院&北京协和医学院药用植物研究所,中药(天然药物)创新药物研发北京市重点实验室,北京 100193;2.中国中医科学院西苑医院实验研究中心,北京 100091]
目的 研究黄芪甲苷(AS-Ⅳ)对甲基乙二醛(MGO)诱导的人视网膜色素上皮细胞损伤的保护作用及分子机制。方法 利用MGO诱导ARPE-19细胞损伤,CCK-8法检测细胞活力,Hoechst 33342染色法观察细胞核形态,流式细胞仪检测细胞凋亡,试剂盒测定细胞内活性氧(ROS)水平、超氧化物歧化酶(SOD)水平和脂质过氧化物丙二醛(MDA)含量,JC-1染色法观察线粒体膜电位的变化,Western blot法检测Bcl-2、Bax和PARP蛋白的表达量,荧光酶标法检测caspase家族蛋白caspase-9和caspase-3的活化水平。结果 MGO能剂量依赖性地降低ARPE-19的细胞活力,AS-Ⅳ预处理能够明显逆转MGO引起的细胞活力下降(P<0.05),改善细胞核形态,减少细胞凋亡,减少ROS和MDA的产生(P<0.05),增加SOD活力(P<0.05),抑制线粒体膜电位的下降,提高Bcl-2/Bax蛋白表达率(P<0.05)和PARP的表达水平,降低caspase-9和caspase-3的活化水平(P<0.05)。结论 AS-Ⅳ对MGO损伤的ARPE-19细胞有明显的保护作用,其作用机制是提高细胞抗氧化能力,调节线粒体通路蛋白的表达,从而抑制细胞凋亡。
糖尿病视网膜病变;黄芪甲苷;甲基乙二醛;人视网膜色素上皮细胞;抗氧化;细胞凋亡
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者最严重的微血管并发症之一。DR能导致不可逆的视力丧失,已经成为致盲的主要疾病[1],DR与自由基介导的氧化损伤有关,氧化应激反应可调节细胞的生理功能和生化反应,在细胞增殖分化过程中发挥重要作用,并可导致细胞凋亡。视网膜色素上皮细胞(retinal pigment epithelium,RPE)位于富含血管的脉络膜和视网膜神经上皮层之间,是视网膜重要的营养、维护和代谢组织,也是外血-视网膜屏障的重要组成部分,RPE因其特殊的位置和功能在DR的发生发展中扮演重要的角色[2]。甲基乙二醛(methylglyoxal,MGO)是糖酵解生成的活性二羰基化合物,在糖尿病患者血浆中大量积累[3],MGO可以通过与氨基酸残基结合,经过复杂反应产生晚期糖基化终末产物(advanced glycation end products, AGEs),作为AGEs最具活性的前体物质,MGO被认为是引发糖尿病并发症的关键物质[4]。在糖尿病患者中,血糖升高导致AGEs在RPE基底膜中聚集,从而引起RPE的损伤[5]。
黄芪甲苷(astragaloside IV,AS-Ⅳ)是中药黄芪的主要活性成分之一,现代药理学研究证明,AS-Ⅳ具有抗肿瘤、抗炎、抗氧化、降糖和改善心血管疾病等药理作用[6],并且AS-Ⅳ对糖尿病周围神经病变和糖尿病大鼠肾脏病变具有改善和治疗效果[7-8],对糖尿病大鼠心肌细胞和糖尿病大鼠视网膜Müller细胞具有保护作用[9-10]。目前尚未见AS-Ⅳ对DR中RPE损伤保护作用的研究报道,本研究采用MGO诱导的ARPE-19细胞损伤为模型,探讨AS-Ⅳ对ARPE-19细胞的保护作用及分子机制,为AS-Ⅳ用于防治DR提供参考。
1 材料与方法
1.1 材料 ARPE-19细胞株购自赛百慷(上海)生物技术股份有限公司;AS-Ⅳ购自成都曼斯特生物科技有限公司,以二甲基亚砜(dimethyl sulfoxide, DMSO)溶解,配制成50 mmol·L-1的贮备液,-20℃保存,用时以无血清培养基稀释至所需浓度,实验中DMSO浓度小于0.1%。DMEM/F12(1 ∶1)培养基、胎牛血清、胰蛋白酶购自美国Gibco公司,青链霉素混合液(100×)购自北京索莱宝科技有限公司,Hoechst 33342、MGO购自美国Sigma公司,CCK-8由日本同仁化学研究所提供,超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)测试盒由南京建成生物工程研究所提供,线粒体膜电位和活性氧检测试剂盒购自碧云天生物技术研究所,caspase-3、caspase-9检测试剂盒购自凯基生物技术股份有限公司,FITC Annexin V凋亡检测试剂盒购自美国BD公司,抗Bcl-2抗体、抗Bax抗体购自英国Abcam公司,抗PARP抗体购自美国CST公司,SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒、山羊抗兔二抗(HRP结合)购自康为世纪生物科技有限公司。
1.2 ARPE-19细胞培养 ARPE-19细胞生长于含有10%胎牛血清、1×105U·L-1青霉素和100 mg·L-1链霉素的DMEM/F12培养基中,置于37℃、5%CO2细胞培养箱中培养,每天换液,每3 d传代1次,选取对数期生长的细胞进行实验。
1.3 实验分组及药物处理
1.3.1 MGO最佳造模浓度的确定 将处于对数期的细胞接种于96孔板中,每组5个复孔,每孔1×104个细胞,接种24 h后,将细胞分为对照组和不同浓度MGO组,弃去完全培养基,分别加入无血清培养基稀释的0.5、0.75、1、2 mmol·L-1MGO溶液,对照组加入无血清培养基,孵育16 h。
1.3.2 AS-Ⅳ最佳作用浓度的确定 将处于对数期的细胞接种于96孔板中,每组5个复孔,每孔1×104个细胞,接种24 h后,将细胞分为对照组、MGO组、MGO+5 μmol·L-1AS-Ⅳ组、MGO+10 μmol·L-1AS-Ⅳ组和MGO+20 μmol·L-1AS-Ⅳ组,弃去完全培养基。对照组和MGO组加入无血清培养基,MGO+不同浓度AS-Ⅳ组加入含不同浓度AS-Ⅳ(5、10、20 μmol·L-1)的无血清培养基,孵育6 h后,MGO组和MGO+不同浓度AS-Ⅳ组加入MGO使其终浓度为1 mmol·L-1,孵育16 h。
1.4 CCK-8检测细胞活力 选取对数期生长的ARPE-19细胞,接种于96孔板中(每孔1×104个),培养24 h后,按以上分组进行实验,然后弃去完全培养基,加入含CCK-8(CCK-8 ∶无血清培养基=1 ∶9)的无血清培养基100 μL,孵育2 h,用酶标仪在450 nm处检测吸光度值,计算细胞活力,每个实验重复3次。
1.5 细胞凋亡检测
1.5.1 Hoechst 33342细胞核荧光染色 细胞经处理后,PBS洗2次,加入无血清培养基稀释的Hoechst 33342染色液,37℃避光染色15 min,PBS洗3次,每次5 min,然后利用高内涵成像系统拍照。
1.5.2 Annexin V-FITC/PI双染 将处于对数生长期的细胞接种于6孔板中,每孔1.5×105个,细胞长满板底约80%时,按上述方法处理细胞,经胰酶消化后离心,用冷PBS洗细胞2次,将细胞重悬于100 μL 1×Binding Buffer中,加入5 μL Annexin V-FITC和5 μL PI,室温避光孵育15 min,加入400 μL 1×Binding Buffer 轻弹混匀,上机检测。
1.6 细胞内氧化应激水平检测
1.6.1 ROS染色 细胞经处理后,用PBS洗2次,加入以无血清培基1 ∶1000稀释的DCFH-DA,37℃避光染色40 min后,无血清培基洗3次,然后加入Hoechst 33342 每孔200 μL,染色15 min,PBS洗3次后利用高内涵成像系统拍照。
1.6.2 细胞内SOD和MDA检测 细胞经处理后,消化收集细胞,利用超声破碎细胞,4℃、12 000 r·min-1离心5 min,取上清,按照试剂盒说明进行SOD和MDA的检测。
1.7 线粒体膜电位检测 细胞经处理后,用PBS洗2次,加入JC-1染色工作液37℃避光染色30 min,1×JC-1染色缓冲液洗3次,然后利用高内涵成像体统拍照。
1.8 Western blot检测蛋白表达 细胞经处理后,胰蛋白酶消化并收集细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的哺乳动物蛋白抽提试剂(体积比为1 ∶1 ∶98),冰上裂解30 min;4℃、12 000 r·min-1离心15 min,取上清稀释10倍进行蛋白定量;将SDS-PAGE上样缓冲液与蛋白样品按照1 ∶4混匀,煮沸5 min,使蛋白充分变性,-20℃保存待用。取等量蛋白样品进行SDS-PAGE电泳3 h,转膜105 V,55 min,然后将NC膜用5%脱脂奶粉封闭2 h,一抗孵育过夜,用TBST洗3次,每次15 min,二抗室温孵育2 h,TBST洗3次,每次15 min,显色后使用凝胶成像仪进行成像。使用Photoshop图像处理软件对蛋白条带的灰度值进行分析。
2 结果
2.1 MGO造模浓度及AS-Ⅳ作用浓度的确定 随着MGO浓度的增加,ARPE-19细胞活力逐渐下降,当MGO浓度为1 mmol·L-1时细胞存活率为(64.75±6.00)%(Fig 1A),故选择1 mmol·L-1MGO孵育16 h作为最佳造模条件;在不同浓度AS-Ⅳ预给药6 h后给予MGO(1 mmol·L-1)孵育16 h,结果显示,AS-Ⅳ浓度为10 μmol·L-1时,细胞存活率为(78.45±5.90)%,与MGO组相比细胞活力明显提高(P<0.05),最终确定AS-Ⅳ的给药浓度为10 μmol·L-1,并且在AS-Ⅳ浓度为10 μmol·L-1时对ARPE-19的细胞活力无明显影响(Fig 1B,P>0.05)。
2.2 AS-Ⅳ对MGO引起的细胞凋亡的影响 利用Hoechst 33342对细胞核染色发现,正常组细胞核呈圆形或椭圆形,完整无皱缩,呈均匀淡蓝色;MGO组细胞核着色不均匀,部分细胞核固缩呈致密亮蓝着色,表现出凋亡的典型特征;AS-Ⅳ给药后细胞核染色较为均匀,与MGO组比较有明显改善(Fig 2A)。Annexin V-FITC/PI双染结果显示,正常组细胞凋亡率为(3.18± 0.30)%,MGO组细胞凋亡率为(19.47±2.48)%,与正常组相比凋亡率明显增加(P<0.05),AS-Ⅳ给药后细胞凋亡率为(7.57±0.81)%,与MGO组相比凋亡率明显降低(Fig 2B、2C,P<0.05)。
2.3 AS-Ⅳ对MGO引起的氧化应激反应的影响 荧光探针DCFH-DA本身没有荧光,可以自由穿过细胞膜,可被细胞内的酯酶水解成DCFH,而DCFH不能通过细胞膜,细胞内的ROS可以将无荧光的DCFH氧化成有绿色荧光的DCF,因而绿色荧光的强度代表细胞内ROS的含量。由Fig 3A、3B可见,与对照组相比,MGO能增加ARPE-19细胞氧化应激反应,细胞绿色加深,荧光强度是对照组的(2.69±0.56)倍,有显著性差异(P<0.05),AS-Ⅳ能够明显减少ROS的产生(P<0.05);且与对照组相比,MGO组细胞内SOD含量明显降低,MDA含量明显增加,AS-Ⅳ能明显增加SOD水平,减少MDA含量(Fig 3C、3D,P<0.05)。
2.4 AS-Ⅳ对MGO引起的细胞线粒体膜电位降低的干预作用 JC-1荧光探针能够快速灵敏的检测线粒体膜电位的变化,正常细胞线粒体膜电位较高,JC-1以聚合物的形式存在于线粒体基质中,产生红色荧光;细胞受到损伤时线粒体膜电位降低,JC-1以单体形式存在,呈现绿色荧光。由Fig 4A、4B可见,对照组细胞红色荧光较强,线粒体膜电位较高,而MGO组细胞受损,线粒体膜电位下降,绿色荧光增强,Red/Green比值为(0.66±0.11),明显低于正常组,AS-Ⅳ能够提高线粒体膜电位,红色荧光增加,绿色荧光减少,与MGO组相比Red/Green比值明显提高(P<0.05)。
2.5 AS-Ⅳ对细胞凋亡蛋白表达的影响 Western blot法检测凋亡蛋白Bcl-2和Bax的表达发现,MGO能明显减少Bcl-2/Bax比值,AS-Ⅳ给药后Bcl-2/Bax比值和PARP的表达明显增加(Fig 5A~5C,P<0.05)。经荧光酶标法检测发现,MGO组caspase-9、caspase-3活力明显增加,AS-Ⅳ能明显降低caspase-9、caspase-3的活化水平(Fig 5D、5E,P<0.05)。

Fig 1 Effect of AS-Ⅳ on cell viability of ARPE-19 cells
A: MGO can reduce ARPE-19 cell viability in a dose-dependent manner; B:AS-Ⅳ can inhibit the reduction of ARPE-19 cell viability induced by MGO.#P<0.05,##P<0.01vscontrol group;*P<0.05vsMGO group

Fig 2 Effect of AS-Ⅳ on ARPE-19 cell apoptosis by MGO
A: Morphology of cell nucleus observed by Hoechst 33342 staining; B, C: Results of induced cell apoptosis rates examined by Annexin V-FITC/PI with flow cytometry.#P<0.05vscontrol group;*P<0.05vsMGO group

Fig 3 Effect of AS-Ⅳ on MGO-induced oxidative stress in ARPE-19 cells
A, B: AS-Ⅳ can significantly inhibit MGO-induced increase of ROS; C: AS-Ⅳ can significantly inhibit MGO-induced decrease of SOD activity; D: AS-Ⅳ can significantly inhibit MGO induced increase of MDA content.#P<0.05vscontrol group;*P<0.05vsMGO group
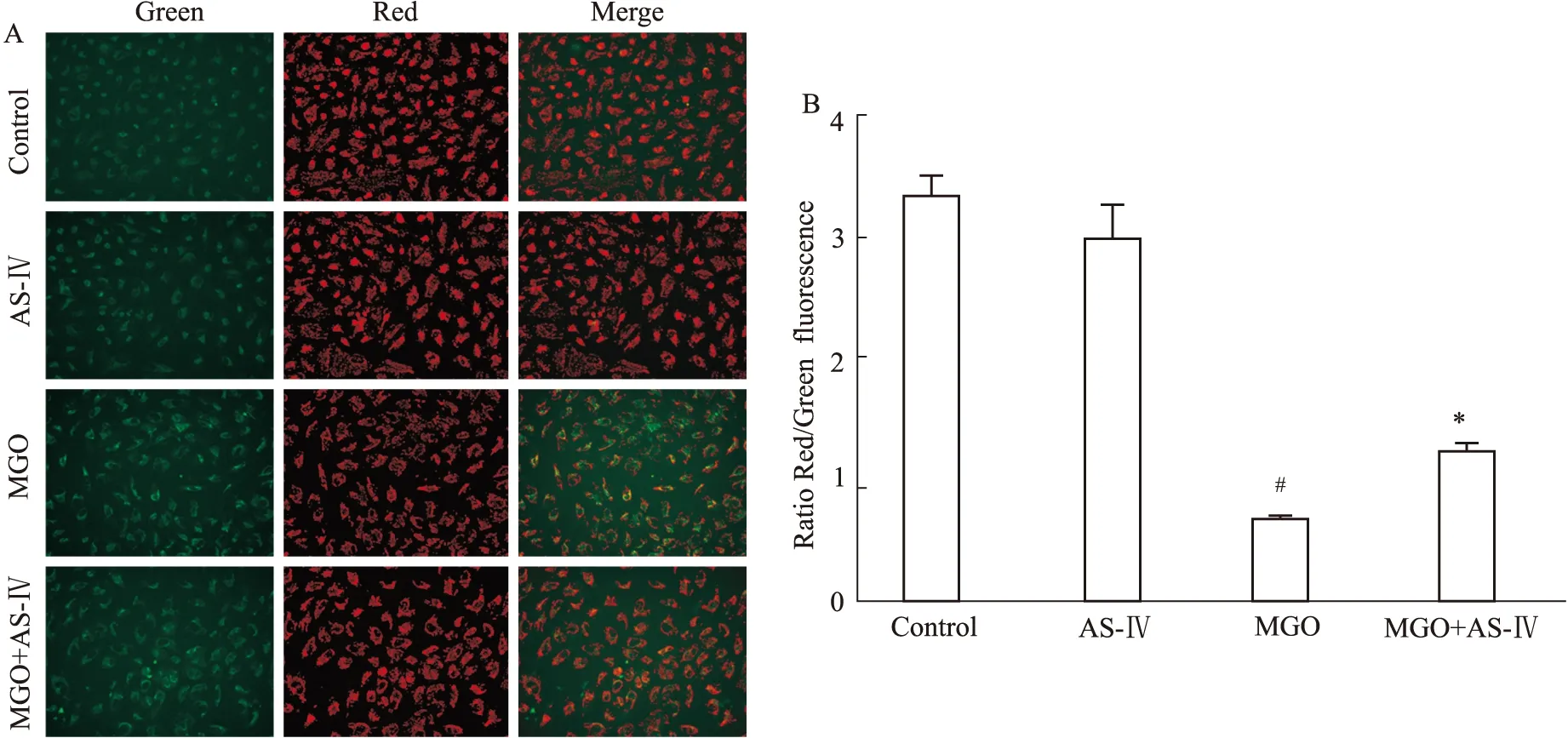
Fig 4 Effect of AS-Ⅳ on mitochondrial membrane potential in ARPE-19 cells
A, B: AS-Ⅳ can significantly inhibit MGO-induced decrease of mitochondrial membrane potential in ARPE-19 cells.#P<0.05vscontrol group;*P<0.05vsMGO group

Fig 5 Effect of AS-Ⅳ on expression of apoptosis related protein in ARPE-19 cells
A ~ C: AS-Ⅳ up-regulates ratio of Bcl-2/Bax and expression of PARP detected by Western blot; D, E: AS-Ⅳ down-regulates activity of caspase-9 and caspase-3.#P<0.05,##P<0.01vscontrol group;*P<0.05vsMGO group
3 讨论
MGO是机体产生的生理代谢产物,健康人体内MGO的浓度约为1 μmol·L-1。糖尿病患者因长期处于高糖状态,体内MGO大量产生并蓄积,MGO浓度为正常人的2 ~ 4倍,并且与血糖水平呈正相关,MGO成为加速DR进展的有害物质[11]。
MGO通过与蛋白质、磷脂和核苷酸形成AGE加合物改变细胞结构和功能[12]。本研究采用MGO损伤的ARPE-19作为细胞模型,研究AS-Ⅳ对ARPE-19细胞的保护作用。结果表明,AS-Ⅳ能够明显抑制MGO诱导的ARPE-19细胞活力的下降;对细胞进行Hoechst 33342染色和Annexin V-FITC/PI双染,发现AS-Ⅳ对细胞核的形态有明显的改善作用,能够减少细胞核皱缩,使细胞核呈均匀蓝染,并且能够明显抑制MGO引起的细胞凋亡。
氧化应激水平的增强在糖尿病并发症(如DR)的发生中起着重要作用[13],ROS的大量产生,破坏了机体内抗氧化防御系统的平衡,导致脂质过氧化物的产生。已有研究显示[14-15],MGO能诱导成骨细胞和内皮细胞氧化应激的产生。本研究发现,MGO通过升高ARPE-19细胞的氧化应激水平而引起细胞损伤,AS-Ⅳ给药后能够减少ROS产生,提高SOD活力,降低MDA水平,从而减轻MGO对ARPE-19细胞造成的损害。由此表明AS-Ⅳ通过抗氧化作用减少氧自由基的产生,提高细胞内的抗氧化酶活性减少脂质过氧化物的产生,从而增强细胞的抗氧化能力。
线粒体的完整性对于细胞的生存至关重要,正常的线粒体膜电位是维持线粒体进行氧化磷酸化、产生三磷酸腺苷的先决条件[16]。活性氧自由基的异常升高能够引起线粒体内膜发生变化,一方面引起线粒体通透性转换孔(mitochondrial permeablity transition pore, MPTP)开放,促凋亡蛋白细胞色素C等被释放至胞质中;另一方面导致线粒体膜电位降低,线粒体膜电位下降是细胞凋亡的早期信号[12]。胞质中的细胞色素C结合并激活APAF-1和caspase-9前体,形成凋亡体,caspase-9前体以这种方式聚集并导致caspas-9的激活,继而活化caspas-3启动caspase级联反应,引发细胞凋亡[17]。Bcl-2家族蛋白对线粒体通路有重要的调控作用,抗凋亡蛋白Bcl-2能够抑制MPTP的开放,减少细胞色素C及凋亡诱导因子的释放,阻止凋亡的发生;促凋亡蛋白Bax正常情况下以单体形式存在于细胞质中,受到凋亡刺激时构象发生变化,导致Bax寡聚体形成并整合到线粒体外膜上,促进细胞色素C的释放,诱导凋亡的发生[18]。通常用Bcl-2和Bax蛋白表达的比率(Bcl-2/Bax)来表示细胞的凋亡情况。本研究发现,MGO可影响Bcl-2家族蛋白的表达,明显降低Bcl-2/Bax比率,提高caspase家族蛋白caspase-9和caspase-3的表达水平,减少caspase-3裂解底物PARP的表达,从而促进ARPE-19细胞凋亡。而AS-Ⅳ能逆转MGO能引起的ARPE-19细胞线粒体膜电位的下降。明显提高Bcl-2/Bax率,下调caspase-9和caspase-3的表达,提高PARP的水平,抑制ARPE-19细胞凋亡。表明AS-Ⅳ通过调节线粒体通路蛋白的表达发挥保护细胞的作用,至于AS-Ⅳ是否通过其他途径如内质网通路和MAPK通路对ARPE-19细胞起保护作用仍需要进一步的研究。
综上所述,AS-Ⅳ能够通过增强细胞的抗氧化能力,提高线粒体膜电位,调节线粒体通路中相关蛋白的表达,从而抑制MGO引起的氧化应激和细胞凋亡,对ARPE-19细胞起到保护作用,并可能在DR中发挥治疗作用。
(致谢:本研究所有实验均在中国医学科学院&北京协和医学院药用植物研究所中药(天然药物)创新药物研发北京市重点实验室进行,感谢中国中医科学院西苑医院实验中心老师们的倾力协助,感谢陈阳老师对实验及文章撰写提供的帮助。)
[1] Wang P,Xing Y,Chen C,et al. Advanced glycation end-product (AGE) induces apoptosis in human retinal ARPE-19 cells via promoting mitochondrial dysfunction and activating the Fas-FasL signaling[J].BiosciBiotechnolBiochem, 2016, 80(2):250-6.
[2] Simó R, Villarroel M, Corraliza L,et al. The retinal pigment epithelium: something more than a constituent of the blood-retinal barrier--implications for the pathogenesis of diabetic retinopathy[J].JBiomedBiotechnol, 2010, 2010:190724.
[3] Kilhovd B K, Giardino I, Torjesen P A, et al. Increased serum levels of the specific AGE-compound methylglyoxal-derived hydroimidazolone in patients with type 2 diabetes[J].Metabolism, 2003, 52(2):163-7.
[4] 陈玉静,李 林,黄小波,等. 脑康Ⅱ号对甲基乙二醛诱导的海马神经元凋亡的影响[J]. 中华中医药杂志, 2010, 25(12):2317-20.
[4] Chen Y J,Li L,Huang X B,et al. Effects of NaoKang II on apoptosis of hippocampal neurons induced by methylglyoxal[J].ChinJTCMP, 2010, 25(12):2317-20.
[5] Stitt A W. AGEs and diabetic retinopathy[J].InvestOphthalmolVisSci, 2010, 51(10):4867-74.
[6] 靳晓飞,张 颖,周晓红,等. 黄芪甲苷对缺氧缺糖/复氧复糖PC12细胞凋亡的影响[J]. 中国药理学通报, 2016, 32(10):1411-5.
[6] Jin X F, Zhang Y, Zhou X H, et al. Effects of astragaloside Ⅳ on apoptosis of PC12 cells induced by hypoxia/hypoglycemia and reoxygenation[J].ChinPharmacolBull, 2016, 32(10):1411-5.
[7] 丁瑜芝,袁松涛,刘 云. 糖尿病周围神经病变及黄芪甲苷对其治疗作用的研究进展[J]. 江苏医药, 2013, 39(15):1817-9.
[7] Ding Y Z, Yuan S T, Liu Y. The research progress of diabetic peripheral neuropathy and the therapeutical effect of astragaloside IV[J].JiangsuMedJ, 2013, 39(15):1817-9.
[8] 陈博南,陈刚毅. 黄芪甲苷对糖尿病肾病大鼠肾脏的保护机制初步研究[J]. 云南中医中药杂志, 2016, 37(2):58-60.
[8] Chen B N, Chen G Y. A preliminary study on the protection mechanism of astragaloside Ⅳ for diatebic nephropathy rats[J].YunnanJTCMMateMed, 2016, 37(2):58-60.
[9] 曹琼丹,杨育红,于胜男,等. 黄芪甲苷对Ⅰ型糖尿病大鼠心肌细胞PGC-1α和NRF-1表达的影响[J]. 中国药理学通报, 2015,31(8):1096-101.
[9] Cao Q D,Yang Y H,Yu S N,et al. Effect of astragaloside IV on expression of PGC-1α and NRF-1 in myocardial cells of type I diatebic rat[J].ChinPharmacolBull, 2015,31(8):1096-101.
[10] 焦伟炜,刘学政. 黄芪甲苷对糖尿病大鼠视网膜Müller细胞的影响[J]. 解剖科学进展, 2015,21(5):512-4.
[10] Jiao W W, Liu X Z. Effect of astragaloside IV on retinal müller cell in diabetic rats[J].ProgAnatSci, 2015,21(5):512-4.
[11] Wang H,Meng Q H,Gordon J R, et al. Proinflammatory and proapoptotic effects of methylglyoxal on neutrophils from patients with type 2 diabetes mellitus[J].ClinBiochem, 2007, 40(16-17):1232-9.
[12] Chan C M, Huang D Y, Huang Y P, et al. Methylglyoxal induces cell death through endoplasmic reticulum stress-associated ROS production and mitochondrial dysfunction[J].JCellMolMed, 2016, 20(9):1749-60.
[13] Giordano C R, Roberts R, Krentz K A, et al. Catalase therapy corrects oxidative stress-induced pathophysiology in incipient diabetic retinopathy[J].InvestOphthalmolVisSci, 2015, 56(5):3095-102.
[14] Suh K S,Choi E M,Rhee S Y,et al. Methylglyoxal induces oxidative stress and mitochondrial dysfunction in osteoblastic MC3T3-E1 cells[J].FreeRadicRes, 2014,48(2):206-17.
[15] Miyazawa N, Abe M, Souma T, et al. Methylglyoxal augments intracellular oxidative stress in human aortic endothelial cells[J].FreeRadicRes, 2010, 44(1):101-7.
[16] 石 静,卿 晨. 线粒体膜电位改变与细胞凋亡[J]. 中国民族民间医药, 2011, 20(7):20-1.
[16] Shi J, Qing C. The change of mitochondrial membrane potential and apoptosis[J].ChinJEthnomedEthnopha, 2011,20(7):20-1.
[17] 梁 凯,曹秉振,陈建魁. 线粒体调控的细胞凋亡研究进展[J]. 生物医学工程与临床, 2014,18(5):501-5.
[17] Liang K, Cao B Z, Chen J K. Progress on cell apoptosis of mitochondrial reguation[J].BMEClinMed, 2014,18(5):501-5.
[18] 周春燕,冯作化.医学分子生物学[M]. 第2版.北京:人民卫生出版社, 2014:181-96.
[18] Zhou C Y, Feng Z H.MedicalMolcularBiology[M]. 2nd ed. Beijing: People’s Medical Publishing House, 2014:181-96.
Protective effect of astragalosides IV on retinal pigment epithelium injury induced by methylglyoxal
ZHOU Yun-feng1, LI Lin1, GE Zheng-yan2, ZHOU Li-dong1, GUO Yu-jie2, JIN Long2, REN Ye2, LI Yan-lin1, SUN Lan1, XU Yang1
[1.BeijingKeyLabofInnovativeDrugDiscoveryofTraditionalChineseMedicine(NaturalMedicine)andTranslationalMedicine,InstituteofMedicinalPlantDevelopment,PekingUnionMedicalCollegeandChineseAcademyofMedicalSciences,Beijing100193,China; 2.ExperimentResearchCenterofXiyuanHospital,ChinaAcademyofChineseMedicalSciences,Beijing100091,China]
Aim To investigate the protective effect of astragaloside IV (AS-Ⅳ) on human retinal pigment epithelium injury induced by methylglyoxal (MGO), and explore its molecular mechanism. Methods The injury of ARPE-19 cells was induced by MGO and the cell viability was measured by CCK-8 method. The morphology of cell nucleus was analyzed by Hoechst 33342 staining and the cell apoptosis was analyzed by flow cytometry to detect labbled Annexin V-FITC/PI. JC-1 staining and fluorescence probe DCFH-DA were employed to evaluate the change of mitochondrial membrane potential and reactive oxygen species (ROS). The levels of SOD, MDA, caspase-9 and caspase-3 were determined by respective kits. Western blot was used to analyse the expression of Bcl-2, Bax and PARP. Results AS-Ⅳ could significantly inhibit the decrease of cell viability induced by MGO, improve the morphology of cell nucleus, reduce the ARPE-19 cell apoptosis rate and the level of ROS and MDA, and increase the activity of SOD. Furthermore, AS-Ⅳ could enhance mitochondrial membrane potential, the ratio of Bcl-2/Bax and the expression of PARP, and inhibit the activation of caspase-9 and caspase-3. Conclusion AS-Ⅳ may protect ARPE-19 cells from the injury induced by MGO by increasing the antioxidant ability of ARPE-19 cells and inhibiting cell apoptosis.
diabetic retinopathy; astragaloside IV; methylglyoxal; retinal pigment epithelium; antioxidation; apoptosis
2017-01-15,
2017-04-10
北京市自然科学基金资助项目(No 7152100);药植所创新团队发展计划(No IT1305)
周云丰(1991-),男,硕士生,研究方向:中药药理学,E-mail:zhouyf1122@126.com; 许 扬(1965-),男,博士,研究员,硕士生导师,研究方向:中药药理学及创新药物,通讯作者,Tel:010-57833234, E-mail:vascular888@126.com
时间:2017-6-7 19:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170607.1904.014.html
10.3969/j.issn.1001-1978.2017.07.007
A
1001-1978(2017)07-0915-07
R284.1;R322.91;R329.25;R587.2;R774.102.2

