三种感染动物阳性血清与口蹄疫病毒重组非结构蛋白的反应原性
孙学强,邵卫星,张如民,南文龙,张兴进,宫枫举,张秀娟,刘 爽
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛立见诊断技术发展中心,山东青岛 266114;3. 郑州职业技术学院,河南郑州 450121)
三种感染动物阳性血清与口蹄疫病毒重组非结构蛋白的反应原性
孙学强1,2,邵卫星1,2,张如民3,南文龙1,张兴进2,宫枫举2,张秀娟1,刘 爽1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛立见诊断技术发展中心,山东青岛 266114;3. 郑州职业技术学院,河南郑州 450121)
本试验通过生物信息学技术比对分析GenBank中口蹄疫病毒(A型、O型和亚洲1型)非结构蛋白的保守序列,根据大肠杆菌密码子偏好性,优化合成了非结构蛋白基因,经过测序和转化,筛选到能够表达重组非结构蛋白的阳性重组菌株。经过Western-blot试验,证明表达的重组非结构蛋白能分别与口蹄疫病毒感染的牛、羊和猪阳性血清发生特异性反应。该重组蛋白待进一步验证后,可用于口蹄疫病毒感染动物的鉴别检测试剂盒研究。
口蹄疫病毒;感染血清;重组非结构蛋白;反应原性
口蹄疫是全球性最重要的动物健康问题之一,在世界大部分地区时有发生,是世界动物卫生组织(OIE)规定的须通报疫病。口蹄疫病毒属于微RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus),有O、A、C、SAT1、SAT2、SAT3及Asia1型7个血清型[1]。口蹄疫病毒的基因组由5´UTR、ORF和3´UTR及PolyA组成,全长约8 500 nt,开放读码框架区(ORF,Open Reading Frame)编码1个多聚蛋白,依次为Lpro蛋白编码区、P1区、P2区和P3区[2-3],基因组结构为VPg_5_ UTR[Lpro/1A—1B—1C—1D—2Anpgp/2B—2C/3A—3B—3C—3D]3_UTR—polyA。用3ABC基因编码的非结构蛋白(Non-structural protein,NSP)为抗原,检测动物体内的NSP抗体是一种很好的区分感染动物和疫苗免疫动物的诊断方法[4]。检测3ABC抗体,免疫动物3ABC抗体阴性,感染动物则为阳性[1]。
大多数发展中国家一直都在通过注射灭活疫苗的办法来控制该病的流行。去除灭活疫苗中的非结构蛋白成为质量控制的关键[5]。随着口蹄疫灭活疫苗纯化工艺的发展[6],研发并应用以口蹄疫病毒NSP为抗原检测动物血清中的特异性抗体,以区别临床病例的感染和免疫,对于口蹄疫的防控意义重大。本试验通过基因优化并合成了表达口蹄疫病毒的非结构蛋白基因,转化表达宿主菌。重组阳性克隆经过诱导后表达的重组NSP能够与牛、羊和猪的病毒感染阳性血清发生特异性反应。该重组蛋白是研究开发口蹄疫病毒非结构蛋白ELISA抗体检测试剂盒的良好候选抗原。
1 材料和方法
1.1 血清、酶和基因合成
经过病毒中和试验验证的牛口蹄疫病毒感染阳性血清、羊口蹄疫病毒感染阳性血清、猪口蹄疫病毒感染阳性血清,由中国农业科学院兰州兽医研究所提供;口蹄疫病毒非结构蛋白基因,由南京金斯瑞生物科技有限公司合成;Taq酶、限制酶,购自宝生物(大连)工程有限公司;大肠杆菌感受态细胞,购自北京全式金生物技术有限公司;硝酸纤维素膜及电泳试剂等,为Sigma公司产品;核酸胶回收试剂盒、质粒小量提取试剂盒、增强型HRPDAB底物显色试剂盒,购自天根生化科技(北京)有限公司;表达载体pET-28a,为本实验室保存;酶标6His标签蛋白单抗,购自英潍捷基(上海)贸易有限公司。
1.2 方法
1.2.1 基因优化合成及鉴定。以NCBI公布口蹄疫病毒(A型、O型和亚洲1型)的非结构蛋白序列通过BLASTP比对,以保守蛋白序列为重组目的蛋白,根据大肠杆菌密码子偏好性进行优化DNA序列,在5´端加入NdeI酶切位点和6His标签蛋白序列,在3´端依次加入终止密码子和HindIII酶切位点序列,委托南京金斯瑞生物科技有限公司合成并克隆至表达载体pET-28a。重组表达载体结构见图1。重组表达质粒鉴定引物FP(5´AATACGACTCACTATAGGG3´)和RP(5´TGCTAGTTATTGCTCAGCGG3´)由生工生物工程(上海)股份有限公司合成。
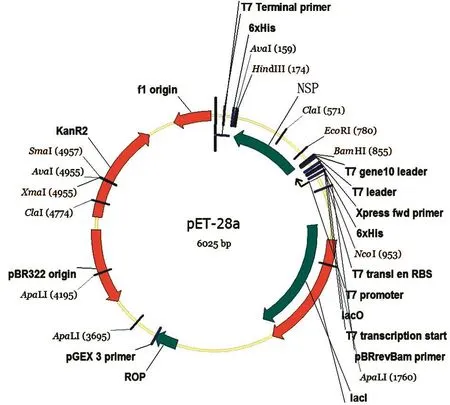
图1 重组表达载体图谱
1.2.2 重组表达载体的鉴定和重组菌株转化。将含有重组表达载体的大肠杆菌接种LB液体培养基37℃培养过夜后,取2 µL菌液用FP和RP进行PCR扩增并电泳鉴定。取2 mL菌液,12 000 r/min 离心120 s,菌体后加入500 µL溶液Ⅰ,充分混匀;加入500 µL溶液Ⅱ后轻柔颠倒混匀至液体清亮;加入700 µL溶液Ⅲ混匀,4 ℃ 13 000 r/min离心 10 min;将上清液体移至吸附柱中,离心60 s;弃滤液,加入500 µL 70%乙醇溶液洗涤,13 000 r/min离心120 s;将吸附柱放入新EP管中,加入 30 µL 洗脱液,然后13 000 r/min 离心1 min,收集的洗脱液中即为重组表达载体。取重组表达载体质粒10 µL、HindIII 1 µL、NdeI 1 µL、10×T Buffer 3 µL、去离子水5 µL,然后进行琼脂糖凝胶电泳。取重组质粒2 µL加入到 100 µL 新鲜的大肠杆菌BL21感受态细胞中,轻柔吹打混匀,冰浴30 min;然后置42 ℃水浴中热休克90 s,迅速置冰中冷却2~3 min;加入800 µL LB培养基,37 ℃ 120 r/min 震荡培养45 min;取100 µL菌液,涂布于含100 µg/mL卡那霉素的LB固体培养基平板上,37 ℃恒温培养16 h。挑取转化后在抗性平板上生长的单菌落,接种于含有卡那霉素抗性的LB液体培养基中培养,培养10 h后,取2 µL菌液用FP和RP进行PCR扩增并电泳鉴定。
1.2.3 非结构蛋白的诱导表达。将鉴定正确的含有重组表达质粒的BL21(DE3)宿主菌的阳性克隆菌株按1:50倍接种于10 mL含1:1 000稀释的卡那霉素的LB液体培养基,37 ℃振荡培养7 h;然后取5 mL加入IPTG至终浓度1 mmol/L,37 ℃振荡培养进行诱导表达。诱导6 h后,所有样品各取0.5 mL,13 000 r/min离心60 s,移出上清液加入蛋白电泳载样缓冲液;沉淀细菌加入40 µL PBS重悬沉淀,充分混匀后加入蛋白电泳载样缓冲液;100 ℃水浴10 min,13 000 r/min离心5 min,各取10 µL上清进行SDS-PAGE检测。
1.2.4 三种动物感染阳性血清与重组蛋白的反应原性。按照常规方法制备12%分离胶和5%的浓缩胶,每孔上样5 µL,80 V进行电泳浓缩,当溴酚蓝进入分离胶后改变电压为120 V。采用半干法转印至NC膜,用5%的脱脂奶封闭过夜;将样品转印膜分别在含有20 µL酶标6His标签蛋白单抗、牛口蹄疫病毒感染阳性血清、羊口蹄疫病毒感染阳性血清和猪口蹄疫病毒感染阳性血清的20 mL TBST中37 ℃孵育1 h后,用TBST洗涤2次,每次10 min;三种阳性血清孵育的转印膜在含有20 µL HRP-SPA的TBST中37℃孵育1 h,然后用TBST洗涤2次,用DAB显色约30 s后终止反应,晾干观察。
2 结果
2.1 重组表达载体的合成目的基因序列分析
根据测序报告,将优化合成的非结构蛋白基因序列进行翻译;对翻译后的蛋白序列经过GenBank比对,发现与口蹄疫病毒A型、O型和Asia 1型的非结构蛋白同源性达到96%。
2.2 重组表达载体的PCR和酶切鉴定
将含有重组表达载体的大肠杆菌接种LB液体培养基37 ℃培养过夜后,取2 µL菌液用FP和RP进行PCR扩增,对产物经过电泳后在凝胶成像系统下观察,结果出现特定长度的扩增片段。对培养物小提质粒后,用HindIII和NdeI双酶切,产物经过电泳也出现与PCR鉴定相同长度的目的基因片段(图2)。
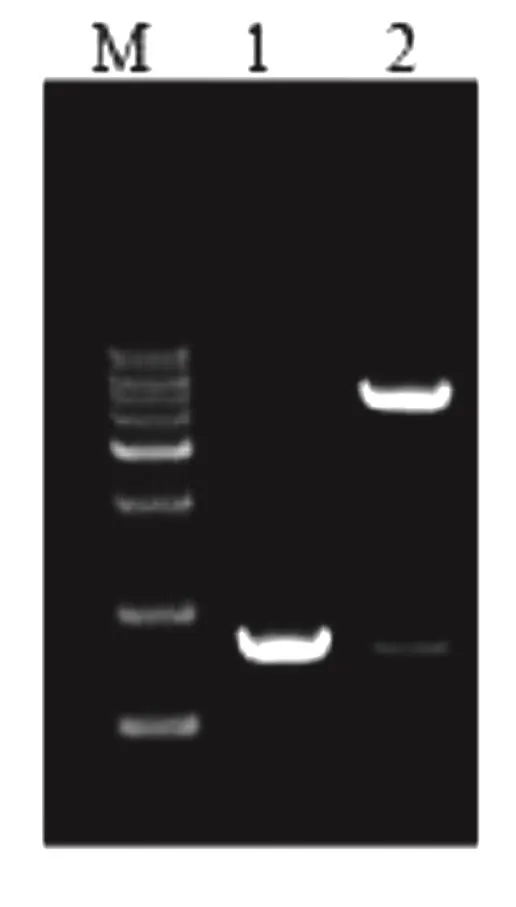
图2 重组表达载体的PCR和酶切鉴定电泳图谱
2.3 重组菌株转化和诱导表达
将鉴定正确的含有重组表达质粒,以热激法转化化学感受态BL21(DE3)宿主菌,经过PCR鉴定,在阳性克隆菌株中出现特定长度的扩增条带。将阳性克隆菌株接种于10 mL含卡那霉素的LB液体培养基培养7 h后,用 IPTG诱导6 h,制备诱导后的菌体和上清蛋白样品,然后进行SDS-PAGE。凝胶经过染色后观察发现,诱导前的菌体和上清以及诱导后的上清均未出现表达条带,诱导后菌体出现丰度较高的表达条带(图3)。
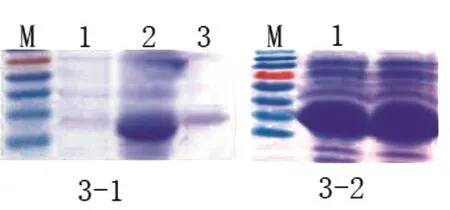
图3 重组阳性克隆诱导产物SDS-PAGE图谱
2.4 三种动物感染阳性血清与重组非结构蛋白的反应结果
将诱导后的培养物上清和菌体蛋白电泳样品进行适当稀释后,再次进行SDS-PAGE电泳。用半干法将PAGE胶上的蛋白条带转印至NC膜,进行western-blot试验。转印的NC膜经过封闭后分别与酶标6His标签蛋白单抗、牛口蹄疫病毒感染阳性血清、羊口蹄疫病毒感染阳性血清、猪口蹄疫病毒感染阳性血清各20 µL进行反应,最后参照增强型HRP-DAB底物显色试剂盒说明书进行显色。观察显色条带,发现酶标6His标签蛋白单抗与重组非结构蛋白出现杂交条带,表明构建、鉴定和筛选的重组质粒以及含有重组质粒的菌株能够表达完整的重组目的蛋白;表达的重组蛋白与牛、羊和猪口蹄疫病毒感染阳性血清反应均出现杂交条带,证明筛选的阳性克隆菌株能够诱导产生的重组非结构蛋白能够与牛、羊、猪口蹄疫病毒感染阳性血清发生反应,而且反应原性良好(图4)。
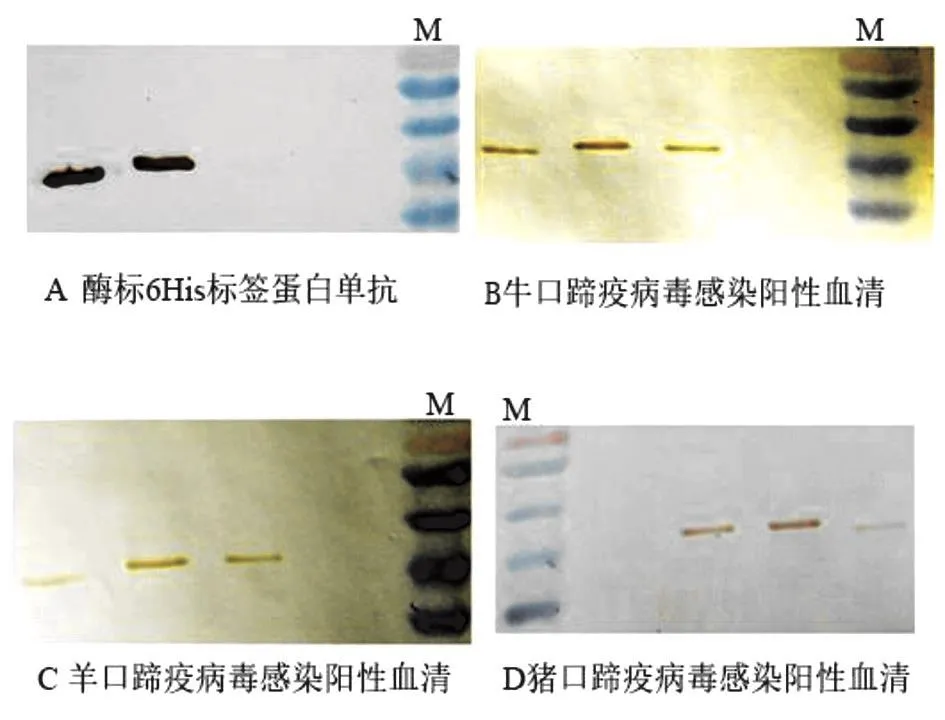
图4 牛、猪、羊感染阳性血清及酶标6His标签蛋白单抗与重组非结构蛋白图谱的western-blot图谱
3 讨论
口蹄疫是由口蹄疫病毒引起的一种急性、热性、高度接触传染性动物疫病。目前,我国仍是口蹄疫危害较为严重的国家之一,流行情况比较复杂。O型、Asia 1型、A型3种血清型口蹄疫病毒并存,猪牛羊等易感动物都有感染。我国当前主要的口蹄疫预防方针是实行区域化管理,严格落实免疫预防、监测净化等防治措施。在监测与流行病学调查方面,县级动物疫病预防控制机构以抗体监测和病原学初筛为主;地市级和省级动物疫病预防控制机构以病原学监测为主[7]。因此,口蹄疫病毒非结构蛋白的检测试剂对于口蹄疫防控工作至关重要,研究开发能够满足需求的检测试剂盒意义重大。
本试验通过基因优化合成获得非结构蛋白的目的基因,未采用提取口蹄疫病毒RNA通过RTPCR获得目的基因。这不但避免了直接操作一类病原微生物存在的生物安全风险,同时根据遗传密码子的简并性和大肠杆菌密码子偏好性,也提高了目的基因能够在大肠杆菌宿主菌中的表达效率。本试验中选择3种感染动物的阳性血清对重组表达蛋白进行免疫杂交,其试验结果和筛选到的阳性克隆更有利于下游的试验设计和开展。但是,对于所用的3种动物阳性血清,由于条件限制,未能确定其感染的口蹄疫病毒亚型。对于该重组蛋白与3种易感动物感染口蹄疫病毒不同亚型的阳性血清以及免疫动物的阳性血清的反应原性,已通过建立ELISA方法得到了进一步验证,相关研究结果和数据另文发表。
利用口蹄疫病毒重组NSP建立检测方法的研究报道很多,有的是用病毒基因组直接提取核酸克隆NSP基因进行原核表达[8],有的用酵母细胞进行表达[9],有的建立了ELISA抗体检测方法[10-11],有的研发胶体金试纸条[12],有的建立了斑点免疫金渗滤法[13],而且有报道国内生产的口蹄疫非结构蛋白3ABC抗体检测试剂盒可以用于牛口蹄疫血清学筛选性试验[14]。本试验获得的表达口蹄疫重组非结构蛋白能够与牛、羊和猪的病毒感染阳性血清发生特异性反应,可以作为研究开发口蹄疫病毒非结构蛋白多种抗体检测试剂盒的良好候选抗原。
[1] 陆承平. 兽医微生物学[M]. 5版. 北京:中国农业出版社,2013:555.
[2] 刘庆军,张永光. 口蹄疫病毒基因组结构及其功能[J].动物医学进展,2005(5):1-5.
[3] 孙靖,于海峰. 口蹄疫病毒基因组结构及功能[J]. 沧州师范专科学校学报,2007(4):116-118.
[4] 朱咏梅,朱来华,郑小龙,等. 口蹄疫非结构蛋白研究进展[J]. 中国动物检疫,2011(5):83-86.
[5] 陈君彦,赵丽霞,关平原. 关于通过监测非结构蛋白抗体来评价口蹄疫疫苗纯度的研究进展[J]. 国外畜牧学(猪与禽),2016(4):67-69.
[6] 赵丽霞,关平原,陈君彦,等. 通过检测非结构蛋白抗体评价口蹄疫疫苗纯度的研究[J]. 中国兽药杂志,2015(4):17-20.
[7] 农业部. 关于印发 《国家口蹄疫防治计划(2016-2020年)》的通知:农医发〔2016〕39号[A]. 北京:农业部,2016-08-22.
[8] 曹轶梅,刘在新,卢曾军,等. 口蹄疫病毒非结构蛋白基因3ABC在大肠杆菌中的高效表达[J]. 畜牧兽医学报,2004(1):115-118.
[9] 李夏莹,郑鹭飞,张秀杰,等. 口蹄疫病毒研究进展 [J].中国畜牧兽医,2015(7):1910-1916.
[10] 王娜. 口蹄疫病毒非结构蛋白3A单抗结合肽的鉴定及阻断ELISA方法的建立[D]. 兰州:甘肃农业大学,2014.
[11] 祝秀梅,卢曾军,胡永浩,等. 检测猪血清口蹄疫病毒非结构蛋白3AB抗体ELISA方法的建立[J]. 甘肃农业大学学报,2008(1):33-37.
[12] 吴磊. 口蹄疫病毒非结构蛋白2C3AB抗体胶体金检测试纸的研制[D]. 北京:中国农业科学院,2010.
[13] 孔繁德,朱文钏,林祥梅,等. 检测口蹄疫病毒非结构蛋白3AB抗体的斑点免疫金渗滤法的建立[J]. 中国兽医科学,2010(7):717-721.
[14] 王玉玲,张俊哲,王可,等. 国内外口蹄疫非结构蛋白3ABC抗体ELISA检测方法的比较[J]. 中国兽医杂志,2015(8):79-81.
(责任编辑:朱迪国)
Reactionogenicity of Foot-and-mouth Disease Virus Recombinant Non-structural Protein against the Positive Sera of Infected Bovine,Goat and Swine
Sun Xueqiang1,2,Shao Weixing1,2,Zhang Rumin3,Nan Wenlong1,Zhang Xingjin2,Gong Fengju2,Zhang Xiujuan1,Liu Shuang1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Regen Diagnostics Development Center,Qingdao,Shandong 266114;3. Zhengzhou Technical College,Zhengzhou,Henan 450121)
The conserved non-structural protein(NSP)sequence of Foot-and-mouth disease virus(type A,type O and type Asia 1)was conf i rmed by blastp from GenBank. The DNA sequence coding the truncated conserved NSP was optimized according to the bias ofE. coli. It was synthesized and cloned to expression vector. After sequencing and transformation,the positive recombinant strains expressing recombinant NSP were screened. Using western-blot,it was conf i rmed that the recombinant truncated NSP could react against with the positive sera of infected bovine,goat and swine. So that,the recombinant truncated NSP could be used as an antigen to develop the DIVA diagnostics kits.
FMDV;infected positive sera;recombinant non-structural protein;reactionogenicity
S852.65
:B
:1005-944X(2017)07-0092-05
10.3969/j.issn.1005-944X.2017.07.026
科技部科技基础性工作专项(2012FY111000)

