高效液相色谱法测定发酵液中的D-核糖与葡萄糖
崔凤杰,胡婉君,周珏,孙文敬,魏转,徐勤华,刘长峰
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.河北化工医药职业技术学院,河北石家庄050026;3.山东德普化工科技有限公司,山东泰安271200)
高效液相色谱法测定发酵液中的D-核糖与葡萄糖
崔凤杰1,胡婉君1,周珏1,孙文敬1,魏转2,徐勤华3,刘长峰3
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.河北化工医药职业技术学院,河北石家庄050026;3.山东德普化工科技有限公司,山东泰安271200)
以RID为检测器,建立高效液相色谱法定量测定发酵液中葡萄糖和D-核糖的方法。该方法的测定条件为:柱型Shodex Suger SH1011,流动相为0.005 mol/L的稀硫酸溶液,柱温为50℃,进样量为10 μL。底物葡萄糖和产物D-核糖的出峰时间分别为11.573 min和13.313 min。得到底物葡萄糖和产物D-核糖的回归方程分别为Y=6.868 4X-0.069 1和Y=6.556 5X+0.004 6,其中Y为葡萄糖或D-核糖的质量浓度,X为对应的峰面积。线性范围在2 g/L~45 g/L时,该法精密度、稳定性和重现性均良好;葡萄糖的平均回收率为99.27%,D-核糖的平均回收率为99.61%,RSD值分别为0.38%和0.14%,说明本方法准确可行。
D-核糖;高效液相色谱法;糖类检测
D-核糖又称D-呋喃核糖,是一种功能性的五碳糖,广泛存在于核糖核酸、NAD、NADP及FAD等中,具有抗衰老、调节体内血糖、血脂含量等功能[1-3]。D-核糖也是诸多药物或食品添加剂合成的中间体和平台化合物[4-5]。在工业生产中,D-核糖的发酵底物一般为淀粉水解糖,其主要成分为葡萄糖。因此,在微生物发酵生产D-核糖过程中,主要涉及底物葡萄糖和产物D-核糖的检测和分析。目前,国际上公认的D-核糖的检测方法主要有苔黑酚法[6]和HPLC法。苔黑酚法[7]虽然有较高的实用性和经济性,但样品的处理过程比较复杂,检测时间也偏长,并且样品中的葡萄糖对检测结果的干扰性较大,可能会导致测定误差较大。近年来,相关的国外文献中有关D-核糖的检测方法均为HPLC法[8-10]。
本文研究了HPLC-RID法同时检测发酵液中D-核糖和葡萄糖,并对其进行方法学考察[11-14],为建立快速、简便、准确的D-核糖和葡萄糖的定量分析方法提供参考。
1 材料与方法
1.1 仪器和试剂
Agilent1100型高效液相色谱仪:安捷伦科技有限公司;FA1004型电子分析天平:上海越平科学仪器有限公司;SW-CJ-2F型双人双面垂直净化工作台:上海博迅实业有限公司;YXQ-WF32型卧式方形压力蒸汽灭菌锅:天水华圆医疗器械有限公司;HYL-C型组合式摇床:太仓市强乐试验设备有限公司;DHP-9272型电热恒温培养箱:上海一恒科技有限公司;TGL-18M型台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司。
菌种:枯草芽孢杆菌(Bacillus subtilis)UJS0717:江苏大学生物工程研究所选育并保藏。
D-核糖发酵液:江苏大学生物工程研究所自制;D-核糖:纯度≥99%,Sigma-Aldrich;葡萄糖、硫酸:分析纯,国药集团化学试剂有限公司;甲醇:色谱级,美国Tedia公司;纯净水:杭州娃哈哈集团。
1.2 方法
1.2.1 培养基制备
斜面培养基(g/L):山梨醇 5,蛋白胨 10,NaCl 2,酵母膏2,琼脂20,用1 mol/L的 HCl或1 mol/L的NaOH溶液调节pH至7.0。该培养基用于菌种保藏及活化。
种子培养基(g/L):葡萄糖 20,酵母膏 3,K2HPO43,KH2PO41,用1 mol/L的HCl或1 mol/L的NaOH溶液调节pH至7.0。该培养基用于发酵种子液的制备。
发酵培养基(g/L):玉米淀粉水解液120 g/L(以葡萄糖计),玉米浆 15,(NH4)2SO47.5,酵母粉 1.0,MnSO4·H2O 0.05,CaCO320。用5 mol/L的HCl或NaOH溶液调节pH至7.0。该培养基用于发酵生产D-核糖。
1.2.2 菌种活化及保藏
将配好的斜面培养基在121℃下灭菌20 min,待冷却后接入一环菌种,并置于36℃的恒温培养箱中培养24 h。可将培养好的斜面放置于4℃的冰箱中保藏。
1.2.3 种子培养
挑取试管中的一环菌种接至种子培养基中(每250 mL锥形瓶中装20 mL种子培养基),在36℃、240 r/min组合式摇床上培养20 h。
1.2.4 D-核糖发酵液制备
将培养好的种子液按照10%的接种量,接种至装有20 mL发酵培养基的250 mL锥形瓶中进行发酵,在36℃、240 r/min组合式摇床上培养。
1.2.5 D-核糖和葡萄糖标品溶液制备
准确称取适量的D-核糖标品(纯度≥99%)和葡萄糖标品(纯度99%),用0.005 mol/L的稀硫酸溶液配制成不同浓度的D-核糖和葡萄糖混合标准品溶液,稀释成的浓度分别为 2、4、5、6、8、10、15、30、45 g/L。
1.2.6 HPLC条件
色谱柱:ShodexSugerSH1011(8.0mmI.D×300mm);流动相:0.005 mol/L的稀硫酸溶液;流速:0.6 mL/min;检测器:示差检测器;柱温:50℃;进样量:10 μL。
1.2.7 D-核糖发酵液样品预处理
利用台式高速离心机,将D-核糖的发酵液在4 200 r/min下离心15 min,来除去菌体和其他杂质,并将上清液稀释适当倍数后用0.45 μm的水系微孔滤膜过滤后备用。
1.2.8 数据处理
2 结果与讨论
2.1 D-核糖和葡萄糖的标准曲线及回归方程
先分别将葡萄糖和D-核糖的标品溶液进行HPLC分析,再在相同的条件下对底物葡萄糖和产物D-核糖的混合标准品进行分析,结果如图1和图2所示。从图中可以看出,葡萄糖的保留时间为11.573 min,D-核糖的保留时间为13.313 min。
相同色谱条件下,用HPLC依次测定浓度为2、4、5、6、8、10、15、30、45 g/L 的 D-核糖和葡萄糖的混合标准品溶液,并记录不同的峰面积。再对混合液的色谱图峰面积测定结果进行线性回归,得到的葡萄糖线性回归方程为:Y=6.868 4X-0.069 1;D-核糖的线性回归方程为:Y=6.556 5X+0.004 6,式中Y为葡萄糖或D-核糖的质量浓度(g/L),X为对应的峰面积。葡萄糖的线性回归方程的决定系数R2=0.999 9,D-核糖的线性回归方程的决定系数R2=0.999 8,t检验和F检验的结果都表示为显著,说明葡萄糖和D-核糖在质量浓度为2 g/L~45 g/L的范围内都成良好的线性关系,葡萄糖和D-核糖的标准曲线如图3和4所示。
2.2 精密度试验
随机抽取一组样品溶液来进行精密度的测定。用HPLC对该样品进行连续重复测定5次,并记录峰面积值,并计算相对标准偏差RSD,具体结果如表1所示,葡萄糖和D-核糖的RSD值分别为0.68%和0.84%,表明本方法精密度良好。

图1 葡萄糖和D-核糖标准品的HPLC图Fig.1 HPLC spectrum of glucose and D-ribose standands

图2 葡萄糖和D-核糖混合标准品的HPLC图Fig.2 HPLC spectrum of mixed glucose and D-ribose standards

图3 高效液相色谱测定葡萄糖的标准曲线Fig.3 Standard curve of glucose determined by HPLC

图4 高效液相色谱测定D-核糖的标准曲线Fig.4 Standard curve of D-ribose determined by HPLC
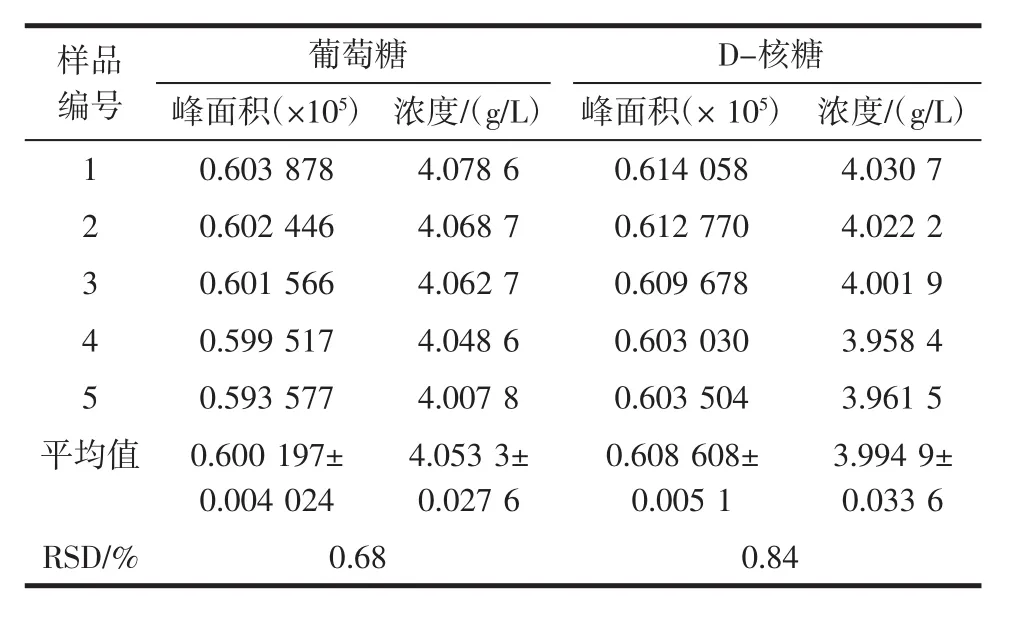
表1 精密度结果Table 1 Precision of experiment results
2.3 稳定性试验
稳定性结果见表2。将样品溶液在室温下放置0、1、2、3、4 h后,在相同的色谱条件下用HPLC测定其峰面积值。再根据相应的线性回归方程来计算样品溶液中的葡萄糖和D-核糖的质量浓度,其RSD值分别为1.89%和1.94%,由表2分析可知样品溶液在4 h内的稳定性良好。

表2 稳定性结果Table 2 Stability of experiment results
2.4 重现性试验
取5份相同的D-核糖发酵液,在相同的色谱条件下,用HPLC测定并记录峰面积值。依据线性回归方程计算发酵液中葡萄糖和D-核糖的质量浓度,其RSD值分别为1.23%和1.17%,结果发现本法重现性较好(表 3)。

表3 重现性结果Table 3 Reproducibility of experiment results
2.5 加标回收率
加标回收率是检验待测样品在前处理和仪器检测中的损失情况,以此来评估检测方案的可行性。准确吸取5份体积为25 mL,葡萄糖和D-核糖的质量浓度分别为26.35 g/L和20.21 g/L的D-核糖发酵液于50 mL的容量瓶中,分别向这5份溶液中加入5 mL的葡萄糖和D-核糖的质量浓度都为2.0 g/L的标准品混合溶液。用0.005 mol/L的稀硫酸溶液定容至50 mL后,用HPLC测定并记录各峰面积值,再依据线性回归方程来计算溶液中葡萄糖和D-核糖的质量浓度。结果如表4所示,葡萄糖的平均回收率为99.27%,D-核糖的平均回收率为99.61%,RSD值分别为0.38%和0.14%,说明本方法准确可行。

表4 加标回收率结果Table 4 Recovery rates of experiment results
3 结论
本文以RID为检测器,建立了HPLC-RID同时定量检测了发酵液中D-核糖和葡萄糖的方法,方法简便、准确、灵敏度高,稳定性和重现性好。所采用的色谱条件可将底物葡萄糖和产物D-核糖有效分离,显著减少了葡萄糖对D-核糖检测结果的干扰。该方法的建立为同时定量分析发酵液中D-核糖和葡萄糖和准确评价生产菌株的葡萄糖利用效率和D-核糖合成得率提供了技术支持。
[1]王亚坤,孙文敬,秦丽,等.D-核糖功能与应用研究进展[J].食品科学,2005,26(8):486-489
[2]秦海宏,王小平,郭俊生,等.D-核糖对果蝇抗衰老和小鼠耐缺氧时间的影响[J].中国老年学杂志,2002,22(1):49-51
[3]阿丽玛,田明杰,韩涛,等.D-核糖对高脂喂饲小鼠胰岛素抵抗的影响[J].营养学报,2013,35(2):142-145
[4]PARK YC,KIM SG,PARK K,et al.Fed-batch production of D-ribose from sugar mixtures by transketolase-deficient Bacillus subtilis SPK1[J].Applied Microbiology and Biotechnology,2004,66(3):297-302
[5]于文兵,严正,高丽丽,等.核糖与运动能力[J].南京体育学院学报:自然科学版,2002,1(3):1-9
[6]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:20-21
[7]伍时华,方杰.地衣酚法定量测定发醇液中D-核糖的研究[J].广西工学院学报,2000,11(4):55-58
[8]SRIVASTAVA RK,MAITI SK,DAS D,et al.Metabolic flexibility of d-ribose producer strain of Bacillus pumilus under environmental perturbations[J].Journal of Industrial Microbiology&Biotechnology,2012,39(8):1227-1243
[9]DE WULF P,SOETAERT W,SCHWENGERS D,et al.Screening and mutational improvement of a D-ribose secreting Candida pelliculosa strain[J].Journal of Fermentation and Bioengineering,1996,82(1):1-7
[10]PARK YC,CHOI JH,BENNETT GN,et al.Characterization of D-ribose biosynthesis in Bacillus subtilis JY200 deficient in transketolase gene[J].Journal of Biotechnology,2006,121(4):508-516
[11]邹小娟,谢和兵,钱芳,等.HPLC法测定苦杏仁中苦杏仁苷含量的方法研究[J].中国药事,2009(1):33-36
[12]戴助.HPLC法测定眼用伏立康唑纳米结晶混悬液含量[J].长江大学学报自然科学版:医学(下旬),2014,11(8):90-92
[13]张建辉,杨代明,吴廷瑞,等.HPLC法和紫外分光光度法测定葛根淀粉中葛根素含量的研究[J].食品与机械,2007,22(6):110-112
[14]王静,韩正洲,杨立伟,等.HPLC和UPLC法对比测定千里香药材中九里香酮的含量[J].药物分析杂志,2010(8):1499-1501
Determination of D-Ribose and Glucose by High Performance Liquid Chromatography Detection
CUI Feng-jie1,HU Wan-jun1,ZHOU Jue1,SUN Wen-jing1,WEI Zhuan2,XU Qin-hua3,LIU Chang-feng3
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,Jiangsu,China;2.Hebei Chemical and Pharmaceutical College,Shijiazhuang 050026,Hebei,China;3.Shandong Depu Chemical Technology Co.,Ltd.,Tai'an 271200,Shandong,China)
A rapid HPLC method for simultaneously and quantitatively determining the D-ribose and glucose with RID-detector was established as:Shodex Suger SH1011 column,0.005 mol/L of diluted sulfuric acid solution as the mobile phase,column temperature of 50 ℃ and the injection volume was 10 μL.Retention time of glucose and D-ribose was 11.573 min and 13.313 min,respectively.The regression equations of glucose and D-ribose were Y=6.868 4X-0.069 1 and Y=6.556 5X+0.004 6,respectively,in which Y means concentration of glucose/D-ribose and X means the peak area ratio.Within the linear range of 2 g/L-45 g/L,the precision,stability and reproducibility of the established method was good.The average coefficient of recovery of glucose and D-ribose were 99.27%and 99.61%,RSD were 0.38%and 0.14%respectively,which revealed that the method was accurate and credible.
D-ribose;high performance liquid chromatography(HPLC);determination of saccharide
2016-10-09
10.3969/j.issn.1005-6521.2017.14.031
山东省泰安市科技发展计划项目(201340629);江苏大学“青年骨干教师培养工程”青年学术带头人培育计划项目;江苏大学高级专业人才科研启动基金项目(08JDG029)
崔凤杰(1980—),男(汉),教授,博士研究生,研究方向:食品生物技术。

