固定化纤维素酶提取牡丹叶黄酮的研究
李佩艳,尹飞
(1.河南科技大学食品与生物工程学院,河南洛阳471023;2.河南科技大学农学院,河南洛阳471023)
固定化纤维素酶提取牡丹叶黄酮的研究
李佩艳1,尹飞2
(1.河南科技大学食品与生物工程学院,河南洛阳471023;2.河南科技大学农学院,河南洛阳471023)
以大孔树脂DM130为载体,考察给酶量、戊二醛浓度、固定化温度、固定化时间4个单因素对固定化纤维素酶提取牡丹叶黄酮的影响,通过正交试验确定固定化纤维素酶提取牡丹叶黄酮的最佳提取工艺。试验结果表明,DM130大孔吸附树脂固定化纤维素酶的最佳工艺参数为:纤维素酶浓度为1.25 mL/g固定化载体、戊二醛浓度为2%、固定化温度为50℃、固定化时间为3 h,牡丹叶黄酮提取率可达1.95%。制备的固定化酶使用4次后牡丹叶黄酮提取率仍达固定化酶第一次提取时的85.13%,说明制备的固定化纤维素酶在牡丹叶黄酮提取中具有良好的效果。
纤维素酶;大孔树脂;固定化;牡丹叶;黄酮
大孔树脂是人工合成的多孔立体结构聚合物,比表面积较大,具有不溶于酸、碱、有机溶剂等特点,已广泛用于多种活性成分的提取[1-2]。大孔树脂可作为固定化酶载体,可通过范德华力或氢键等分子间作用力对酶分子进行吸附,再通过交联剂戊二醛提高其吸附稳定性而制备固定化酶[3]。目前已有很多研究报道表明采用大孔树脂固定化脂酶[4]、果胶酶[5]、脂肪酶[6-7]、核酸酶[8],均取得较好的固定化效果。由于大孔树脂价格低廉,制备固定化酶方法简便,极易回收利用,且重复利用次数多,因此大孔树脂作为固定化酶的载体越来越受到关注。
牡丹(Paeonia suffruticosa Andr.),毛莨科、芍药属,是重要的观赏植物和药用植物。牡丹种质资源丰富,种植面积大,在我国已经成为广泛栽培的一种经济作物,主要分布于河南、山东、湖北、甘肃、重庆、安徽等省[9]。对牡丹的研究大都集中在牡丹花上[10-12],对于牡丹叶的研究报道较少。牡丹叶是牡丹的主要副产品,其产量也相当可观,每年花期过后大量的牡丹叶无人问津,造成了极大的浪费。牡丹叶含有黄酮等多种活性物质[13-14],开发利用价值大,若对其进行深加工利用,则会产生极大的经济效益。
酶法提取是黄酮类化合物提取常用的方法之一,它在有机溶剂提取的基础上,利用纤维素酶、果胶酶等将细胞壁降解,使植物中的有效成分暴露出来,从而提高其提取效果[15];其中纤维素酶在黄酮类化合物提取中应用较多,很多文献报道纤维素酶可提高植物黄酮提取得率[16-17]。然而,目前酶法提取牡丹叶黄酮大都采用游离酶提取[18],酶不能回收反复利用,因此酶消耗量大,造成了极大的浪费;如果将酶制备成固定化酶则可重复利用,这将大大降低黄酮提取过程中酶的用量,减少不必要的浪费,降低黄酮提取的成本。因此,本试验采用大孔树脂为载体固定纤维素酶,并将制备的固定化酶应用到牡丹叶黄酮的提取,为牡丹叶黄酮的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
牡丹叶:采摘于河南科技大学,品种为“洛阳红”;大孔树脂(S-8、D101、AB-8、DM130、X-5 树脂):安徽三星树脂科技有限公司;纤维素酶(酶活力单位为10 000 U/mL):和氏璧生物技术有限公司;戊二醛、氢氧化钠:天津市科密欧化学试剂有限公司;乙醇:天津市鼎盛鑫化工有限公司;亚硝酸钠:天津市福晨化学试剂厂;硝酸铝:天津市化学试剂三厂;盐酸:陕西化学试剂一厂;3,5-二硝基水杨酸(DNS):国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器
101-2-BS电热鼓风干燥箱:上海市跃进医疗器械厂;722N 722N型分光光度计:上海市精科仪器厂;HH-4恒温水浴锅:江苏省金坛市亿通电子有限公司;台式循环水真空泵:河南省巩义市英峪仪器厂。
1.3 方法
1.3.1 固定化纤维素酶的制备方法及酶活力测定
大孔树脂预处理方法参照赵玉芬等[19]方法进行。将经过预处理的大孔树脂抽干,准确称取1.0 g树脂于三角瓶中,加入1 mL纤维素酶溶液(酶活力单位为100 00 U/mL),混匀,将三角瓶置于摇床上,室温下吸附一段时间后加入戊二醛交联,之后收集树脂并抽干,洗涤后得到固定化纤维素酶。
采用王华等[20]方法测定固定化纤维素酶活性。在50℃、pH 4.8条件下,取1 g固定化酶,加入2 mL 1%羧甲基纤维素钠溶液,50℃水浴30 min,加入6 mL DNS试剂振摇后,沸水浴10 min,冷却,加蒸馏水定容至50 mL,用紫外分光光度法测定溶液在540 nm下的吸光度值。固定化纤维素酶活定义为:1 g固定化酶在50℃、pH 4.8条件下,每分钟水解底物羧甲基纤维素钠产生1 μmol葡萄糖所需的酶量为1个酶活性单位(U)。
1.3.2 牡丹叶黄酮提取及测定方法
固定化纤维素酶法提取牡丹叶黄酮参照李佩艳等[14]方法进行。准确称取牡丹叶粉末1.0 g,加入蒸馏水40 mL,调节pH值为4.5,加入1 g固定化纤维素酶,酶解温度为45℃下酶解4 h,30目筛过滤,加入60%乙醇溶液在70℃下浸提3 h,定溶至100 mL,测定牡丹叶黄酮含量,按下式计算牡丹叶黄酮提取率。
牡丹叶黄酮提取率/%=牡丹叶中提取黄酮质量/牡丹叶质量×100
1.3.3 纤维素酶固定化载体的筛选
以 S-8、D101、AB-8、DM130、X-5 大孔吸附树脂作为固定化纤维素酶的载体,各取上述大孔树脂1.00 g,按照1.3.1方法固定化纤维素酶,按1.3.2方法测定不同固定化纤维素酶对牡丹叶黄酮提取率的影响,确定纤维素酶的最佳固定化载体。
1.3.4 单因素试验
分别考察给酶量(0、0.25、0.5、0.75、1、1.25、1.5 mL/g固定化载体)、戊二醛浓度(1%、2%、3%、4%、5%、6%、7%)、固定化温度(30、40 、50、60、70 ℃)、固定化时间(1、2、3、4、5、6、7 h)对牡丹叶黄酮提取率的影响。
1.3.5 正交试验
以单因素试验结果为基础,设计四因素三水平L9(34)正交试验,得出固定化纤维素酶提取牡丹叶黄酮的最佳工艺参数。
1.3.6 固定化纤维素酶重复利用次数对牡丹叶黄酮提取率的影响
按1.3.2方法进行牡丹叶黄酮提取,1.0 g牡丹叶粉末,加入1 g固定化酶进行酶解提取,之后将固定化酶回收,用蒸馏水清洗3遍,重复使用,考察固定化纤维素酶重复利用次数对牡丹叶黄酮提取率的影响。
2 结果与分析
2.1 固定化载体的选择
不同载体制备固定化纤维素酶对牡丹叶黄酮提取率的比较见表1。
由表1可看出,以DM130为载体制备的固定化纤维素酶对牡丹叶黄酮提取效果最好,牡丹叶黄酮提取率可达1.56%,因此选用DM130作为纤维素酶的最佳固定化载体。
2.2 单因素试验
2.2.1 给酶量对牡丹叶黄酮提取率的影响
给酶量对牡丹叶黄酮提取率的影响见图1。

表1 不同载体制备固定化纤维素酶对牡丹叶黄酮提取率的比较Table 1 Comparison of immobilized cellulase prepared by different carrier on peony leaves flavonoids extraction yield
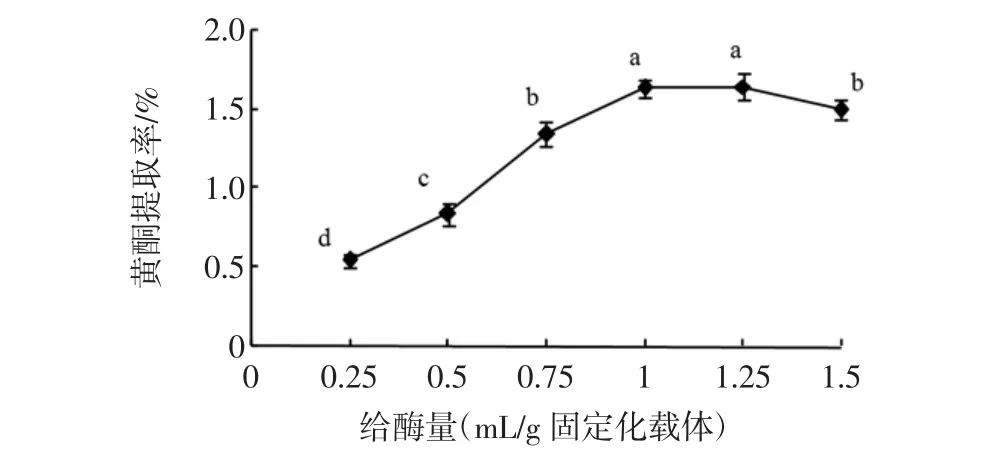
图1 给酶量对牡丹叶黄酮提取率的影响Fig.1 The amount of cellulose on the extraction efficiency of flavonoids from peony leaves
牡丹叶黄酮提取率随着纤维素酶给酶量的增加而迅速增加,当给酶量达到1 mL/g固定化载体时,牡丹叶黄酮提取率最高,这是因为酶浓度较低时,酶分子和大孔树脂的结合效应占主导,酶浓度越大,结合效应也越大,相应的固定化纤维素酶活性也越高,牡丹叶黄酮提取率也越高;之后随着纤维素酶浓度的增加酶活性逐渐缓慢降低,这可能是由于纤维素酶浓度达到一定程度后,大孔树脂上的酶分子密度增加,活性基团趋于饱和,结合的酶分子过多会造成酶作用的空间位阻增加,导致酶活性下降,牡丹叶黄酮提取率也下降,这与前人研究大孔树脂固定化酶结果一致[5,21]。因此,选择1 mL/g固定化载体为固定化酶最佳给酶量。
2.2.2 戊二醛浓度对牡丹叶黄酮提取率的影响
戊二醛浓度对牡丹叶黄酮提取率的影响见图2。
随戊二醛浓度的增加牡丹叶黄酮提取率也逐渐增加,当戊二醛浓度为2%时,固定化纤维素酶对牡丹叶黄酮提取率最高,但随着戊二醛浓度的进一步增加,固定化纤维素酶活性逐渐下降,牡丹叶黄酮提取率也逐渐下降。这可能是因为大量的戊二醛使纤维素酶分子之间发生高度交联,导致酶活性中心构型发生变化,酶活性下降[21]。所以确定2%浓度的戊二醛为固定化纤维素酶的最佳浓度。

图2 戊二醛浓度对牡丹叶黄酮提取率的影响Fig.2 Effects of different concentrations of glutaraldehyde on the extraction efficiency of flavonoids from peony leaves
2.2.3 固定化温度对牡丹叶黄酮提取率的影响
固定化温度对牡丹叶黄酮提取率的影响见图3。

图3 固定化温度对牡丹叶黄酮提取率的影响Fig.3 Effects of different immobilized temperature on the extraction efficiency of flavonoids from peony leaves
随着固定化温度的升高,牡丹叶黄酮提取率逐渐升高,当温度达到50℃时,牡丹叶黄酮提取率最高,之后随着固定化温度的进一步升高,牡丹叶黄酮提取率反而快速下降,这是因为蛋白质的吸附是吸热过程,在温度较低时不容易吸附到树脂上,固定化温度的升高有利于酶在大孔树脂上的吸附,从而提高固定化酶的活性,但是温度上升到一定程度时,温度过高会导致纤维素酶失活而引起固定化酶活性的降低,从而导致牡丹叶黄酮提取率的下降。因此,选择50℃为固定化酶的最佳固定温度。
2.2.4 固定化时间对牡丹叶黄酮提取率的影响
固定化时间对牡丹叶黄酮提取率的影响见图4。
牡丹叶黄酮提取率随着固定化时间的延长逐渐增加,当固定化3 h后,牡丹叶黄酮提取率达到最大值,此时固定化载体对纤维素酶的吸附达到了平衡,之后随着固定化时间的延长固定化酶活性逐渐下降,牡丹叶黄酮提取率也逐渐下降。这可能是由于固定化时间过长导致酶自身稳定性降低、固定化过程中交联程度过高,从而影响了酶促反应速率,导致固定化酶活性下降,从而引起牡丹叶黄酮提取率的下降。因此,选择固定化3 h作为固定化酶的最佳固定化时间。

图4 固定化时间对牡丹叶黄酮提取率的影响Fig.4 Effects of different immobilized time on the extraction efficiency of flavonoids from peony leaves
2.3 正交试验
根据单因素试验结果,采用正交试验设计对固定化纤维素酶提取牡丹叶黄酮做进一步优化,正交试验结果见表2,固定化酶提取牡丹叶黄酮正交试验方差分析见表3。

表2 大孔吸附树脂对牡丹叶黄酮吸附条件的正交试验结果Table 2 Results and layout of orthogonal test on adsorption conditions of flavonoids from peony leaves

表3 固定化酶提取牡丹叶黄酮正交试验方差分析Table 3 Analysis of variance of the orthogonal array design for optimization of flavonoid extraction
极差分析表明:四因素对固定化纤维素酶提取牡丹叶黄酮影响的主次顺序为:A>C>B>D,即:给酶量>固定化温度>戊二醛浓度>固定化时间,而且由表3方差分析结果可看出,给酶量、固定化温度、戊二醛浓度、固定化时间4个因素对固定化酶提取牡丹叶黄酮的影响均达到了显著水平。由正交试验得到固定化纤维素酶提取牡丹叶黄酮的最佳提取条件为A3B2C2D2,即纤维素酶给酶量为1.25 mL/g固定化载体、戊二醛浓度为2%、固定化温度为50℃、固定化时间为3 h,根据此最佳条件进行验证试验,得到固定化纤维素酶提取牡丹叶黄酮提取率为1.95%。
2.4 固定化纤维素酶重复利用次数对牡丹叶黄酮提取率的影响
固定化酶使用次数对牡丹叶总黄酮提取量的影响见图5。

图5 固定化酶使用次数对牡丹叶总黄酮提取量的影响Fig.5 Effects of cycle time on the extraction of flavonoids from peony leaves
如图5所示,随着固定化纤维素酶使用次数的增加,牡丹叶黄酮提取率逐渐降低,固定化纤维素酶重复使用4次,牡丹叶黄酮提取率为1.66%,为固定化酶第一次提取时的85.13%。固定化酶使用4次后牡丹叶黄酮提取率迅速降低,固定化纤维素酶使用6次后,牡丹叶黄酮提取量仍为固定化酶第一次提取时的51.79%,说明本试验制备的固定化纤维素酶对于提取牡丹叶黄酮具有很好的效果。固定化纤维素酶可多次重复使用,使用固定化纤维素酶提取牡丹叶黄酮更节约成本。
3 结论
本试验以DM130大孔吸附树脂为载体制备固定化纤维素酶,并将其应用到牡丹总黄酮提取,通过正交试验得到了固定化纤维素酶提取牡丹叶黄酮的最佳工艺:给酶量1.25 mL/g固定化载体、戊二醛浓度2%、固定化温度50℃、固定化时间3 h,在此条件下牡丹叶黄酮提取量为1.95%。固定化纤维素酶使用4次,牡丹叶黄酮提取量仍达85.13%,说明制备的固定化纤维素酶在牡丹叶黄酮的提取中具有良好的效果,能重复利用。
采用大孔树脂固定化纤维素酶方法简单易行,价格低廉,可以重复使用,节约成本,便于工业化生产和应用。本试验通过正交试验得到固定化酶提取牡丹叶黄酮的最佳工艺,不仅可为牡丹叶黄酮的工业化生产提供一定的数据支持,也为牡丹叶的深加工利用提供提供新的思路和方法。
[1]Zhang Y,Li S F,Wu X W,et al.Macroporous resin adsorption for purification of flavonoids in Houttuynia cordatu Thunb[J].Journal of the Chinese Institute of Chemical Engineers,2007,15(6):872-876
[2]周林,蔡妙颜,郭祀远,等.大孔吸附树脂应用的研究进展[J].昆明理工大学学报(理工版),2003,28(6):99-102
[3]郭庆启,张娜,符群,等.AB-8大孔树脂固定化溶菌酶及酶学性质研究[J].食品科学,2012,33(17):216-220
[4]王海雄,吴侯,翁新楚.大孔树脂固定猪胰脂酶的初步研究[J].生物技术,2004,14(3):27-30
[5]王瑞芳,陈姗姗,仇农学.S-8大孔树脂固定果胶酶条件的优化研究[J].中国食品添加剂,2006(4):67-70
[6]饶美香,张熊禄,余开辉,等.DM-130大孔树脂固定脂肪酶的研究[J].应用科技,2005,32(11):63-64
[7]吴茜茜,穆文侠,孙健,等.大孔树脂D101固定中性脂肪酶及其生物催化作用[J].食品与发酵工业,2006,34(8):65-68
[8]Li B B,Chen Y,Chen X C,et al.A novel immobilization method for nuclease P1on macroporous absorbent resin with glutaraldehyde cross-linking and determination of its properties[J].Process Biochemistry,2012,47:665-670
[9]郭大龙.牡丹种质资源遗传多样性研究进展[J].北方园艺,2007(9):61-65
[10]Zhao D Q,Tang W H,Hao Z J,et al.Identification of flavonoids and expression of flavonoid biosynthetic genes in two coloured tree peony flowers[J].Biochemical and Biophysical Research Communications,2015,459:450-456
[11]Xue J Q,Wang S L,Zhang P,et al.On the role of physiological substances,abscisic acid and itsbiosynthetic genes in seed maturation and dormancy of tree peony(Paeonia ostii‘Feng Dan’)[J].Scientia Horticulturae,2015,182:92-101
[12]Zhang C,Wang W N,Wang Y J,et al.Anthocyanin biosynthesis and accumulation in developing flowers oftree peony(Paeonia suffruticosa)‘Luoyang Hong’[J].Postharvest Biology and Technology,2014,97:11-22
[13]李叶,唐浩国,刘建学,等.牡丹叶总黄酮提取工艺条件优化研究[J].农业技术与装备,2009(2):14-16
[14]李佩艳,韩四海,罗登林,等.牡丹叶黄酮的酶法提取条件优化及其对亚硝酸盐的清除作用[J].食品科学,2016,37(6):77-81
[15]陶文亮,李慧力.酶法在植物黄酮提取中的应用[J].贵州化工,2010,35(5):31-32,35
[16]段文录,吴峰敏,张延萍,等.纤维素酶法提取鱼腥草总黄酮工艺[J].河南科技大学报(自然科学版),2010,31(1):98-100
[17]奚奇辉,李士敏.纤维素酶在竹叶总黄酮提取中的应用[J].中草药,2004,35(2):166-167
[18]李佩艳,尹飞,刘建学,等.响应面法优化酶法提取红薯叶总黄酮的工艺[J].食品工业科技,2012,33(1):275-277,281
[19]赵玉芬,李佩艳,郑小林,等.大孔树脂对红薯叶总黄酮的吸附及解吸特性研究[J].生物技术进展,2013(6):433-438
[20]王华,王莹,李爱娟,等.海藻酸钠交联包埋法固定化纤维素酶研究[J].江苏农业科学,2013,41(3):325-327
[21]陈姗姗,李党生.以离子交换树脂为载体的果胶酶固定化研究[J].江苏农业科学,2013,41(4):251-253
Study of Immobilized Cellulose Extraction Flavanoids from Peony Leaves
LI Pei-yan1,YIN Fei2
(1.College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471023,Henan,China;2.College of Agronomy,Henan University of Science and Technology,Luoyang 471023,Henan,China)
DM130 macroporous resin as the carrier,the effects of cellulose amount,glutaraldehyde concentration,immobilized temperature and immobilized time on the extraction ratio of flavanoids from peony leaves were investigated.The optimum technology of extracting flavanoids from peony leaves by immobilized cellulose was determined by orthogonal experiments.The results showed that the most appropriate immobilized conditions of DM130 macroporous resin were:cellulose amount 1.25 mL/g macroporous resin,glutaraldehyde concentration 2%,immobilized temperature 50℃,immobilized time 3 h,and the extraction ratio of peony leaves flavanoids was 1.95%.Immobilized cellulose could be used for 4 batches and its extraction ratio of peony leaves flavanoids was up 85.13%of the immobilized cellulose extraction for the first time,which suggested that immobilized cellulose had a good effect on extracting total flavanoids from peony leaves.
cellulase;macroporous resin;immobilization;peony leaves;flavanoids
2016-11-01
10.3969/j.issn.1005-6521.2017.14.010
河南科技大学博士科研启动基金项目(4009-13480053);河南科技大学青年科学基金项目(2015QN035);农产品高值化利用与快速检测技术项目(2015XTD007)
李佩艳(1977—),女(汉),讲师,博士,研究方向:食品质量与安全控制、果蔬贮藏与保鲜。

