鸡PERK的原核表达及多克隆抗体的制备
袁晓琴, 刘梦茜, 李春燕, 陈仕怡, 许丽惠, 周五朵, 吴异健, 王全溪
(福建农林大学福建省兽医中药与动物保健重点实验室,福建 福州 350002)
鸡PERK的原核表达及多克隆抗体的制备
袁晓琴, 刘梦茜, 李春燕, 陈仕怡, 许丽惠, 周五朵, 吴异健, 王全溪
(福建农林大学福建省兽医中药与动物保健重点实验室,福建 福州 350002)
根据鸡的蛋白激酶R样内质网激酶(PERK)基因序列进行抗原肽分析,选择含大片段抗原表位区约1 500 bp的一段基因(15~1 515 bp)设计一对特异性引物后进行RT-PCR扩增,并构建pET-32a(+)-PERK重组质粒,将其转化至BL21(DE3)感受态细胞中.优化诱导表达条件,纯化重组蛋白后免疫兔并制备多克隆抗体.PCR鉴定、酶切鉴定和测序结果表明,pET-32a(+)-PERK重组质粒构建成功.SDS-PAGE电泳鉴定结果表明,重组蛋白在1.0 mmol·L-1IPTG、25 ℃下诱导9 h时的表达量最大.蛋白纯化结果表明,100 mmol·L-1咪唑洗脱液可较好地洗脱重组蛋白,获得较多的纯化蛋白.免疫结束后,抗体效价检测结果表明,制备的多克隆抗体效价达1∶32 000,可以与重组蛋白特异结合.
鸡蛋白激酶R样内质网激酶(PERK); 原核表达; 多克隆抗体
内质网是由细胞质内膜组成的一些片状的囊腔和管状的腔,这些管腔相互连接形成了密闭的管道.机体内蛋白质和脂肪的合成主要是在内质网中进行的,除此之外,内质网还可以进行蛋白质的修饰、折叠以及钙离子的贮存等.正常情况下,蛋白激酶R样内质网激酶(protein kinase R-like ER kinase, PERK)主要通过其管腔内结构域与内质网伴侣蛋白Bip蛋白相结合,结构相对稳定[1].PERK 是内质网I型跨膜蛋白中的一种,具有丝氨酸/苏氨酸蛋白激酶的活性,其结构包括信号肽和跨膜结构域,一般位于内质网腔中的是N末端,而C末端则位于胞质中[2].多种因素(如缺血再灌注损伤、氧化应激、内质网钙代谢紊乱、卵磷脂合成障碍等)都可能引起机体发生内质网应激.内质网应激时可引发未折叠蛋白反应[3-5].简单来说,当内质网中的蛋白发生错误折叠与未折叠从而致使蛋白在内质网管腔内大量堆积,由此发生内质网应激.
当发生内质网应激时,PERK可以先通过自身磷酸化从而使真核翻译起始因子2α(eukaryoticinitiation factor 2α, eIF2α)上第51位的丝氨酸也发生磷酸化,当eIF2α磷酸化后,会抑制翻译起始复合物中二磷酸鸟苷与三磷酸鸟苷之间的相互交换,进而抑制蛋白质的翻译和合成,导致细胞周期的停滞[6-7].大多发生内质网应激时,PERK信号转导通路对细胞的保护作用会大于损伤作用,但假如应激一直持续,内质网会经PERK途径上调内质网伴侣蛋白CCAAT/增强子结合蛋白同源蛋白的表达水平,并促进其活化.而CCAAT/增强子结合蛋白同源蛋白可以下调Bcl2等抗凋亡基因,导致活性氧含量增加,从而使线粒体膜损伤、细胞色素C释放,最终细胞发生凋亡[8-9].Zhu et al[10]研究显示,甘草酸可以通过内质网应激PERK-eIF2α途径诱导肺癌细胞的细胞周期停滞在G1期,表明PERK/elF2α途径是未折叠蛋白反应信号的通路之一,无内质网应激时,PERK与GRP78/Bip结合处于无活性状态;当发生内质网应激时,PERK与分子伴侣Bip分离而处于活化状态,诱导其下游elF2α磷酸化,终止细胞内绝大部分蛋白质的合成,调控细胞的细胞周期[11-12].
可见,PERK在内质网应激过程中发挥着重要的作用.虽然国内外关于内质网应激的报道居多,但均未报道禽病也可以引起内质网因未折叠蛋白的堆积而发生应激.因此,为进一步研究鸡PERK的生物学功能,本试验对鸡的PERK蛋白进行体外原核表达和多克隆抗体的制备,旨在为研究禽类病毒与内质网应激的关系提供参考.
1 材料与方法
1.1 材料
DH5α和E.coliBL21(DE3)感受态细胞购自北京全式金生物技术有限公司;pET-32a(+)原核表达载体购自Promega北京生物技术有限公司;健康新西兰黄兔由福建农林大学大学生创业中心提供.
主要试剂有T4连接酶(美国Promega公司),EcoRⅠ、SalⅠ快速限制性内切酶(大连宝生生物技术公司)和异丙基-β-D-硫代半乳糖苷(IPTG)(博士德生物技术有限公司)等.
1.2 引物的设计与合成
参照美国生物技术信息中心(NCBI)中鸡的PERK基因全长序列(登录号:XM_420868),利用DNAMAN软件选择一段大小约为1 500 bp的基因(15~1 515 bp),运用Premier 5.0软件设计一对特异性引物[13].
上游引物(EcoRⅠ):ATGAATTCACGGTTCTCTTCTTGTTGGGA;下游引物(SalⅠ):CCGTCGACATGGTGCCAACGATTTCTTTC(划线处为酶切位点).引物送往上海生物工程技术有限公司合成.
1.3PERK基因的扩增
将从细胞中提取的总RNA反转录后的cDNA作为模板进行PCR扩增,待PCR扩增结束后用1%琼脂糖凝胶进行电泳检测,纯化回收PCR产物.
1.4 pET-32a(+)-PERK重组质粒的构建
将pET-32a(+)原核表达载体与纯化后的目的片段分别用EcoRⅠ和SalⅠ进行酶切反应.反应结束后,高温灭活30 min,在目的片段与载体的摩尔比例为7∶1的条件下置4 ℃连接过夜.
1.5 pET-32a(+)-PERK重组质粒的鉴定及其表达鉴定
将连接后的重组质粒转化至DH5α感受态细胞中进行过夜培养,提取质粒并进行PCR鉴定、酶切鉴定和测序.将鉴定正确的重组质粒转化至BL21中,挑取单克隆菌落接种于液体培养基中,并以其为模版,分别以目的基因上、下游引物和T7上、下游引物进行PCR鉴定.
1.6 重组蛋白诱导表达体系的优化
将保存的菌种以1∶100的比例接种于LB培养基中,于摇床(37 ℃)中培养8 h,加入终浓度为1.0 mmol·L-1的IPTG,分别培养0、3、5、7、9和11 h,确定最佳的诱导时间.
在菌液IPTG终浓度为1.0 mmol·L-1,且诱导时间相同的条件下,分别在4、25、37和45 ℃下培养,确定最佳的诱导温度.
菌液在最佳的诱导温度和培养时间下,分别加入0、0.2、0.4、0.6、0.8和1.0 mmol·L-1IPTG进行诱导,确定最佳的诱导浓度.
1.7 重组蛋白的纯化及鉴定
依据ProteinIsoTM Ni-NTA Resin操作方法[14]进行蛋白分离纯化,分别用20、 40、60、80、100、120和140 mmol·L-1咪唑洗脱液洗脱,确定咪唑的最佳浓度.纯化后的蛋白用BCA蛋白浓度测量试剂盒测定,并将纯化后的重组蛋白进行SDS-PAGE电泳分析鉴定.
1.8 兔抗PERK多克隆抗体的制备鉴定与其效价测定
以重组蛋白为抗原免疫新西兰黄兔.黄兔在免疫前先采血1 mL,将其血清作为阴性对照.将1 mg 重组蛋白与1 mL不完全弗氏佐剂混合后在黄兔的皮下组织进行多点注射,14 d后进行第2次免疫(方法与第1次的相同),免疫3 d后采血,取血清进行蛋白免疫印记鉴定,待鉴定正确后隔3 d进行第3次免疫.第3次免疫以1 mg 重组蛋白溶液与1 mL完全弗氏佐剂混合注射,7 d后于心脏采血,取血清进行蛋白免疫印记鉴定.将纯化后的重组蛋白(20 mg·mL-1)作为抗原包被于96孔酶标板中.将采聚的血清以1∶1 000的比例为底,按2n倍比稀释7次后分别作为一抗,HRP标记的羊抗兔IgG抗体为二抗,应用间接ELISA法测定血清的抗体效价.
2 结果与分析
2.1PERK基因的RT-PCR扩增结果

M:DNA 分子质量标准;1:PERK基因扩增产物.图1 PERK基因的PCR扩增电泳图Fig.1 Electrophoresis of PERK gene amplified by PCR
PCR扩增后获得大小约为1 500 bp的特异性条带,与预期结果相符(图1).
2.2 重组表达质粒的鉴定结果
将pET-32a(+)-PERK重组质粒进行PCR鉴定和酶切鉴定.结果(图2A)表明,该重组质粒为阳性菌群,可扩增出一条大小约为1 500 bp的特异性条带,用载体通用引物T7可扩增一条大于目的基因的条带(约为2 250 bp),进而提取其质粒进行酶切鉴定.单酶切的产物可见一条大小约为7 400 bp的线性质粒条带,双酶切的产物可见目的基因大小约为1 500 bp的条带及空质粒大小约为5 900 bp的条带,与预期的大小相符(图2B).
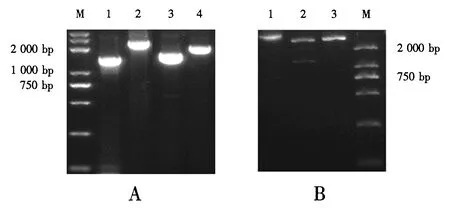
A:阳性克隆菌重组质粒的PCR鉴定(M:DNA分子质量标准;1:PERK;2:T7引物;3:PERK上游引物+T7下游引物;4:PERK下游引物+T7上游引物);B:阳性克隆菌重组质粒的酶切鉴定(M:DNA分子质量标准;1:重组质粒;2:EcoRⅠ和SalⅠ限制酶双酶切;3:SalⅠ限制酶单酶切.
2.3 pET-32a(+)-PERK重组质粒的遗传进化树
pET-32a(+)-PERK重组质粒测序结果确定重组质粒正确,图3表明,该序列与鸡PERK基因的同源性较高.
2.4 重组蛋白诱导表达条件的优化结果
重组蛋白诱导表达条件的优化结果表明,随着诱导时间的变化,重组蛋白表达量也在不断变化,诱导9 h时的蛋白表达量最高,条带大小约为78 ku(图4A).
在诱导时间和IPTG终浓度相同的条件下,不同温度下重组蛋白的表达量不同,诱导温度为25 ℃时的表达量最大(图4B).
在诱导时间和温度相同的条件下,用不同终浓度的IPTG进行诱导,结果(图4C)显示,IPTG最佳的终浓度为1 mmol·L-1.

图3 pET-32a(+)-PERK重组质粒的遗传进化树

A:诱导时间的优化(M:蛋白质分子质量标准;1:空质粒;2~7:诱导0、3、5、7、9和11 h时的重组蛋白);B:诱导温度的优化(M:蛋白质分子质量标准;1:空质粒;2:重组蛋白未诱导;3~6:4、25、37和45 ℃下诱导的重组蛋白);C:诱导浓度的优化(M:蛋白质分子质量标准;1:空质粒;2~7:0、0.2、0.4、0.6、0.8和1.0 mmol·L-1 IPTG诱导下的重组蛋白).
2.5 重组蛋白的纯化结果

M:蛋白质分子质量标准;1:纯化前的蛋白;2~8:20、40、60、80、100、120和140 mmol·L-1的咪唑洗脱液.图5 重组蛋白纯化的SDS-PAGE电泳图Fig.5 Electrophoregram of recombinant protein purified by SDS-PAGE
用不同浓度的咪唑洗脱液洗脱重组蛋白,结果(图5)显示,咪唑浓度为100 mmol·L-1时洗脱蛋白的量较多,且杂蛋白较少.
2.6 重组蛋白的蛋白免疫印记鉴定结果
以His·Tag标签蛋白的抗体作为一抗,pET-32a空载体菌组为对照,分别对获得的重组蛋白进行蛋白免疫印记鉴定.结果(图6)显示,该重组蛋白为所预期的蛋白.

A:PERK;B:标签蛋白.
2.7 PERK多克隆抗体的蛋白免疫印记鉴定结果

图7 重组蛋白的蛋白免疫印记鉴定电泳图Fig.7 Electrophoregram of recombinant protein identified by Western blot
以PERK阳性血清作为一抗,设pET-32a空载体菌组作为对照,分别对获得的重组蛋白进行蛋白免疫印记鉴定.结果(图7)显示,该多克隆抗体为预期的抗体.
2.8 PERK多克隆抗体的效价
以20 mg·mL-1重组蛋白为抗原,将采集到的兔血清以1:1 000的比例按2n倍比稀释7次后分别作为一抗,HRP标记的羊抗兔IgG抗体为二抗,应用间接ELISA法测定抗体效价.结果(图8)表明,该免疫程序制备的兔多克隆抗体效价可达到1∶32 000.

图8 PERK多克隆抗体的效价
3 讨论与小结
本试验选取鸡PERK基因含大片段抗原表位区约1 500 bp的一段基因(15~1 515 bp)进行后续试验,是由于鸡PERK基因全长片段高达3 000 bp,直接进行PCR扩增无法扩增出目的基因,只能选取其中一段的大片段抗原表位区的基因设计一段特异性的引物进行扩增.本试验对PERK基因进行扩增后,用EcoRⅠ和SalⅠ快速限制性内切酶切割目的基因和原核表达质粒,连接之后转DH5α扩增,再于E.coliBL21(DE3)中进行表达,之后对重组蛋白的表达条件进行优化筛选,获得理想表达量的重组蛋白.
本试验在诱导时发现,重组蛋白于150 r·min-1转速摇菌比200 r·min-1更有利于重组蛋白的表达,而吕小婷等[14]在表达番鸭呼肠孤病毒 σA 蛋白时则是200 r·min-1的转速摇菌更有利于其表达.本试验获得的多克隆抗体效价可达1∶32 000,这与吕小婷等[14]制备的番鸭呼肠孤病毒σA蛋白多克隆抗体效价大于 1∶32 000及武娟等[15]制备的诺如病毒衣壳蛋白多克隆抗体效价1∶10 000相比,该效价在理想范围内.
目前关于禽类内质网应激的研究以及通过PERK / eIF2α 通路使细胞周期停止的研究较少,为了研究这条通路,以寻求更多的方法治疗心血管和心脏等疾病,急需PERK多克隆抗体,而市面上鸡源的PERK多克隆抗体几乎没有,因此制备鸡的PERK多克隆抗体对之后的研究尤为重要.
[1] GREGOR M G, HOTAMISLIGIL G S. Adipocyte stress: The endoplasmic reticulum and metabolic disease [J]. Journal of Lipid Research,2007,48(9):1 905-1 914.
[2] 宋洋,袁宜勤,郁洁.内质网应激PERK凋亡通路研究进展[J].中华中医药学刊,2013(5):1 009-1 011.
[3] ZHANG K, KAUFMAN R J. The unfolded protein response: a stress signaling pathway critical for health and disease [J]. Neurology, 2006,66(1):102-109.
[4] 周映彤,肖洪彬,毕明刚.活性氧与内质网应激[J].中国药理学通报,2011,27(5):597-600.
[5] 关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34(11):1 136-1 141.
[6] BLAIS J D, FILIPENKO V, BI M, et al. Activating transcription factor 4 is translationally regulated by hypoxic stress [J]. Molecular & Cellular Biology, 2004,24(17):7 469-7 482.
[7] 薛欣,赵京元,李玉梅.肿瘤坏死因子α诱导PERK-eIF2α介导的未折叠蛋白反应[J].毒理学杂志,2011(2):100-103.
[8] KOJIMA E, TAKEUCHI A, HANEDA M, et al. The function of GADD34 is a recovery from a shutoff of protein synthesis induced by ER stress: elucidation by GADD34-deficient mice [J]. FASEB J,2003,17(11):1 573.
[9] 吕振嵘,刘秀华.蛋白激酶R样内质网激酶信号通路在内质网应激中作用的研究进展[J].生理科学进展,2011,42(2):154-157.
[10] ZHU J, CHEN M, CHEN N, et al. Glycyrrhetinic acid induces G1 phase cell cycle arrest in human nonsmall cell lung cancer cells through endoplasmic reticulum stress pathway [J]. International Journal of Oncology,2015,46(3):981-988.
[11] BREWER J W, DIEHL J A. Mammalian unfolded protein response inhibits cyclin D1 translation and cell-cycle progression [J]. Proc Natl Acad Sci U S A, 1999,96(15):8 505-8 510.
[12] HAMANAKA R B, BENNETT B S, CULLINAN S B, et al. PERK and GCN2 contribute to eIF2alpha phosphorylation and cell cycle arrest after activation of the unfolded protein response pathway [J]. Molecular Biology of the Cell,2006,16(12):5 493-5 501.
[13] 郑逢梅,赵军,霍金耀,等.PEDV流行株N基因主要抗原表位原核表达及ELISA方法的建立[J].中国兽医学报,2014,34(3):371-378.
[14] 吕小婷,廖加磊,孙雪宁,等.番鸭呼肠孤病毒σA蛋白的原核表达及其多克隆抗体的制备[J].中国兽医科学,2016(2):174-179.
[15] 武娟,赵玉然,唐庆娟,等.诺如病毒衣壳蛋白多克隆抗体的制备及效价分析[J].食品科学,2014,35(11):105-108.
(责任编辑:施晓棠)
Prokaryotic expression and polyclonal antibody preparation of chicken PERK kinase
YUAN Xiaoqin, LIU Mengxi, LI Chunyan, CHEN Shiyi, XU Lihui,ZHOU Wuduo, WU Yijian, WANG Quanxi
(Fujian Key Laboratory of Traditional Chinese Veterinary Medicine and Animal HealthFujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Based on the antigen peptide sequence of chicken protein kinase R-like ER kinase (PERK) gene, an about 1500 bp DNA fragment encoding the major epitope domain was amplified by RT-PCR with specific primers, and then was expressed with expression vector pET 32a in BL21 cell (DE3). After expression with optimized condition of temperature, time and IPTG concentration, the purified recombinant protein was used to prepare the polyclonal antibody of PERK. Results of PCR, restriction enzyme digestion and sequencing showed that the recombinant plasmid pET-32a (+)-PERK was constructed successfully. SDS-PAGE analysis showed that the optimal expression conditions of recombinant protein were to induce at 25 ℃ with 1.0 mmol·L-1IPTG for 9 h. Protein purification result showed that 100 mmol·L-1imidazole could elute recombinant proteins effectively, resulting in higher quantity of purified protein. After immunization, the titer of the polyclonal antibody was to 1∶32 000, which could be combined with PERK.
chicken protein kinase R-like ER kinase (PERK); prokaryotic expression; polyantibody
2017-01-30
2017-04-12
国家自然科学基金——促进海峡两岸科技合作联合基金资助项目(U1305212).
袁晓琴(1994-),女,硕士研究生.研究方向:动物病原与分子生物学.Email:1825639283@qq.com.通讯作者王全溪(1978-),副教授,博士.研究方向:宿主与病原互作.Email:wqx608@126.com.
S852.65
A
1671-5470(2017)04-0428-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.04.012

