拟南芥AGO基因家族分析及盐胁迫下的表达验证
岳路明,宋剑波,,3,徐晓峰,杨海奇,莫小为,宋 军,莫蓓莘
1) 深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳518060;2) 深圳大学光电工程学院,广东深圳518060;3) 江西农业大学理学院,江西南昌330045;4) 深圳大学生命与海洋科学学院,广东省表观遗传学重点实验室,广东深圳518060

【生物工程 / Bioengineering】
拟南芥AGO基因家族分析及盐胁迫下的表达验证
岳路明1,宋剑波1,2,3,徐晓峰4,杨海奇1,莫小为4,宋 军2,莫蓓莘1
1) 深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳518060;2) 深圳大学光电工程学院,广东深圳518060;3) 江西农业大学理学院,江西南昌330045;4) 深圳大学生命与海洋科学学院,广东省表观遗传学重点实验室,广东深圳518060
argonaute(AGO)蛋白家族成员在小核糖核酸(RNA)介导的转录后调控中有重要作用.通过拟南芥AGO蛋白家族的结构域及各类植物中的AGO蛋白的进化关系进行分析,发现AGO蛋白在植物中结构和进化相对保守.根据已有的芯片数据,对拟南芥中AGO蛋白家族的组织表达进行分析,发现某些AGO基因具有组织表达的特异性.进一步通过基因上游启动子响应元件分析,以及盐等胁迫下的芯片和反转录聚合酶链式反应(RT-PCR)实验数据分析,发现AGO2、AGO3和AGO7等基因受到盐等非生物胁迫的诱导表达.初步探明了拟南芥中AGO基因家族在盐胁迫下的差异表达规律.
植物生理学;拟南芥;小核糖核酸;argonaute蛋白;转录后调控;非生物胁迫
argonaute(AGO)蛋白是核糖核酸(ribonucleicacid,RNA)介导的转录后基因调控复合物 (RNA-inducedsilencingcomplex,RISC)的重要蛋白,由于AGO基因突变会导致拟南芥叶子呈管状,形似八爪鱼,故取名argonaute蛋白,简称AGO蛋白.AGO蛋白被Bohmert等[1]首次在拟南芥中发现后,该类蛋白相继在细菌(bacteria)、 古细菌(pyrococcusfuriosus)和真菌(eubacteria)中被发现[2],表明AGO蛋白广泛存在于各种生物中.由于完整的AGO蛋白很难表达和结晶[3],直到2003年,才有科学家从低等生物古细菌[4]和真细菌[5]中解析出AGO蛋白的晶体结构.AGO蛋白由N-端可变结构域、保守的PAZ(piwi-argonaute-zwue)结构域、中间连接结构域和PIWI结构域组成[6].
AGO蛋白结构的多样性导致其功能的差异性.初期研究发现,植物AGO1基因的突变会影响转录后沉默和对病毒的抗性[7].在植物中,小RNA会与AGO1蛋白形成RISC复合体,进一步对靶标信使RNA(messengerRNA,mRNA)进行剪切[8].最新研究发现,拟南芥中的AGO1[9]、AGO2[10]、AGO4[11]、AGO7[12]和AGO10[13]都能切割靶标基因.在功能上,AGO蛋白参与植物生长发育的调控.研究还发现AGO蛋白的催化活性对于胚胎的早期发育至关重要[14].另外,AGO蛋白还参与调控植物逆境胁迫的应答.例如在烟草中,AGO1的差异表达能够改变植物对病毒感染的耐受能力,使遭受病毒侵染的烟草不仅恢复性状,同时还增强了冷胁迫的耐受能力[15].在豌豆中,菜豌豆的P68蛋白(Pisumsativump68,PSP68)作为非生物氧化和应激反应通路的分子开关,通过与AGO1蛋白相互作用,可改善作物对逆境的耐受性[15].另外,AGO蛋白还有些特殊功能,例如AGO蛋白能与某些mirtron微小RNA(MicroRNA,miRNA)相结合,作用于靶标mRNA的3′非编码区(untranslatedregions,UTR),进行基因表达的调控,这可能是一种新的基因表达调控模式[16].
可见,AGO蛋白在生物体内作为一个保守的基因家族,可能参与非生物胁迫等多种生物调控.本研究对植物中AGO蛋白的结构域和进化关系、拟南芥中AGO基因的组织表达以及在各类非生物胁迫下表达分析,初步探明了在盐等非生物胁迫下,AGO基因家族的差异表达模式.
1 材料与方法
1.1 植物材料及相关数据来源 拟南芥(ArabidopisisthalianaCol)种子由加州大学陈雪梅教授惠赠.拟南芥AGO基因及AGO蛋白序列信息从拟南芥信息资源网站(http://www.arabidopsis.org/)下载; 其他物种蛋白信息从植物基因组学网站(https://phytozome.jgi.doe.gov/pz/portal.html)获得.
1.2 拟南芥AGO蛋白的序列分析
利用MEGA6.0 软件neighbor-joining法则的P-距离(P-distance)模型构建进化树,Bootstrapmethod值为1 000.利用EMBL-EBI计算平台(http://pfam.xfam.org/)对拟南芥的结构域进行分析. 采用PlantCARE软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子胁迫元件.利用拟南芥数据库e-FPBrowser(http://bbc.botany.utoronto.ca/efp)上的AGO基因相对表达信息和胁迫条件下的表达信息,通过Mev生物学软件构建AGO基因组织表达芯片和AGO基因在胁迫下的表达芯片.
1.3 盐胁迫下AGO基因的表达分析
拟南芥幼苗在霍格兰德营养液中培养两周后转移到含150 mmol/L氯化钠的霍格兰德营养液中,分别处理0、3、6和12 h,收取3个生物学重复.利用Trizol法提取RNA,反转录成cDNA,设计10种AGO基因的RT-PCR(realtimefluorescencequantitativePCR,RT-PCR)引物(表1)分析盐胁迫处理不同时间后样品中AGO基因表达量的变化.

表1 RT-PCR检测AGO基因表达引物序列
2 结果与分析
2.1 AGO家族的进化树分析
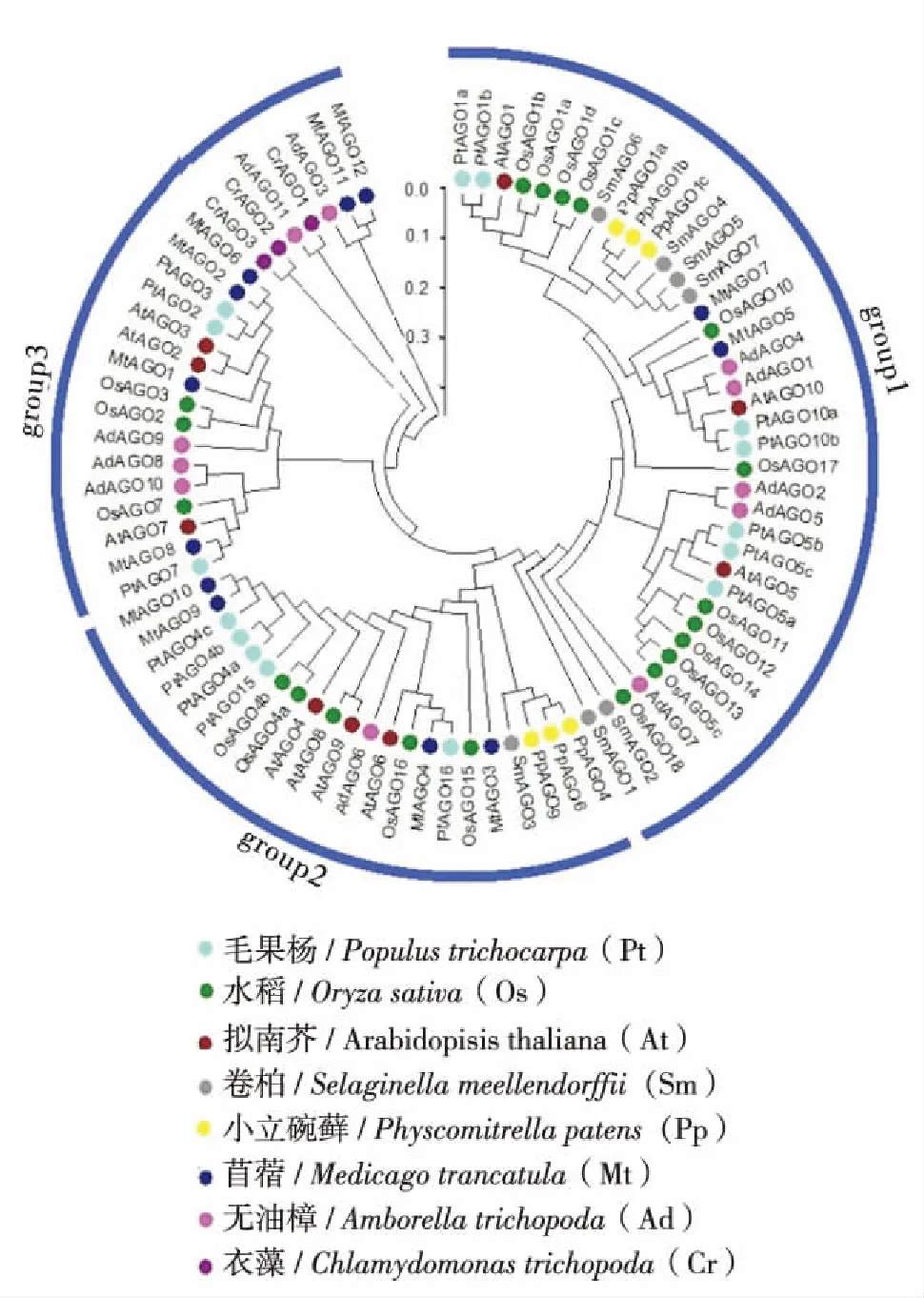
图1 AGO蛋白的进化树Fig.1 Phylogenetic tree of AGO proteins
通过构建系统进化树分析拟南芥(Arabidopisisthaliana, At)、 无油樟(Amborellatrichopoda, Ad)、 苜蓿(Medicagotrancatula, Mt)、 衣藻(Chlamy-domonastrichopoda, Cr)、 水稻(Oryzasativa, Os)、 毛果杨(Populustrichocarpa, Pt)、 小立碗藓(Physcomitrellapatens, Pp)和卷柏(Selaginellameellendorffii, Sm)等植物中AGO基因家族的进化关系(图1),同时构建拟南芥中AGO蛋白的结构域分布图(图2).结果发现莱茵衣藻、小立碗藓、拟南芥和水稻分别有3、6、10和19种AGO蛋白同源基因.这说明随着进化程度的升高,植物中AGO蛋白的数目和种类也不断增加.另外,AGO蛋白根据其在植物中的进化关系分为2类[17]. 在拟南芥中,属于第1类蛋白的有AGO1、AGO5和AGO10,结构上都包含Mid结构域,并且AGO1还包含了特殊的甘氨酸富集结构域;AGO2、AGO3和AGO7以及AGO4、AGO6、AGO8和AGO9分别属于第2和第3类蛋白.在拟南芥中,AGO1所形成的RISC复合体是小RNA发挥剪切功能的重要场所.从进化树上可以看到,该AGO蛋白在水稻、毛果杨、卷柏和小立碗藓中都有亲缘关系很近的同源基因(图1).
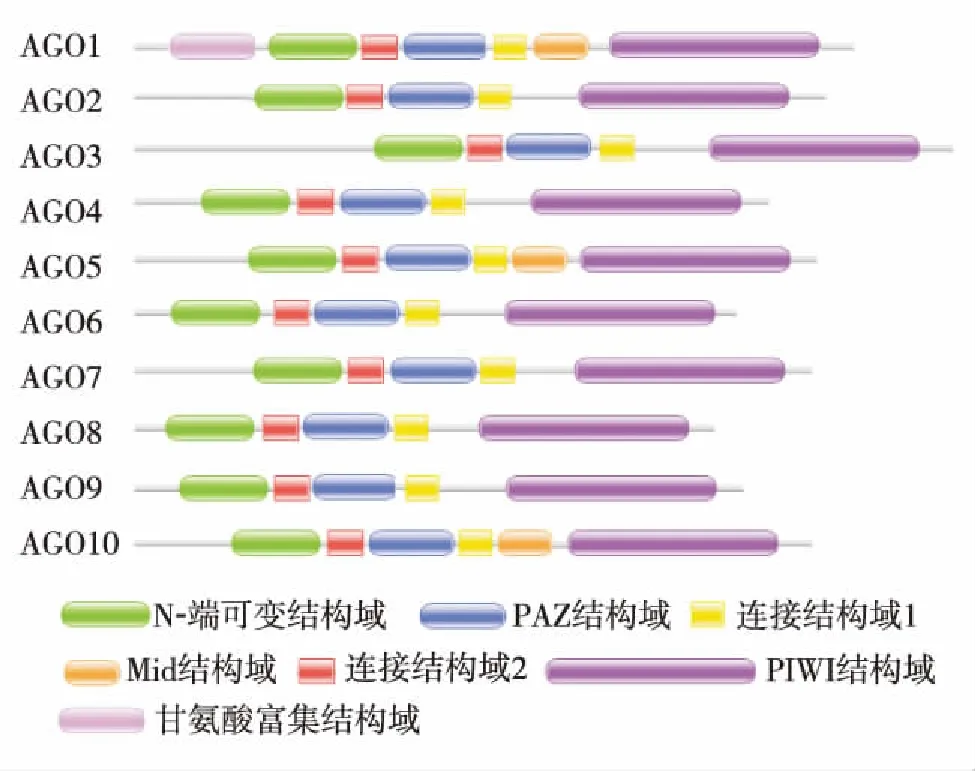
图2 拟南芥AGO蛋白的结构域Fig.2 Domain of AtAGO proteins
2.2AGO基因在植物中的组织表达分析
为探明AGO基因在植物各组织中的表达情况,从拟南芥数据库e-FPBrowser中获取了9种AGO基因的表达信息(AGO8除外).分析发现AGO基本表达呈现以下规律:AGO1为组成型表达,除成熟花粉外,其他组织中表达较高;AGO2和AGO3在种子中表达较高,其他组织中表达较低;AGO4除在萼片中没有表达外,其他组织中都有表达;AGO5、AGO7、AGO9和AGO10在花和种子中表达较高;AGO6植株中整体表达较低(图3).以上结果说明AGO基因家族存在明显的组织表达差异性.
2.3 胁迫相关的启动子元件分析
通过在线分析软件PlantCARE分析AGO基因转录起始位点上游2 000碱基对(basepair,bp)的启动子序列,发现含有很多非生物响应相关元件(表2).例如,所有AGO基因中都含有厌氧诱导的响应元件,其中AGO2启动子中含有11个厌氧诱导胁迫元件;含3个以上同一种胁迫元件的有AGO2、AGO3、AGO6和AGO9, 其中AGO3基因含ABA应答元件、厌氧诱导元件等多种胁迫元件,且数目都在3个以上;以上结果说明AGO基因很可能参与非生物胁迫应答.
2.4AGO蛋白在非生物胁迫下的基因芯片分析
为了进一步探明拟南芥AGO蛋白与非生物胁迫之间的关系,根据已有的芯片数据,对AGO基因家族(AGO6和AGO8除外)在胁迫下的表达情况进行分析(图4),发现某些AGO基因对非生物胁迫有响应.例如AGO2受基因毒性胁迫诱导表达强烈,且在根部受紫外损伤胁迫诱导表达明显;AGO3在地上部分受冷害、盐和渗透胁迫诱导表达;AGO7受氧化、盐和紫外胁迫诱导表达.相反,也有一些AGO基因在胁迫下,表达下调.例如AGO4在基因毒性、热、盐、紫外和机械损伤胁迫下,基因表达下调明显;AGO9在干旱、渗透、盐和紫外胁迫下,表达下调;AGO10在紫外和机械损伤胁迫下表达下调.另外,AGO1属于组成型表达,所以在各种条件下表达都比较高(图4).综上所述,某些AGO基因在逆境胁迫下有着明显的差异表达.

图3 AGO在拟南芥各个组织中的表达Fig.3 Expression profiles of AtAGO genes in various tissues
2.5 AGO蛋白在盐胁迫下的表达分析
为进一步验证上述AGO基因受到胁迫诱导表达,通过RT-PCR对拟南芥中10种AGO基因在盐胁迫下的表达进行了分析(图5).结果发现,AGO2、AGO3和AGO7在盐胁迫下被诱导表达强烈,这与芯片数据一致;而AGO8基因处理前与处理后皆无信号,说明其在拟南芥中是一个假基因. 总之,通过芯片及RT-PCR的实验数据说明部分AGO基因受到环境胁迫的诱导表达,这说明AGO蛋白可能在植物遭受逆境时,发挥一些特殊功能.
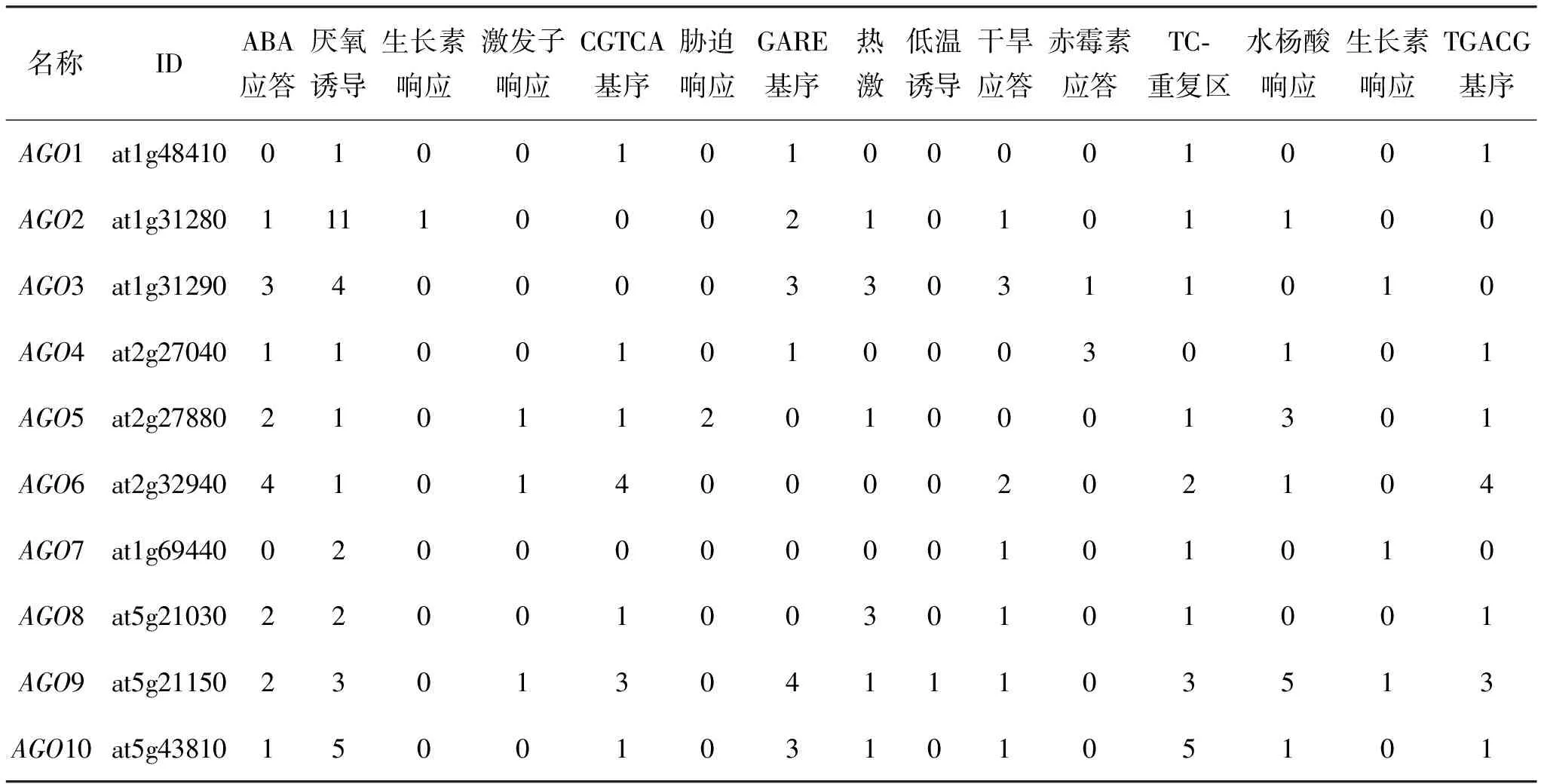
表2 拟南芥AGO基因胁迫相关的启动子元件分析
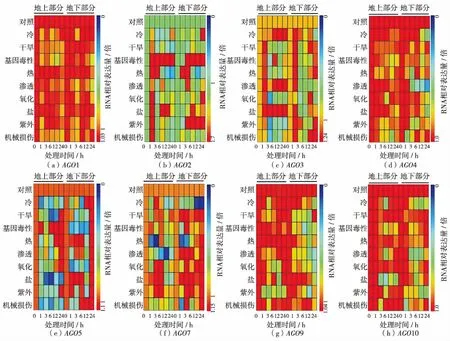
图4 拟南芥AGO基因在非生物胁迫下的芯片数据分析Fig.4 The microarray data of AtAGOs under abiotic stress

图5 拟南芥AGO基因在盐胁迫下的表达分析Fig.5 The relative expression of AtAGOs under salt stress
3 讨 论
本研究归纳了AGO基因的结构特点、进化特点及受盐等非生物胁迫的表达规律.结构与进化上,10种AGO蛋白均含有4个结构域.PAZ结构域和连接结构域形成的口袋更容易与呈酸性的小RNA 3′末端和5′末端相结合.AGO蛋白的进化分类与AGO蛋白的结构与功能关系密切,从亲缘关系上AGO蛋白可以分为3大类,第1类与拟南芥中的AGO1蛋白结构相似,故又称AGO同源蛋白;第2类与果蝇中的PIWI蛋白结构类似,故将其统称为PIWI同源蛋白;第3类最先在蠕虫中发现,它们具有结合siRNA的能力[20].功能上,以AGO蛋白为主要成分的RISC复合体与DCL蛋白家族协同作用,参与转录后基因表达的调控.但是每种AGO蛋白的功能又有所不同,所以发挥作用的组织和亚细胞区域也不完全相同.AGO蛋白在花粉中的表达量普遍偏低,但AGO9基因在花粉中的表达量很高.有研究表明,AGO9主要在生殖细胞的伴胞细胞中表达,参与次级卵母细胞的产生与DNA的修复[21],并在卵细胞分化的过程中起到重要的作用[22].大多数AGO基因的表达主要集中在花器官中,表明这些AGO蛋白在生殖发育中也发挥着重要的作用.
虽然之前很多研究表明,AGO蛋白通过转录后调控影响植物的生长发育.但近年研究表明,AGO蛋白也参与了某些胁迫反应的调控.如AGO3基因可以响应盐胁迫,并在盐胁迫下表达上调[20].对AGO基因的启动子元件分析发现,AGO基因启动子中都含有与胁迫相关的元件.这说明AGO蛋白不仅在植物生长发育过程中发挥重要的作用,且在逆境胁迫中也可能发挥作用.RT-PCR的结果显示在盐胁迫下,拟南芥AGO2、AGO3和AGO7基因的表达上调明显,说明这些蛋白可能在植物遭受逆境时,能发挥一些特殊功能.但AGO基因参与植物胁迫相应调控的分子机制尚不清楚,有待进一步研究.
/ References:
[1] Bohmert K, Bellini C, Bouchez D, et al. AGO1 defines a novel locus ofArabidopsiscontrollingleafdevelopment[J].EmboJournal,1998,17(1):170-180.
[2]Rodríguez-LealD,Castillo-CobiánA,Rodríguez-ArévaloI,etal.Aprimarysequenceanalysisoftheargonauteproteinfamilyinplants[J].FrontiersinPlantScience, 2016,7:01347.
[3]HallTMT.Structureandfunctionofargonauteproteins[J].Structure, 2005,13(10):1403-1408.
[4]SongJJ.CrystalstructureofargonauteanditsimplicationsforRISCsliceractivity[J].Science, 2004,305(5689):1434-1437.
[5]YuanYuren,PeiYi,MaJinbao,etal.CrystalstructureofA.aeolicusargonaute,asite-specificDNA-guidedendoribonuclease,providesinsightsintoRISC-mediatedmRNAcleavage[J].MolecularCell, 2005,19(3):405-419.
[6]RivasFV,ToliaNH,SongJJ,etal.Purifiedargonaute2andansiRNAformrecombinanthumanRISC[J].NatureStructural&MolecularBiology, 2005,12(4):340-349.
[7]MorelJB.Fertilehypomorphicargibayte(ago1)mutantsimpairedinpost-transcriptionalgenesilencingandvirusresistance[J].ThePlantCellOnline, 2002,14(3):629-639.
[8] 马 轩,李盛本,莫蓓莘,等.拟南芥ago1-27突变体的RNA-seq分析[J].深圳大学学报理工版, 2017,34(1):27-32.MaXuan,LiShengben,MoBeixin,etal.RNA-seqanalysisonArabidopsisago1-27mutant[J].JournalofShenzhenUniversityScienceandEngineering,2017,34(1):27-32.(inChinese)
[9]DerghalA,DjelloulM,TrouslardJ,etal.Anemergingroleofmicro-RNAintheeffectoftheendocrinedisruptors[J].FrontiersinNeuroscience, 2016,10:00318.
[10]ConnertyP,AhadiA,HutvagnerG.RNAbindingproteinsinthemiRNApathway[J].InternationalJournalofMolecularSciences, 2016,17(1):31.
[11]KobayashiH,TomariY.RISCassembly:coordinationbetweensmallRNAsandargonauteproteins[J].BiochimicaetBiophysicaActa(BBA)-GeneRegulatoryMechanisms, 2016,1859(1):71-81.
[12]TaiowaA.Montgomery,MiyaD.Howell,etal.Specificityofargonaute7-miR390interactionanddualfunctionalityinTAS3trans-actingsiRNAformation[J].Cell,2008,133(1):128-141.
[13]RoodbarkelariF,DuF,TruernitE,etal.ZLL/AGO10maintainsshootmeristemstemcellsduringArabidopsisembryogenesisbydown-regulatingARF2-mediatedauxinresponse[J].BMCBiology, 2015,13(1) :74.
[14]Gerson-GurwitzA,WangS,SatheS,etal.AsmallRNA-catalyticargonautepathwaytunesgermlinetranscriptlevelstoensureembryonicdivisions[J].Cell, 2016,165(2):396-409.
[15]BanuMSA,HudaKMK,SahooRK,etal.Peap68impartssalinitystresstoleranceinricebyscavengingofROS-mediatedH2O2andinteractswithargonaute[J].PlantMolecularBiologyReporter, 2015,33(2):221-238.
[16]HansenTB,VenφMT,JensenTI,etal.Argonaute-associatedshortintronsareanovelclassofgeneregulators[J].NatureCommunications, 2016,7:11538.
[17]FangXiaofeng,QiYijun.RNAiinplants:anargonaute-centeredview[J].ThePlantCell, 2016,28(2):272-285.
[18]ZhangZhonghui,LiuXiuying,GuoXinwei,etal.ArabidopsisAGO3predominantlyrecruits24-ntsmallRNAstoregulateepigeneticsilencing[J].NaturePlants, 2016,2(5):16049.
[19]WuestSE,VijverbergK,SchmidtA,etal.Arabidopsisfemalegametophytegeneexpressionmaprevealssimilaritiesbetweenplantandanimalgametes[J].CurrentBiology, 2010,20(6):506-512.
[20] 李 超,杜志游,陈集双.解读AGO蛋白结构及其功能[J]中国生物化学与分子生物学学报, 2009(11):969-976.LiChao,DuZhiyou,ChenJishuang.StructuralandfunctionalelucidationofAGOproteins[J].ChineseJournalofBiochemistryandMolecularBiology,2009(11):969-976.(inChinese)
[21]OliverC,SantosJL,PradilloMN.OntheroleofsomeargonauteproteinsinmeiosisandDNArepairinArabidopsisthaliana[J].FrontiersinPlantScience, 2014,5:5177.
[22]Rodríguez-LealD,León-MartínezG,Abad-ViveroU,etal.NaturalvariationinepigeneticpathwaysaffectsthespecificationoffemalegameteprecursorsinArabidopsis[J].ThePlantCell, 2015,27(4):1034-1045.
【中文责编:晨 兮;英文责编:艾 琳】
2017-01-04;Accepted:2017-03-27
Professor Mo Beixin. E-mail: bmo@szu.edu.cn
Bioinformatical and experimental analysis ofAGOgenes in response to salt stress
Yue Luming1, Song Jianbo1,2,3, Xu Xiaofeng4, Yang Haiqi1, Mo Xiaowei4, Song Jun2, and Mo Beixin1
1) Shenzhen Key Laboratory of Microbial Genetic Engineering, College of Life and Oceanography, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 2) College of Optoelectronic Engineering, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 3) College of Science, Jiangxi Agricultural University, Nanchang 330045, Jiangxi Province, P.R.China 4)Guangdong Provincial Key Laboratory for Plant Epigenetics, College of Life and Oceanography, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China
AGO family proteins play an important role in small RNA-mediated post-transcriptional regulation. Analyzing the domain and evolution of AGO family proteins in diverse plant species, we revealed that the structural organization of AGOs is evolutionally conserved between different plant species. Based on the experimental data, someAGOgeneswerespecificallyexpressedinvarioustissuesinArabidopsis.Sequenceanalysisshowedthatthereareabioticstressrelatedcis-actingelementsinthepromotorsofAGOgenes,microarrayandRT-PCRdataalsoindicatedtheexpressionsofAGO2,AGO3andAGO7genesareinducedundersaltandotherabioticstressconditions.ThisisthefirststudytodemonstratethedifferentialexpressionpatternsofAGOsundersaltstressinArabidopsis.
plant physiology;Arabidopsisthaliana;smallRNA;AGOproteins;post-transcriptionalregulation;abioticstress
:Yue Luming, Song Jianbo, Xu Xiaofeng, et al. Bioinformatical and experimental analysis ofAGOgenes in response to salt stress[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(4): 352-357.(in Chinese)
Q
A
10.3724/SP.J.1249.2017.04352
国家自然科学基金资助项目(31571332; 31560076)
岳路明(1990—), 男, 深圳大学硕士研究生.研究方向: 生物化学与分子生物学.E-mail: 1510211663@qq.com宋剑波(1983—), 男, 深圳大学博士后研究人员、江西农业大学讲师. 研究方向:植物学与分子生物学.E-mail:thinkskier@163.com岳路明、宋剑波为共同第一作者.
Foundation:National Natural Science Foundation of China (31571332; 31560076)
引 文:岳路明,宋剑波,徐晓峰,等. 拟南芥AGO基因家族分析及盐胁迫下的表达验证[J]. 深圳大学学报理工版,2017,34(4):352-357.

