纳米管辅助紫杉醇化疗口腔舌癌的增敏疗效分析
牛 莹,蒋林珊
(大连大学 医学院,辽宁 大连 116622)
纳米管辅助紫杉醇化疗口腔舌癌的增敏疗效分析
牛 莹,蒋林珊
(大连大学 医学院,辽宁 大连 116622)
旨在研究多壁碳纳米管负载紫杉醇后对口腔舌癌SCC-15细胞的影响,探讨多壁碳纳米管负载紫杉醇后化疗口腔舌癌的增敏疗效作用。通过制备多壁碳纳米管和多壁碳纳米管-多烯紫杉醇载药系统,分别与SCC-15口腔舌癌细胞共育,采用CCK-8检测活性,Prestoblue检测细胞增殖抑制率,免疫组化法检测P53蛋白的表达,hoechst/PI双染法检测细胞凋亡,探讨碳纳米管对紫杉醇化疗口腔舌癌的敏感性是否提高,为临床化疗肿瘤提供了新方法。
多壁碳纳米管;紫杉醇;多壁碳纳米管-紫杉醇;SCC-15口腔舌癌细胞
0 引言
舌癌是人类最常见的肿瘤之一,临床治疗多以化疗为主,刚开始治疗效果好,但是一段时间后易复发,对人体健康危害严重。治疗舌癌的化疗药中,以新型抗肿瘤药物多烯紫杉醇最为有效,但多烯紫杉醇(Paclitaxel)水溶性差,口服生物利用度不高,多以静脉注射进行治疗,临床注射剂应用时,其溶剂毒性较大,干扰药效[1]。所以迫切需要研制生物利用度高、毒性低的多烯紫杉醇新剂型,以提高其临床疗效。多壁碳纳米管为一种中间空心的管腔,有很大的比表面积,对多种药物有较强的负载能力,和很好的细胞渗透能力,可运载化疗药物进入细胞或组织,在此过程中,并不影响药物的性能,且对癌细胞有很好的抑制作用,对正常细胞不会产生明显的毒副作用,从而达到更好地化疗口腔舌癌的效果[2]。
为提高紫杉醇化疗口腔舌癌的敏感性,本研究以口腔舌癌SCC-15细胞系为模型,拟用抗肿瘤药物多烯紫杉醇负载于碳纳米管上,研发一种具有临床应用前景的载药纳米复合植入剂,通过载药碳纳米管系统和单纯紫杉醇进行肿瘤治疗的体外实验,运用细胞生物学和分子生物学等手段,采用细胞增殖和毒性检测、细胞周期检测等方法,检测紫杉醇负载于碳纳米管后对肿瘤化学治疗的敏感性。为临床化疗肿瘤提供新方法。
1 多壁碳纳米管的制备和纯化
采用化学沉淀法制备多壁碳纳米管(MWCNTS),用天平称取250 mg MWCNTs加入到250 mL的浓H2SO4和浓 HNO3混合物(体积比=3:1)中,将样品置于超声清洗器中进行处理5 h,10000 r/min,20 min,经微孔滤膜抽滤,用移液枪取超纯水清洗至调整PH至7.0,置于80℃条件下待其干燥至恒重后,备用。
2 多壁碳纳米管-多烯紫杉醇载药系统的制备
取一定量的多烯紫杉醇,加入无水乙醇溶解,再加入一定量的 MWCNTs,在探头超声下,慢慢加入一定量的ddH2O清洗,10000 r/min,高速离心10 min,获取MWCNTs-多烯紫杉醇溶液;吸出上清液,加入一定量的表面活性剂,在超声中处理2 h,10000 r/min,离心 10 min,去除游离的多烯紫杉醇和未分散的MWCNTs,得到载药MWCNTs-多烯紫杉醇溶液,分装保存备用。
3 细胞培养、检测及结果
3.1 SCC-15细胞培养与传代
将消化液(0.25%胰蛋白酶)从冰箱中取出,加热使其融化;打开紫外灯照射超净工作台30 min,用75%酒精溶液擦净;取对数生长的SCC-15细胞,吸出旧培养液,加入3 mLPBS缓冲液,充分震荡;加入0.25%胰蛋白酶消化液,消化5~10 min;在倒置显微镜下仔细观察培养瓶,待培养瓶中的细胞肿胀或细胞增大后停止消化;取适量DMEM-F12培养液(含10%小牛血清),轻轻吹洗培养瓶底层贴有细胞的部分,使细胞脱落并分散形成细胞悬液,1000 r/mim,离心5 min;吸出离心管的上清液,加入培养液(含10%小牛血清)2 mL,轻轻吹打使之成为均匀的细胞悬液,进行分装;写上细胞的种类和日期,做好标记。稍微拧松培养瓶盖,置于 37℃,5%C02培养箱中培养24 h后观察细胞生长状况;
3.2 细胞毒性检测
本实验将 MWCNTs-多烯紫杉醇溶液和单纯紫杉醇溶液按不同浓度分6组。按照CCK-8法,6组的浓度分别2.0、4.0、8.0、16.0、32.0、64.0 μg/mL,作用数小时后,计算其对SCC-15细胞生长的抑制率表示其对 SCC-15细胞的毒性。取对数生长期的SCC-15 细胞按 6×103个/孔(200 μL)接种于 96 孔培养板中;将培养板放于37℃,5%CO2培养箱中培养,24 h后分别将药物倍比稀释,形成6个级别的浓度。每一浓度的化疗药物设6个平行孔,每个孔加入药物20 μL,并设立阴性对照组(只加培养液,无细胞和药物),阳性对照组(有细胞和培养液,无药物),置于培养箱中继续培养48 h,倒置显微镜下观察;每孔加入CCK-8溶液20 μL;将培养板在培养箱内孵育4 h;最后用酶标仪检测450 nm处的OD值,记录实验结果。
抑制率=(1-实验组的OD值/对照组的OD值)×100%
设计不同浓度的多壁碳纳米管-紫杉醇实验组和单纯紫杉醇实验组进行对照实验,作用24 h后,观察两种药物对SCC-15细胞生长的抑制率,由此评价两种药物对细胞的毒性作用。结果见图1,药物浓度在 4 µg/mL以下时对 SCC-15细胞的抑制率较低(<40%),且各浓度组之间无显著差异(P>0.05),随着药物浓度的增高,抑制率的差别逐渐增大。和单纯紫杉醇药物组相比,多壁碳纳米管-紫杉醇药物组的抑制率最高,与单纯紫杉醇药物组差别显著(P<0.05)。

图1 不同浓度的多壁碳纳米管-紫杉醇和单纯紫杉醇对细胞生长的抑制作用
3.3 多壁碳纳米管-紫杉醇和紫杉醇载药系统对SCC-15细胞生长的抑制
本实验分为多壁碳纳米管-紫杉醇药物组,紫杉醇药物组,无药对照组,每组设 6个复孔,采用Prestoblue法检测。取对数生长期的SCC-15细胞按6×103(200 μL/孔)接种于96孔培养板中,放于37℃,5%CO2培养箱中培养,24 h后更换DMEN-F12培养液;向两药物组加入受试药物各 200 μL,无药对照组加入培养液 200 μL,充分混匀后在培养箱内培养72 h;加入Prestoblue 5 μL,10min后用酶标仪检测560 nm处的OD值。
细胞增殖抑制率=(1-实验组的OD值/无药对照组的OD值)×100%
多壁碳纳米管-紫杉醇和紫杉醇均能抑制口腔舌癌SCC-15细胞增殖,与无药对照组相比,均有显著性差异(P<0.05)。结果见表 1,多壁碳纳米管-紫杉醇对SCC-15细胞的增值抑制率比紫杉醇高6%。

表1 多壁碳纳米管-紫杉醇和紫杉醇载药系统对SCC-15细胞增殖的抑制率
3.4 P53蛋白检测
取以上各组细胞(无药对照组、紫杉醇组、MWCNTs-紫杉醇组)经 10000 r/mim,离心后取载玻片进行细胞涂片;向每张涂片加过氧化氢溶液2 mL,室温下孵育20 min;用PBS洗3次,每次5 min;加非免疫动物血清50 µL,室温下孵育10 mim,再用吸管吸取PBS冲洗1次;加入50 µL的P53抗体(一抗),4℃培养24 h;用吸管吸取PBS冲洗3次,每次5 min;吸取50 µL生物素标记的第二抗体,加到涂片上,室温下孵育10 min;PBS冲洗3次,每次5 min;加入链亲和素-过氧化物酶溶液,室温下孵育10 mim;PBS冲洗3次,每次5 min;加入100 µL新鲜配制的的DAB溶液,置显微镜下观察细胞;用自来水冲洗,苏木素复染,中性树脂封固。
免疫组化法检测P53蛋白的表达,由图2、图3所示,相对于无药对照组图4,单纯紫杉醇组和多壁碳纳米管-紫杉醇组均抑制突变型P53蛋白的表达,多壁碳纳米管-紫杉醇组更为明显。

图2 培养24h紫杉醇组细胞突变型p53蛋白的表达(sp*200)

图3 培养24 h多壁碳纳米管-紫杉醇组细胞突变型p53蛋白的表达(sp*200)
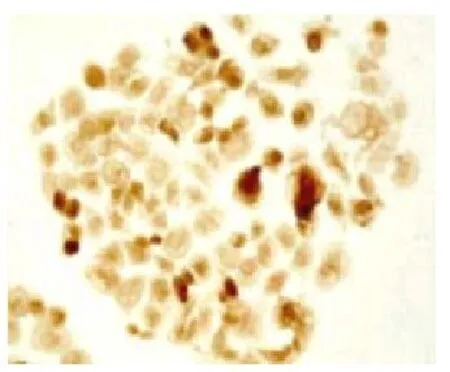
图4 培养24 h无药对照组细胞突变型p53蛋白的表达(sp*200)
3.5 细胞凋亡检测
对数生长的 SCC-15细胞2×105/孔接种于 24孔培养板中,置培养箱中24 h后,分为三组,对照组1(空白组)和对照组2分别加入10 μg/mL的无血清培养液,单纯的多烯紫杉醇溶液,实验组加入MWCNTs-多烯紫杉醇,置于培养箱中培养 24h;加入PBS洗3遍;加入5 μg/mL的hoechst33342,避光染色 10 min;加入 15 μg/mL 的 PI,避光染色 10 min;用流式细胞仪检测荧光。
结果判断:正常细胞为低蓝光/低红光,坏死细胞为低蓝光/高红光,早期凋亡细胞为高蓝光/低红光,晚期凋亡细胞高蓝光/红光。
如表2所示,空白组可见细胞核呈均匀弥散的低蓝色荧光,红色荧光少见;单纯紫杉醇组除可见到低蓝色荧光以外,还可见少量高蓝色和红色荧光(晚期凋亡细胞);多壁碳纳米管-紫杉醇组可见高蓝色荧光(早期凋亡细胞)和部分红色荧光(晚期凋亡细胞),由此可知紫杉醇组和多壁碳纳米管-紫杉醇组与空白组比较,细胞凋亡数量多,而紫杉醇组晚期细胞凋亡数较少,多壁碳纳米管-紫杉醇组晚期细胞凋亡数量多,说明多壁碳纳米管-紫杉醇组比紫杉醇组具有更高的诱导SCC-15口腔舌癌细胞凋亡的作用。

表2 hoechst33342、PI双染法检测口腔舌癌细胞SCC-15细胞内荧光(100×)
4 讨论
紫杉醇是从红豆杉中提取出来的化合物,在化疗口腔舌癌方面疗效较好,但是由于其水溶性差,口服生物利用度不高,多以静脉注射进行治疗,临床注射剂应用时,其溶毒性较大,严重干扰了药效,这就限制了紫杉醇静脉注射化疗肿瘤。所以,研制生物相容性好、利用度高及毒性低的多烯紫杉醇成为当前人们的关注的焦点。目前,国内外多烯紫杉醇新剂型的探究热点主要集中在靶向性和水溶性两个方面,常用的且研究较为广泛的有脂质体、胶束、纳米粒等,这些药物能准确地到达肿瘤病灶,并缓慢的释放。但是这些药物也有很大的毒副反应,如过敏反应,对心、肾及神经也有一定程度的毒副作用等[3]。且靶向性不强,粒径大小不稳定,因此,粒径大小恒定、水溶性好、药物释放缓慢及靶向性好的 MWCNTs-Paclitaxel制剂成为研究当前的研究热点[4,5]。
有研究者[6]将Paclitaxel吸附到了PLGA(聚合纳米粒)上,在对该聚合纳米粒进行表面修饰,由此降低细胞毒性。使多烯紫杉醇在正常组织的蓄积显著减少,使肿瘤病灶的靶向性大大提高。Mu[7]采用萃取技术制备的PLGA纳米微球,其平均粒径为纳米级,这种纳米级的结构能显著减少对正常细胞的损害。张景勍等[8]通过蒸发法制备的紫杉醇制剂,在外加磁场的作用下,可以使Paclitaxel准确的到达肿瘤病灶,提高了靶向性。本研究用沉淀法制备 MWCNTs,并将其负载于 Paclitaxel上,形成 MWCNTs-Paclitaxel溶液。进行了一系列的体外检测试验,以达到提高Paclitaxel的靶向性和细胞抑制率,降低毒副作用的效果。在细胞毒性试验中,我们将MWCNTs-Paclitaxel溶液和单纯的 Paclitaxel溶液分别分为 6个浓度组(2.0~64.0 µg/mL),与SCC-15细胞共育数小时后,观察其对细胞增殖的抑制率表示表示对口腔舌癌SCC-15细胞的毒性。结果表明,两个药物组均能抑制细胞的增殖,当药物浓度在 4 µg/mL以下时,对SCC-15细胞的抑制率较低(<40%),各浓度组之间无明显差异(P>0.05),随着药物浓度增加,抑制率差别逐渐增大,和单纯的多烯紫杉醇组相比,MWCNTs-Paclitaxel组的抑制率高,与单纯Paclitaxel组差别显著(P<0.05),表明低浓度的MWCNTs-Paclitaxel对肿瘤细胞的毒性小,高浓度的MWCNTs-Paclitaxel对肿瘤细胞的毒性大,且有剂量依赖性,由此可知,MWCNTs-Paclitaxel有很好的靶向性。在此之前,研究者Joshi M等[9]将甲氨蝶呤与C60富勒烯和MWCNTs进行偶联,用MTT法进行细胞毒性检测,研究表明该复合物在一定浓度下对肿瘤细胞有很强的毒性。然而,近年来,碳纳米管的生物安全性同样引起了人们的注意。Hu S等[10]将聚乙二醇修饰的MWCNTs注射到BALBA/c小鼠体内,与单用MWCNTs相比,小鼠的免疫功能基本不受影响。高宁宁等[11]将功能化的MWCNTs进行小鼠腹腔注射,观察其对小鼠巨噬细胞的影响,研究发现修饰后的MWCNTs的生物相容性大大改善。为此,为了提高碳纳米管的生物相容性,减少对正常组织的损害,今后的研究还应从多种角度,用不同的方法来研究其毒理作用。
紫杉醇作为重要的化疗药物,特异性作用于细胞的G2期和M期,从而阻断细胞的增殖。MTT法和Prestoblue法是体外检测细胞活性常用的方法,但是因为MTT还原所产生的甲瓒产物水溶性低,需要溶解后才能检测,所以选用Prestoblue检测 MWCNTs-Paclitaxel和单纯Paclitaxel对口腔舌癌SCC-15细胞生长的抑制率,结果表明:在与SCC-15细胞共育72小时后,MWCNTs -Paclitaxel和单纯Paclitaxel均能抑制SCC-15细胞的增殖,且与无药对照组相比,都具有显著地差异性。其中,MWCNTs-Paclitaxel药物组对SCC-15细胞的增殖抑制率比单纯Paclitaxel组高6%。付旭东[12]将NGR-SWCNTs-Paclitaxel纳米制剂与MCF-7细胞共育72小时后,用MTT法检测细胞增殖抑制率,并选用了不同的细胞株进行检测,如SMMC-7721肝癌细胞、PC-3前列腺癌细胞、EC9706食管癌细胞等,结果表明以碳纳米管为载体的制剂对肿瘤细胞增殖的抑制作用与多项研究结果一致[13,14]。除了细胞活性的检测外,我们进行了P53蛋白的表达和细胞凋亡的检测。
P53蛋白是一种抑癌基因,当受到刺激后可突变为癌基因,因此失活的P53基因对肿瘤的形成非常重要,并对其发生和发展有很大的影响。P53蛋白的突变与很多人类恶性肿瘤的发生、发展及转归过程息息相关。Bosari等[15,16]采用免疫组化法抑制大肠癌P53蛋白的表达,发现了大肠癌预后差的原因是由于P53基因蛋白过表达。本研究采用免疫组化法,将MWCNTs-Paclitaxel和单纯的多烯紫杉醇与 SCC-15细胞共育,再在显微镜下观察。由于P53蛋白突变后,其半衰期变短、构象改变,所以可以被检测,结果发现:两组药物均能抑制突变型 P53蛋白的表达,以MWCNTs-Paclitaxel更为明显。早前,柴潇潇[17]研究发现 Paclitaxel可以使癌细胞凋亡。本研究采用hoechst33342/PI双染法检测了细胞凋亡,结果发现MWCNTs-Paclitaxel和单纯的 Paclitaxel都能诱导细胞凋亡,但是MWCNTs-Paclitaxel较单纯的Paclitaxel具有更显著的诱导细胞凋亡的作用。还有研究者[18]认为GDF3过表达可以促进Paclitaxel诱导细胞凋亡。今后,在分子水平上探讨Paclitaxel诱导SCC-15细胞凋亡的机制将成为我们的研究重点。
5 结论
紫杉醇载药的MWCNTs对SCC-15口腔舌癌细胞有明显的细胞增殖抑制率,能显著的抑制P53蛋白的表达以及更显著地诱导细胞凋亡的作用。所以可以认为和单纯的紫杉醇相比,碳纳米管提高了紫杉醇化疗口腔舌癌的敏感性,碳纳米管紫杉醇载药系统治疗肿瘤的疗效显著提高,为临床化疗肿瘤提供了新方法。
[1] 卢亮亮. 多烯紫杉醇在中晚期老年肺癌患者放射治疗中产生的增敏及毒副作用临床研究[D]. 山东大学, 2016.
[2] Li H, Zhang N, Hao Y, et al. Formulation of curcumin delivery with functionalized single-walled carbon nanotubes:characteristics and anticancer effects in vitro [J]. Drug Deliv.2014, 21(5): 379-87.
[3] Chervinsky DS, Brecher ML, Hoelcle MJ. Cremophor-EL enhances taxol efficacy in a multi-drug resistant C1300 neuroblastoma cell line [J].Anticancer Res, 1993, 13(1): 93-96.
[4] Wang L, Shi J, Zhang H, et al. Synergistic anticancer effect of RNAi and photothermal therapy mediated by functionalized single-walled carbon nanotubes [J]. Biomaterials, 2013, 34(1):262-274.
[5] Delogu LG, Vidili G, Venturelli E, et al. Functionalized multiwalled carbon nanotubes as ultrasound contrast agents[J]. Proc Natl Acad Sci USA, 2012, 109(41): 16612-16617.
[6] Ateh DD, Leinster VH, Lambert SR, et al. The intracellular uptake of CD95 modified paclitaxel-loaded poly (lactic-coglycolic acid) microparticles [J]. Biomaterials, 2011, 32(33):8538-8547.
[7] Mu L, Feng SS. A novel controlled release formulation for the anticancer drug paclitaxel (Taxol): PLGA nanoparticles containing vitamin E TPGS [J]. Nanoscale Res Lett, 2016,11(1): 452.
[8] 张景勍, 张志荣, 秦少容, 等. 紫杉醇磁性长循环脂质体的研究[J]. 中国药学杂志, 2003(07): 41-43.
[9] Joshi M, Kumar P, Kumar R, et al. Aminated carbon-based"cargo vehicles" for improved delivery of methotrexate to breast cancer cells [J]. Mater Sci Eng C Mater Biol Appl,2017, 75: 1376-1388.
[10] Hu S, Wang T, Pei X, et al. Synergistic Enhancement of Antitumor Efficacy by PEGylated Multi-walled Carbon Nanotubes Modified with Cell-Penetrating Peptide TAT [J].Nanoscale Res Lett, 2016, 11(1): 452.
[11] 高宁宁, 张莹, 张秋. 碳纳米管的免疫毒性研究[J]. 环境化学, 2008(06): 835-838.
[12] 雷景根. 多烯紫杉醇抑制 SMMC-7721肝癌细胞的研究[J]. 实用肿瘤学杂志, 2006(02): 111-113.
[13] 萧畔. 多西紫杉醇诱导前列腺癌PC-3细胞凋亡及耐药前后的蛋白质组学研究[D]. 山东大学, 2012.
[14] 卢红, 樊青霞, 王瑞林. 人食管鳞癌紫杉醇耐药细胞株Ec9706/P-1凋亡的变化[J]. 肿瘤防治研究, 2010(12): 1356-1359.
[15] Bosari S, Viale G, Bossi P, et al. Cytoplasmic accumulation of p53 protein: an independent prognostic indicator in colorectal adenocarcinomas [J]. J Natl Cancer Inst, 1994, 86(9): 681-687.
[16] Yamaguchi A, Nakagawara G, Kurosaka Y, et al. p53 immunoreaction in endoscopic biopsy specimens of colorectal cancer, and its prognostic significance [J]. Nature,1993, 68(2): 399-402.
[17] 柴潇潇. 紫杉醇诱导细胞凋亡过程中JNK信号通路的作用及NF-κBp65蛋白表达的变化[D]. 河北医科大学, 2015.
[18] 李强. 人生长分化因子 GDF3在乳腺癌中的功能初探暨CDK5剪接本的克隆及其生物学性质分析[D]. 复旦大学,2010.
Nanotubes Auxiliary Paclitaxel Chemotherapy Sensitization Effect Analysis of Oral Tongue Cancer
NIU Ying, JIANG Lin-shan
(College of Medicine, Dalian University, Dalian 116622, China)
To study on multi-walled carbon nanotubes load after paclitaxel on SCC - 15 oral tongue cancer cell, the influence of load explore multi-walled carbon nanotubes paclitaxel chemotherapy after the sensitization effect of oral tongue cancer. Through the preparation of multi-walled carbon nanotubes and multi-walled carbon nanotubes -polyene taxol drug delivery system, respectively with SCC to 15 oral tongue cancer cells produced, tested by CCK-8 testing activity, Prestoblue detection cell proliferation inhibition rate, immunohistochemical method to detect the expression of P53 protein, hoechst/PI double staining to detect apoptosis, explore carbon nanotubes on taxol oral tongue cancer chemotherapy sensitivity is improved, which provides a new way for clinical tumor chemotherapy.
multi-walled carbon nanotubes; Paclitaxel; multi-walled carbon nanotubes-Paclitaxel; oral squamous cell carcinomaSCC-15 cells
R739.8
A
1008-2395(2017)03-0063-06
2017-05-22
牛莹(1974-),女,讲师,博士,研究方向:口腔医学。

