基于Russell机理分光光度法检测液相体系•OH浓度的改进
赵海谦,高杏存,刘城昊,王忠华,周伟,高继慧
(1东北石油大学土木建筑工程学院,黑龙江 大庆 163318;2哈尔滨工业大学能源科学与工程学院,黑龙江 哈尔滨 150001)
基于Russell机理分光光度法检测液相体系•OH浓度的改进
赵海谦1,高杏存1,刘城昊1,王忠华1,周伟2,高继慧2
(1东北石油大学土木建筑工程学院,黑龙江 大庆 163318;2哈尔滨工业大学能源科学与工程学院,黑龙江 哈尔滨 150001)
基于Russell反应机理检测液相体系•OH浓度的分光光度法具有费用低、操作简单等优点,但测试精度低、重复性差是该方法面临的主要问题。分析了该方法精度低的主要原因,提出改进型方法,分析了常见阴阳离子对萃取剂萃取坚牢蓝BB盐(FBBs)的影响,确定了改进型方法的关键检测条件,在此基础上重新建立了•OH浓度与重氮砜产物吸光度之间的函数关系。结果表明:FBBs的干扰是造成检测精度低的根本原因;FeSO4对抑制萃取剂萃取FBBs作用明显,从而大幅度削弱FBBs的干扰;Na+、K+、NO3-几乎对重氮砜产物的吸收峰不产生影响,Cl-对测试结果的影响与其浓度有直接关系;改进型方法的合理萃取时间为300 s,FBBs与甲基亚磺酸(MSIA)摩尔比为50;并得到了•OH浓度与吸光度之间的函数关系式。
液相体系;•OH;分光光度法;Russell反应机理;改进型方法
Key words:liquid system; •OH; spectrophotometric method; Russell mechanism; modified method
引 言
羟基自由基(•OH)在大气光化学、生命科学、环境科学、化学合成等多个领域中扮演着重要角色。定量检测气相及液相体系中的•OH浓度一直是研究的热点与难点[1-4]。现有液相体系•OH浓度的检测方法主要包括:电子自旋共振法[5-6]、电化学法[7-8]、荧光法[9-10]及分光光度法。
电子自旋共振法是利用自旋捕捉剂与自由基结合,生成相对稳定的自旋加合物,利用自旋加合物的数量计算自由基的浓度[11]。该方法稳定性与灵敏度较好,但高昂的仪器价格及捕获剂成本限制了其广泛应用。另外,该方法属于半定量检测•OH浓度的方法。荧光法是利用•OH的强氧化性,诱导底物发光或减弱底物发光强度,通过测量发光强度来测定•OH浓度[12]。常采用荧光分光光度计或HPLC配合荧光检测器。荧光法灵敏度高,检出限低。但寻找适合各种体系且发光强度高的荧光探针是很困难的。另外,由于荧光信号易受干扰,故准确度一般,难以定量。电化学法主是用电化学仪器获得加合物的极谱图,通过峰电流变化间接测定•OH浓度[13]。电化学法检出限较低,且具有仪器简单、测定快速等优点。然而该方法通用性不强,电信号易受溶液中其他参数干扰,故不能准确定量测量溶液中•OH浓度。分光光度法仪器价格低廉,所使用的捕获剂及显色剂价格均较低,操作方法简单,在检测溶液体系内•OH浓度方面一直受到广泛关注。已有研究者成功采用该方法实现了溶液体系内•OH浓度的定量检测[14-22]。
液相体系内•OH浓度测试研究中,基于Russell反应机理的检测方法是一个重要分支。该方法使用二甲基亚砜作为•OH捕获剂,其具有捕获能力强、水中溶解度大、性能稳定且价格低廉等多方面优势,可以很好解决液相体系中•OH的捕获难题[14,23-25]。Russell反应始于捕获剂二甲基亚砜与•OH的反应,产物包括甲基亚磺酸(MSIA)和甲基自由基CH3•。该反应还伴随其他副反应,生成 CH3OO•、甲醛、甲醇等物质。Russell反应可简单描述如下[15-16]
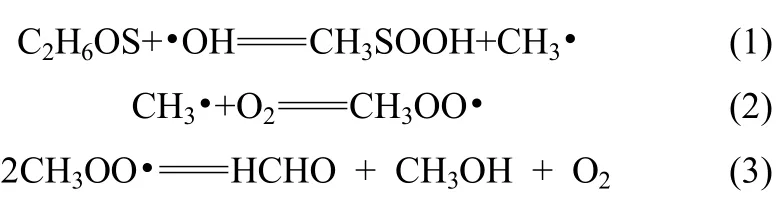
从检测反应过程中的不同产物出发,衍生出了不同•OH浓度检测方法。Klein等[17]提出测试甲醛HCHO的产量来反映•OH的浓度。然而甲醛的生成需要2个CH3OO•参与,因此甲醛产生量很小,而且 CH3OO•还会与体系内其他物质发生发应,测试误差较大。由于该方法的固有缺陷,虽有部分研究者进行了一定改进,但均没有获得重要突破。Repine等[18]提出向体系内添加RH,与CH3•反应生成CH4,然后利用气相色谱测试CH4来反映•OH的量。与上一种方法相比,甲烷的生成量比较多,对减小误差有益,但反应(2)对测试精度有很大影响。几年后,普渡大学Babbs等[19-21]提出用甲基亚磺酸CH3SOOH与坚牢蓝BB盐(FBBs)反应生成重氮砜产物,用萃取剂将重氮砜产物从原体系中萃取出来,通过分光光度计检测其浓度来反映•OH的浓度。
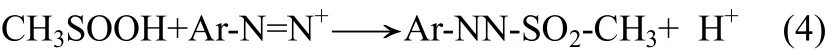
由于甲基亚磺酸是二甲基亚砜与•OH的直接产物,不受其他副反应的影响,且甲基亚磺酸的存在时间远比其他自由基类生成物长,因此,该方法具有得天独厚的优势。然而,Babbs等采用该方法检测 Fenton体系分解过程中•OH浓度时,误差近20%[15]。作者研究发现操作条件对该方法的检测结果影响很大,导致实验可重复性低[22]。研究初步确定,造成这一问题的主要原因是萃取剂萃取重氮砜产物的同时,FBBs同样被萃取。FBBs严重影响了重氮砜产物的检测精度。抑制萃取剂对FBBs的萃取,实现萃取剂对重氮砜产物的选择性萃取,是该方法成功的关键。
研究了FBBs对重氮砜产物检测结果的影响规律,成功抑制了萃取剂对 FBBs的萃取,消除了其对测试结果的影响,确定了关键操作条件,重新建立了•OH浓度与重氮砜产物吸光度之间的函数关系。
1 实验部分
1.1 试剂
H2O2、FeSO4、DMSO、甲苯、正丁醇、吡啶、苯亚磺酸钠、草酸钛钾均为国产分析纯,FBBs(染料含量大于80%)由阿拉丁公司生产。
1.2 分析测试仪器
紫外可见分光光度计,T6型,北京普析通用;振荡器,SHA-B型,哈尔滨精达;微量注射泵,LSP01-1A型,保定兰格;纯水机,Master-s型,上海和泰;离心机,TG16-WS,上海卢湘仪;磁力搅拌器,C-MAG HS7,德国IKA。
1.3 测试方法
1.3.1 FBBs的萃取与吸光度检测 新配制一定浓度FBBs溶液。取1 ml置于20 ml试管中,加入3 ml甲苯/丁醇萃取剂(2/1)充分萃取一定时间后静置至溶液分层,将下层液体抽弃。向上层溶液中加入5 ml丁醇/水饱和溶液洗涤,充分洗涤后,离心3 min(500g)。将下层溶液抽弃,向上层溶液加入 1 ml吡啶,采用分光光度计测试。
实验中的FBBs存放时间不能超过24 h,每日实验应使用新配制的FBBs溶液。
1.3.2 显色反应及萃取 新配制浓度为 10 μmol·L-1的苯亚磺酸钠溶液,则溶液中的亚磺酸离子浓度亦为10 μmol·L-1。取一定体积亚磺酸离子溶液,加入过量FBBs溶液,放置暗处反应10 min。加入3 ml甲苯/丁醇溶液(质量比为2:1)充分萃取后,保留上层溶液。向上层溶液加入5 ml丁醇/水饱和溶液,一定程度去除过量的 FBBs,充分洗涤后,离心3 min(500g)。将下层溶液抽弃,向上层溶液加入1 ml吡啶,采用分光光度计测试。
改进型方法采用添加剂抑制萃取剂对FBBs的萃取时,仅需在亚磺酸离子与FBBs暗处反应10 min后,加入添加剂即可,后续萃取等操作步骤不变。
2 结果与讨论
2.1 操作条件对检测结果的影响
采用文献[20]中操作方法,取 1 ml 50 μmol·L-1苯亚磺酸钠,添加FBBs的量为苯亚磺酸钠的50倍,进行显色与萃取操作。然而在实际检测过程中发现,即使在相同苯亚磺酸钠浓度条件下,随着操作条件不同(如萃取时间等),检测结果发生很大变化。
2.1.1 萃取时间对检测结果的影响 研究首先对不同萃取时间条件下的检测结果进行了分析。取5 ml 10 μmol·L-1苯亚磺酸钠,添加 50 倍的 FBBs,10 min显色反应后进行萃取操作,萃取时间分别为 30~300 s。不同萃取时间条件下的重氮砜产物检测结果如图1所示。
可见,测试重氮砜产物浓度时,当萃取时间小于30 s,出峰位置在425 nm,该峰为重氮砜产物吸收峰[22],检测未受干扰。但由于萃取时间较短,不能保证重氮砜产物被完全萃取。随萃取时间延长,出峰位置左移,峰值大小明显升高,测试结果发生很大变化,导致测试可重复性很差,误差较大。说明体系内存在重氮砜产物检测的干扰物质,萃取剂萃取重氮砜产物的同时也会萃取该干扰物质。该物质出峰位置小于425 nm,随着萃取时间延长,干扰物质被萃取量增加,导致峰值升高。
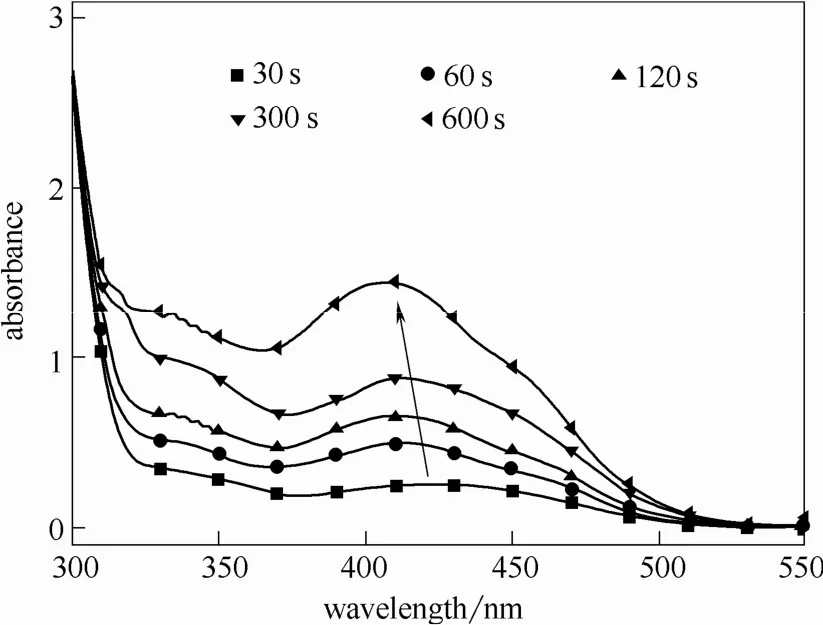
图1 萃取时间对检测结果的影响Fig.1 Influence of extraction time on test result
2.1.2 干扰物质确定 初步分析可知,干扰物质在体系中的浓度较高,可以被萃取剂大量萃取。为了保证萃取操作之前苯亚磺酸钠几乎全部转化为重氮砜产物,显色反应时添加的显色剂FBBs量远大于苯亚磺酸钠。因此,该干扰物质极有可能是反应(4)剩余的过量FBBs。
为确定该干扰物质是否为 FBBs,需研究甲苯/丁醇萃取剂对FBBs的萃取特性,以及FBBs的吸收特性。实验中取1 ml浓度为2 mmol·L-1的FBBs溶液,然后进行1.3.1中的萃取与吸光度检测操作。萃取时间分别为60、120、300 s。图2显示的是纯FBBs的萃取检测结果。
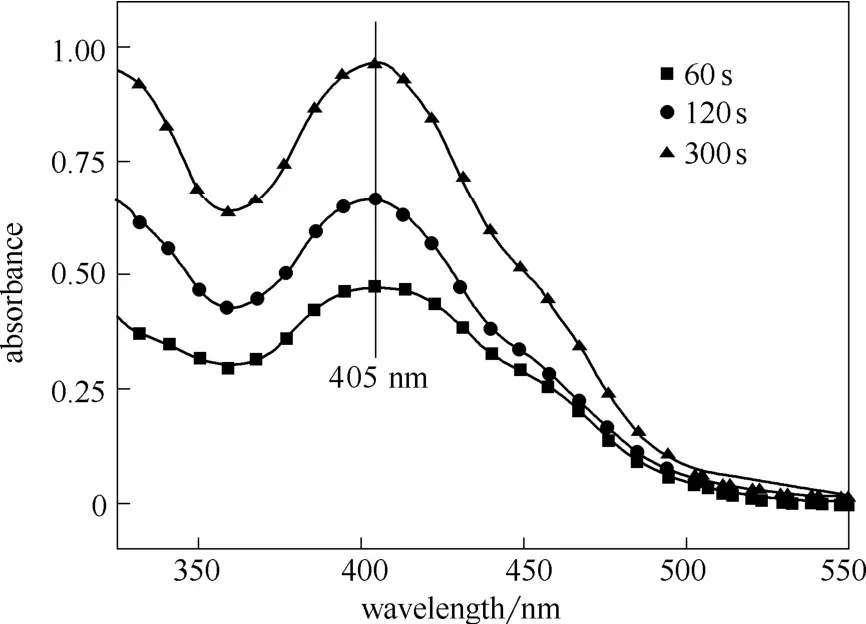
图2 FBBs萃取检测结果Fig.2 Extraction and test result of FBBs
从图2中可见,萃取剂萃取纯FBBs后,分光光度计可以检测到明显的吸收峰。该吸收峰一定是FBBs的吸收峰,说明萃取剂确实可以萃取FBBs。FBBs的出峰位置在405 nm处,符合2.1.1节中干扰物质出峰位置。从图中还可以看到,FBBs吸收峰随着萃取时间的延长而不断增大。这是图1中随着萃取时间增加,吸收峰出峰位置左移且不断增大的原因。由此可以判断,检测的干扰物质确为FBBs。由于FBBs出峰位置距离重氮砜产物的吸收峰(425 nm)较近。萃取的FBBs吸收峰极易对重氮砜产物吸收峰产生干扰而影响检测精度。
萃取检测重氮砜产物时,当萃取时间较短(30 s),萃取剂萃取的 FBBs量很少,未对重氮砜产物检测产生影响,此时出峰位置为425 nm。但由于萃取时间较短,不能保证所有目标产物重氮砜产物被萃取剂完全萃取。若延长萃取时间,以确保重氮砜产物被充分萃取,此时FBBs同样被大量萃取。当萃取剂中FBBs达到一定浓度,其吸收峰将覆盖重氮砜产物吸收峰。因此,如何保证足够的萃取时间,确保重氮砜产物被充分萃取,同时抑制萃取剂对FBBs的萃取是该检测方法成功的关键。
2.2 FBBs萃取的抑制
2.2.1 FeSO4对FBBs萃取的抑制作用 研究发现,FeSO4对萃取剂(甲苯/丁醇溶剂)萃取FBBs有显著的抑制作用,大大减弱了FBBs对重氮砜产物测试的干扰。因此,在显色反应操作过程中,在加入甲苯/丁醇萃取剂之前,先向体系内添加一定量FeSO4,使其在体系内浓度达到 200 mmol·L-1,然后再对重氮砜产物进行萃取,萃取时间为300 s。
图3显示的是添加FeSO4与不添加FeSO4两组实验的萃取结果照片。左侧试管为未添加FeSO4情况下的萃取结果;右侧试管为添加FeSO4情况下的萃取结果。可见,添加FeSO4后,待测萃取液(上层溶液)颜色明显比未添加FeSO4条件下浅,表明FBBs未被大量萃取。图4为添加与不添加FeSO4两组实验的分光光度检测结果。从图4可以看到,体系内添加200 mmol·L-1的FeSO4后,经过长时间萃取,峰值远低于同条件不添加FeSO4情况,且峰值位置保持425 nm。说明此时FBBs几乎没有被甲苯/丁醇萃取剂萃取。高浓度 FeSO4实现了甲苯/丁醇萃取剂对重氮砜产物的选择性萃取。

图3 FeSO4对FBBs萃取的抑制照片Fig.3 Influence of FeSO4on FBBs extraction
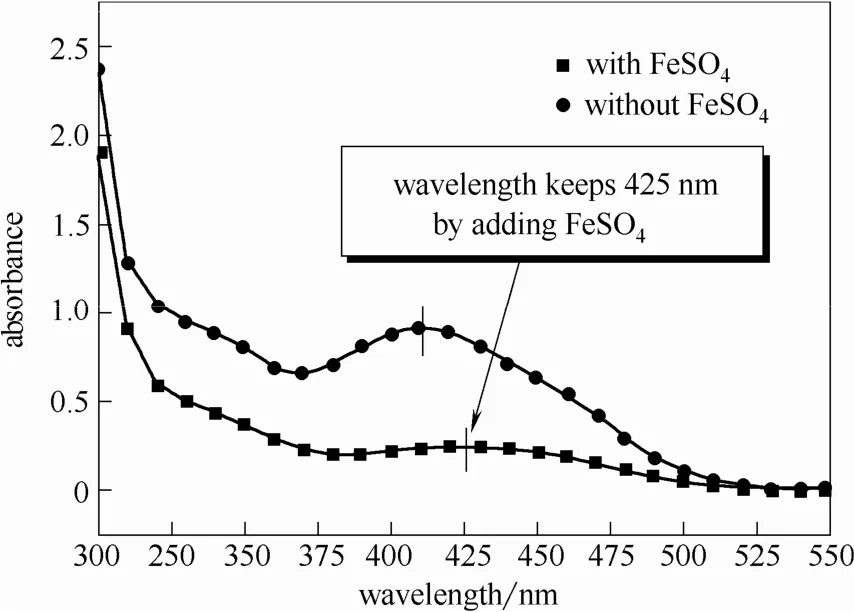
图4 添加FeSO4前后分光光度检测结果Fig.4 Spectrophotometric test result before and after adding FeSO4
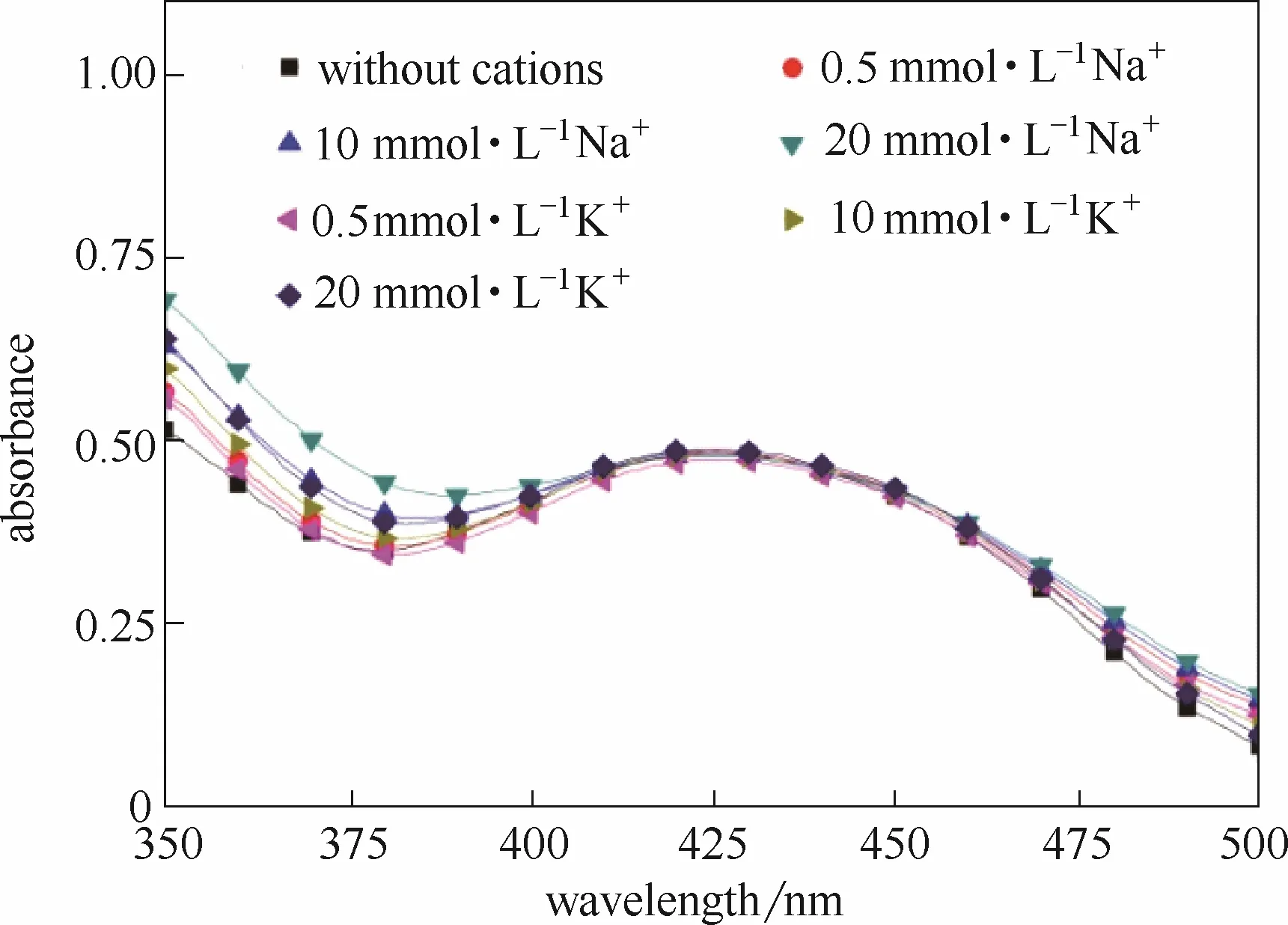
图5 Na+、K+对检测结果的影响Fig.5 Influence of Na+and K+on test
基于此结论,本文提出改进型检测方法,即在萃取操作之前,向体系内加入适量FeSO4,然后进行萃取与检测。
2.2.2 常见阴阳离子对检测结果的影响 检测•OH浓度时,液相体系可能会存在其他离子。本次实验重点研究Na+、K+、NO3-、Cl-4种典型阴阳离子对该方法检测结果的影响。实验中,取 10 ml 10 μmol·L-1苯亚磺酸钠,添加50倍的FBBs,10 min显色反应后,加入适量FeSO4及阴阳离子后,进行萃取操作,萃取时间为300 s。研究Na+、K+的影响时,添加的试剂为 Na2SO4及 K2SO4;研究、的影响时,添加的试剂为Fe(NO3)2及FeCl2。Na+、K+对检测结果的影响如图5所示;、Cl-对检测结果的影响如图6所示。
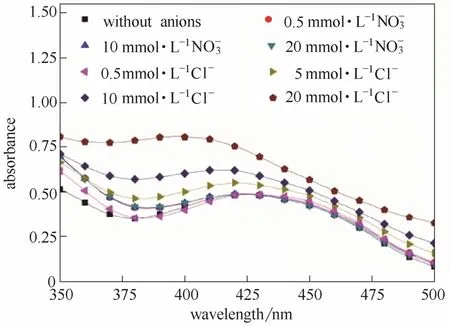
图6 、Cl-对检测结果的影响Fig.6 Influence ofand Cl-on test
图5显示,在0.5~20 mmol·L-1浓度范围内,Na+、K+几乎对重氮砜产物的吸收峰不产生影响。从图6中可以看到,无论浓度高低,NO3-基本不对重氮砜产物的检测产生影响。Cl-对测试的影响与其在体系中的浓度有很大的关系。当其浓度为 0.5 mmol·L-1时,重氮砜产物的吸收峰未发生明显变化;然而随着 Cl-在体系内浓度的增加,吸收峰的峰值不断增大,且吸收峰的位置明显左移;当其浓度为20 mmol·L-1时,最大吸收峰出现在400 nm左右,吸收峰大小明显高于实际值。可见,该检测方法对于含有高浓度Cl-的溶液体系并不适用。
2.3 关键操作条件确定
FeSO4虽然可以有效抑制萃取剂对 FBBs的萃取,但如果萃取时间过长,FBBs在萃取剂内的浓度仍会不断累积,当其浓度达到一定值时,依然会对重氮砜产物的检测产生影响。如果萃取时间过短,又不能保证所有重氮砜产物被充分萃取,因此即使添加 FeSO4,合理的萃取时间也是十分关键的。另外,体系内FBBs的添加量对其萃取有重要影响。为保证有限显色反应时间内,MSIA全部转化为重氮砜产物,需要向体系内加入过量的 FBBs,以加快反应(4)的反应速率。然而FBBs的添加量越多,体系内浓度越高,其越容易被萃取剂萃取。因此,合理的FBBs添加量亦是十分关键的操作条件。
2.3.1 萃取时间确定 实验中,取5 ml浓度为10 μmol·L-1的苯亚磺酸钠溶液于一试管内,加入1.25 ml浓度为2 mmol·L-1的FBBs溶液,置于暗处反应10 min。向试管内加入FeSO4并充分溶解,使其浓度达到200 mmol·L-1。然后进行萃取与检测操作步骤。萃取时间为60~600 s。不同萃取时间条件下,分光光度检测结果如图7所示。
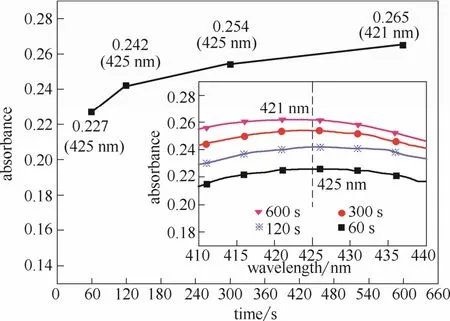
图7 萃取时间对检测结果的影响Fig.7 Inflence of extraction time on test result
从图7中可以看出,加入FeSO4后,萃取时间60~300 s时对应的最大出峰位置均在425 nm,随着萃取时间的延长,峰值不断增大。当萃取时间继续增加至600 s时,峰值比300 s略有增大,但最大峰值位置开始左移,出现在421 nm,这表明FBBs的峰开始对重氮砜产物的峰产生干扰。为保证重氮砜产物被充分萃取并避免FBBs对检测结果产生干扰,加入FeSO4后,萃取时间取300 s。
2.3.2 FBBs添加量确定 文献[20]中确定的最佳FBBs:MSIA 摩尔比为 50,但研究中未采用 FeSO4对FBBs的萃取进行抑制。向体系内添加FeSO4后,最佳 FBBs:MSIA 摩尔比是否发生变化还需要重新研究。
图8显示的是不同FBBs:MSIA摩尔比条件下,重氮砜产物的检测结果。实验中,分别取5 ml浓度为10 μmol·L-1的苯亚磺酸钠溶液于5支试管内,每支试管加入不同体积浓度为2 mmol·L-1的FBBs溶液,置于暗处反应10 min,FBBs与苯亚磺酸钠摩尔比分别为10、25、50、100、150。向试管内加入FeSO4并充分溶解,使其浓度达到200 mmol·L-1。然后进行萃取与检测操作步骤,萃取时间为300 s。
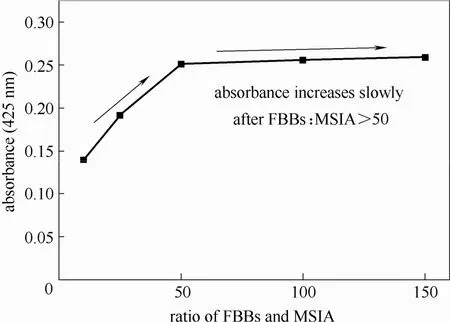
图8 FBBs:MSIA对检测结果的影响Fig.8 Influence of FBBs:MSIA ratio on test result
从图中可知,当FBBs:MSIA摩尔比小于50时,重氮砜产物的吸收峰随摩尔比的增加而大幅度提高,FBBs:MSIA摩尔比从10上升到50时,吸收峰增加了79.3%。当FBBs:MSIA摩尔比大于50时,重氮砜产物的吸收峰随摩尔比的增加速率明显减慢,FBBs:MSIA摩尔比从50到 150,吸收峰仅增加3.2%。前面研究结果已表明,体系内FBBs的浓度越高,其被萃取剂萃取的速率及萃取量越大,对重氮砜产物检测结果的干扰也越大。综合考虑显色反应速率以及避免FBBs萃取,合理的FBBs:MSIA摩尔比为50。
2.4 标准曲线绘制
采用改进型检测方法绘制了MSIA浓度与吸光度的标准曲线,如图 9所示。可见在 25~150 μmol·L-1浓度范围内,吸光度随MSIA浓度的增加而线性增加,满足一阶线性关系式:A=0.01127+0.0047C(A为吸光度;C为亚磺酸离子浓度,μmol·L-1)。根据该标准曲线,即可根据分光光度计检测得到的吸光度结果计算得到体系内MSIA浓度(即•OH浓度)。
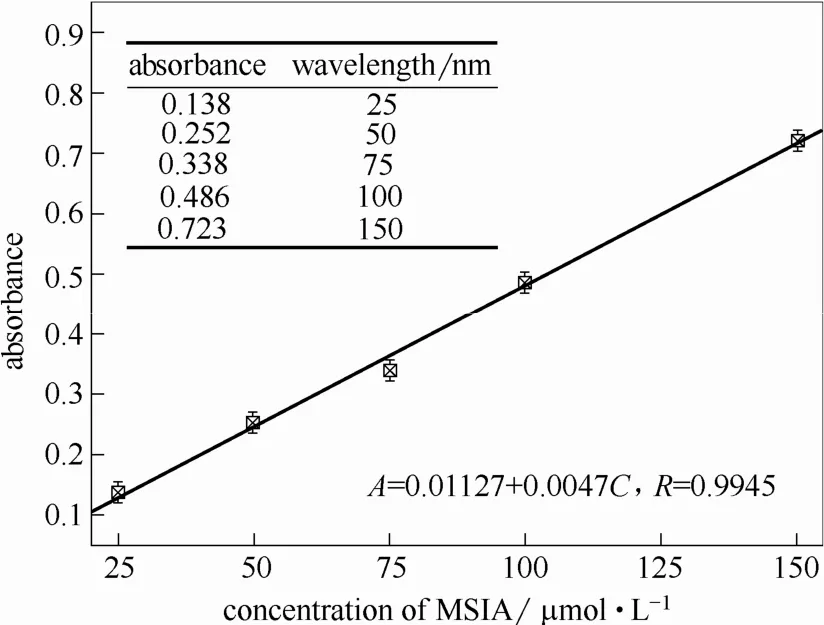
图9 MSIA标准曲线Fig.9 Standard curve of MSIA
3 结 论
确定了分光光度法检测•OH浓度精度低的根本原因是显色剂FBBs对•OH浓度标志物重氮砜产物测量的干扰。采用 FeSO4成功抑制了萃取剂对FBBs的萃取,并分析了典型阴阳离子对测试结果的影响。确定了改进型方法的关键操作条件,在此基础上重新建立了MSIA浓度(即•OH浓度)与吸光度之间的函数关系。得到如下结论:
(1)萃取剂萃取重氮砜产物时,坚牢蓝BB盐会被同步萃取;由于出峰位置接近,萃取的坚牢蓝BB盐对重氮砜产物的检测产生严重干扰。
(2)FeSO4对坚牢蓝BB盐的萃取有很强的抑制作用,基于此提出改进型检测方法。
(3)Na+、K+、NO3-几乎对重氮砜产物的吸收峰不产生影响。Cl-对测试的影响与其在体系中的浓度有很大的关系,当其浓度为20 mmol·L-1时,对重氮砜产物的检测有很大影响。
(4)改进型方法最佳萃取时间为 300 s,最佳FBBs:MSIA 摩尔比为 50。
(5)MSIA浓度与吸光度满足一阶线性关系式:A=0.01127+0.0047C。
[1] GLIGOROVSKI S, STREKOWSKI R, BARBATI S, et al.Environmental implications of hydroxyl radicals (·OH)[J]. Chemical Reviews, 2015, 115(24): 13051-13092.
[2] 朱佳裔, 沈吉敏, 陈忠林, 等. FeOOH/H2O2体系去除水中对氯硝基苯[J]. 化工学报, 2012, 63(1): 272-278.ZHU J Y, SHEN J M, CHEN Z L, et al. Removal of para-chloronitrobenzene in water by FeOOH/H2O2[J]. CIESC Journal,2012, 63(1): 272-278.
[3] FORMAN H J, AUGUSTO O, BRIGELIUS-FLOHE R, et al. Even free radicals should follow some rules: a guide to free radical research terminology and methodology[J]. Free Radical Biology and Medicine,2015, 78: 233-235.
[4] 赵海谦, 高继慧, 周伟, 等. 抗坏血酸对Fe2+/H2O2体系氧化NO的促进作用[J]. 化工学报, 2015, 66(7): 2636-2642.ZHAO H Q, GAO J H, ZHOU W, et al. Promotion of ascorbic acid on oxidation of NO by Fe2+/H2O2system[J]. CIESC Journal, 2015,66(7): 2636-2642.
[5] NISHINO A, MAOKA T, YASUI H. Analysis of reaction products of astaxanthin and its acetate with reactive oxygen species using LC/PDA ESI-MS and ESR spectrometry[J]. Tetrahedron Letters,2016, 57(18): 1967-1970.
[6] KATO S, MATSUOKA D, MIWA N. Antioxidant activities of nano-bubble hydrogen-dissolved water assessed by ESR and 2,2-bipyridyl methods[J]. Materials Science and Engineering: C,2015, 53: 7-10.
[7] PLUANGKLANG T, WYDALLIS J B, CATE D M, et al. A simple microfluidic electrochemical HPLC detector for quantifying Fenton reactivity from welding fumes[J]. Analytical Methods, 2014, 6(20):8180-8186.
[8] SI J C, LU L, GAO Z F, et al. A sensitive electrochemical method based on Fenton-induced DNA oxidation for detection of hydroxyl radical[J]. Analytical Methods, 2014, 6: 6536-6540.
[9] CAO L Y, WU Q F, LI Q, et al. Fluorescence and HPLC detection of hydroxyl radical by a rhodamine-nitroxide probe and its application in cell imaging[J]. Journal of Fluorescence, 2014, 24(2): 313-318.
[10] LI S, TIMOSHKIN I V, MACLEAN M, et al. Fluorescence detection of hydroxyl radicals in water produced by atmospheric pulsed discharges[J]. IEEE Transactions on Dielectrics and Electrical Insulation, 2015, 22(4): 1856-1865.
[11] FESSENDEN R W. ESR of reacting radicals[J]. Applied MagneticResonance, 2014, 45(5): 483-503.
[12] ZHUANG M, DING C, ZHU A, et al. Ratiometric fluorescence probe for monitoring hydroxyl radical in live cells based on gold nanoclusters[J]. Analytical Chemistry, 2014, 86(3): 1829-1836.
[13] LIU F, DU J, SONG D, et al. A sensitive fluorescent sensor for the detection of endogenous hydroxyl radicals in living cells and bacteria and direct imaging with respect to its ecotoxicity in living zebra fish[J]. Chemical Communications, 2016, 52(25): 4636-4639.
[14] 张曾, 黄干强, 潘光建. 高温碱性H2O2体系中羟自由基的研究[J].中国造纸, 2005, 24(11): 8-12.ZHANG Z, HUANG G Q, PAN G J. A study on the hydroxyl radicals in high temperature alkali hydrogen peroxide system[J]. China Pulp &Paper, 2005, 24(11): 8-12.
[15] STEINER M G, BABBS C F. Quantitation of the hydroxyl radical by reaction with dimethyl-sulfoxide[J]. Archives of Biochemistry and Biophysics, 1990, 278(2): 478-481.
[16] 徐向荣, 王文华, 李华斌. 比色法测定 Fenton反应产生的羟自由基及其应用[J]. 生物化学与生物物理进展, 1999, 26(1): 65-67.XU X R, WANG W H, LI H B. Determination of hydroxyl radicals in Fenton reaction by colorrmetric assay and its application[J]. Progress in Biochemistry and Biophysics, 1999, 26(1): 65-67.
[17] KLEIN S M, COHEN G, CEDERBAUM A I. Production of formaldehyde during metaboism of dimethyl sulfoxide by hydroxyl radical generating systems[J]. Biochemistry, 1981, 20(21): 6006-6012.
[18] REPINE R E, EATON J W, ANDERS M W, et al. Generation of hydroxyl radical by enzymes, chemicals, and human phagocytes in vitro[J]. Journal of Clinical Investigation, 1979, 64(6):1642-1651.
[19] BABBS C F, GRIFFIN D W. Scatchard analysis of methane sulfinic acid production from dimethyl-sulfoxide — a method to quantify hydroxyl radical formation in physiologic systems[J]. Free Radical Biology and Medicine, 1989, 6(5): 493-503.
[20] BABBS C F, GALE M J. Colorimetric assay for methanesulfinic acid in biological samples[J]. Analytical Biochemistry, 1987, 163(1):67-73.
[21] BABBS C F, STEINER M G. Detection and quantitation of hydroxyl radical using dimethyl-sulfoxide as molecular probe[J]. Methods in Enzymology, 1990, 186(11): 137-147.
[22] ZHAO H Q, GAO J H, ZHOU W, et al. Quantitative detection of hydroxyl radicals in Fenton system by UV-vis spectrophotometry[J].Analytical Methods, 2015, 7(13): 5447-5453.
[23] CHEN W C, CHANG J L, ZEN J M. Sensitive and selective detection of iron-catalysed hydroxyl radical formation in water without chemical probes[J]. Analytical Methods, 2013, 5(10): 2485-2490.
[24] MOHAMADIN A M. Possible role of hydroxyl radicals in the oxidation of dichloroacetonitrile by Fenton-like reaction[J]. Journal of Inorganic Biochemistry, 2001, 84(1): 97-105.
[25] SI F, YAN K, ZHANG X. Study on H2O2/TAED and H2O2/TBCC bleaching mechanism related to hydroxyl radical with a fluorescent probe[J]. Carbohydrate Polymers, 2014, 103: 581-586.
Improvement of spectrophotometric method based on Russell mechanism for detection of •OH concentration in liquid
ZHAO Haiqian1, GAO Xingcun1, LIU Chenghao1, WANG Zhonghua1, ZHOU Wei2, GAO Jihui2
(1Institute of Civil Engineering & Architecture, Northeast Petroleum University, Daqing 163318, Heilongjiang, China;2College of Energy Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China)
Spectrophotometric method based on Russell mechanism for detection of •OH concentration in liquid has many advantages, such as low-cost, simple operation, and so on. However, low precision and poor repeatability are its main disadvantages. The reason of this method’s low precision was elucidated, and a modified method was proposed. The influence of typical cations and anions on extraction of Fast Blue BB salt (FBBs) was analyzed. Key operating conditions for the modified method was determined. Based on the results, a relationship between •OH concentration and absorbance of diazosulfones was rebuilt. The interference of FBBs in the diazosulfone extraction process is the main reason of low precision. FeSO4has a strong ability to hold back extraction of FBBs by extraction agent, which decreases influence of FBBs on diazosulfones detection violently.Na+, K+, NO3-do not have obvious effects on the detection result, while Cl-influence is in relation to its concentration. The conditions for the modified method are: extraction time 300 s and molar ratio of FBBs to methylsulfinic acid (MSIA) is 50. The function relationship between •OH concentration and absorbance is obtained.
date:2016-11-18.
ZHAO Haiqian, dqzhaohaiqian@163.com
supported by the National Natural Science Foundation of China (51606036, 91434134) and the Heilongjiang Science Funds for Youths (QC2014C047).
X 132
A
0438—1157(2017)07—2805—07
10.11949/j.issn.0438-1157.20161636
2016-11-18收到初稿,2017-03-18收到修改稿。
联系人及第一作者:赵海谦(1981—),男,博士,副教授。
国家自然科学基金项目(51606036,91434134);黑龙江省青年科学基金项目(QC2014C047)。

