电化学合成氨研究进展
刘淑芝,韩伟,刘先军,崔宝臣
(东北石油大学化学化工学院,石油与天然气化工省重点实验室,黑龙江 大庆 163318)
电化学合成氨研究进展
刘淑芝,韩伟,刘先军,崔宝臣
(东北石油大学化学化工学院,石油与天然气化工省重点实验室,黑龙江 大庆 163318)
氨是世界上产量最大的化工产品之一,在全球经济中占有重要地位。传统的Haber-Bosch合成氨工艺需要在高温高压下进行,并且氢的平衡转化率低、能耗高、污染严重。电化学方法因可实现氨的常温常压合成而成为备受关注的研究领域。电化学合成氨的关键在于选择合适的电解质、制备电极及电催化剂,并将其有机组合在一起构建成高效稳定的电解池体系。综述了液体电解质、质子导体陶瓷膜电解质、熔盐电解质、陶瓷膜-熔盐复合电解质和有机质子交换膜电解质5类电解质体系的电化学合成氨的研究进展,介绍了相应的电化学合成氨原理,分析了技术发展现状和存在的问题,展望了未来研究的发展方向。
电化学;合成氨;电解质;电极;催化
引 言
氨既是重要的化工产品,又是染料、医药等工业的重要原料。工业上合成氨常采用传统的Haber-Bosch法,以N2和H2为原料,在高温、高压和催化剂的作用下进行,该方法存在工艺流程复杂、氢的平衡转化率低、能耗高、环境污染严重、对设备要求高等缺点[1]。因此,研究者不断探索新的合成氨方法,如微波及超声波法、常温常压流光放电法等[2],以期能够在常压或低温常压下实现氨的合成。1985年,Pickett等[3]首次采用电化学方法完成了合成氨循环,虽然氨产率和电流效率很低,但该方法实现了合成氨从“高压”到“常压”的飞跃,引起了世界科学家的普遍关注,开启了合成氨研究的新领域。
电化学合成氨在电能的推动下,可使热力学非自发的合成氨反应不受或少受热力学平衡限制,实现低温常压合成氨,得到研究者的广泛关注。近年来,已有文献对相关方面研究成果进行报道[4-6]。本文对不同电解质体系下电化学合成氨的国内外研究情况及最新进展进行了较为全面的综述,可为研究者提供参考。
1 液体电解质体系
液体电解质体系主要包括水溶液电解质、有机溶剂电解质和离子液体电解质3类,优点是可在接近室温甚至常温常压条件下实现氨的电化学合成。
1.1 水溶液电解质
水溶液作电解质电化学合成氨是人们较早探索的领域。1989年,Furuya等[7]报道了以 Na2SO4水溶液为电解质,分别以负载Pt和金属酞菁的气体扩散电极为阳极和阴极,在常温常压下由N2和H2电化学合成氨,但电流效率很低。电流效率很大程度上取决于电解质的性质及金属酞菁的金属中心种类[8-9]。Kordali等[10]以KOH水溶液为电解质,Nafion膜作隔膜,采用Ru/C阴极和铂阳极,由N2和H2O电化学合成氨,常压 20℃时氨产率为 3.43×10-12mol·s-1·cm-2,产氨电流效率为 0.28%。Chen 等[11]在碳纸上沉积负载Fe2O3/CNT(碳纳米管)催化剂,然后与Nafion115膜热压在一起为阴极,采用Pt为阳极,以 Ag/AgCl为参比电极,KHCO3水溶液为电解质,向阴极通入 N2,在 20℃常压下电化学合成氨,产率为 3.59×10-12mol·s-1·cm-2,产氨电流效率约为 0.025%。Kőleli等[12]在 Li2SO4/H+(H2SO4为质子供体)水溶液体系中电化学合成氨,常温、6.1 MPa 下氨产率为 3.68×10-10mol·s-1·cm-2。
水溶液作为电化学合成氨的电解质具有清洁和来源广泛等优点,但由于N2在水中的溶解度极低和阴极上存在水电解产H2的竞争反应,致使产氨电流效率非常低。
1.2 有机溶剂电解质
与水相比,脂族醇对N2溶解能力较强(超过水的30倍),也能有效抑制水电解产H2反应。Tsuneto等[13]以乙醇+LiClO4的四氢呋喃溶液为电解质,在室温下考察了Ti、Mo、Fe、Co、Ni、Cu、Ag等几种金属阴极的电化学合成氨情况,常压产氨电流效率为5%~8%。当压力提高至5.1 MPa,Fe作阴极时,电流效率提高至 58%,最大氨产率约为 4.0×10-9mol·s-1·cm-2。Kim 等[14]以异丙醇/去离子水作电解质,硫酸为支持电解质,采用Pt片阳极和多孔镍阴极常温常压下电化学合成氨,氨产率为1.54×10-11mol·s-1·cm-2,产氨电流效率低于 1.0%。由于异丙醇易于在阴极上电解还原,他们又将LiCl溶解在阴极稳定性高的乙二胺中作电解质,玻碳电极作阳极,镍片作阴极,并由CMX膜将电解池分隔成两室,常温常压下氨产率为 3.58×10-11mol·s-1·cm-2,产氨电流效率为17.2%[15]。与常温常压下的水溶液电解质合成氨相比,有机电解质产氨效率明显提高。
1.3 离子液体电解质
离子液体电解质与有机溶剂电解质相比,具有不挥发、不可燃、高的离子导电性和化学稳定性等特点。Pappenfus等[16]利用含有LiClO4的离子液体1-乙基-3-甲基咪唑-二(三氟甲磺酰基酰)亚胺(EMI-TFSI)作电解质,乙醇(氢源)和氮气为原料,分别采用2 cm2的Ni片和Pt片为阴极和阳极,电流密度为2 mA·cm-2,在室温常压下合成氨电流效率最高为 5.1%,在此条件下反应时间过长会导致EMI-TFSI分解。
2 质子导体陶瓷膜电解质体系
质子导体陶瓷膜是一类重要的具有 H+传导能力的固体电解质。Stotz等[17]首次发现在高温、水蒸气气氛下CuO、Cu2O、NiO和部分稳定的ZrO2中质子的存在,1981年Iwahara等[18]发现一些材料,如SrCeO3在高温(600~1000℃)含H2气氛中具有良好的质子传导性,此后,质子导电材料引起人们的广泛重视。Marnellos等[19]于1998年首次报道了采用 SrCe0.95Yb0.05O3-δ(SCY)陶瓷膜作电解质,以H2和N2为原料,Pd薄膜为阴极和阳极,在双室电解池(图1)中常压电化学合成氨,570℃下氨产率最高为 5×10-11mol·s-1·cm-2,电流效率接近 75%。该研究开创了新一代电化学合成氨方法,得到广泛关注与深入研究。
以水或氢气为氢源,利用质子导体电解质电化学合成氨的原理是:H2或水蒸气在阳极上生成H+,H+通过电解质迁移到阴极,在阴极上形成NH3。具
体反应如下。
阳极

图1 电解池反应器[19]Fig.1 Schematic diagram of cell-reactor[19]1—SCY ceramic tube (H+conductor); 2—quartz tube; 3—cathodic electrode (Pd); 4—anodic electrode (Pd); 5—galvanostat-potentiostat;6—voltmeter
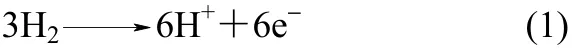
或
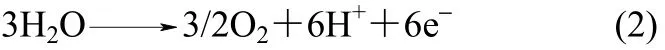
阴极
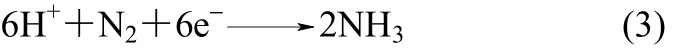
目前,电化学合成氨常用的质子导体陶瓷膜电解质材料主要是低价阳离子掺杂的萤石、烧绿石及钙钛矿结构的复合氧化物。由于材料中温区(400~600℃)的质子电导率是影响合成氨的重要因素,研究主要集中在改善固体电解质在中温区的电性质。陶瓷电解质的制备方法也对合成氨有较大影响,目前多采用柠檬酸盐溶胶-凝胶法,与固相反应法相比,该方法操作简单、快捷,制备的粉体粒度小、分布窄、纯度高,陶瓷烧结温度大大降低,烧结时间大大缩短,得到的陶瓷密度和硬度相对较高,电导率有所提高,氨产率也相应提高。
2.1 萤石型氧化物电解质
萤石氧化物通式为AO2,是典型的氧离子导体,大多数工作集中在对其氧离子导电性的研究。近年来,已有研究证明了掺杂 CeO2电解质在高温、H2/H2O气氛中的质子导电行为[20]。
CeO2基固体电解质材料在400~800℃范围具有较高离子传导率,使其在电化学合成氨方面得到应用。Liu等[21]以单掺杂萤石氧化物 Ce0.8M0.2O2-δ(M= La,Y,Gd,Sm)固体陶瓷膜为电解质,Ag-Pd作电极,以湿H2和N2为原料电化学合成氨。4种电解质在 H2气氛中均为质子导体,其中,Ce0.8Sm0.2O2-δ的电导率最高,620℃下的氨产率也最高,为 8.2×10-9mol·s-1·cm-2。他们还发现 La、Ca双掺杂材料(Ce0.8La0.2)0.975Ca0.025O2-δ的电导率大于La单掺杂,说明少量掺杂Ca在提高样品晶格混乱度方面发挥了一定的作用,从而使导电率提高,氨产率也随之提高[22]。
2.2 烧绿石型氧化物电解质
典型的烧绿石型结构通式为A2B2O7,其中A、B分别是+3价和+4价阳离子,属立方面心晶系。与萤石型结构相比,烧绿石结构具有高的化学稳定性、高熔点和离子电导率,传导温度与萤石型氧化物相近,且烧绿石结构中氧离子空隙是有序的,不发生电子导电。烧绿石可通过掺杂其他低价离子(如稀土或碱土金属)取代结构中的A原子或B原子,调整A与B的相对离子半径,增加结构中离子排列的混乱度,提高结构中的空位浓度,改善其离子导电能力及氧化物的特性。
La2Zr2O7具有典型的烧绿石结构,未掺杂的La2Zr2O7不具有或只有微小的质子导电性,掺杂低价离子如稀土Y 或碱土金属(Ca、Sr)可以使其具有与钙钛矿质子导电氧化物相媲美的质子导电性,但其传导温度更低。Omata等[23]发现 Ca掺杂的La2Zr2O7在200~600℃时几乎是纯的质子导体,600℃时电导率可达10-2S·cm-1。掺杂取代La 位置比取代 Zr 位置的质子浓度高出两倍,这种现象可能是由于烧绿石晶型的特殊结构:O2-只被La3+包围。Xie等[24-25]制备了 Ca 单掺杂和 Ca、Ce 双掺杂的La1.9Ca0.1Zr2O6.95(LCZ)、La1.9Ca0.1Zr1.6Ce0.4O6.975(LCZC) 固体复合氧化物电解质,采用Ag-Pd电极,以湿H2和N2为原料电化学合成氨,掺杂后样品总的导电率明显增加,表明元素掺杂可以提高样品中的空穴浓度,从而提高样品的离子导电性能,氨产率也随着明显增加,500℃时LCZ 和LCZC 的氨产率分别为 1.75×10-9、7.8×10-10mol·s-1·cm-2,均远高于未掺杂La2Zr2O7的氨产率6.8×10-12mol·s-1·cm-2。
2.3 钙钛矿型氧化物电解质
钙钛矿复合氧化物的化学式为 ABO3,其中SrCeO3、LaGaO3、BaCeO3基等钙钛矿型质子导体是近年来人们发现的电导率较高的几种电解质材料,广泛用作多种电化学装置的固体电解质。这类电解质都有极强的掺杂能力,可通过掺杂来改善材料的电化学性能及化学稳定性,近年来,以钙钛矿型氧化物质子导体作电解质的电化学合成氨得到广泛研究。目前对钙钛矿材料的掺杂研究工作主要集中在三价稀土离子上,一般掺杂Sc、Y、Yb、Nb、Gd 等[26]。
2.3.1 SrCeO3基钙钛矿电解质 SrCeO3是最早被发现的钙钛矿结构质子导体,但其电导率和稳定性较低,在 Ce 位上掺入少量三价阳离子可改善SrCeO3在高温含氢气氛中的质子传导性[18]。单掺杂的 SrCeO3通式为 SrCe1-xMxO3-δ,M= Yb3+,Y3+,Gd3+,La3+,Sc3+等。宿新泰等[27]制备了 Y 掺杂SrCeO3复合氧化物电解质 SrCe0.95Y0.05O3-δ(SCY),采用 Ag-Pd 合金作电极,适宜的合成氨温度为480℃,氨产率可达 2.84×10-9mol·s-1·cm-2,明显高于文献[19]中采用相同电解质时的氨产率5×10-11mol·s-1·cm-2,并且氨合成温度降低了 90℃。这个结果归因于陶瓷粉体采用溶胶-凝胶法制备,同时陶瓷片的厚度降至0.8 mm,也在一定程度上提高了质子电导率。
2.3.2 LaGaO3基钙钛矿电解质 LaGaO3基氧化物是优良的氧离子导体,关于其氧离子电导性的研究已有大量报道,但它们的质子导电性一直被人们所忽视。2006年,Ma等[28]报道了 Sr 和Mg掺杂的La0.9Sr0.1Ga0.8Mg0.2O3-α在 600~1000℃范围内的 H2气氛中几乎是纯质子导体,其质子电导率可达1.4×10-2~1.4×10-1S·cm-1,质子迁移数>0.99,被认为是有前途的中温电解质。
LaGaO3基电解质的缺点是随着时间延长Ga流失,导致材料致密度下降而影响性能。为了改善其化学稳定性,进行了大量掺杂研究。陈成等[29]制备了系列双掺杂的La0.9M0.1Ga0.8Mg0.2O3-α(M=Ca2+,Sr2+,Ba2+)陶瓷电解质,通过电导率的同位素效应和氢的电化学透过实验证明,在氢气气氛中该系列陶瓷样品几乎是纯的质子导体。几种电解质的质子电导率、氨产率与晶胞自由体积(Vf)有很好的相关性:Sr2+>Ba2+>Ca2+,Vf增大有利于质子传输。以 Pt为电极,H2和 N2为原料电化学合成氨,La0.9Sr0.1Ga0.8Mg0.2O3-α的氨产率最高,为2.53×10-9mol·s-1·cm-2,这与其具有最高质子电导率有关。
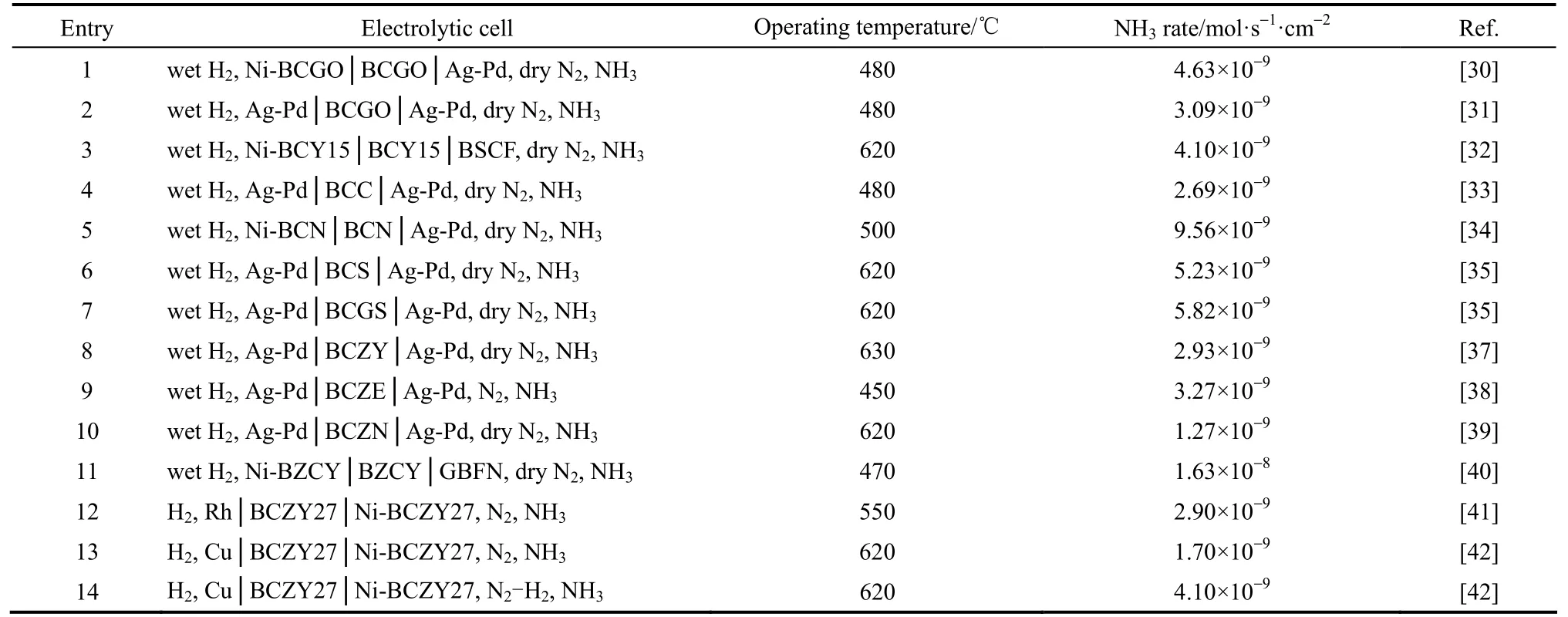
表1 不同BaCeO3基质子导体电解质的合成氨产率Table 1 Ammonia production rates achieved with different BaCeO3proton conductors electrolyte systems
2.3.3 BaCeO3基钙钛矿电解质 钙钛矿结构电解质电导率随着A、B 位原子电负性的降低而升高,结合电负性的大小:Ca>Ba, Ti>Nb>Zr>Ce,BaCeO3具有比其他钙钛矿氧化物更高的电导率,可较容易超过10-2S·cm-1,是目前被广泛研究的质子导体,用于合成氨研究较多的是B位单掺杂或双掺杂的 BaCeO3,如 Gd、Y、Ca、Nd、Sm 单掺杂的BaCe0.85Gd0.15O3-α(BCGO)、BaCe0.8Gd0.2O3-δ(BCGO)、BaCe0.85Y0.15O3-α(BCY15)、BaCe1-xCaxO3-α(BCC)、BaCe0.9Nd0.1O3-δ(BCN)、BaCe0.9Sm0.1O3-δ(BCS)和Gd、Sm 双掺杂的 BaCe0.80Gd0.10Sm0.10O3-δ(BCGS)等[30-35]。BaCeO3虽然质子电导率高,但其化学稳定性较差,易与CO2和H2O反应在界面形成碳酸盐和氢氧化物,阻碍质子传导。而锆酸盐如BaZrO3,具有更高的化学稳定性及机械强度,但质子电导率相对较低,掺杂改性后合成氨产率仍然较低[36]。BaCeO3-BaZrO3固溶体复合质子导体可有效整合二者的优点,同时避免各自的缺点,使其既具有较高的电导率又具有较高的化学稳定性,也可对其进一步掺杂改性。近年来报道的用于电化学合成氨的此类材料有BaCe0.2Zr0.7Y0.1O3-δ(BCZY)、BaCe0.65Zr0.2Er0.15O3-α(BCZE)、BaCe0.8Zr0.1Nd0.1O3-α(BCZN)、BaZr0.1Ce0.7Y0.2O3-α(BZCY)、BaZr0.7Ce0.2Y0.1O2.9(BZCY27)等[37-42],部分 BaCeO3基及其复合质子导体电解质的具体氨产率见表1。
提高高温质子导体输出功率的关键是减小工作温度下固体电解质隔膜的电阻,提高电极材料的催化活性。与固相反应法比,虽然目前广泛采用的柠檬酸溶胶-凝胶法合成的电解质陶瓷提高了氨产率,但提高幅度有限。采用电极支撑型结构使陶瓷电解质薄膜化已成为提高氨产率的有效手段之一。该结构中电极通常为 Ni/电解质的多孔金属陶瓷,由含NiO 的电解质材料还原而得,拥有足够的气孔率,形成输运气体和电极反应产物所需要的多孔结构,可以大大增加电极-电解质-气体三相界面,促进反应的进行。此外,这种多层结构可以大大降低固体电解质薄膜的厚度(通常只有几十微米),有利于降低电解质内阻及能耗、提高电流效率及合成氨产率。
张蔚等[34]采用多次丝网印刷的方法,将电解质BaCe0.9Nd0.1O3-δ(BCN)浆料印刷在多孔金属陶瓷阳极NiO-BCN基膜上,制备出厚度约为40 μm的致密均匀BCN固体电解质薄膜,测定了多层膜结构在湿H2/N2气氛中的电导率,与厚度为0.8 mm的陶瓷膜电解质相比,多层膜结构的电导率明显提高,氨产率也相应提高。朱剑莉等[40]用浆料旋涂法结合后续的热处理在NiO-BZCY阳极支撑体上制备出厚度为50 μm的致密BZCY 电解质薄膜,然后在电解质薄膜上再制备多孔性GdBaFeNiO5+δ(GBFN)阴极膜,以 H2和 N2为原料,在470℃下的最高氨产率为1.63×10-8mol·s-1·cm-2。这一结果高于迄今所报道的基于质子导体陶瓷膜电解法的合成氨产率,认为获得较高的氨产率除了因BZCY电解质具有优良的导电性能及阴极材料GBFN优良的电极极化性能外,使用薄膜电解质有利于提高产氨效率。
2.3.4 复杂钙钛矿电解质 复杂钙钛矿型质子导体的结构为 A2( B′1+xB″1-x)O6和 A3(B′1+xB″2-x)O9(化学式中A、B′、B″均为金属离子),A为+2价,B′为+3价或+2价阳离子,B″通常为+5价。结构中B′和B″交替占据B 位,当金属离子组成稍微偏离化学计量组成(x>0)时,为保持电中性便可产生氧离子空位及质子导电性。Li等[43]制备了系列复合氧化物Ba3(Ca1.18Nb1.82)O9(BCN18)、Ba3CaZr0.5Nb1.5O9(BCZN)、Ba3Ca0.9Nd0.28Nb1.82O9(BCNN)电解质,3种电解质合成氨的最佳温度均为620℃,其中,BCNN 的氨产率最高为 2.16×10-9mol·s-1·cm-2。
陶瓷膜固体电解质一般需要在 400℃以上才具有明显的导通质子能力,而高温会导致生成的氨分解,在热力学上不利于合成氨,因此,该类电解质体系电化学合成氨速率至今一直没能有更高的突破。
3 熔盐电解质体系
熔盐电解质具有电导率高(比水溶液至少高 1个数量级,比有机电解质高几个数量级)、离子迁移和扩散速度快等优点,在电化学合成氨研究中受到重视。Tsuyoshi等[44]采用含氮离子的熔融碱金属卤化物LiCl-KCl-CsCl-Li3N为电解质,多孔Ni为电极电化学合成氨,机理如图 2所示,通入阴极的 N2还原为N3-,在阳极上,H2与N3-反应形成氨,400℃下氨的最大产率约为 3.3×10-9mol·s-1·cm-2,产氨电流效率为 72%。Kim 等[45]研究了在 LiCl-KCl-CsCl电解质中几种金属阴极材料对氮还原性能的影响,其氮还原的活性顺序为Co > Ni > Fe >Ti,这种性能的差异归因于上述材料的电阻率与其润湿性之间的协同关系。最近,他们分别将纳米Fe2O3和CoFe2O4悬浮于LiCl-KCl-CsCl共熔物中,以N2和水蒸气为原料电化学合成氨,纳米粒子具有催化 N2还原的作用,Fe2O3催化活性优于CoFe2O4[46]。

图2 电解合成氨原理[44]Fig.2 Schematic drawing of principle of electrolytic synthesis of ammonia[44]
2014年,本课题组与美国乔治华盛顿大学Licht教授合作,在以H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展[47]。该方法以熔融NaOH-KOH为电解质,悬浮的纳米Fe2O3作催化剂,镍片为阳极,200目(74 μm)的蒙乃尔筛网为阴极,当电流密度为2 mA·cm-2,电压为1.2 V时,200℃下氨产率为 2.4×10-9mol·s-1·cm-2,合成氨电流效率为 35%,同时副产H2,产H2速率为6.6×10-9mol·s-1·cm-2,电解池无须任何隔膜,结构简单。电化学合成氨机理是:阴极上Fe2O3和H2O得到电子还原成Fe和OH-,OH-通过电解质迁移至阳极失去电子氧化生成 O2,而阴极上生成的 Fe与 H2O和N2反应生成氨[48]。具体反应如下。
阴极

阳极

化学反应
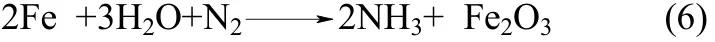
总反应

在上述电化学合成氨过程中,阴极上电解Fe2O3还原成Fe的同时,也会发生水电解为H2的副反应,降低合成氨的电流效率,另外因团聚、沉淀等作用使得纳米Fe2O3在电解质中不能长时间稳定悬浮。为此,最近Cui等[49]将Fe2O3负载到粉末活性炭上,制备了 Fe2O3/AC催化剂,载体活性炭的密度与熔融 NaOH-KOH密度接近,故电解反应时 Fe2O3/AC在电解质中不会发生聚沉,更重要的是发现采用 Fe2O3/AC为催化剂电化学合成氨时,活性炭粉末吸附在阴极上,明显抑制了水电解产H2的副反应,增强了电解Fe2O3还原成Fe的反应,250℃下最高氨产率为 8.27×10-9mol·s-1·cm-2。
4 陶瓷膜-熔盐复合电解质体系
陶瓷膜-熔盐的复合材料是通过向陶瓷材料粉体中添加二元或多元低温金属熔盐,在高压下成型,再经高温烧结而成。这类材料由于熔盐的存在大大提高了离子电导率,还可有效抑制电子导电,增强材料的稳定性,许多研究者以此类材料为电解质,研究其电化学合成氨性能。
4.1 陶瓷膜-混合磷酸盐复合电解质
王本辉等[50]制备了不同复合比的 Ce0.8Y0.2O1.9(YDC)-Ca3(PO4)2-K3PO4陶瓷膜复合电解质,采用Pd-Ag为电极,在中温区(400~800℃)测试了其电化学性能。与YDC相比,二元磷酸盐质量为20%的复合电解质电导率与氨产率提高最大,650℃时在湿 H2/N2气氛中的电导率达到 5.75×10-2S·cm-1,氨产率为 9.5×10-9mol·s-1·cm-2。他们又以天然气和N2为原料,La0.9Sr0.1Al0.9Mg0.1O3-δ(LSAM)-Ca3(PO4)2-K3PO4为电解质,Pd-Ag为电极,650℃时氨产率为 6.95×10-9mol·s-1·cm-2[51]。刘玉星等[52]也在相同电解质中进行合成氨测试,650℃时氨产率为 5.30×10-9mol·s-1·cm-2。
4.2 陶瓷膜-混合碳酸盐复合电解质
混合碳酸盐(Li/Na/K)2CO3熔点较低,能够显著降低合成氨的电解温度,受到研究者的广泛关注。Amar等[53-63]在这方面做了大量工作,研究的复合电解质主要包括LiAlO2-(Li/Na/K)2CO3、Ce0.8Sm0.2O2-δ(SDC)-(Li/Na/K)2CO3、Ce0.8Gd0.18Ca0.02O2-δ(CGDC)-(Li/Na/K)2CO3、Ce0.8Gd0.2O2-δ(CGO)-(Li/Na/K)2CO3等,具体氨产率见表 2。他们虽然没有获得更高的氨产率,但实现了在单室反应器中直接以湿空气为原料合成氨[61-62],同时采用相对于贵金属较为廉价的钙钛矿作电催化剂,合成温度也普遍低于陶瓷膜电解质,降低了合成氨成本。

表2 不同陶瓷膜-混合碳酸盐复合电解质的合成氨产率Table 2 Ammonia production rates achieved with different ceramic membrane-mixed carbonic acid electrolyte systems
5 有机质子交换膜电解质体系
质子交换膜(PEM)是一种在低温条件下(低于150℃)对质子导通、对电子绝缘,具有选择透过性的功能高分子膜,如磺化SEBS质子交换膜、磺化聚醚醚酮膜、磷酸掺杂新型聚苯并咪唑等。目前广泛使用的全氟磺酸质子交换膜,如Nafion膜,因其化学稳定性和热稳定性比较高,质子导电性强,被公认为是一种良好的质子交换膜材料。Nafion膜的化学结构如图3所示[64],其离子传导的微结构比较经典的是Hsu等[65]提出的团簇网络模型,如图4所示,孔径约为4 nm的亲水性磺酸基团离子簇分布在有机疏水聚四氟乙烯基团上,这些团簇由直径约1 nm的通道彼此相连,促进团簇间的质子传递。
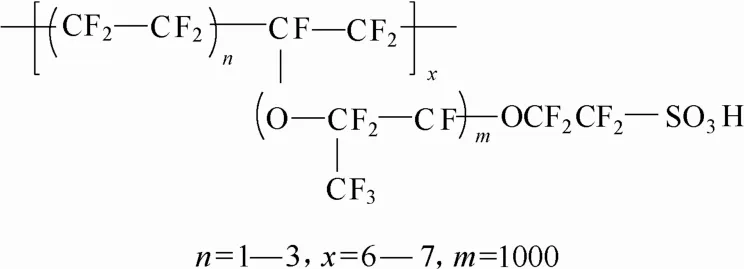
图3 Nafion膜的化学结构[64]Fig. 3 General chemical formula of Nafion membranes[64]

图4 Nafion膜的团簇网络模型[65]Fig. 4 Cluster-network model for Nafion membranes[65]
用 PEM 作电解质可以使合成氨的温度大大降低,真正实现在低温常压条件下电化学合成氨。但由于氮气分子的键能较大,在低温常压条件下电化学合成氨时,需要阴极催化性能较好的电催化剂。近年来,新疆大学在这方面做了较为深入的研究。在早期的工作中,多以复合氧化物陶瓷片作为电极,如SmFe0.7Cu0.3-xNixO3(SFCN)、Sm1.5Sr0.5MO4(M=Ni,Co,Fe)、Sm2-xCexCuO4(SCC)等作阴极,80℃时的氨产率最高可达 1.13×10-8mol·s-1·cm-2,电流效率为 90.4%,实现了在低温常压条件下电化学方法合成氨。但由于制作较大的陶瓷片比较困难,制约其在工业中的应用,他们又尝试将电极材料粉体与一定比例的聚四氟乙烯(PTFE)混合均匀,用涂膜法均匀涂在碳纤维纸上,制作出碳纤维纸作支撑的复合氧化物电极,具体氨产率情况见表3。
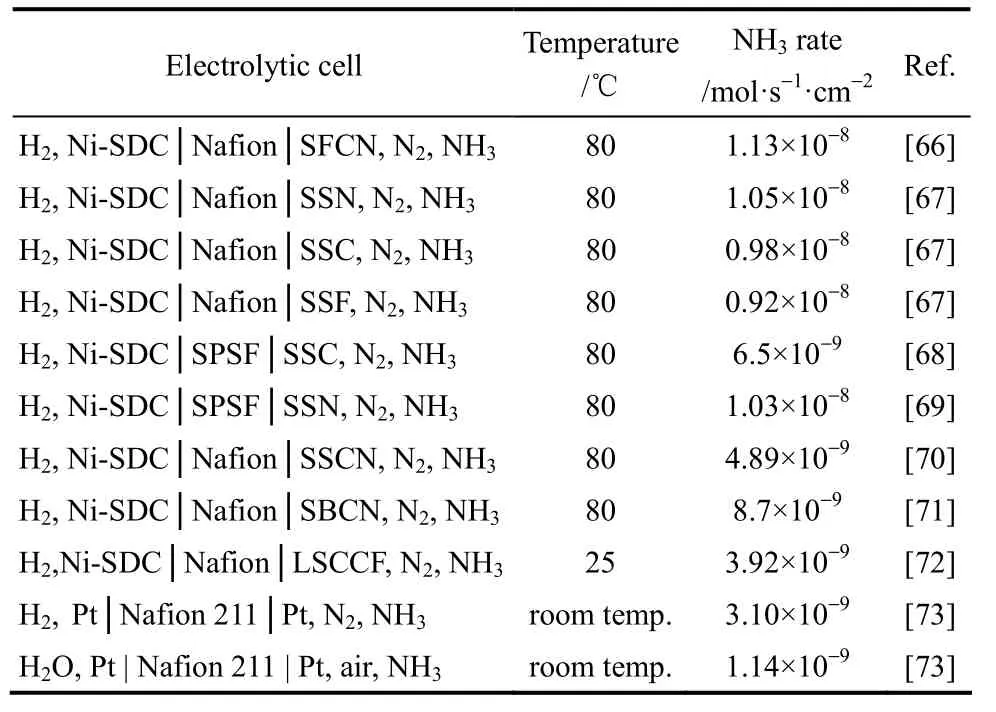
表3 不同PEM电解质体系的合成氨产率Table 3 Ammonia production rates achieved with different PEM electrolyte systems
有机质子交换膜(PEM)电化学合成氨虽然可以实现常温常压合成氨,且氨产率普遍高于陶瓷膜固体电解质,但氨是弱碱,容易与酸性膜反应,降低其质子传导性。
6 总结与展望
本文综述了5种电解质体系电化学合成氨的研究进展情况,其中,液体电解质可实现常温常压下电化学合成氨,但氨产率普遍较低。采用有机质子交换膜电解质也可在常温常压或低温常压合成氨,相比于其他电解质体系氨产率较高,目前最大的制约是质子交换膜与氨反应而降低其质子导电能力,提高膜材料的稳定性是解决问题的关键。陶瓷膜是目前研究最多的电解质体系,也已取得了一定的成绩,但由于其必须在较高的温度下才具有明显的离子导电能力,受高温氨易分解的影响,氨产率很难突破。陶瓷膜中添加低温熔盐是提高其较低温度下的电导率、降低合成氨温度的有效方法,目前的研究只限于 Ca3(PO4)2/K3PO4和(Li/Na/K)2CO3两种混合盐,还应进一步研究其他离子电导率更高、熔点低的混合盐体系,提高氨产率。陶瓷膜电解质合成氨电解池的结构也是影响氨产率的重要因素,电极支撑的多层膜结构可以减小陶瓷膜电解质的厚度,降低电解质内阻,提高电流效率。直接以湿空气为原料,在以多层膜结构为电解单元的单室反应器中电化学合成氨,由于反应器结构简单,原料无须分离、廉价易得,将成为合成氨今后的发展方向。
总之,电化学合成氨研究虽然取得了较大进展,但是还很不成熟,尚处于基础研究阶段,距实际应用还很遥远。通过优选合成氨电解质体系,降低操作温度,提高电催化剂的催化活性和电极稳定性,同时优化电解池的结构设计,提高电化学合成氨的电流效率,摆脱Haber-Bosch合成氨以煤或天然气化石能源为原料的依赖,开发出以水和空气为原料的直接低温常压合成氨方法具有重要的理论价值和现实意义。
[1] NAKAJIMA J, SEKIGUCHI H. Synthesis of ammonia using microwave discharge at atmospheric pressure[J]. Thin Solid Films,2008, 516(13): 4446-4451.
[2] BAI M D, BAI X X, ZHANG Z T. Synthesis of NH3by non equilibrium plasma under normal pressure[J]. Chin. J. Appl. Chem.,1998, 15(5): 71-73.
[3] PICKETT C J, TALARMIN J. Electrosynthesis of ammonia[J].Nature, 1985, 317(6038): 652-653.
[4] GIDDEY S, BADWAL S P S, KULKARNI A. Review of electrochemical ammonia production[J]. Int. J. Hydrogen Energ.,2013, 38: 14576-14594.
[5] SHIPMAN M A, SYMES M D. Recent progress towards the electrosynthesis of ammonia from sustainable resources[J]. Catal.Today, 2017, 286: 57-68.
[6] AMAR I A, LAN R, PETIT C T G, et al. Solid-state electrochemical synthesis of ammonia: a review[J] J. Solid State Electrochem., 2011,15: 1845-1860.
[7] FURUYA N, HIROSHI Y. Nitrogen fixation using a gas diffusion eletrode loaded Fe-phthalocyanine[J]. Denki Kagaku, 1989, 57(3):261-262.
[8] FURUYA N, HIROSHI Y. Electroreduction of nitrogen to ammonia on gas-diffusion electrodes modified by Fe-phthalocyanine[J].Electroanal. Chem., 1989, 263: 171-174.
[9] FURUYA N, HIROSHI Y. Electroreduction of nitrogen to ammonia on gas-diffusion electrodes modified by metal phthalocyanine[J].Electroanal. Chem., 1989, 272: 263-266.
[10] KORDALI V, KYRIACOU G, LAMBROU C. Electrochemical synthesis of ammonia at atmospheric pressure and low temperature in a solid polymer electrolyte cell[J]. Chem. Comm., 2000, 31(48):1673-1674.
[11] CHEN S M, PERATHONER S, AMPELLI C, et al. Electrocatalytic synthesis of ammonia at room temperature and atmospheric pressure from water and nitrogen on a carbon-nanotube-based electrocatalyst[J]. Angew. Chem., 2017, 129(10): 2743-2747.
[12] KŐLELI F, KAYAN D B. Low overpotential reduction of dinitrogen to ammonia in aqueous media[J]. Electroanal. Chem., 2010,638:119-122.
[13] TSUNETO A, KUDO A, SAKATA T. Lithium-mediated electrochemical reduction of high pressure N2to NH3[J]. Electroanal.Chem., 1994, 367: 183-188.
[14] KIM K, LEE N, YOO C Y, et al. Communication-electrochemical reduction of nitrogen to ammonia in 2-propanol under ambient temperature and pressure[J]. J. Electrochem. Soc., 2016, 163(7):F610-F612.
[15] KIM K, YOO C Y, KIM J N, et al. Electrochemical synthesis of ammonia from water and nitrogen in ethylenediamine under ambient temperature and pressure[J]. J. Electrochem. Soc., 2016, 163(14):F1523-F1526.
[16] PAPPENFUS T M, LEE K, THOMA L M, et al. Wind to ammonia:electrochemical processes in room temperature ionic liquids[J]. ECS Trans., 2009, 16: 89-93.
[17] STOTZ S, WAGNER C. Die löslichkeit von wasserdampf und wasserstoff in festen oxiden[J]. Ber. Bunsenges Phys. Chem., 1966,70(8): 781-788.
[18] IWAHARA H, ESAKA T, UCHIDA H, et al. Proton conduction in sintered oxides and its application to steam electrolysis for hydrogen production[J]. Solid State Ionics, 1981, 3/4: 359-363.
[19] MARNELLOS G, STOUKIDES M. Ammonia synthesis at atmospheric pressure[J]. Science, 1998, 282(5386): 98-100.
[20] NIGARA Y, YASHIRO K, KAWADA T, et al. The atomic hydrogen permeability in (CeO2)0.85(CaO)0.15at high temperatures[J]. Solid State Ionics, 2001, 145(1/2/3/4): 365-370.
[21] LIU R Q, XIE Y H, WANG J D, et al. Synthesis of ammonia at atmospheric pressure with Ce0.8M0.2O2-δ(M=La, Y, Gd, Sm) and their proton conduction at intermediate temperature[J]. Solid State Ionics,2006, 177(1/2): 73-76.
[22] 刘瑞泉, 谢亚红, 李志杰, 等. 质子导体 (Ce0.8La0.2)1-xCaxO2-δ在合成氨中的应用[J]. 物理化学学报, 2005, 21(9): 967-970.LIU R Q, XIE Y H, LI Z J, et al. Application of proton conductors(Ce0.8La0.2)1-xCaxO2-δin synthesis of ammonia[J]. Acta Phys.-Chim.Sin., 2005, 21(9): 967-970.
[23] OMATA T, OKUDA Y M. Electrical properties of proton-conducting Ca2+-doped La2Zr2O7with a pyrochlore-type structure[J]. J.Electrochem. Soc., 2001, 148(6): 252-261.
[24] XIE Y H, WANG J D, LIU R Q, et al. Preparation of La1.9Ca0.1Zr2O6.95with pyrochlore structure and its application in synthesis of ammonia at atmospheric pressure[J]. Solid State Ionics,2004, 168(1): 117-121.
[25] 谢亚红, 刘瑞泉, 王吉德, 等. Ca、Ce 双掺杂烧绿石型复合氧化物的合成及离子导电性能研究[J]. 无机化学学报, 2004, 20(5):551-554.XIE Y H, LIU R Q, WANG J D, et al. Synthesis and electrical properties of Ca and Ce doped pyrochlore-type oxides[J]. Chin. J.Inorg. Chem., 2004, 20(5): 551-554.
[26] ZUO C D, ZHA S W, LIU M L, et al. Ba(Zr0.1Ce0.7Y0.2)O3-δas an electrolyte for low-temperature solid-oxide fuel cells[J]. Adv. Mater.,2006, 18(24): 3318-3320.
[27] 宿新泰, 刘瑞泉, 王吉德. SrCe0.95Y0.05O3-δ在中温区的电化学性质及其在常压合成氨中的应用[J]. 化学学报, 2003, 61(4): 505-509.SU X T, LIU R Q, WANG J D. Electrochemical properties of SrCe0.95Y0.05O3-δat intermediate temperature and its application to ammonia synthesis at atmospheric pressure[J]. Acta Chim. Sinica,2003, 61(4): 505-509.
[28] MA G L, ZHANG F, ZHU J L, et al. Proton conduction in La0.9Sr0.1Ga0.8Mg0.2O3-α[J]. Chem. Mater., 2006, 18(25): 6006-6011.
[29] 陈成, 王文宝, 马桂林. La0.9M0.1Ga0.8Mg0.2O3-α的中温质子导电性及其在常压合成氨中的应用[J]. 化学学报, 2009, 67(7): 623-628.CHEN C, WANG W B, MA G L. Proton conduction in La0.9M0.1Ga0.8Mg0.2O3-αat intermediate temperature and its application to synthesis of ammonia at atmospheric pressure[J]. Acta Chim. Sinica, 2009, 67(7): 623-628.
[30] CHEN C, MA G. Proton conduction in BaCe1-xGdxO3-αat intermediate temperature and its application to synthesis of ammonia at atmospheric pressure[J]. J. Alloys Compd., 2009, 485(1/2): 69-72.
[31] LI Z J, LIU R Q, WANG J D, et al. Preparation of BaCe0.8Gd0.2O3-δby the citrate method and its application in the synthesis of ammonia at atmospheric pressure[J]. J. Solid State Electrochem., 2005, 9(4):201-204.
[32] WANG W, CAO X B, GAO W J, et al. Ammonia synthesis at atmospheric pressure using a reactor with thin solid electrolyte BaCe0.85Y0.15O3-αmembrane[J]. J. Memb. Sci., 2010, 360(1/2):397-403.
[33] LIU J W, LI Y D, WANG W B, et al. Proton conduction at intermediate temperature and its application in ammonia synthesis at atmospheric pressure of BaCe1-xCaxO3-α[J]. J. Mater. Sci., 2010,45(21): 5860-5864.
[34] 张蔚, 宿新泰, 刘瑞泉. 多层膜结构 BaCe0.9Nd0.1O3-δ的制备及其在常压合成氨中的应用[J]. 中国稀土学报, 2006, 24(1): 102-106.ZHANG W, SU X T, LIU R Q. Synthesis of BaCe0.9Nd0.1O3-δmultilayer membrane and its application to ammonia synthesis at atmospheric pressure[J]. J. Chin. Soc. Rare Earths, 2006, 24(1):102-106.
[35] LI Z J, LIU R Q, WANG J D, et al. Preparation of double-doped BaCeO3and its application in the synthesis of ammonia at atmospheric pressure[J]. Sci. Tech. Adv. Mater., 2007, 8(7/8):566-570.
[36] YUN D S, JOO J H, YU J H, et al. Electrochemical ammonia synthesis from steam and nitrogen using proton conducting yttrium doped barium zirconate electrolyte with silver, platinum, and lanthanum strontium cobalt ferrite electrocatalyst[J]. J. Power Sources,2015, 284: 245-251.
[37] 李志杰, 王吉德, 刘瑞泉, 等. 铈、钇双掺杂钙钛矿型复合氧化物的合成及其在常压合成氨中的应用[J]. 中国稀土学报, 2005, 23(1):62-67.LI Z J, WANG J D, LIU R Q, et al. Synthesis of Ce and Y doped perovskite-type oxides and its application in synthesis of ammonia at atmospheric pressure[J]. J. Chin. Soc. Rare Earths, 2005, 23(1):62-67.
[38] YIN J L, WANG X W, XU J H, et al. Ionic conduction in BaCe0.85-xZrxEr0.15O3-αand its application to ammonia synthesis at atmospheric pressure[J]. Solid State Ionics, 2011, 185(1): 6-10.
[39] 朱剑莉, 马桂林. BaCe0.8Zr0.10Nd0.10O3-α的质子导电性及在常压合成氨中的应用[J]. 南昌大学学报(理科版), 2012, 36(5): 462-471.ZHU J L, MA G L. Proton conduction in BaCe0.8Zr0.10Nd0.10O3-αand its application to ammonia synthesis at atmospheric pressure[J]. J.Nanchang University (Nat. Sci.), 2012, 36(5): 462-471.
[40] 朱剑莉, 马桂林, 占忠亮. 阳极支撑BZCY 电解质及GBFN 阴极膜在常压合成氨中的性能研究[J]. 中国稀土学报, 2012, 30(6):744-749.ZHU J L, MA G L, ZHAN Z L. Performances of anode-supported BZCY electrolyte and GBFN cathode membranes in ammonia synthesis at atmospheric pressure[J]. J. Chin. Soc. Rare Earths, 2012,30(6): 744-749.
[41] VASILEIOU E, KYRIAKOU V, GARAGOUNIS I, et al. Ammonia synthesis at atmospheric pressure in a BaCe0.2Zr0.7Y0.1O2.9solid electrolyte cell[J]. Solid State Ionics, 2015, 275: 110-116.
[42] VASILEIOU E, KYRIAKOU V, GARAGOUNIS I, et al.Electrochemical enhancement of ammonia synthesis in a BaZr0.7Ce0.2Y0.1O2.9solid electrolyte cell[J]. Solid State Ionics, 2016,288: 357-362.
[43] LI Z J, LIU R Q, XIE Y H, et al. A novel method for preparation of doped Ba3(Ca1.18Nb1.82)O9-δ: application to ammonia synthesis at atmospheric pressure[J]. Solid State Ionics, 2005, 176(11/12):1063-1066.
[44] TSUYOSHI M, TOKUJIRO N, TOSHIYUKI N, et al. Electrolytic synthesis of ammonia in molten salts under atmospheric pressure[J]. J.Am. Chem. Soc., 2003, 125(2): 334-335.
[45] KIM K, KIM J N, YOON H C, et al. Effect of electrode material on the electrochemical reduction of nitrogen in a molten LiCl-KCl-CsCl system[J]. Int. J. Hydrogen Energy, 2015, 40(16): 5578-5582.
[46] KIM K, YOON H C, KIM J N, et al. Electrochemical synthesis of ammonia from water and nitrogen catalyzed by nano-Fe2O3and CoFe2O4suspended in a molten LiCl-KCl-CsCl electrolyte[J]. Korean J. Chem. Eng., 2016, 33(6): 1777-1780.
[47] LICHT S, CUI B C, WANG B H, et al. Ammonia synthesis by N2and steam electrolysis in molten hydroxide suspensions of nanoscale Fe2O3[J]. Science, 2014, 345(6197): 637-640.
[48] LI F F, LICHT S. Advances in understanding the mechanism and improved stability of the synthesis of ammonia from air and water in hydroxide suspensions of nanoscale Fe2O3[J]. Inorg. Chem., 2014, 53:10042-10044.
[49] CUI B H, ZHANG J H, LIU S Z, et al. Electrochemical synthesis of ammonia directly from N2and water over iron-based catalysts supported on activated carbons[J]. Green Chem., 2017, 19: 298-304.
[50] 王本辉, 刘瑞泉, 王吉德, 等. Ce0.8Y0.2O1.9-Ca3(PO4)2-K3PO4复合电解质在中温区的质子导电性及在常压合成氨中的应用[J]. 无机化学学报, 2005, 21(10): 1551-1554.WANG B H, LIU R Q, WANG J D, et al. Doped Ceria-Ca3(PO4)2-K3PO4composite electrolyte: proton conductivity at intermediate temperature and application in atmospheric pressure ammonia synthesis[J]. Chin. J. Inorg. Chem., 2005, 21(10):1551-1554.
[51] WANG B H, WANG J D, LIU R Q, et al. Synthesis of ammonia fromnatural gas at atmospheric pressure with doped ceria-Ca3(PO4)2-K3PO4composite electrolyte and its proton conductivity at intermediate temperature[J]. J. Solid State Electrochem., 2006, 11 (1): 27-31.
[52] 刘玉星, 刘瑞泉, 王吉德. La0.9Sr0.1Al0.9Mg0.1O3-δ-Ca3(PO4)2-K3PO4复合电解质的合成及在常压天然气合成氨中的应用[J]. 无机化学学报, 2007, 23(2): 339-342.LIU Y X, LIU R Q, WANG J D. La0.9Sr0.1Al0.9Mg0.1O3-δ-Ca3(PO4)2-K3PO4composite electrolyte: preparation and application to ammonia synthesis at atmospheric pressure[J]. Chin. J. Inorg.Chem., 2007, 23 (2): 339-342.
[53] AMAR I A, LAN R, PETIT C T G, et al. Electrochemical synthesis of ammonia based on a carbonate-oxide composite electrolyte[J]. Solid State Ionics, 2011, 182(1): 133-138.
[54] AMAR I A, LAN R, PETIT C T G, et al. Electrochemical synthesis of ammonia based on Co3Mo3N catalyst and LiAlO2-(Li,Na,K)2CO3composite electrolyte[J]. Electrocatalysis, 2015, 6(3): 286-294.
[55] AMAR I A, LAN R, PETIT C T G, et al. Electrochemical synthesis of ammonia using Fe3Mo3N catalyst and carbonate-oxide composite electrolyte[J]. Int. J. Electrochem. Sci., 2015, 10: 3757-3766.
[56] AMAR I A, PETIT C T G, ZHANG L, et al. Electrochemical synthesis of ammonia based on doped-ceria-carbonate composite electrolyte and perovskite cathode[J]. Solid State Ionics, 2011, 201(1):94-100.
[57] AMAR I A, PETIT C T G, MANN G, et al. Electrochemical synthesis of ammonia from N2and H2O based on (Li, Na,K)2CO3-Ce0.8Gd0.18Ca0.02O2-δcomposite electrolyte and CoFe2O4cathode[J]. Int. J. Hydrogen Energy, 2014, 39(9): 4322-4330.
[58] AMAR I A, PETIT C T G, LAN R, et al. Electrochemical synthesis of ammonia from wet nitrogen using La0.6Sr0.4FeO3-δ-Ce0.8Gd0.18Ca0.02O2-δcomposite cathode[J]. RSC Adv., 2014, 4(36):18749-18754.
[59] AMAR I A, LAN R, TAO S W. Electrochemical synthesis of ammonia directly from wet N2using La0.6Sr0.4Fe0.8Cu0.2O3-δ-Ce0.8Gd0.18Ca0.02O2-δcomposite catalyst[J]. J. Electrochem. Soc., 2014,161(6): H350-354.
[60] AMAR I A, LAN R, TAO S W. Synthesis of ammonia directly from wet nitrogen using a redox stable La0.75Sr0.25Cr0.5Fe0.5O3-δ-Ce0.8Gd0.18Ca0.02O2-δcomposite cathode[J]. RSC Adv., 2015, 5:38977-38983.
[61] LAN R, ALKHAZMI K A, AMAR I A, et al. Synthesis of ammonia directly from wet air at intermediate temperature[J]. Appl. Catal. B:Environmental, 2014, 152/153: 212-217.
[62] LAN R, ALKHAZMI K A, AMAR I A, et al. Synthesis of ammonia directly from wet air using new perovskite oxide La0.8Cs0.2Fe0.8Ni0.2O3-δas catalyst[J]. Electrochim. Acta, 2014, 123:582-587.
[63] LAN R, ALKHAZMI K A, AMAR I A, et al. Synthesis of ammonia directly from wet air using Sm0.6Ba0.4Fe0.8Cu0.2O3-δas the catalyst[J].Faraday Discuss., 2015, 182: 353-363.
[64] SAITO M, HAYAMIZU K, OKADA T. Temperature dependence of ion and water transport in perfluorinated ionomer membranes for fuel cells[J]. J. Phys. Chem. B, 2005, 109(8): 3112-3119.
[65] HSU W Y, GIERKE T D. Ion transport and clustering in nafion perfluorinated membranes[J]. J. Memb. Sci., 1983, 13(3): 307-326.
[66] XU G C, LIU R Q, WANG J. Electrochemical synthesis of ammonia using a cell with a nafion membrane and SmFe0.7Cu0.3-xNixO3(x = 0—0.3) cathode at atmospheric pressure and lower temperature[J]. Sci.China Ser. B: Chem., 2009, 52(8): 1171-1175.
[67] XU G C, LIU R Q. Sm1.5Sr0.5MO4(M=Ni, Co, Fe) cathode catalysts for ammonia synthesis at atmospheric pressure and low temperature[J]. Chin. J. Chem., 2009, 27(4): 677-680.
[68] LIU R Q, XU G C. Comparison of electrochemical synthesis of ammonia by using sulfonated polysulfone and nafion membrane with Sm1.5Sr0.5NiO4[J]. Chin. J. Chem., 2010, 28(1): 139-142.
[69] 王进, 刘瑞泉. SDC 和SSC 在低温常压电化学合成氨中的性能研究[J]. 化学学报, 2008, 66(7): 717-721.WANG J, LIU R Q. Property research of SDC and SSC in ammonia synthesis at atmospheric pressure and low temperature[J]. Acta Chim.Sinica, 2008, 66(7): 717-721.
[70] 徐艳丽, 刘瑞泉. Sm1.2Sr0.8Co1-xNixO4+δ( x = 0.0, 0.1, 0.2) 粉体在低温常压下电化学合成氨中的阴极催化性能[J]. 化学通报, 2010,(9): 809-813.XU Y L, LIU R Q. Cathode catalytic performance of Sm1.2Sr0.8Co1-xNixO4+δ(x = 0.0, 0.1, 0.2) in electrosynthesis ammonia at atmospheric pressure and lower temperature[J]. Chemistry, 2010,(9): 809-813.
[71] ZHANG Z F, ZHONG Z P, LIU R Q. Cathode catalysis performance of SmBaCuMO5+δ(M=Fe, Co, Ni) in ammonia synthesis[J]. J. Rare Earths, 2010, 28(4): 556-559.
[72] 崔银仓, 刘瑞泉. LSCCF粉体在低温常压电化学合成氨中的阴极催化性能[J]. 新疆大学学报(自然科学版), 2010, 27(4): 473-477.CUI Y C, LIU R Q. Cathode catalytic performance of LSCCF powders in electro synthesis ammonia at atmospheric pressure and lower temperature[J]. J. Xinjiang University (Nat. Sci. Edition), 2010,27(4): 473-477.
[73] LAN R, IRVINE J T S, TAO S W. Synthesis of ammonia directly from air and water at ambient temperature and pressure[J]. Scientific Reports, 2013, 3:1145.
Advances in electrochemical synthesis of ammonia
LIU Shuzhi, HAN Wei, LIU Xianjun, CUI Baochen
(Provincial Key Laboratory of Oil & Gas Chemical Technology, College of Chemistry & Chemical Engineering,Northeast Petroleum University, Daqing 163318, Heilongjiang, China)
Ammonia (NH3) is one of the most widely produced chemicals worldwide with a key role in the growth of global economy. Traditional ammonia synthesis by the Haber-Bosch process runs at high temperature and pressure with low hydrogen conversion, high energy consumption and severe environmental pollution.Electrochemical synthesis of ammonia has been immensely studied as it is operated at ambient temperature and pressure. The electrochemical synthesis has been improved via choosing electrolyte systems, preparing electrodes and electrocatalysts, and constructing highly efficient and stable electrochemical cells. This review summarized recent progress of electrochemical ammonia synthesis in five electrolyte systems including liquid electrolyte,proton conductor ceramic membrane, molten salts, a composite electrolyte of molten salts and ceramic membrane,and organic proton exchange membrane. Mechanism of electrochemical ammonia production, current technical status, major challenges and future directions were discussed.
electrochemistry; synthesis of ammonia; electrolyte; electrode; catalysis
date:2017-01-18.
CUI Baochen, lszcbccx@163.com
supported by the Natural Science Foundation of Heilongjiang Province (B2015011) and the Foundation of Northeast Petroleum University.
O 646.5
A
0438—1157(2017)07—2621—10
10.11949/j.issn.0438-1157.20170085
2017-01-18收到初稿,2017-03-24收到修改稿。
联系人:崔宝臣。
刘淑芝(1966—),女,博士,教授。
黑龙江省自然科学基金项目(B2015011);东北石油大学科研启动基金项目。

