烟草烟碱转化相关蛋白质筛选分析研究*
童春义,蒋斌,金立锋,赵冰,杨粤军
(1.湖南大学 生物学院,植物功能基因组学与发育调控湖南省重点实验室(湖南大学),湖南 长沙 410082;2.中国烟草总公司郑州烟草研究院,河南 郑州 450001; 3.河南中烟工业有限责任公司,河南 郑州 450016;4.湖南师范大学 医学院,湖南 长沙 410081)
烟草烟碱转化相关蛋白质筛选分析研究*
童春义1,蒋斌1,金立锋2,赵冰3†,杨粤军4
(1.湖南大学 生物学院,植物功能基因组学与发育调控湖南省重点实验室(湖南大学),湖南 长沙 410082;2.中国烟草总公司郑州烟草研究院,河南 郑州 450001; 3.河南中烟工业有限责任公司,河南 郑州 450016;4.湖南师范大学 医学院,湖南 长沙 410081)
为了研究烟草中烟碱转化机理,应用比较蛋白组学方法研究了高烟碱烟草中烟碱转化相关蛋白质表达情况.采用双向电泳联用质谱技术比较了实验组高烟碱转化烟草叶片和对照组野生型烟草叶片的蛋白质差异,获得了分辨率和重复性较好的双向电泳图谱.选取了34个差异蛋白质点,采用MALDI-TOF-TOF-MS进行肽质谱指纹图分析,最终有12个蛋白质点得到了可靠鉴定,其中在实验组中相对下调的蛋白有7个,相对上调的蛋白有5个.通过比对蛋白质组库数据,发现这些差异表达的蛋白质主要是参与碳水化合物代谢、能量代谢等功能,而且亚细胞定位主要是在叶绿体和线粒体,表明这些蛋白表达水平与烟碱转化具有密切关系,为研究高烟碱转化率烟叶的形成机理提供了新的依据.
烟草;叶片;烟碱;高转化;差异蛋白质组
烟草为富含生物碱的作物,烟草生物碱主要包括烟碱、降烟碱、新烟草碱和假木贼碱4种主要碱[1].烟草生物碱中,以烟碱为最重要,它约占烟草生物碱总量的95%以上,其次是去甲基烟碱,又称降烟碱.烟草生物碱的组成和含量对烟叶品质和安全性至关重要,适宜的烟碱含量,尽可能低的降烟碱含量等生物碱指标是优质低害烟叶的重要特征[2].烟碱是使烟草具有商品价值的主要因素,烟碱的作用是产生生理强度,使吸食者感觉兴奋[3],但其含量过高损害人体健康.而烟叶中的降烟碱虽然含量不高, 但很容易与烟草中亚硝胺形成烟草特有亚硝胺(Tobacco-specific nitrosamines,TSNA).而TSNA是一种严重致癌物,影响吸烟者健康,同时高含量降烟碱会改变烟叶颜色,从金黄色变成樱红色,影响外观质量,降低烟叶的吸食品质[4].吸烟与健康问题已成为目前国内外关注的热点.研究烟碱去甲基化代谢及调控机理对烟草减害具有重要意义.
烟碱转化一直也是烟草及植物研究者关注的焦点,2005年美国北卡州立大学Siminszky博士利用基因芯片从不同烟碱转化率的白肋烟中筛选到了烟碱去甲基化的关键基因——一种细胞色素P450单加氧酶CYP82E亚家族[5-6],该家族中三个基因具有烟碱去甲基化活性,被称为烟碱去甲基化酶,通过RNAi抑制高烟碱转化株中三个基因的转录可以使烟碱转化率从98%降低到0.8%,比普通栽培种中烟碱转化率还要低3.6倍[7],从而获得降烟碱含量较低的高品质烟叶株系.然而,烟碱去甲基化酶基因的表达调控机制尚不明确,同时烟碱去甲基化酶的互作蛋白也未见报道.差异蛋白组学通过对烟碱高表达和野生型烟叶蛋白的差异表达进行研究,有助于挖掘烟碱去甲基化过程重要蛋白,可为筛选烟碱去甲基化酶基因互作蛋白以及研究其表达调控机制提供重要数据和前期基础.为此本文以前期获得的烟碱高表达的突变株和烟碱正常表达的野生型为实验材料,通过蛋白质双向电泳技术分离鉴定差异表达蛋白,以期找到烟碱转化相关重要蛋白,为进一步探讨烟碱转化机理提供理论依据.
1 材料与方法
1.1 仪器与试剂
EttanTM双向电泳系统(美国Amersham Biosciences公司);UV-1600型紫外分光光度计(北京瑞利分析仪器公司);LGJ-10冷冻干燥机(北京四环科学仪器厂);Voyager DE-STR 飞行时间质谱仪(美国Applied Biosystems 公司).固相pH梯度干胶条(pH = 4~7,线性梯度,24 cm),载体两性电解质(pH = 4~7),固相pH梯度等电聚焦电泳(IPG)缓冲液(pH = 4~7),矿物油,尿素,3-(3-(胆酰胺基丙基)二甲氨基)丙磺酸盐(CHAPS)和二硫苏糖醇(DTT)等均购自美国Amersham Biosciences公司;丙烯酰胺、硫脲、过硫酸铵、四甲基乙二胺(TEMED)、牛血清白蛋白(BSA)、苯甲基磺酰氟(PMSF)、碘乙酰胺、甘氨酸、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、乙腈、TPCK-胰蛋白酶、铁氰化钾、硫代硫酸钠、三氟乙酸和基质α-氰基-4-羟基肉桂酸(CCA)均为Sigma公司产品;Taq酶为MBI公司产品;植物RNA提取试剂盒为安比奥生物技术公司产品;其它试剂均为国产分析纯试剂,所有试剂均用超纯水配制.高烟碱转化烟草材料(hnc1)为中烟公司郑州烟草研究院基因研究中心在海南陵水以野生型白肋烟品种B37中筛选获得和保存.
1.2 样品制备及烟碱测定
烟草材料栽培在郑州烟草研究院温室,盛花期打顶,7 d后,取11~13片成熟叶片快速放入干冰或液氮中冷冻,之后转移至-80 ℃冰箱保存备用.
取部分冻干叶片,液氮下研磨成粉,测定时取粉末适量,应用液相色谱/质谱联用仪(LC/MS)测定烟碱、去烟碱含量,并计算烟碱转化率.
1.3 双向凝胶电泳
将-80 ℃冰箱中保存的烟草叶片在液氮中研磨成粉末,然后将粉末悬浮在含有10%三氯乙酸(TCA)和0.3% DTT的预冷丙酮溶液中,在-20 ℃冰箱沉淀过夜.然后在4 ℃,16 000 r/min离心1 h.弃上清,重悬沉淀于0.3% DTT的预冷丙酮溶液中,4 ℃,16 000 r/min离心30 min,弃上清,重复一次,最终得到的沉淀在冷冻干燥后置-80 ℃下保存备用.
烟草叶片蛋白500 μg先溶于裂解液(7 mol/L 尿素,2 mol/L硫脲,4% CHAPS,40 mM Tris和2 mM PMSF)中,振荡混匀,30 min后加入2倍量的样品溶解液(8 mol/L尿素,4% CHAPS,2% pharmalyte 3-10,1% DTT)混匀,充分溶解,12 000 r/min离心10 min,取上清液加入水化液(6 mol/L 尿素,2 mol/L硫尿,2% CHAPS,3 mg/mL DTT,0.5% IPG缓冲液pH 3~10,痕量溴酚蓝)充分混合至总体积为450 μL,12 000 r/min离心10 min,取上清液加入第一向胶条槽.第一向等电聚焦电泳参考Gorg等[8]的方法和IPGphorTM等电聚焦系统操作指南进行.第二向垂直SDS-PAGE电泳参考文献[9]的方法进行.使用质量分数为10%的分离胶.
1.4 考染和图像分析
参考Amersham Biosciences公司关于双向电泳的实验技术指南的硝酸银方法进行染色.染色后的凝胶用图像扫描仪透射扫描成像,所得图谱用PDQuest软件进行图像分析,比较蛋白质点差异.
1.5 肽质谱指纹图分析和数据库检索
参照文献[10]的方法对蛋白质点胶内酶切,提取多肽混合物进行MALDI-TOF-MS质谱分析.采用反射模式,正离子测定,离子源加速电压20 kV,激光波长337 nm,脉冲宽度3 ns,离子延迟提取100 ns,真空度5.3×10-5Pa,质谱信号单次扫描累加100次.获得的混合物肽片段数据通过Mascot(http://www.matrixscience.com)网站进行检索.数据库为NCBI;物种为拟南芥;胰酶酶切;允许不完全裂解位点数为1;固定修饰为碘乙酰胺化;可变修饰为甲硫氨酸氧化;质量容差为0.2.
2 结果与讨论
2.1 烟草材料烟碱转化情况分析
采用生物碱和非靶向全组分代谢物检测方法测定了实验组和对照组成熟叶片烟碱含量和去降烟碱含量,如图1所示.由图1可知,相对于对照组野生型烟草B37,突变体烟碱含量减低25%,而降烟碱含量升高16.2倍,烟碱转化率从3.45%提高到43.55%,烟碱转化率得到显著提高.说明选取的实验组为典型高烟碱转化植株,适用于高烟碱转化研究.


图1 实验组突变体hnc1与对照组野生 型B37烟碱、降烟碱含量(A)及烟碱转化 率(B)比较Fig.1 Comparison of the content of nicotine and nornicotine and the percent conversion of nicotine between mutant hnc1 and wild type B37
2.2 烟草蛋白的双向电泳图谱分析
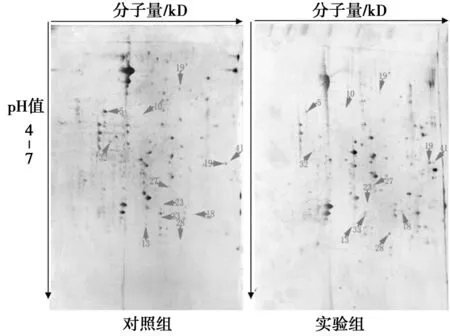
图2 烟叶蛋白双向电泳结果Fig.2 The result of 2D electrophoresis
通过双向电泳技术对实验组和对照组烟草蛋白进行分离,并通过扫描成像,用PDQuest软件进行图像分析,结果如图2.分析发现,突变株烟叶蛋白与野生型比较,共找到56个蛋白质点表达有差异,其中表达上调22个,表达下调34个.差异点分子量集中在25~55 kD,等电点集中在pH 4.5~6.5之间.选取其中34个分布较集中,且丰度较大的蛋白质进行进一步的酶解和质谱鉴定.
2.3 差异蛋白质点的鉴定分析
根据差异蛋白的表达量和质量,选取了34个蛋白质点进行肽质谱指纹图分析及数据库检索,最终有12个蛋白质点得到了可靠的鉴定(见表1).部分蛋白质点由于在MALDI-TOF-TOF分析中肽质谱指纹图分辨率比较低,灵敏度不够,或者因为匹配率和覆盖率太低未能得到鉴定,还需要通过其它分析方法进行逐一证实[11].图2中箭头标出的为得到鉴定的差异蛋白质点,表1为鉴定得到的差异蛋白质情况.从结果可知,差异表达的蛋白质主要是参与碳水化合物代谢、能量代谢等功能,而且亚细胞定位主要是在叶绿体和线粒体.而叶绿体和线粒体也正是生物碱物质合成代谢的场所.

表1 鉴定得到的差异蛋白质性质及其功能分析Table 1 Properties and functions of identified differential expression protein
注:a↑ 上调upregulated in mutant;↓ 下调downregulated in mutant
2.4 讨论
烟碱是烟草体内重要的次生代谢物质,其合成、积累以及转化过程受到一个非常复杂的网络调控,影响因素的不定性使调控措施很不稳定.本文鉴定得到的蛋白质主要是参与碳水化合物代谢、能量代谢等功能的蛋白.烟碱向降烟碱转化的过程是一个复杂的生物化学反应的过程[12].早期多数有关烟碱去甲基化的研究是在具有烟碱转化能力的野生烟草上进行的.早在20世纪40年代,研究者Dawson等[13]就发现耳状烟草和粘毛烟草中降烟碱的主要来源是烟碱去甲基化.烟碱转化的主要部位为叶片,降烟碱含量的增加与烟碱含量的降低相伴随.烟碱去甲基化酶在离体和活体内的部分定性已有所报道[14].细胞破碎后,烟碱去甲基酶活性与微体组分和内质网等相联系.去甲基活动依赖于还原态核苷的出现.去甲基的速率在由NADPH 作电子供体时比采用NADH 做供体高15 倍.鉴定成功的苹果酸酶(malic enzyme,ME)是调控苹果酸代谢的关键酶,可以催化苹果酸氧化脱羧的可逆反应,产生丙酮酸和CO2,以及伴随NAD(P)+的还原反应.根据辅酶特异性,苹果酸酶可分为NAD+或NADP+依赖性苹果酸酶,并广泛存在于自然界中.苹果酸酶广泛地参与不同的代谢途径,包括C4植物中的固碳作用、真菌和动物中脂质合成的NADPH源泉、以及组织快速繁殖时线粒体能量的供给等.能催化苹果酸与草酰乙酸之间的可逆转换[15].得到鉴定的蛋白中5号,19’号等为NAD+或NADP+依赖性苹果酸酶,在突变体中表达下调,表明突变体中烟碱去甲基酶活性较野生型高,烟碱转化率相应增加,降烟碱增加.

其他已鉴定蛋白(10号,18号,23号和28号)为亚细胞结构结合蛋白,虽然未能找到与烟碱转化直接的关系,但叶绿体和线粒体为植物生物碱合成和应用场所,其表达的差异也间接参与了烟碱的调控.
3 结 论
本文通过采用双向电泳技术对烟碱高转化烟草叶片蛋白和野生型进行分离鉴定分析,鉴定得到12个差异表达蛋白,这些蛋白主要参与碳水化合物代谢、能量代谢等,且影响和调节了烟碱转化,是烟碱转化过程中重要的蛋白酶,其表达上调或者下调直接影响着烟碱转化程度,对这些蛋白表达程度的鉴定比较,为探讨烟碱转化机理提供了直接的蛋白数据.然而,要通过解析得到的这些差异去完全解读烟碱转化机理还存在较大困难,同时要完全弄清烟碱转化机理过程中蛋白质变化情况也存在难题,尤其是目前基因组和蛋白组数据库中与烟草相关的序列信息和功能注释还不完备,质谱鉴定出来的蛋白还有待于进一步的验证,因此要深入研究烟草烟碱转化机理及解析的蛋白质表达情况来联系烟碱转化率的具体作用还需要进一步研究.
[1] 史宏志,张建勋.烟草生物碱[M].北京:中国农业出版社,2004.
SHI Hongzhi,ZHANG Jianxun.Tobacco alkaloids[M].Beijing:China Agriculture Press,2004.(In Chinese)
[2] 李超,史宏志,刘国顺.烟草烟碱转化及生物碱优化研究进展[J].河南农业科学,2007,36(6):14-17.
LI Chao,SHI Hongzhi,LIU Guoshun.Review on the conversion of nicotine to nornicotine and optimization of alkaloid composition in tobacco[J].Journal of Henan Agricultural Sciences,2007,36(6):14-17.(In Chinese)
[3] 王瑞新,韩富根.烟草化学品质分析[M].郑州:河南科学技术出版社,1992:77.
WANG Ruixin,HAN Fugen.Tobacco chemistry quality analysis[M].Zhengzhou:Henan Science and Technology Press,1992:77.(In Chinese)
[4] JEFFREY R N,TSO T C.Qualitative differences in the alkaloid fraction of cured tabacco[J].J Agr Food Chem,1995,3(8):680-682.
[5] SIMINSZKY B,GAVILANO L B,BOWEN S W,etal.Conversion of nicotine to nornicotine in Nicotiana tabacum is mediated by CYP82E4,a cytochrome P450 monooxygenase[J].Proc Natl Acad Sci U S A,2005,102(41):14919-14924.
[6] GAVILANO L B,COLEMAN N P,BURNLEY L E,etal.Genetic engineering of Nicotiana tabacum for reduced nornicotine content[J].J Agr Food Chem,2006,54(24):9071-9078.
[7] CHAKRABARTI M,BOWEN S W,COLEMAN N P,etal.CYP82E4-mediated nicotine to nornicotine conversion in tobacco is regulated by a senescence-specific signaling pathway[J].Plant Mol Boil,2008,66(4):415-427.
[8] GORG A,OBERMAIER C,BOGUTH G,etal.Recent developments in two-dimensional gel electrophoresis with immobilized pH gradients:wide pH gradients up to pH 12,longer separation distances and simplified procedures[J]. Electrophoresis,1999,20(4/5):712-717.
[9] 谢锦云,李小兰,陈平,等.温敏核不育水稻花药蛋白质组初步分析[J].中国生物化学与分子生物学报,2003,19 (2):215-221.
XIE Jingyun,LI Xiaolan,CHEN Ping,etal.Preliminary proteomic analysis of the proteins of thermo-sensitive genetic sterile rice anther[J].Chinese Journal of Biochemistry and Molecular Biology,2003,19(2):215-221.(In Chinese)
[10]MEADUS W J.A semi-quantitative RT-PCR method to measure the in vivo effect of dietary conjugated linoleic acid on porcine muscle PPAR gene expression[J].Biological Procedures Online,2003,5(1):20-28
[11]陈冬冬.初探烟草根尖组织特异蛋白质对烟碱生物合成的影响[D].开封:河南农业大学,2009:18-19.
CHEN Dongdong.Preliminary studies on differentially expressed proteins related to nicotine biosynthesis in fluecured tobacco roots[D].Kaifeng:Henan Agricultural University,2009:18-19.(In Chinese)
[12]史宏志.烟草烟碱去甲基化研究进展[J].作物研究,2006,20(3):276-280.
SHI Hongzhi.Study on nicotine to nornicotine conversion in tobacco[J].Crop Research,2006,20(3):276-280.(In Chinese)
[13]DWASON R F.On the biosynthesis of nornicotine and anabasine[J].J Am Chem Soc,2002,67:503-504.
[14]CHELVARAJAN R L,FANNIN F F,BUSH L P.Study of nicotine demethylation in Nicotiana otophora[J].J Agric Food Chem,1993,41(6):858-862.
[15]郑恩霞,程文娟,王宗达,等.苹果酸酶的分子生物学研究进展[J].安徽农学通报,2009,15(10):51-52.
ZHENG Enxia,CHENG Wenjuan,WANG Zongda,etal.Advances in research of molecular biology of malic enzyme[J].Anhui Agricultural Science Bulletin,2009,15(10):51-52.(In Chinese)
[16]BOWLER C,VAN MONTAGUE M,INZE D.Superoxide dismutase and stress tolerance[J] .Annual Review of Plant Biology,1992,43(1):83-116.
[17]宋林霞,徐振彪.磷酸甘油酸变位酶[J].生命的化学,2011,31(1):86-89.
SONG Linxia,XU Zhenbiao.Phosphoglyceratemutase[J].Chemistry of Life,2011,31(1):86-89.(In Chinese)
Screening Analysis of Tobacco-nicotine Conversion Related Proteins
TONG Chunyi1,JIANG Bin1,JIN Lifeng2,ZHAO Bing3†,YANG Yuejun4
(1.College of Biology,Hunan University,Changsha 410082,China; 2.Zhengzhou Tobacco Research Institute of CNTC,Zhengzhou 450001,China; 3.Henan Zhongyan Industrial Co.,LTD,Zhengzhou 450016,China; 4.College of Medicine,Hunan Normal University,Changsha 410081,China)
To study the mechanism of tobacco-nicotine conversion,the expression of nicotine conversion related proteins of high tobacco-nicotine conversion was explored by differential proteomics. Two-dimensional electrophoresis combining MS spectrometry were used to compare the expression of the proteins between high nicotine conversion tobacco (experimental group) and wild type tobacco (control group). After obtaining the distinguishable and repeatable 2-D pictures,there were 34 different proteins spots between the two tobacco plant leaves.12 different protein spots were then identified by the Matrix Assisted Laser Desorption/ Ionization-time of Flight Mass Spectrometry-Mass Spectrometry (MALDI-TOF-TOF-MS),including 7 protein spots down-regulated in white flower leaves (experimental group),and 5 protein spots up-regulated. In addition to comparison analyses with proteomic database,these proteins are involved in carbohydrate,energy metabolism and so on. Most of them are chloroplasts or mitochondria proteins. In a whole,these differential expression proteins were closely related with tobacco nicotine conversion,which can provide another pathway for finding the mechanism of tobacco nicotine conversion.
tobacco;leaves;nornicotine;high conversion;differential proteomics
1674-2974(2017)06-0119-06
10.16339/j.cnki.hdxbzkb.2017.06.020
2015-10-20
国家自然科学基金资助项目(31201074),National Natural Science Foundation of China(31201074)
童春义(1981-),男,江西余江人,湖南大学副教授,博士 †通讯作者,E-mail:zhzhjl@163.com
TQ937
A

