凝沉型及交联型淀粉微球的水包水乳液法制备及理化特性比较研究
冼学权,黎演明,杨 辉,潘丽霞,李秉正
(广西科学院 非粮生物质酶解国家重点实验室;国家非粮生物质能源工程技术研究中心;广西生物质炼制重点实验室,广西 南宁 530007)
凝沉型及交联型淀粉微球的水包水乳液法制备及理化特性比较研究
冼学权,黎演明,杨 辉,潘丽霞,李秉正*
(广西科学院 非粮生物质酶解国家重点实验室;国家非粮生物质能源工程技术研究中心;广西生物质炼制重点实验室,广西 南宁 530007)
以酸变性木薯淀粉为原料,采用水包水乳液法在不同温育温度下制备了凝沉型和交联型淀粉微球,并对微球的产率和理化特性进行比较研究。随着温育温度的提高,凝沉型淀粉微球的产率降低,但交联型淀粉微球的产率提高。温育温度为6℃时,凝沉型淀粉微球产率最高,达到79.8%。交联型淀粉微球的溶胀率和亚甲基蓝吸附量明显大于凝沉型淀粉微球。扫描电镜照片显示,凝沉型和交联型淀粉微球基本均为球形,但凝沉型淀粉微球表面较粗糙且有多个小凹坑,而交联型淀粉微球表面较致密。X射线衍射图谱显示凝沉型淀粉微球为部分结晶结构,而交联型淀粉微球为无定形结构。热重分析结果表明,凝沉型淀粉微球的热稳定性明显高于交联型淀粉微球。
淀粉微球;水包水乳液;凝沉;交联;理化特性
0 引言
淀粉微球是一种以淀粉或淀粉衍生物为原料制备的、粒径为微米级的球形或类球形淀粉基材料。淀粉微球最先应用于医药领域,原因是淀粉不仅来源广、可再生而且价格较低廉,同时具备无毒、无免疫原性、生物相容性良好、能在人体内被淀粉酶完全降解等优点,能够满足医学领域的各项需求,可用作药物载体[1]、止血材料[2]和栓塞剂[3]等。研究人员还对淀粉微球应用于食品[4]、水处理以及精细化工等其他领域进行了许多有益的尝试,结果显示了其良好的应用前景。
迄今为止,国内外学者已经对淀粉微球开展了大量研究。在制备方法方面,传统的油包水(W/O)乳液法[5]简单易行,可靠性高,应用最广泛。Elfstrand等[6-7]最早将水包水(W/W)乳液法应用于淀粉微球制备,并首次利用淀粉分子的凝沉(又称老化或回生)特性作为固化方式。W/W乳液法利用两种高分子水溶液在一定条件下相互混合时发生相分离这一特性,采用无毒的水溶性高分子溶液代替W/O乳液中的油相作为连续相,不仅能避免在成球和(或)洗涤过程中由于淀粉微球与有机溶剂接触而影响其所载物质的活性,还能避免有机溶剂残留过高的潜在风险,因此在医药和功能食品等对安全性要求较高的领域具有广阔的应用前景。Li等[8-9]和Puncha-arnon等[10]采用 W/W 乳液法和交联固化方式分别成功制备了淀粉微球,并对有关W/W乳液组成和制备条件对制备效果的影响进行了研究。然而与W/O乳液法相比,W/W乳液法制备淀粉微球的报道仍然较少。
采用W/W乳液法制备淀粉微球时,可利用淀粉的凝沉特性,使淀粉分子通过氢键作用再度结合,达到淀粉溶液液滴固化成球的目的,所制备的微球可称为凝沉型淀粉微球(Recrystallized starch microspheres,RSMs);也可以利用水溶性交联剂将淀粉分子交联在一起,实现淀粉溶液液滴的固化,所得到的微球可称为交联型淀粉微球(Crosslinked starch microspheres,CSMs)。可以预见,由于固化方式不同,凝沉型和交联型淀粉微球的成球机理和理化特性必然存在差异,适用范围也应有所不同。对上述两种淀粉微球进行比较研究,不仅有利于进一步理解W/W乳液法制备淀粉微球时不同固化方式的特点,还有利于更全面地了解两种微球的理化特性,为更有针对性地开展应用研究提供依据。到目前为止,未见对RSMs和CSMs进行系统性比较研究的报道。
作者以酸变性木薯淀粉(Acid-modified Cassava Starch,ACS)为原料,采用W/W乳液法在不同温育温度下制备RSMs和CSMs。对所制备淀粉微球的产率、溶胀率和亚甲基蓝(MB)吸附量进行测定,并利用扫描电镜(SEM)、X射线衍射仪(XRD)和热重分析仪(TG)等对微球进行表征。在此基础上,研究比较两种淀粉微球的制备过程特点及理化特性,进而提出它们潜在的应用领域建议。
1 材料与方法
1.1 材料
酸变性木薯淀粉(食品级,Mw=203.6 ku):广西农垦明阳生化集团有限公司;聚乙二醇20 000(化学纯):汕头市西陇化工厂有限公司;三偏磷酸钠(TSTP,分析纯):阿法埃莎(天津)化学有限公司;无水乙醇(分析纯):成都市科龙化工试剂厂;氢氧化钠(分析纯):国药集团化学试剂有限公司;MB(分析纯):广东光华科技股份有限公司。
1.2 仪器与设备
HH-4恒温水浴锅:江苏金坛市宏华仪器厂;GT10-1离心机:北京时代北利离心机有限公司;Ultima IV X射线衍射仪:日本Rigaku公司;S-3400N扫描电镜:日本Hitachi公司;iS10红外光谱仪:美国Thermo Scientific公司;Q50热重分析仪:美国TA公司。
1.3 方法
1.3.1 木薯淀粉微球的制备
1.3.1.1 RSMs的制备
(a)乳化:将淀粉乳(m(ACS)∶m(H2O)=12∶50)在沸水浴中糊化15 min形成透明的淀粉糊。待温度降至55℃后,取15 mL淀粉糊缓慢倒入含有60 mL聚乙二醇20000溶液(质量分数为37.5%)的烧杯中,然后搅拌5 min以形成W/W乳液。其中,淀粉糊为乳液的分散相。乳化过程中,搅拌转速和乳化温度分别为500 r/min和55℃。(b)温育:将烧杯转移至水浴装置中静置温育3 h(以待分散相利用凝沉作用固化成球),温度分别为6、25、37℃。(c)分离:将乳液倒入离心管并离心15 min(6 000 r/min),下层产物即为淀粉微球。(d)洗涤:分别用去离子水和无水乙醇洗涤微球各3次,每次洗涤后离心除去上清液。(e)干燥:将洗涤后的微球真空干燥(60℃,12 h),最后保存在干燥器中备用。
1.3.1.2 CSMs的制备
(a)乳化:将15 mL含有NaOH和交联剂TSTP的淀粉溶液(m(ACS)∶m(H2O)∶m(NaOH)∶m(TSTP)=12∶50∶1∶3,pH>14)缓慢倒入含有 60 mL 聚乙二醇20000溶液(质量分数为37.5%)的烧杯中,然后搅拌5 min形成W/W乳液。其中,淀粉溶液为乳液的分散相。乳化过程中,搅拌转速和乳化温度分别为500 r/min和30℃。(b)温育:将烧杯转移至水浴装置中静置温育3 h(以待分散相利用交联作用固化成球),温度分别为25℃和37℃;(c)分离、洗涤和干燥:同“RSMs的制备”。
1.3.2 产率的计算
分别按照公式(1)和公式(2)计算 RSMs和CSMs的产率。

式中:YRSMs为 RSMs的产率,%;MRSMs为制得 RSMs的质量,g;MACS为加入 ACS 的质量,g;YCSMs为CSMs的产率,%;MCSMs为制得 CSMs的质量,g;MTSTP为加入TSTP的质量,g。
1.3.3 溶胀率的测定
参照文献[11]中的方法测定淀粉微球的溶胀率。在离心管中称取约60 mg微球样品,然后加入1 mL生理盐水(质量分数为0.9%的NaCl溶液)充分混匀后于室温(25℃)静置。待微球充分溶胀后,离心弃去上清液并小心地吸去微球表面的液体,称量得到微球湿质量。将微球在105℃干燥6 h,称量得到微球干质量。根据公式(3)计算淀粉微球的溶胀率。每个样品的溶胀率测定2次,并取平均值。

式中:Q为微球的溶胀率,%;Ws为微球湿质量,mg;Wd为微球干质量,mg。
1.3.4 MB吸附量的测定
参照文献[12]的方法测定淀粉微球的MB吸附量。将200 mg微球放入含有MB溶液(0.5 mg/mL,100 mL)的三角烧瓶中,摇匀后在室温避光保存2 h。测定吸附前后MB溶液的浓度变化,并根据公式(4)计算淀粉微球的MB吸附量。每个样品的MB吸附量测定2次,并取平均值。

式中:L为MB的吸附量,mg/g;C0为MB溶液的初始质量浓度,mg/mL;C1为吸附后MB溶液的质量浓度,mg/mL;V为MB溶液的体积,mL;M为微球质量,g。
1.3.5 扫描电镜分析
采用Hitachi公司的 SEM(S-4300N)观察样品的表面形貌。对样品喷金处理后观察并拍照,加速电压为10 kV。
1.3.6 X射线衍射分析
采用Rigaku公司的XRD(Ultima IV)测定样品的晶体结构。管压40 kV,管流30mA,扫描速度5°/min,在 5~45°(2θ)范围内进行叠扫。
1.3.7 热重分析
采用TA公司的TG(Q50)测定样品的热分解特性。样品质量 8~10 mg,升温速率 15℃/min,氮气流速30 mL/min,加热范围30~800℃。
2 结果与分析
2.1 产率、溶胀率和MB吸附量
表1为不同固化方法和温育温度下制备的淀粉微球的产率、溶胀率和MB吸附量。从表1可以看出,温育温度对两种微球的产率、溶胀率和MB吸附量均有明显的影响,但由于二者的固化方式不同,因此影响规律有所不同。
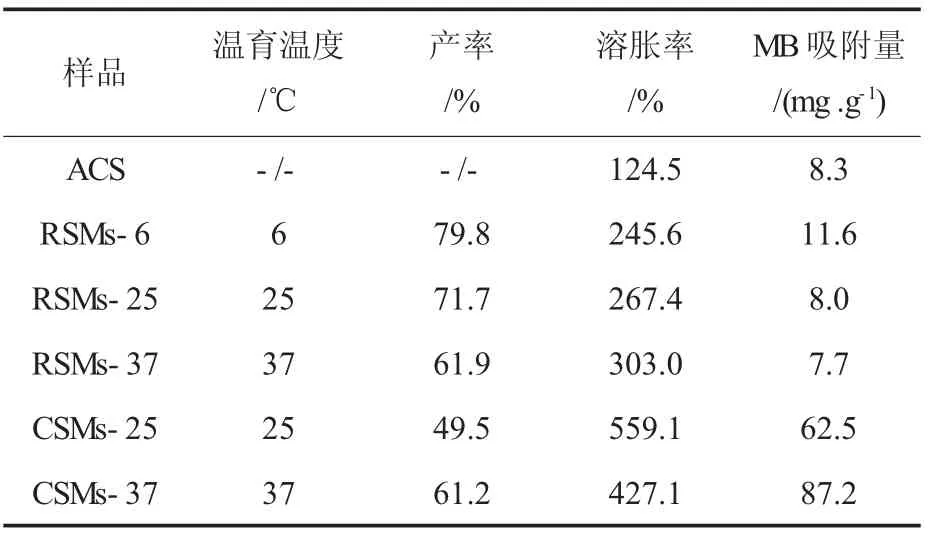
表1 淀粉微球的产率、溶胀率和MB吸附量Table 1 Yield,swelling degree and MB adsorption of starch microspheres
RSMs是淀粉先经过高温糊化,再经过凝沉过程固化形成。对RSMs而言,当温育温度为6℃时产率最大,达到79.8%。随着温育温度升高,其产率降低,溶胀率升高,MB吸附量差别不大。原因是RSMs主要通过淀粉分子凝沉而固化成球,而温度是影响凝沉的重要因素之一。较低的温育温度有助于加快淀粉分子的凝沉速率[13],从而有利于提高成球速率和微球结构的紧致程度。成球速率越高,说明相同时间内越多淀粉分子结合到微球上,因此产率也较高。结构越紧致,说明微球抵抗溶胀的能力越强。
CSMs是淀粉经过NaOH碱解后,再由交联剂交联固化而成。对于CSMs而言,温育温度为37℃时产率较高,溶胀率较低,MB吸附量最高,为87.2 mg/g。原因是在较高的温育温度下交联反应速率较高,因此成球速率和微球的交联程度也较高。一方面,淀粉分子相互间作用力较强,导致溶胀率较低;另一方面,带负电荷的交联键-磷酸二酯键相对较多,使得对阳离子模型药物MB吸附量增大。结果与文献[10]报道的规律一致。
将不同固化方法制备淀粉微球的产率、溶胀率和MB吸附量进行比较,发现CSMs的产率低于RSMs,但溶胀率较大。原因可能是制备CSMs时使用的交联剂TSTP过量,大部分未参与到交联反应中,洗涤时直接被除去,导致产率较低。同时,与RSMs中的氢键数量相比,CSMs中交联键数量较少,造成其结构的紧致程度不如RSMs,因而溶胀率较高。另外,CSMs的MB吸附量远大于RSMs。原因是CSMs主要通过带负电荷的磷酸酯键吸附带正电荷的MB,因此吸附量远远大于主要通过范德华力吸附MB的RSMs。
RSMs和CSMs在溶胀率和MB吸附量上的差异,提示它们的适用领域有所不同。RSMs可用于包埋分子质量较大的药物(如蛋白药物等)和食品活性成分(如益生菌等),其较小的溶胀率有利于实现所包埋物质的控制释放。CSMs具有较强的吸水溶胀能力,可起到覆盖伤口和富集凝血因子的作用,具有用作止血剂的潜力。另外,对阳离子型药物较强的吸附能力使其还有望用作该类药物的载体。
2.2 表面形貌分析
图1分别为ACS、RSMs和CSMs的SEM照片。从图1可以看出,ACS颗粒的形状主要为卵形和卵形截切型,且表面光滑(图1a)。与原木薯淀粉[14]相比,ACS的表面形貌并没有明显变化,说明变性处理未改变其形貌。RSMs和CSMs的形状相似,基本均为球形,原因是分散的淀粉分子在球状液滴内重新结合,因此液滴的形状很大程度上决定了微球的形状。
虽然两种淀粉微球的形状基本相同,但RSMs的表面相对粗糙,且分布有大量小凹坑(图1d);而CSMs的表面致密且较平滑,未观察到明显的小凹坑(图1f)。RSMs和 CSMs表面形貌上的差异可能由不同的固化方式造成,需要进一步研究方可确定。

图1 ACS(a:1000×,b:4000×)、RSMs(c:1000×,d:4000×)和 CSMs(e:1000×,f:4000×)的 SEM 照片Fig.1 SEM images of ACS(a:1000×,b:4000×),RSMs(c:1000×,d:4000×)and CSMs(e:1000×,f:4000×)
2.3 晶体结构分析
由图2 可以看出,ACS 在 15.1°、17.2°、18.2°和23.0°有强烈的结晶衍射峰,与黄祖强等[15]报道的原木薯淀粉谱图一致,属于A型结晶结构。RSMs的XRD图谱仅在17.2°位置观察到强烈的结晶衍射峰,而属于木薯淀粉的其他3个特征峰的强度均大幅减弱,难以观察到。原因是在温育过程中淀粉分子重新排列,形成的有序结构比木薯淀粉大幅减少。RSMs的相对结晶度低于ACS,与溶胀率测试结果一致,均说明RSMs的结构紧致程度低于ACS。李雨露等[16]也报道过相似的结果,即老化莲子淀粉的XRD图谱只在17°出现较明显的衍射峰,与天然的莲子淀粉相比差异明显。
与RSMs明显不同,CSMs的图谱呈现属于无定形物质的“馒头峰”,观测不到明显的结晶衍射峰。此结果与文献[9]报道的马铃薯淀粉微球的XRD图谱一致。这是因为采用交联作为固化方式时,淀粉分子之间主要通过交联反应形成的磷酸酯键结合,而且淀粉溶液中的NaOH也起着阻止淀粉分子有序排列形成晶体的作用。
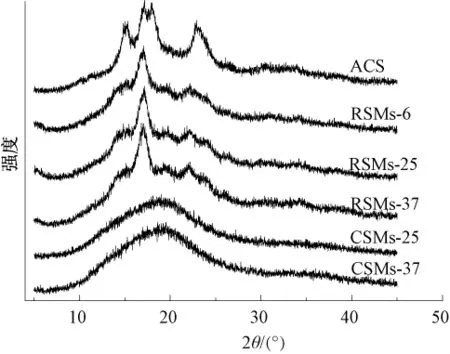
图2 ACS、RSMs和 CSMs的 XRD图谱Fig.2 XRD patterns of ACS,RSMs and CSMs
从图2还可以看出,同种类型淀粉微球之间的XRD图谱差别很小,说明温育温度对这两种类型微球晶体结构的影响十分有限。
2.4 热稳定性分析
由图3可以看出,各样品的TG曲线在140℃附近均进入第1个平台期,此前的失重可认为是样品中自由水和结合水的蒸发。TG曲线的第2个失重阶段为样品的热分解阶段。ACS的热分解温度为284.5℃,与谢新玲等[17]报道的原木薯淀粉热分解温度(290℃)较接近,说明酸变性处理并未对木薯淀粉的热稳定性产生明显影响。RSMs的热分解温度在287~289℃范围内,最大分解速率温度在305~308℃范围内,与ACS差别很小。这是因为RSMs同样为部分结晶结构,淀粉分子通过有序排列形成大量氢键,具有较强的分子间作用力,虽然结晶度小于ACS,但热稳定性基本相同。不同的是,CSMs的热分解温度在250℃左右,最大分解速率温度在280℃左右,均明显低于ACS和RSMs。原因可能是CSMs中虽然存在键能较强的交联键,但由于数量较少,因此整体上看淀粉分子间作用较弱,造成热稳定性较差。这一结果与溶胀率测定结果相符,均表明CSMs结构的紧致程度比RSMs低。
与固化方法相比,温育温度对淀粉微球的热稳定性影响较小。不同温育温度制备的RSMs热分解温度变化仅为1℃左右,而CSMs热分解温度的差别略大,但也仅为6.6℃。

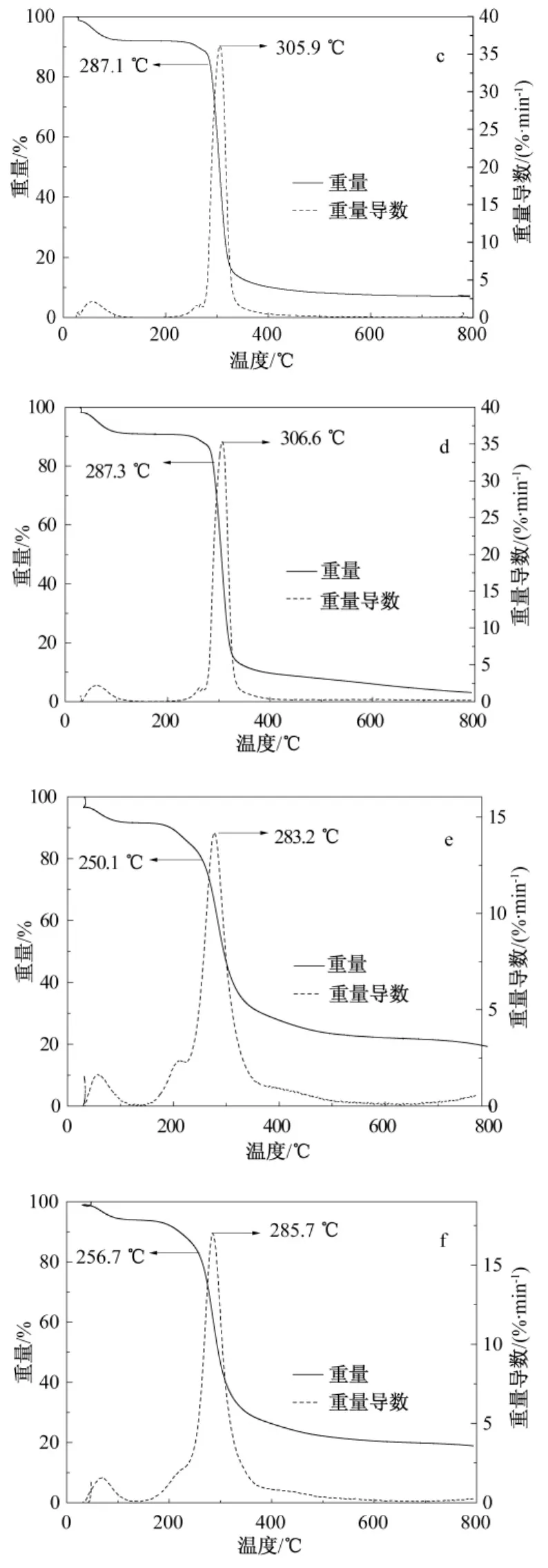
图3 ACS(a)、RSMs-6(b)、RSMs-25(c)、RSMs-37(d)和 CSMs-25(e)、CSMs-37(f)的 TG 曲线Fig.3 TG curves of ACS(a),RSMs-6(b),RSMs-25(c),RSMs-37(d),CSMs-25(e)and CSMs-37(f)
3 结论
(1)采用不同固化方式制备淀粉微球时,温育温度的影响呈现不同的规律。以凝沉作为固化方式时,随着温育温度升高,淀粉微球的产率降低,溶胀率提高,MB吸附量仅在7.7~11.6 mg/g范围内小幅波动;采用交联作为固化方式时,随着温育温度提高,淀粉微球产率提高,溶胀率降低,MB吸附量从62.5 mg/g提高到87.2 mg/g。
(2)凝沉和交联两种固化方式制备的淀粉微球均为球形,但RSMs表面较粗糙,而CSMs表面致密。晶体结构方面,RSMs为部分结晶结构,但结晶程度小于ACS,而CSMs为无定形结构。从热稳定性看,RSMs明显高于CSMs。
[1] MALAFAYA P B,STAPPERS F,REIS R L.Starch-based microspheres produced by emulsion crosslinking with a potential media dependent responsive behavior to be used as drug delivery carriers[J].Journal of Materials Science:Materials in Medicine,2006,17(4):371-377.
[2] BJÖRSES K,FAXÄLV L,MONTAN C,et al.In vitro and in vivo evaluation of chemically modified degradable starch microspheresfor topicalhaemostasis[J].Acta Biomaterialia,2011,7(7):2558-2565.
[3] IEZZI R,POMPILI M,NESTOLA M,et al.Transarterialchemoembolization with degradable starch microspheres (DSM-TACE):an alternative option for advanced HCC patients Preliminary results[J].European Review for Medical and Pharmacological Sciences,2016,20(13):2872-2877.
[4] 钱斯日古楞,王红英.磁性淀粉微球固定化脂肪酶的研究[J].食品科学,2004,25(4):47-50.
[5] HAMDI G,PONCHEL G,DUCHÊNE D.Formulation of epichlorohydrin cross-linked starch microspheres[J].Journal of Microencapsulation,2001,18:373-383.
[6] ELFSTRAND L,ELIASSON A C,JÖNSSON M,et al.From starch to starch microspheres:Factors controlling the microspheres quality[J].Starch/Stärke,2006,58(8):381-390.
[7] ELFSTRAND L,ELIASSON A C,WAHLGREN M.The effect of starch material,encapsulated protein and production conditions on the protein release from starch microspheres[J].JournalofPharmaceuticalSciences, 2009, 98(10):3802-3815.
[8] LI B Z,WANG L J,LI D,et al.Fabrication of starch-based microparticles by an emulsification-crosslinking method[J].Journal of Food Engineering,2009,92(3):250-254.
[9] LI B Z,WANG L J,LI D,et al.Preparation and characterization of crosslinked starch microspheres using a two-stage water-in-water emulsion method [J].Carbohydrate Polymers,2012,88(3):912-916.
[10] PUNCHA-ARNON S, JIRANUNTAKULW,UTTAPAP D.Effects of crosslinking temperature and time on microstructure and stability of cassava starch microspheres[J].Carbohydrate Polymers,2015,134:344-352.
[11] LIN W C,YU D G,YANG M C.pH-sensitive polyelectrolyte complex gel microspheres composed of chitosan/sodium tripolyphosphate/dextran sulfate:swelling kinetics and drug delivery properties[J].Colloids and Surfaces B:Biointerfaces,2005,44(2):143-151.
[12] LI B Z,WANG L J,LI D,et al.Physical properties and loading capacity of starch-based microparticles crosslinked with trisodium trimetaphosphate[J].Journal of Food Engineering,2009,92(3):255-260.
[13] RIBOTTA P D,LEÓN A E,AÑÓN M A C.Effect of freezing and frozen storage on the gelatinization and retrogradation of amylopectin in dough baked in a differentialscanning calorimeter[J].Food Research International,2003,36(4):357-363.
[14] REN G Y,DONG L,WANG L J,et al.Morphological properties and thermoanalysis of micronized cassava starch[J].Carbohydrate Polymers,2010,79(1):101-105.
[15]黄祖强,胡华宇,童张法,等.机械活化对木薯淀粉糊透明度的影响[J].过程工程学报,2006,6(3):427-430.
[16]李雨露,刘小如,李红艳,等.水分含量对莲子淀粉回生影响及分子动力学模拟分析[J].食品科学,2015,36(17):83-87.
[17]谢新玲,罗冯笑,童张法,等.磁性木薯淀粉微球的结构表征及反应机理研究[J].化工新型材料,2014,42(9):158-164.
COMPARATIVE STUDY ON PREPARATION AND PROPERTIES OF RECRYSTALLIZED AND CROSSLINKED STARCH MICROSPHERES BY WATER-IN-WATER EMULSION METHOD
XIAN Xuequan, LI Yanming, YANG Hui, PAN Lixia, LI Bingzheng
(State Key Laboratory of Non-Food Biomass and Enzyme Technology/National Engineering Research Center for Non-Food Biorefinery/Guangxi Key Laboratory of Biorefinery,Guangxi Academy of Science, Nanning 530007, China)
Starch microsphere is of importance for low price,non-toxic and biocompatible properties as a novel starch-based material.The similarities and differences of preparation and properties of recrystallized starch microspheres(RSMs)and crosslinked starch microspheres(CSMs)were studied in the present study.RSMs and CSMs were prepared by water-in-water emulsion method at different incubation temperatures using acid-modified cassava starch as raw material.Yields and properties of two types of starch microspheres were comparatively studied as well.The results showed that the yield of RSMs decreased but that of CSMs increased with incubation temperature increasing.Maximum yield of RSMs(79.8%)was achieved when incubation temperature was 6℃.Swelling degree and methylene blue(MB)adsorption of CSMs were considerably higher than those of RSMs.Scanning electron microscopy images showed that although both of them were mainly spherical,RSMs were coarse with pits on the surface while CSMs were compact.X-ray diffraction patterns demonstrated that RSMs were of partial crystalline,but CSMs were of amorphous material.Thermogravimetry analysis indicated that the thermostability of RSMs was better than that of CSMs.
starch microspheres;water-in-water emulsion;recrystallized;crosslinked;physicochemical properties
TS231
B
1673-2383(2017)03-0025-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170621.1050.010.html
网络出版时间:2017-6-21 10:50:28
2016-10-24
广西自然科学基金项目(2013GXNSFBA019256;2014GXNSFBA118063;2015GXNSFAA139281)
冼学权(1987—),男,广西桂平人,助理研究员,研究方向为淀粉化学与技术。
*通信作者

