前列地尔联合一氧化氮治疗先天性心脏病合并肺动脉高压患儿的临床研究Δ
罗世官,陈宏明,谭荣邦,李日著,刘 莉(右江民族医学院附属医院胸心血管外科,广西百色 533000)
·药物与临床·
前列地尔联合一氧化氮治疗先天性心脏病合并肺动脉高压患儿的临床研究Δ
罗世官*,陈宏明,谭荣邦,李日著,刘 莉(右江民族医学院附属医院胸心血管外科,广西百色 533000)
目的:观察前列地尔联合一氧化氮对先天性心脏病合并肺动脉高压患儿的临床效果及免疫功能的影响。方法:采用回顾性研究方法,选取2009年8月-2015年2月我院胸心血管外科收治的40例先天性心脏病合并肺动脉高压患儿,依据治疗方式不同分为一氧化氮组(单独组)和前列地尔+一氧化氮组(联合组),各20例。两组患儿均给予先天性心脏病合并肺动脉高压的常规手术治疗;单独组患儿术后予以外源性吸入一氧化氮(体积分数为20×10-6),联合组患儿在此基础上联合静脉泵入前列地尔5 ng/(kg·min),持续72 h。比较两组患儿治疗前后的心率、左室射血分数、平均动脉压、肺动脉压、T淋巴细胞和免疫球蛋白(Ig)的变化,以及不良反应发生情况。结果:治疗前,两组患儿上述各项指标比较,差异均无统计学意义(P>0.05)。治疗后,两组患儿的心率、左室射血分数、平均动脉压、CD3+、IgA、IgM和IgG水平无明显变化,但CD4+、CD4+/CD8+、Treg/CD4+均较治疗前显著升高,肺动脉压、CD8+、Th1、Th2、Th1/Th2、Th17/CD4+、补体C3和补体C4水平均较治疗前显著下降,且联合组上述指标均显著优于单独组,差异均有统计学意义(P<0.05)。两组患儿均未见明显不良反应发生。结论:前列地尔联合一氧化氮可显著降低先天性心脏病合并肺动脉高压患儿的肺动脉压,改善T淋巴细胞表达情况,降低补体C3和C4水平,且安全性较高。
前列地尔;一氧化氮;先天性心脏病;肺动脉高压;免疫功能
肺动脉高压是一种由肺小血管痉挛、增生和过度肌化所致肺血管阻力进行性增高的病理综合征,也是先天性心脏病最常见的合并症之一[1]。目前,针对先天性心脏病合并肺动脉高压的治疗方式主要以心脏矫治/修复缺损手术为主,但多数患儿常因不同程度心肌储备功能的降低和心肌应激性的增强,导致手术治疗风险高,且极易出现肺动脉高压危象[2]。已有研究证实,吸入一氧化氮是一种可降低肺动脉高压的有效方法,亦是辅助先天性心脏病手术治疗的重要手段[3]。前列地尔,又名前列腺素E1,是一种天然前列腺素类物质,为肺动脉高压靶向治疗的主要药物之一[4]。本研究拟探讨前列地尔联合一氧化氮治疗先天性心脏病合并肺动脉高压的疗效及其对患儿免疫功能的影响,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:①经超声心动图和X线影像学检查确诊,并于先天性心脏病矫治术中测定肺动脉压,得肺动脉压/主动脉压≥0.5的患者;②无解剖畸形校正不当引起的机械性肠梗阻;③患儿家长均知情同意并签署知情同意书。
排除标准:①严重感染或酸碱失衡者;②肝肾功能明显异常者;③血压存在显著波动者。
1.2 研究对象
本研究方案经医院医学伦理委员会审核通过后,采用回顾性研究方法,选取2009年8月-2015年2月我院胸心血管外科收治的40例先天性心脏病合并肺动脉高压患儿为研究对象,其中男性23例、女性17例;年龄1~14岁,平均年龄(3.78±1.94)岁;室间隔缺损(Ventricular septal defect,VSD)21例,VSD+房间隔缺损(Atrial septal defect,ASD)6例,VSD+动脉导管未闭合(Patent ductus arteriosus,PDA)5例,PDA 4例,ASD+PDA 4例。依据治疗方式不同将患儿分为一氧化氮组(单独组)和前列地尔+一氧化氮组(联合组),各20例。两组患儿的年龄、性别比、肺动脉压/主动脉压、病理类型等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
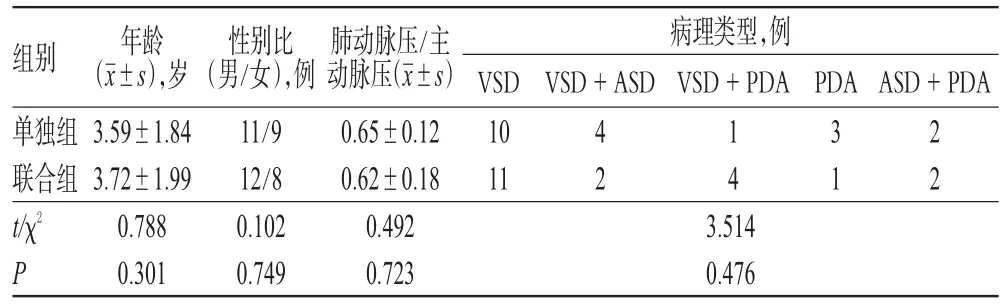
表1 两组患儿一般资料比较(n=20)Tab 1 Comparison of general information of patients between 2 groups(n=20)
1.3 治疗方法
两组患儿均给予先天性心脏病合并肺动脉高压的常规手术治疗;术后返回重症监护室后均给予Maquet Servo-i呼吸机(德国西门子公司)支持,通气模式为压力型同步间歇指令通气(P-SIMV),潮气量为8 mL/(kg·min),呼吸频率为20~30次/min,吸入氧的体积分数为40%~50%,呼气末正压为6 cmH2O(1 cmH2O=0.098 kPa)。单独组患儿予以外源性吸入一氧化氮,将一氧化氮治疗仪(佛山分析仪有限公司)接入患儿吸气管道,控制一氧化氮的体积分数为20×10-6,并监测血清高铁血红蛋白的浓度,待循环稳定后逐步减少一氧化氮流量直至撤除治疗仪;联合组患儿在此基础上静脉泵入前列地尔(哈药集团生物工程有限公司,批准文号:国药准字H20094203,规格:1 mL∶5 μg)5 ng/(kg·min),持续72 h。所有患儿均采用常规补液和抗感染治疗,以保证血压平稳、血容量充足、末梢温度恢复和尿量>4 mL/(kg·h)。
1.4 观察与检测指标
①测定两组患儿治疗前后的心率、左室射血分数、平均动脉压和肺动脉压的变化。②采用美国Beckman公司的FC500型流式细胞仪测定两组患儿治疗前后外周血T淋巴细胞亚群CD3+、CD4+、CD8+的水平,计算CD4+/CD8+;避光孵育之后,分别检测CD4+T细胞亚群Th1、Th2、Th17和调节性T细胞(Treg)的水平变化,应用Cellquest软件对结果进行分析。所有样品均由专业检验技术人员严格按照说明书和试验要求操作完成,并予以相应的质量控制。③于治疗前后分别采集两组患儿静脉血,应用速率散射免疫比浊法检测免疫球蛋白(Ig)A、IgM、IgG,以及补体C3和C4的水平,检测用试剂盒均购自美国Beckman公司。④观察两组患儿不良反应发生情况。
1.5 统计学方法
应用SPSS 19.0软件对数据进行统计分析。计量资料以s表示,两组间比较采用独立样本Student-t检验,治疗前后组内比较采用配对Student-t检验;计数资料以例数表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿治疗前后心率、左室射血分数、平均动脉压和肺动脉压比较
治疗前,两组患儿的心率、左室射血分数、平均动脉压和肺动脉压比较,差异均无统计学意义(P>0.05);治疗后,两组患儿的心率、左室射血分数和平均动脉压无明显变化,但肺动脉压均较治疗前显著下降,且联合组肺动脉压显著低于单独组,差异均有统计学意义(P<0.05),详见表2(表中,1 mmHg=0.133 kPa)。
2.2 两组患儿治疗前后T淋巴细胞亚群指标比较
治疗前,两组患儿的T淋巴细胞亚群指标(CD3+、CD4+、CD8+、CD4+/CD8+)比较,差异均无统计学意义(P>0.05);治疗后,两组患儿的CD4+和CD4+/CD8+均较治疗前显著升高,CD8+较治疗前显著降低,且联合组上述指标均显著优于单独组,差异均有统计学意义(P<0.05);两组患儿治疗前后的CD3+比较,差异均无统计学意义(P>0.05),详见表3。
2.3 两组患儿治疗前后Th1、Th2、Treg/CD4+和Th17/ CD4+比较
治疗前,两组患儿的Th1、Th2、Th1/Th2、Treg/CD4+和Th17/CD4+比较,差异均无统计学意义(P>0.05);治疗后,两组患儿的Th1、Th2、Th1/Th2和Th17/CD4+均较治疗前显著降低,Treg/CD4+较治疗前显著升高,且联合组上述指标均显著优于单独组,差异均有统计学意义(P<0.05),详见表4。
2.4 两者患儿治疗前后免疫功能指标比较
治疗前,两组患儿的IgA、IgM、IgG、补体C3和C4水平比较,差异均无统计学意义(P>0.05);治疗后,两组患儿的IgA、IgM和IgG水平无明显变化,但补体C3和C4水平均较治疗前显著下降,且联合组上述指标均显著低于单独组,差异均有统计学意义(P<0.05),详见表5。
表2 两组患儿治疗前后心率、左室射血分数、平均动脉压和肺动脉压比较(s,n=20)Tab 2 Comparison of heart rate,LVEF,mean arterial pressure and pulmonary arterial pressure between 2 groups before and after treatments(s,n=20)
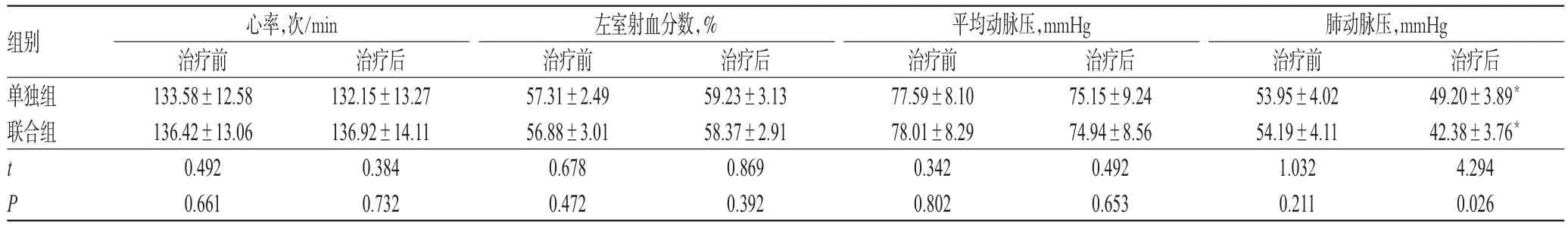
表2 两组患儿治疗前后心率、左室射血分数、平均动脉压和肺动脉压比较(s,n=20)Tab 2 Comparison of heart rate,LVEF,mean arterial pressure and pulmonary arterial pressure between 2 groups before and after treatments(s,n=20)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别单独组联合组tP治疗后75.15±9.24 74.94±8.56 0.492 0.653心率,次/min治疗前133.58±12.58 136.42±13.06 0.492 0.661治疗后132.15±13.27 136.92±14.11 0.384 0.732左室射血分数,%治疗前57.31±2.49 56.88±3.01 0.678 0.472治疗后59.23±3.13 58.37±2.91 0.869 0.392平均动脉压,mmHg治疗前77.59±8.10 78.01±8.29 0.342 0.802肺动脉压,mmHg治疗前53.95±4.02 54.19±4.11 1.032 0.211治疗后49.20±3.89*42.38±3.76*4.294 0.026
表3 两组患儿治疗前后T淋巴细胞亚群指标比较(s,n=20)Tab 3 Comparison of T lymphocyte subset indexes between 2 groups before and after treatment(s,n=20)
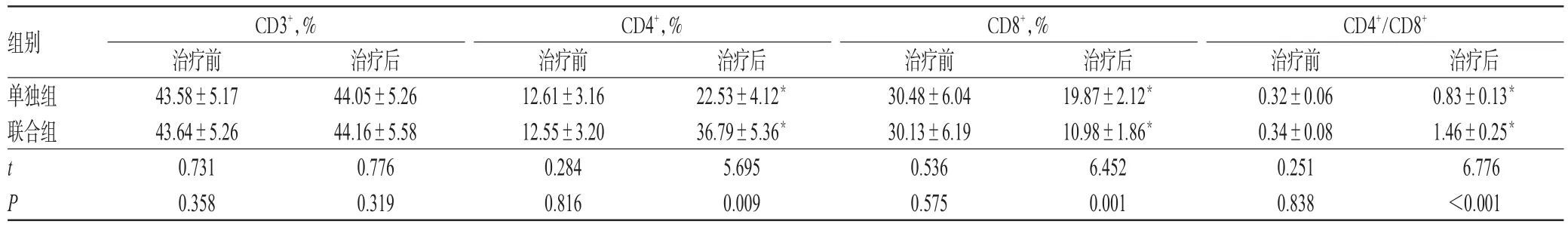
表3 两组患儿治疗前后T淋巴细胞亚群指标比较(s,n=20)Tab 3 Comparison of T lymphocyte subset indexes between 2 groups before and after treatment(s,n=20)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别单独组联合组CD3+,%CD4+,%CD8+,% tP治疗后0.83±0.13*1.46±0.25*6.776<0.001治疗前43.58±5.17 43.64±5.26 0.731 0.358治疗后44.05±5.26 44.16±5.58 0.776 0.319治疗前12.61±3.16 12.55±3.20 0.284 0.816治疗后22.53±4.12*36.79±5.36*5.695 0.009治疗前30.48±6.04 30.13±6.19 0.536 0.575治疗后19.87±2.12*10.98±1.86*6.452 0.001 CD4+/CD8+治疗前0.32±0.06 0.34±0.08 0.251 0.838
表4 两组患儿治疗前后Th1、Th2、Treg/CD4+和Th17/CD4+比较(s,n=20)Tab 4 Comparison of Th1,Th2,Treg/CD4+and Th17/CD4+between 2 groups before and after treatment(s,n=20)

表4 两组患儿治疗前后Th1、Th2、Treg/CD4+和Th17/CD4+比较(s,n=20)Tab 4 Comparison of Th1,Th2,Treg/CD4+and Th17/CD4+between 2 groups before and after treatment(s,n=20)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别单独组联合组tP治疗后2.46±0.33*1.15±0.12*4.555 0.031 Th1,%治疗前7.12±1.18 7.14±1.25 0.282 0.825治疗后4.88±0.71*1.92±0.58*6.323 0.001 Th2,%治疗前3.21±0.44 3.23±0.41 0.133 0.927治疗后2.43±0.31*1.28±0.26*4.998 0.026 Th1/Th2治疗前2.12±0.05 2.06±0.08 0.160 0.904治疗后1.75±0.09*1.30±0.08*8.045<0.001 Treg/CD4+治疗前3.52±1.32 3.59±1.28 0.462 0.624治疗后6.26±1.11*9.05±1.56*5.820 0.009 Th17/CD4+治疗前4.28±0.84 4.31±0.77 0.319 0.772
表5 两组患儿治疗前后免疫功能指标比较(s,g/L,n=20)Tab 5 Comparison of immune function indexes between 2 groups before and after treatment(s,g/L,n=20)
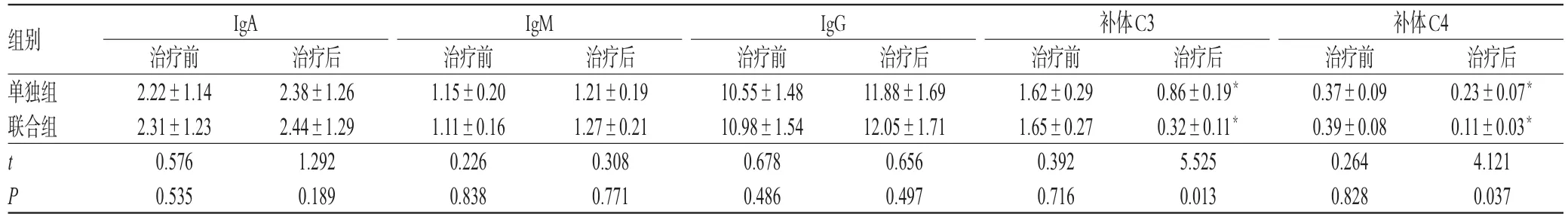
表5 两组患儿治疗前后免疫功能指标比较(s,g/L,n=20)Tab 5 Comparison of immune function indexes between 2 groups before and after treatment(s,g/L,n=20)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别单独组联合组IgA IgM IgG tP治疗后0.23±0.07*0.11±0.03*4.121 0.037治疗前2.22±1.14 2.31±1.23 0.576 0.535治疗后2.38±1.26 2.44±1.29 1.292 0.189治疗前1.15±0.20 1.11±0.16 0.226 0.838治疗后1.21±0.19 1.27±0.21 0.308 0.771治疗前10.55±1.48 10.98±1.54 0.678 0.486治疗后11.88±1.69 12.05±1.71 0.656 0.497补体C3治疗前1.62±0.29 1.65±0.27 0.392 0.716治疗后0.86±0.19*0.32±0.11*5.525 0.013补体C4治疗前0.37±0.09 0.39±0.08 0.264 0.828
2.5 不良反应
治疗期间,两组患儿均未见明显不良反应发生。
3 讨论
肺动脉高压是先天性心脏病中最主要的合并症,尤其是伴有中、重度肺动脉高压的先天性心脏病患儿,目前尚无标准的治疗策略[5]。传统内科治疗方法主要有限制体力活动、吸氧、抗凝、利尿和强心等,临床效果并不理想[6]。外科治疗难度则更大,不仅可直接导致肺部血管或组织功能损伤,还能促使肺血管应激性收缩而引发肺动脉高压和低心排综合征,进而导致心力衰竭和肺动脉高压危象[7]。研究显示,一氧化氮可有效扩张肺部血管,减少肺血管阻力,降低心肌对钙诱导的收缩敏感性,且对肺动脉高压具有特异性改善作用[8]。但临床实践发现,一氧化氮吸入治疗存在患者无反应或过分依赖的缺点,严重制约了其应用[9]。前列地尔是一种天然前列腺素类物质,不易失活且易于分布在受损血管,靶向特性好,具有扩张血管和抑制血小板聚集的作用,是临床上治疗肺动脉高压的主要药物之一[10]。基于此,本研究采用一氧化氮和前列地尔联合应用的治疗策略。结果显示,单独组患儿吸入一氧化氮之后,肺动脉压显著降低,平均动脉压和左室射血分数出现一定程度的改善,提示一氧化氮对先天性心脏病合并肺动脉高压患儿具有较好的疗效。联合组患儿肺动脉压的降低幅度显著大于单独组,表明前列地尔联合一氧化氮可协同降低先天性心脏病患儿的肺动脉血压,原因可能为:(1)一氧化氮具有改善通气-血流比值的作用,可帮助患儿形成有效通气,在一定程度上提高了前列地尔的基础疗效;(2)一氧化氮可选择性降低肺循环和体循环的血流比值,减少由右向左的分流,同时降低肺泡表面活性物质的亲水能力和表面张力,促进肺泡的复张,并与前列地尔发生协同作用[11]。
目前,不论是一氧化氮还是前列地尔的治疗机制均未得以阐明,两者的联合作用机制更是未见报道。近年来,已有研究显示,先天性心脏病患儿存在免疫缺陷和免疫调节功能紊乱,特别是合并有肺部感染或肺动脉高压的患儿,其免疫功能的缺失症状更为明显[12]。众所周知,免疫功能是在淋巴细胞、单核细胞和其他有关细胞及其产物的相互作用下实现的。其中,T淋巴细胞(主要包括辅助性T细胞、Treg和效应T细胞)是完成细胞免疫的主要细胞,T淋巴细胞的水平不仅可直接反映机体抵御疾病的能力,还是判定疾病预后的关键指标[13]。因此,本研究测定了两组患儿的T淋巴细胞水平。结果发现,与治疗前比较,两组患儿治疗后的CD4+、CD4+/CD8+和Treg/ CD4+显著升高,CD8+、Th1、Th2、Th1/Th2、Th17/CD4+显著降低,且联合组患儿的改善程度显著优于单独组。提示一氧化氮可使T淋巴细胞水平发生良性改变,促进细胞免疫功能恢复;而前列地尔联合一氧化氮可协同影响T淋巴细胞水平,进一步改善免疫平衡的紊乱状态。
除了细胞免疫之外,由B细胞介导的体液免疫也是机体免疫功能的重要组成部分之一。本研究结果还显示,两组患儿治疗前后的IgA、IgM和IgG水平并未发生明显变化,这可能与一氧化氮和前列地尔并不直接作用于Ig有关。但研究结果也发现,两组患儿的补体C3和C4水平显著下降,且联合组指标显著低于单独组,表明一氧化氮和前列地尔的作用靶标可能集中于炎症相关的免疫反应,其具体作用机制仍有待深入研究。
综上所述,前列地尔联合一氧化氮可显著降低先天性心脏病合并肺动脉高压患儿的肺动脉压,改善T淋巴细胞表达情况,降低补体C3和C4水平,且安全性较高。但由于本研究纳入的病例数量较少,收集病例的时间跨度较长,研究结论可能存在一定的局限性,亟待后续大样本、多中心临床试验加以验证。此外,本研究结果仅可提示前列地尔联合一氧化氮可通过改善患儿部分免疫功能指标促进机体康复,但其具体药理作用机制仍未明确,尚需后续研究深入探讨。
[1] Thomas IC,Glassner-Kolmin C,Gomberg-Maitland M.Long-term effects of continuous prostacyclin therapy in adults with pulmonary hypertension associated with congenital heart disease[J].Int J Cardiol,2013,168(4):4117-4121.
[2] Alonso-Gonzalez R,Lopez-Guarch CJ,Subirana-Domenech MT,et al.Pulmonary hypertension and congenital heart disease:an insight from the REHAP National Registry[J].Int J Cardiol,2015,184:717-723.
[3] Klinger JR,Abman SH,Gladwin MT.Nitric oxide deficiency and endothelial dysfunction in pulmonary arterial hypertension[J].Am J Resp Crit Care Med,2013,188(6):639-646.
[4] Vishwanath H,Ian E.Alprostadil for the treatment of impotence[J].Expert Opin Pharmaco,2014,15(3):421-428.
[5] D’Alto M,Romeo E,Argiento P,et al.Therapy for pulmonary arterial hypertension due to congenital heart disease and Down’s syndrome[J].Int J Cardiol,2013,164(3):323-326.
[6] Dimopoulos K,Wort SJ,Gatzoulis MA.Pulmonary hypertension related to congenital heart disease:a call for action [J].Euro Heart J,2014,35(11):691-700.
[7] Becker-Grünig T,Klose H,Ehlken N,et al.Efficacy of exercise training in pulmonary arterial hypertension associated with congenital heart disease[J].Int J Cardiol,2013,168(1):375-381.
[8] Lakshminrusimha S,Steinhorn RH.Inodilators in nitric oxide resistant persistent pulmonary hypertension of the newborn[J].Pediatr Crit Care Med,2013,14(1):107-109.
[9] Datar SA,Oishi PE,Gong W,et al.Altered reactivity and nitric oxide signaling in the isolated thoracic duct from an ovine model of congenital heart disease with increased pulmonary blood flow[J].Am J Physiol Heart Circ Physiol,2014,306(7):954-962.
[10] Lee JC.Therapeutic effect of prostaglandin E1in monocrotaline-induced pulmonary arterial hypertension rats[J]. Anat Cell Biol,2017,50(1):60-68.
[11] Milger K,Felix JF,Voswinckel R,et al.Sildenafil versus nitric oxide for acute vasodilator testing in pulmonary arterial hypertension[J].Pulm Circ,2015,5(2):305-312.
[12] Halnon NJ,Jamieson B,Plunkett M,et al.Thymic function and impaired maintenance of peripheral T cell populations in children with congenital heart disease and surgical thymectomy[J].Pediatr Res,2005,57(1):42-48.
[13] Coulie PG,van den Eynde BJ,van der Bruggen P,et al. Tumour antigens recognized by T lymphocytes:at the core of cancer immunotherapy[J].Nat Rev Cancer,2014,14(2):135-146.
Clinical Study of Alprostadil Combined with Nitric Oxide in the Treatment of Congenital Heart Disease Complicated with Pulmonary Hypertension
LUO Shiguan,CHEN Hongming,TAN Rongbang,LI Rizhu,LIU Li(Dept.of Thoracic and Cardiovascular Surgery,the Affiliated Hospital of Youjiang Medical College for Nationalities,Guangxi Baise 533000,China)
OBJECTIVE:To observe clinical effects of alprostadil combined with nitric oxide in the treatment of congenital heart disease complicated with pulmonary hypertension and its effects on immune function.METHODS:In retrospective study,40 cases of congenital heart disease complicated with pulmonary hypertension in thoracic and cardiovascular surgery department of our hospital during Aug.2009 to Feb.2015 were selected and divided into nitric oxide group(single group)and alprostadil+nitric oxide group(combination group)according to therapy method,with 20 cases in each group.Both groups
conventional surgery. Single group was given extrinsic inhalation of nitric oxide(volume fraction of 20×10-6)after surgery;combination group was additionally given intravenous pump of alprostadil 5 ng/(kg·min)for consecutive 72 h,on the basis of combination group.The heart rate,left ventricular ejection fraction(LVEF),mean arterial pressure,pulmonary arterial pressure,T lymphocyte and immunoglobulin(Ig)of children before and after treatment,and the occurrence of ADR were compared between 2 groups.RESULTS:Before treatment,there was no statistical significance in above indexes between 2 groups(P>0.05).After treatment,heart rate,LVEF,mean arterial pressure,the levels of CD3+,IgA,IgM and IgG in 2 groups had no significant change,but CD4+,CD4+/CD8+,Treg/ CD4+were increased significantly;pulmonary arterial pressure,the levels of CD8+,Th1,Th2,Th1/Th2 and Th17/CD4+,supplement C3 and supplement C4 were decreased significantly,compared to before treatment.Above indexes in the combination group was significantly better than the single group,with statistical significance(P<0.05).No obvious ADR was found in 2 groups. CONCLUSIONS:Alprostadil combined with nitric oxide could significantly reduce the pulmonary hypertension in children with congenital heart disease complicated with pulmonary hypertension,improve the level of T lymphocytes,and decrease the levels of supplement C3 and supplement C4 with good safety.
Alprostadil;Nitric oxide;Congenital heart disease;Pulmonary hypertension;Immune function
R541.1
A
1001-0408(2017)17-2366-04
2016-06-13
2016-08-22)
(编辑:胡晓霖)
国家自然科学基金资助项目(No.81560076)
*副主任医师。研究方向:瓣膜外科及先心病的外科治疗。电话:0776-2806995。E-mail:luoshiguan2009@sina.com
DOI10.6039/j.issn.1001-0408.2017.17.17

