自体外周血富白细胞-血小板纤维蛋白对兔关节外骨道内移植肌腱腱骨早期愈合的影响
刘一军 徐斌 涂俊 余刚
安徽医科大学第一附属医院运动创伤与关节镜科(合肥230022)
自体外周血富白细胞-血小板纤维蛋白对兔关节外骨道内移植肌腱腱骨早期愈合的影响
刘一军 徐斌 涂俊 余刚
安徽医科大学第一附属医院运动创伤与关节镜科(合肥230022)
目的:探讨兔关节外骨道内使用自体外周血富白细胞-血小板纤维蛋白(L-PRF)对移植肌腱早期腱骨愈合的影响。方法:30只健康新西兰大白兔平均分为实验组和空白对照组。将兔的半腱肌腱取出制成游离肌腱,植入同侧关节外胫骨近端的横向骨道内制成腱骨愈合模型。实验组加入自体血来源的L-PRF,对照组不加入L-PRF。分别于术后4、8、12周三个时间点处死实验动物取材,切片染色,行腱骨界面的组织形态学观察、Buark评级,并在高倍镜下行成纤维细胞计数并分析。结果:各个时间点实验组成纤维细胞数目均多于对照组,差异均具有统计学意义(P<0.05);在3个时间点中,与对照组相比,实验组腱骨连接更加紧密,腱骨间隙更小,胶原纤维排列更有序规则;标志腱骨早期愈合的Sharpey样纤维在4周时的实验组即可观察到,而对照组8周时才可观察到,并且随着时间延长,两组Sharpey样纤维均持续增多;两组标本的腱骨界面组织形态学Buark评级差异有统计学意义(P<0.05)。结论:自体血来源的LPRF可促进关节外骨道内移植半腱肌腱腱骨的早期愈合。
富白细胞-血小板纤维蛋白;关节外;腱骨愈合
韧带或肌腱损伤属于运动创伤中的多发病、常见病。目前,韧带重建和修复是治疗关节韧带损伤的主要手段。而韧带重建或修复术包括在关节内和关节外,且这些重建或修复成功的关键在于腱骨的良好愈合。以往实验大多是关于关节内的腱骨愈合研究(如前交叉韧带重建),其中有研究[1]表明富血小板血浆(platelet rich plasma,PRP)对关节内腱骨愈合有明显促进作用。但是在关节外与PRP具有同源性的富白细胞-血小板纤维蛋白(leukocyte-and platelet-rich fi⁃brin,L-PRF)对移植肌腱的腱骨愈合影响的报道相对较少。本研究用兔自体外周血制备L-PRF膜,将其与自体半腱肌腱移植肌腱一同植入关节外胫骨近端骨隧道,观察L-PRF对关节外腱骨愈合是否有促进作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
体重约2.5 kg的健康成年雄性新西兰大白兔30只,委托安徽医科大学动物实验中心购买、饲养,动物生产许可证号:SCXK(苏)2016-0005,动物使用许可证号:SYXK(皖)2014-007。所有兔子在实验前后均为单笼饲养。
1.1.2 主要材料及试剂
普通离心机;红头的干燥玻璃采血管;HE染色试剂盒(北京索莱宝科技有限公司);Masson三色染色试剂盒(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 L L--P P R R F F的制备
根据之前研究的技术方法[2]制备L-PRF,制备过程严格遵守无菌操作原则。从兔耳缘抽取约5 m l静脉血于红头干燥无菌玻璃采血管中(不加抗凝剂),立即放入离心机中配平,然后以3000 r/min的转速离心10 min。离心结束后取出玻璃管,可见管内明显的三层结构:上层为贫血小板血浆(platelet-poor plasma,PPP),中间为富白细胞和血小板的纤维蛋白凝块,下层为红细胞层。用移液管移除PPP,再用镊子取出L-PRF于无菌金属板上。然后用手术刀切除附着在L-PRF底端的红细胞层,完整保留L-PRF凝块。最后轻柔按压LPRF凝块,挤出残留其中的贫血小板血浆,制成L-PRF膜留待实验中使用。
1.2.2 动物分组及模型[[33]]的建立
30只新西兰大白兔分为实验组和对照组,每组15只。10%的水合氯醛腹腔注射麻醉(3 ml︰1 kg)后,以兔子的后肢为实验肢,术区备皮消毒铺巾。取髌旁内侧入路,作长约30 mm的纵行切口,于胫骨结节内后,大腿内侧逐层分离出半腱肌腱,在近端的肌腱和肌腹交界处以上尽量靠近近端切断,然后在肌腱远端止点处切断肌腱并取出,剔除肌肉部分。将肌腱对折,并将上述制备的L-PRF膜放在两端肌腱之间,对折后的肌腱长度约15 mm。对折后的肌腱两游离端用无菌缝线编织缝合,折叠处用无菌丝线穿过后备用。在同侧关节外内侧副韧带下止点下方约5 mm处,由内向外用2.0克氏针水平钻取一骨道,测深尺测得骨道长度12 ±1 mm。将上述编织好的肌腱的折叠端处的丝线穿过无菌缝针,用缝针由内向外穿过骨道,并将肌腱拉入骨道内,在骨道内口留出长约2 mm的肌腱以供固定。在内侧骨道口用编织线再次穿过肌腱缝合收紧固定在周围的软组织上,外侧同样缝合收紧固定在周围的软组织上。实验组在折叠的两段肌腱之间加入L-PRF膜,对照组不加L-PRF膜。碘伏生理盐水反复冲洗皮下组织,逐层间断缝合切口,术后单笼饲养,自主活动,前3天常规肌肉注射抗生素预防感染。
1.2.3 动物标本处理、组织学观察及B B u u a a r r k k评级
分别于术后第4、8、12周三个时间点,每组处死5只兔子,截取包含有移植肌腱的骨组织,剔除周围软组织,置于10%的中性福尔马林中固定24小时后,再置于EDTA-2Na缓冲液中脱钙6~8周,每2~3天换一次脱钙液。脱钙结束后,标本经脱水、透明、石蜡包埋,制成5 μm厚切片。然后行HE、Masson染色。HE染色进行腱骨界面间的组织形态学观察,并对各个时间点的成纤维细胞计数,每个切片取5个高倍镜视野;Masson染色观察腱骨间的胶原纤维增生及排列,并行腱骨间组织形态学的Buark[4]半定量评级。此评级标准以腱骨界面愈合的组织形态学为评级依据,作Ⅰ、Ⅱ、Ⅲ、Ⅳ四级半定量评价。用目镜测微尺测量各标本切片腱骨界面单位长度中Sharpey样纤维占有的比例来进行分级。具体Buark标准为:Ⅰ级:缺乏组织结构的疏松纤维血管组织界面;Ⅱ级:已机化的纤维血管组织伴有胶原纤维产生,占有的界面长度<30%;Ⅲ级:成熟的纤维组织、细胞和血管减少,占有的界面长度为30%~60%;Ⅳ级:纤维血管组织机化成致密结缔组织,垂直骨道方向的Sharpey样纤维占有的界面长度>60%。在相应的时间点,每组标本制15张切片,观察评估每张切片的分级,并统计相应级别的切片数量。
1.2.4 统计学方法
采用SPSS 16.0软件进行数据分析,定量资料的组间数据采用t检验,等级资料采用两组单向有序分类资料的非参数秩和检验。设定α=0.05为检验水准。
2 结果
2.1 H H E E染色组织学观察结果
术后4周对照组腱骨界面间隙较大,可见大量的炎症细胞及少量的成纤维细胞并且排列紊乱,腱骨间连接较为疏松。实验组腱骨界面可见较少的炎症细胞及较多的成纤维细胞,并有少量的未成熟软骨细胞及Sharpey样纤维形成。术后8周对照组腱骨界面成纤维细胞的数量增多但仍排列较为紊乱,并出现了未成熟的软骨细胞及Sharpey样纤维,腱骨间连接较4周时紧密。实验组Sharpey样纤维较4周时增多增粗,未成熟的软骨细胞增多并出现少量的成熟软骨细胞,腱骨连接更加紧密。术后12周时对照组Sharpey样纤维排列仍较紊乱,出现了少量的钙化软骨,腱骨间连接较为紧密。实验组腱骨界面形成大量的排列有序规则的Sharpey样纤维,并且成熟的软骨数目增多,纤维软骨与钙化软骨间形成类似潮线样结构,腱骨间的纤维连接更加有序紧密。见图1。

图1 标本切片HE染色光镜观察(×100)
2.2 H H E E染色成纤维细胞计数结果
如表1所示,3个时间点实验组成纤维细胞计数均显著多于对照组(P<0.05)。
表1 术后两组标本HE染色腱骨界面成纤维细胞计数比较(±s)

表1 术后两组标本HE染色腱骨界面成纤维细胞计数比较(±s)
各个时间点与对照组相比:*P<0.05。
组别对照组(n=15)实验组(n=15)时间12周12.47±1.55 18.13±1.51*4周12.67±1.99 18.27±2.87*8周14.80±1.74 25.40±1.40*
2.3 Ma a s s s s o o n n三色染色结果
术后4周,对照组腱骨间隙与实验组相比较大,腱骨连接较松弛,部分腱骨间仍见有间隙,腱骨间有少量的成纤维细胞及胶原纤维;实验组腱骨间间隙较小,可见有较多的成纤维细胞增生及胶原纤维,并有少量与骨隧道壁垂直连接的Sharpey样纤维。术后8周,对照组腱骨间成纤维细胞明显增生,胶原纤维的数量亦较4周时增多,出现与骨道壁垂直连接的少量Sharpey样纤维;实验组腱骨间胶原纤维大量增生,排列亦较为规则,与骨道壁垂直连接的Sharpey样纤维增多。术后12周,对照组骨隧道与移植肌腱间纤维细胞未见明显增多,胶原纤维量增多较明显,但是排列欠规整;实验组骨隧道与移植肌腱间胶原纤维排列规则致密,与骨道壁连接紧密,并含有大量的Sharpey样纤维。见图2。
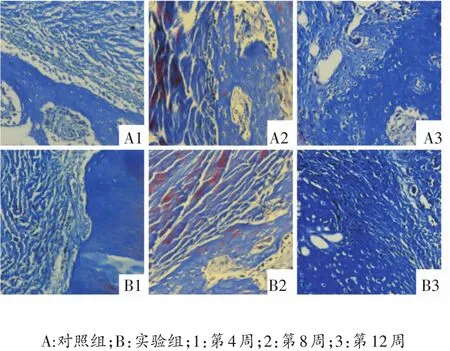
图2 标本切片M asson染色光镜观察(×100)
2.4 两组标本的组织形态学B B u u a a r r k k评级
两组标本切片的组织形态学Buark评级结果见表2和表3。两组的腱骨界面组织形态学Buark评级差异有统计学意义(P<0.05)。实验组的Buark评级高于对照组。

表2 两组标本切片的组织形态学Buark评级结果

表3 两组标本12周内组织形态学Buark评级比较
3 讨论
使用移植肌腱重建韧带手术成功的关键在于腱骨之间的牢固愈合。正常的腱骨之间的结构分为两种:一种是通过肌腱末端的纤维软骨与骨皮质连接的直接止点结构,此结构由典型的4层组织构成:肌腱或韧带[由平行的胶原纤维和少许细长的纤维母细胞(腱细胞)组成]、未钙化的纤维软骨、钙化的软骨、骨组织,交叉韧带的止点则属于此种;另一种则是肌腱的纤维末端直接与皮质骨连接。这些止点中肌腱末端的附着是通过胶原纤维的互相交叉穿行附着在骨骼上,这种胶原纤维被称为Sharpey纤维[5]。理想的腱骨愈合为形成正常的止点结构,但是人为的移植肌腱的腱骨愈合往往需要较长的愈合时间,而以Sharpey样纤维锚固在骨道壁上是腱骨愈合的早期标志。本实验结果显示,实验组4周的标本切片中可观察到Sharpey样纤维,12周时观察到大量Sharpey样纤维;而对照组在8周时才能在标本的切片中观察到少量Sharpey样纤维,12周时该纤维未见明显增多,并且排列不规则。故结果表明自体血来源的L-PRF能够促进移植肌腱在关节外骨道内早期的腱骨愈合。
既往有许多血小板浓缩液对腱骨愈合影响的研究,如Wu等[6]的兔子肩袖损伤研究中,使用PRP组与对照组相比,其腱骨愈合界面胶原纤维排列更加规则,连续性更强;在相同的时间点PRP组的生物力学负荷更大,并且在6周时骨形态发生蛋白-2的表达多于对照组。Seijas等[7]在给98位患者进行自体髌腱移植物重建前交叉韧带术后,随机选择是否注射PRP,用核磁共振(MRI)进行术后评估。结果显示在4周和6周时PRP组与对照组相比髌腱移植物结构重塑更佳。但是血小板浓缩液不只是PRP,文献中[8]基于白细胞和纤维蛋白的成分不同将血小板浓缩液分为4个家族:纯的富血小板血浆(pure platelet-rich plasma,P-PRP)、富白细胞和血小板血浆(leukocyte-and platelet-rich plasma,L-PRP)、纯的富血小板纤维蛋白(pure platelet-rich fi⁃brin,P-PRF)、富白细胞血小板纤维蛋白(leukocyteand platelet-rich fibrin,L-PRF)。P-PRP是指富含生长因子的血浆,L-PRP通常以胶体或液体的形式存在,包被有低密度的胶原蛋白网并含有白细胞。P-PRF又被称为富血小板纤维蛋白基质(platelet-rich fibrin ma⁃trix,PRFM),L-PRF包含有高密度的纤维蛋白网并仅以胶体形式存在。这些血小板浓缩液都主要含有表皮生长因子(EGF)、胰岛素样生长因子(IGF-Ⅰ)、转化生长因子β1(TGF-β1)、血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子。这些因子在细胞的增殖分化、趋向性和血管再生中起着重要作用。PRP的获取一般要多次离心获得,并且要加入外源性的抗凝剂及激活剂,操作较复杂,易产生污染;另一方面没有标准统一的方法来获得PRP,因此可能产生不同含量的血小板和生长因子进而影响结果。而本实验应用的LPRF是第二代的血小板浓缩液,一次离心即可获得,无需加入抗凝剂,在离心过程中L-PRF即被激活,无需添加外源性激活剂[9,10]。并且有研究表明[10]L-PRF中的生长因子持续缓慢地释放且持续时间较长。另外,PRF在整形外科的实验研究应用较多,研究[11,12]显示PRF能促进骨缺损区骨再生。也有研究[13]表明L-PRF可以促进肩袖损伤修补术后早期的血管再生反应。而腱骨的早期愈合是腱骨界面的新生骨长入肌腱与Sharpey样纤维相互锚固的过程[14]。因此本实验假设L-PRF可以促进移植肌腱与关节外骨道壁的愈合。上述组织学的结果也表明其可以促进关节外腱骨的早期愈合,这可能与L-PRF中含有多种生长因子及白细胞有关,但其具体机制有待深入研究。
陆军等[15]曾使用大鼠关节外骨道建立腱骨愈合模型,本实验采用类似的方法。该模型的手术操作相对简单,对患肢的影响较小,且可双侧肢体同时造模。但是,本实验也有许多不足之处,如样本量较少,每个时间点只有5只兔子;本实验的结果仅用了组织学的切片观察,而未进行生物力学的定量分析及分子生物学上的蛋白表达研究;另外,实验观察的时间较短,其长期的愈合情况有待进一步观察研究。
总之,腱骨愈合研究的核心问题在于实施一定的干预方法促进其更快、更加牢固的愈合。本实验采用自体外周血来源的L-PRF,具有提取简单、价廉、创伤小、无排斥反应等优点,且能够促进关节外腱骨的早期愈合。随着研究的深入,其一定会有广阔的临床应用前景。
[1]Ersen A,Demirhan M,Atalar AC,et al.Platelet-rich plas⁃ma for enhancing surgical rotator cuff repair:evaluation and comparison of two application methods in a rat mod⁃el[J].Arch Orthop Trauma Surg,2014,134(3):405-411.
[2]Dohan Ehrenfest DM,Del Corso M,Diss A,et al.Threedimensional architecture and cell composition of a Chouk⁃roun's platelet-rich fibrin clot and membrane[J].J Peri⁃odontol,2010,81(4):546-555.
[3]Sun L,Zhou X,Wu B,et al.Inhibitory effect of synovial fluid on tendon-to-bone healing:an experimental study in rabbits[J].Arthroscopy,2012,28(9):1297-1305.
[4]Demirag B,Sarisozen B,Ozer O,et al.Enhancement of tendon-bone healing of anterior cruciate ligament grafts by blockage of matrix metalloproteinases[J].J Bone Joint Surg Am,2005,87(11):2401-2410.
[5]Doschak MR,Zernicke RF.Structure,function and adapta⁃tion of bone-tendon and bone-ligament complexes[J].J Musculoskelet Neuronal Interact,2005,5(1):35-40.
[6]Wu Y,Dong Y,Chen S,et al.Effect of platelet-rich plas⁃ma and bioactive glass powder for the improvement of ro⁃tator cuff tendon-to-bone healing in a rabbit model[J]. Int JMol Sci,2014,15(12):21980-21991.
[7]Seijas R,Ares O,Catala J,et al.Magnetic resonance im⁃aging evaluation of patellar tendon graft remodelling af⁃ter anterior cruciate ligament reconstruction with or with⁃out platelet-rich plasma[J].J Orthop Surg(Hong Kong),2013,21(1):10-14.
[8]Dohan Ehrenfest DM,Rasmusson L,Albrektsson T.Classi⁃fication of platelet concentrates:from pure platelet-rich plasma(P-PRP)to leucocyte-and platelet-rich fibrin(LPRF)[J].Trends Biotechnol,2009,27(3):158-167.
[9]Choukroun J,Diss A,Simonpieri A,et al.Platelet-rich fi⁃brin(PRF):a second-generation platelet concentrate.Part IV:clinical effects on tissue healing[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(3):e56-60.
[10]Kazemi D,Fakhrjou A.Leukocyte and Platelet Rich Plas⁃ma(L-PRP)Versus Leukocyte and Platelet Rich Fibrin(LPRF)For Articular Cartilage Repair of the Knee:A Com⁃parative Evaluation in an Animal Model[J].Iran Red Crescent Med J,2015,17(10):e19594.
[11]Durmuslar MC,Balli U,Ongoz Dede F,et al.Evaluation of the effects of platelet-rich fibrin on bone regeneration in diabetic rabbits[J].J Craniomaxillofac Surg,2016,44(2):126-133.
[12]Li Q,Reed DA,Min L,et al.Lyophilized platelet-rich fi⁃brin(PRF)promotes craniofacial bone regeneration through Runx2[J].Int JMol Sci,2014,15(5):8509-8525.
[13]Zumstein MA,Rumian A,Lesbats V,et al.Increased vas⁃cularization during early healing after biologic augmenta⁃tion in repair of chronic rotator cuff tears using autolo⁃gous leukocyte-and platelet-rich fibrin(L-PRF):a pro⁃spective randomized controlled pilot trial[J].J Shoulder Elbow Surg,2014,23(1):3-12.
[14]Cohen DB,Kawamura S,Ehteshami JR,et al.Indometha⁃cin and celecoxib impair rotator cuff tendon-to-bone healing[J].Am J Sports Med,2006,34(3):362-369.
[15]陆军,Jr RV.大鼠关节外骨隧道游离肌腱移植模型的建立[J].中华骨科杂志,2014,34(8):864-871.
Effectsof Leukocyte-and Platelet-rich Fibrin on Tendon-bone Healing of Rabbits’Extra-articular Bone Tunnel in the Early Period
Liu Yijun,Xu Bin,Tu Jun,Yu Gang
DepartmentofSports Injury Arthroscopic Surgery,The FirstAffiliated HospitalofAnhuiMedicalUniversity,Hefei 230022,China
Xu Bin,Email:youchen100@126.com
ObjectiveTo evaluate the early effect of leukocyte-and platelet-rich fibrin(L-PRF)on tendon-bone healing in rabbits’extra-articular bone tunnel.M ethodsThirty healthy New Zealand rab⁃bits were random ly divided into an experimental group and a control group,each of 15.The semitendi⁃nosus tendon harvested from the hind leg of each rabbit was prepared as free autografts.Each auto⁃graft was implanted into the bone tunnel created at ipsilateral proximal tibial metaphysis.The experi⁃mental group was added with autologous peripheral blood-derived L-PRF,while the control group did not add anything.Speciments from each group were harvested at 4,8 and 12 weeks after operation. The morphological changes were observed and evaluated at each time point.The fibroblasts on the ten⁃don-bone interface were counted and analyzed under the high magnification microscope.ResultsThe number of fibroblasts between the tendon and bone in the experimental group was significantly higher than that of the control group at each time point(P<0.05).And the connection between tendon and bone was closer and the collagen fibers were more regular in the experimental group than the control group at each time point.Sharpey’s-like fibers which marked the early healing of the tendon to bone,were observed at 4th week in the experimental group,while they were observed at 8th week in the con⁃trol group.As the healing time extended,Sharpey’s like fibers continue to increase in both groups and significant differences were observed in the histological morphology(Buark grades)between the two groups(P<0.05).Conclusion Autologous peripheral blood-derived L-PRF can promote early healing of autologous tendon to bone in the extra-articular bone tunnel of model rabbit.
leukocyte-and platelet-rich fibrin,extra-articular,tendon bone healing
2016.09.03
安徽省自然科学基金(编号:1208085MH157)
徐斌,Email:youchen100@126.com

