PI3K/Akt信号通路在磷酸三钙磨损颗粒诱导小鼠颅骨溶解中的作用
张雨笛严明俞立虹章思烨诸葛建颖郭健恒丁樑张云
1绍兴文理学院医学院(浙江绍兴312000)2杭州电子科技大学生命信息与仪器工程学院(浙江杭州310018)
PI3K/Akt信号通路在磷酸三钙磨损颗粒诱导小鼠颅骨溶解中的作用
张雨笛1严明2俞立虹1章思烨1诸葛建颖1郭健恒1丁樑1张云1
1绍兴文理学院医学院(浙江绍兴312000)2杭州电子科技大学生命信息与仪器工程学院(浙江杭州310018)
目的:研究PI3K/Akt信号通路在磷酸三钙(tricalcium phosphate,TCP)磨损颗粒诱导小鼠颅骨溶解中的作用。方法:36只雄性ICR小鼠随机分为假手术组(Sham)、模型组(TCP)和LY294002处理组,每组12只。取TCP磨损颗粒30 mg置于颅顶后缝合皮肤构建小鼠颅骨溶解模型。LY294002处理组小鼠于术后第2天颅顶局部注射PI3K抑制剂LY294002(5 mg·kg-1),每周3次;假手术组小鼠颅骨顶仅注射生理盐水,注射时间与LY294002一致。2周后处死动物取骨膜和颅骨。通过Micro-CT分析小鼠颅骨溶解情况、骨密度(bone mineral density,BMD)和骨矿含量(bone mineral content,BMC);HE染色观察颅骨表面炎症反应及破骨细胞(osteoclasts)形成;Real-time PCR检测骨组织中破骨细胞生成标志物抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)、组织蛋白酶K(cathepsin K,CstK)、核因子κB受体活化因子配体(receptor activator for nuclear factor-κB kigand,RANKL)和c-Fos的mRNA水平;ELISA检测骨膜中炎症因子TNF-α、IL-1β和IL-6等水平;Western Blotting检测颅骨组织Akt、p-AktSer473和p-AktThr308等蛋白表达变化。结果:Micro-CT和组织形态学分析结果显示,PI3K抑制剂LY294002能明显抑制TCP磨损颗粒诱导小鼠颅骨溶解和破骨细胞形成(P<0.05),增加BMD和BMC含量(P<0.05);下调破骨细胞生成标志物TRAP、CstK、RANKL和c-Fos等mRNA水平(P<0.05),并抑制炎症因子TNF-α、IL-1β和IL-6的释放(P<0.05);而且LY294002显著减弱TCP磨损颗粒诱导的Akt信号蛋白活化,导致p-AktS⁃er473和p-AktThr308等蛋白表达明显下调(P<0.05)。结论:PI3K/Akt信号通路参与调控TCP磨损颗粒诱导的假体周围骨溶解,可作为假体周围骨溶解和关节松动的治疗靶标。
磷酸三钙(TCP)磨损颗粒;骨溶解;破骨细胞;PI3K/Akt信号通路
人工关节置换是目前治疗严重关节疾患、重建关节功能的重要手段,但是长期使用关节假体,尤其是髋关节和膝关节假体晚期容易发生无菌性松动,导致人工关节置换失败和关节翻修。新近假体翻修术回顾性研究发现聚乙烯、金属钛和陶瓷等关节假体经过长期磨损产生大量的磨损颗粒,这些颗粒可激活假体周围组织细胞释放TNF-α、IL-1β和IL-6等炎症因子[1,2],诱导破骨细胞分化、活化,最终导致骨溶解和关节假体松动[3]。因此,磨损颗粒诱导骨溶解是关节假体晚期松动、关节置换失败和二次翻修的主要原因,抑制假体周围骨溶解是减少关节松动和置换失败的重要手段。虽然对骨溶解已有较多研究,但是对其发生确切机制尚不明确。本研究采用磷酸三钙(tricalcium phosphate,TCP)颗粒诱导小鼠颅骨溶解模型,观察PI3K的特异性抑制剂LY294002对TCP磨损颗粒诱导假体周围骨溶解的影响,探讨PI3K/Akt信号通路参与调控机理,为临床防治骨溶解和关节松动提供新的治疗靶标和实验基础。
1 材料与方法
1.1 实验动物及分组
6周龄SPF级雄性ICR小鼠36只,体重18~22 g,购于浙江省医学科学院实验动物中心,许可证号:SCXK(浙)2014-0001。所有实验动物对待和照顾严格遵循《实验动物管理条例》,并经过绍兴文理学院医学院实验动物伦理委员会许可。实验前动物适应性饲养1周,环境温度22°C~24°C,湿度50%~70%,动物自由进食进水,自然昼夜节律光照。
将36只小鼠随机分为假手术组(Sham)、模型组(TCP)和LY294002处理组,每组12只。腹腔注射3%戊巴比妥钠麻醉小鼠后,无菌条件下取颅顶正中矢状切口,长约0.8 cm。分离皮下组织,显露出1 cm×1 cm颅骨区域。其中假手术组进行原位缝合,其余2组取TCP磨损颗粒30 mg置于颅顶后缝合皮肤[4]。LY294002组小鼠于术后第2天颅顶局部注射LY294002(5 mg·kg-1),每周3次。假手术组小鼠颅顶注射生理盐水,注射时间与LY294002一致。2周后处死小鼠取骨膜和颅骨(以正中矢状缝为中心的方形区域)。
1.2 主要试剂
TCP磨损颗粒(浙江大学化学系);鲎试剂(上海吴昊经贸有限公司);TNF-α、IL-1β和IL-6 ELISA试剂盒和ECL化学发光检测试剂盒(杭州联科生物技术有限公司);LY294002、Trizol和RIPA裂解液(碧云天生物试剂有限公司);TRAP、CstK、RANKL和c-Fos引物(上海生工生物工程公司);兔源Akt抗体、兔源p-AktSer73抗体、兔源p-AktThr308抗体和小鼠源β-actin抗体(美国Cell Signaling公司);PVDF膜(美国Millipore公司)。
1.3 T T C C P P磨损颗粒的准备
TCP磨损颗粒经电镜扫描显示TCP磨损颗粒平均粒径为1.997μm(90%<3.2μm),颗粒容易发生[4]。将TCP磨损颗粒置于70%乙醇溶液,室温震荡浸泡48 h后去除乙醇。干燥后用30 mg玻璃纸分装,将颗粒置于250°C恒温箱中3 h。采用鲎试剂法检测TCP磨损颗粒表面内毒素含量小于该试剂盒的最低检测线,即排除内毒素污染。
1.4 测试指标与方法
1.4.1 Micr r o o--C C T T扫描与三维重建[[55]]
各组小鼠颅骨经4%多聚甲醛固定48 h后,行Mi⁃cro-CT扫描(条件为电压59 kV、电流167μA、深度16 bit、曝光时间295 ms,分辨率为9.18μm),选颅骨相同位置的感兴趣区域(region of interest,ROI)进行三维重建。应用Micview V2.1.2三维重建和ABA专用骨骼分析软件定量分析骨溶解面积、骨密度(bone mineral densi⁃ty,BMD)和骨矿含量(bone mineral content,BMC)。
1.4.2 组织学观察[[66]]
各组颅骨经4%多聚甲醛固定48 h,流水冲洗0.5 h,然后经10%EDTA(pH 7.4)脱钙2周,每3天更换1次脱钙液。梯度乙醇脱水,石蜡包埋后,颅骨切片厚度为7μm。在梯度乙醇中脱水,二甲苯脱蜡后行HE染色,置于IX70显微镜观察TCP磨损颗粒周围破骨细胞生成情况。利用Image Pro-Plus 5.0(美国Media Cybernet⁃ics公司)计算正中矢状缝区域三核及以上破骨细胞数(osteoclasts number)。
1.4.3 Real-tim m e e P P C C R R[[77]]
检测骨组织中破骨细胞生成标志物抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)、组织蛋白酶K(cathepsin K,CstK)、核因子κB受体活化因子配体(receptor activator for nuclear factor-κB kigand,RANKL)和c-Fos的mRNA水平。每组随机取3只小鼠,取等重量颅骨剪成1mm3碎片;加入液氮研磨成粉末后加Trizol(1 mL)按试剂盒说明书提取总RNA,测定260 nm/280 nm吸光比值在1.8~2.0之间。逆转录合成cDNA;以GADPH为内参,对目的基因进行PCR扩增(7900HT Fast Real-time PCR,美国应用系统公司),检测模板Ct值进行相对定量,引物序列见表1。

表1 各靶基因及其引物序列
每组随机选取3只小鼠,取等重量颅骨骨膜、剪碎后加入RIPA裂解液200μL,冰上裂解30 min。于4° C经12000r/min离心15 min后收集上清液。每孔加入50μL上清液,按TNF-α、IL-1β和IL-6等ELISA试剂盒的操作说明书检测骨膜中上述炎症因子的变化。
1.4.5 骨组织蛋白的提取与Western Blot t t t i i n n g g检测蛋白表达
每组随机选取3只小鼠,取等重量颅骨于研钵内液氮环境下研磨成粉末,置于EP管中。加入RIPA裂解液800μL冰上裂解30 min,于4°C经12000 r/ming离心15 min后收集取上清液。采用BCA法检测各组总蛋白浓度。加入上样缓冲液后煮沸10 min,冷却后每孔上样30μg蛋白,进行15%SDS-PAGE电泳,电泳完成后将蛋白转移到PVDF膜上,用5%脱脂牛奶常温封闭2 h,分别加入Akt(1:1000)、p-AktSer473(1:1000)、p-AktThr308(1:1000)及β-actin(1:1000)等抗体后置于4°C孵育过夜。次日用TBST洗涤3次后加入HRP标记的二抗室温孵育2 h,TBST清洗3次后加入ECL显色液;通过凝胶成像系统扫描分析各蛋白表达的变化。
1.5 统计学处理
数据均采用平均数±标准差表示,采用SPSS 17.0统计软件进行统计学分析,其中多个样本间比较采用完全随机设计的单因素方差分析(ANOVA),两两比较采用最小显著性差异法(LSD法)。P<0.05为差异具有统计学意义。
2 结果
2.1 Micr r o o--C C T T分析
Micro-CT图像显示,与假手术组比较,模型组小鼠颅骨正中矢状缝发生明显骨溶解,而LY294002组骨溶解程度明显减轻(图1,P<0.05)。定量分析结果表明模型组小鼠颅骨BMD和BMC显著降低,分别减少为假手术组的46.9%±5.1%和43.4%±3.7%;颅顶局部注射LY294002能明显增加BMD和BMC,分别为模型组的1.91±0.07倍和1.62±0.04倍(图2,P<0.05)。

图1 M icro-CT扫描图
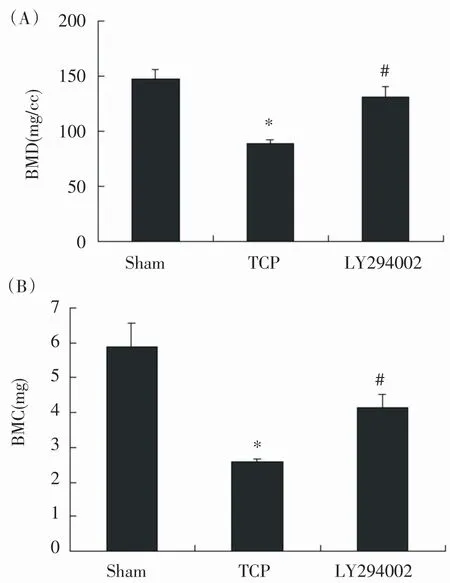
图2 M icro-CT分析小鼠颅骨参数的变化(n=4)
2.2 H H E E染色结果
HE染色结果显示:假手术组破骨细胞数仅为4.2 ±0.7个,而TCP磨损颗粒植入后可诱导大量破骨细胞生成,其破骨细胞数增加为37.4±4.7个,是假手术组的4.78±0.07倍(P<0.05)。而LY294002处理后显著抑制破骨细胞生成,其破骨细胞数减少为13.6±2.0个(P<0.05)(图3)。

图3 LY 294002阻止TCP磨损颗粒诱导假体周围破骨细胞生成(n=3)
2.3 Real-tim m e e P P C C R R检测结果
与假手术组比较,模型组小鼠颅骨组织中破骨细胞生成标志物TRAP、CstK、RANKL和c-Fos等mRNA水平显著增加(表2,P<0.05)。LY294002处理后骨组织中TRAP、CstK、RANKL和c-Fos等mRNA水平明显下调,分别减少为模型组的46.8%±6.3%、48.8%± 4.2%、30.3%±3.6%和29.6%±1.9%(P<0.05)。

表2 LY 294002下调假体周围破骨细胞生成标志物m RNA水平(n=3)
2.4 E E L L I I S S A A检测结果
与假手术组比较,模型组小鼠颅骨骨膜炎性因子TNF-α、IL-6和IL-1β水平均明显升高,分别增加为假手术组的1.79±0.13倍、2.12±0.24倍和4.92±0.40倍(表3,P<0.05)。与模型组比较,LY294002组骨膜中TNF-α、IL-6和IL-1β含量水平显著减少,仅为模型组的58.5%±6.1%、42.6%±2.8%和22.4%±2.0%(P<0.05)。

表3 LY294002抑制TCP磨损颗粒诱导的TNF-α、IL-6和IL-1β释放(n=4)
2.5 Western Blot t t t i i n n g g检测结果
对小鼠颅骨组织中Akt效应分子即其磷酸化形式(p-Akt)水平检测结果显示:与假手术组比较,模型组骨组织中Akt蛋白发生活化,表现为p-AktThr308和p-AktSer473蛋白表达明显升高,并呈一定的时间依赖性(图4,P<0.05)。与模型组比较,LY294002处理能显著减弱TCP磨损颗粒诱导的Akt活化,造成p-AktThr308和p-AktSer473表达明显降低,分别减少为模型组的23.6%±3.1%和28.9%±1.8%(图5,P<0.05)。提示:TCP磨损颗粒诱导小鼠颅骨溶解过程中PI3K/Akt信号通路被激活。

图4 TCP磨损颗粒诱导假体周围骨组织Akt信号蛋白活化(n=4)
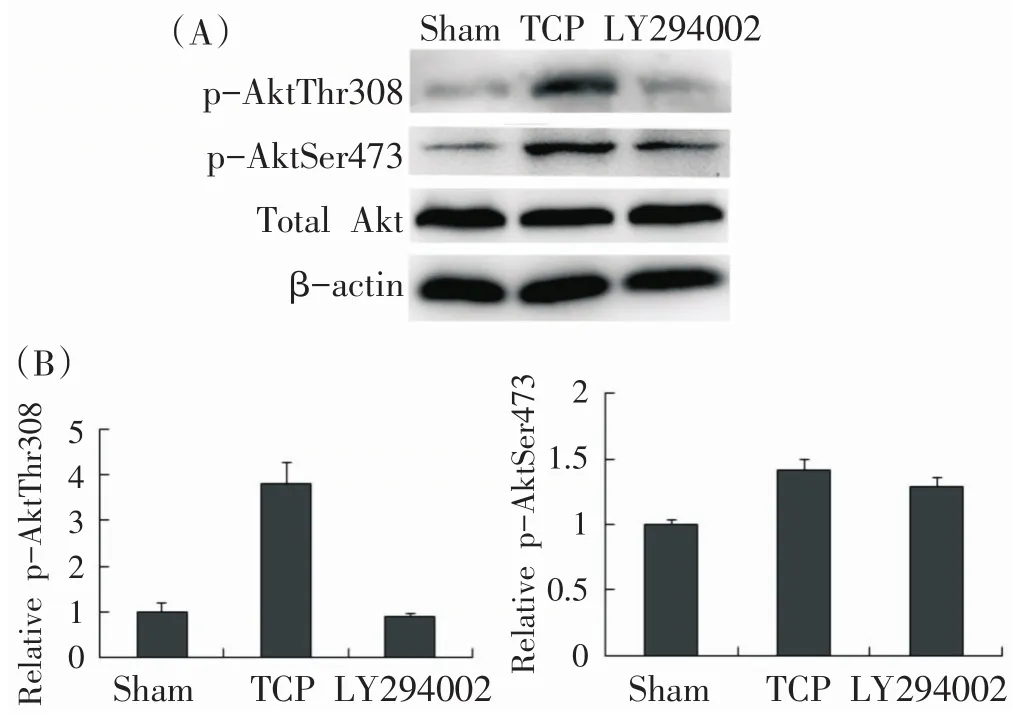
图5 LY294002减弱TCP磨损颗粒诱导的Akt蛋白活化(n=4)
3 讨论
磨损颗粒诱导的假体周围骨溶解是导致假体松动和关节置换失败的主要原因之一。破骨细胞参与调控磨损颗粒介导的骨溶解,因此,抑制破骨细胞的活化和骨溶解是减少假体松动的重要手段。目前有关骨溶解发生机制研究多集中于NF-κB、MAPK和JAK/STAT等信号通路,而对于PI3K/Akt通路在磨损颗粒诱导的假体周围骨溶解中的作用研究很少。本研究通过构建TCP磨损颗粒诱导小鼠颅骨溶解模型,通过Micro-CT分析和H.E.染色证实TCP磨损颗粒可诱导小鼠颅骨发生明显的骨溶解和大量破骨细胞生成以及BMD和BMC显著降低。而颅顶局部注射PI3K抑制剂LY294002能显著抑制假体周围骨溶解、破骨细胞生成及其活性,减少炎症因子TNF-α、IL-1β和IL-6的释放,并减弱TCP磨损颗粒诱导的Akt活化,表明PI3K/ Akt通路参与调控CP颗粒诱导的小鼠颅骨溶解和破骨细胞生成。
有研究表明磨损颗粒可诱导假体周围组织细胞生成大量TNF-α、IL-1β和IL-6等炎症因子[1,2],后者能诱导破骨细胞分化、活化及存活,最终造成骨溶解[3]。因此,炎症是磨损颗粒诱导假体周围骨溶解的重要因素之一[2]。本研究应用ELISA法检测到TCP磨损颗粒可诱导TNF-α、IL-1β和IL-6等炎症因子的释放,增加骨膜中TNF-α、IL-1β和IL-6水平,上调RANKL表达[8],促进破骨细胞生成和骨吸收,与Lange[9,10]研究结果一致。LY294002处理后能显著抑制TCP磨损颗粒诱导的上述炎症因子释放,阻断破骨细胞生成和骨溶解。因此,PI3K/Akt信号通路在TCP磨损颗粒诱导炎症因子释放过程中发挥重要的作用。
有研究认为炎症因子不仅能直接或间接调节破骨细胞活性和骨吸收,而且其所触发的下游PI3K/Akt信号通路也参与调控破骨细胞活化、成熟及迁移[11,12],是炎症性骨代谢疾病一个重要的治疗靶点。炎症因子可通过与受体结合并活化PI3K,后者通过PI3K依赖的激酶1(PDK1)激活其效应分子Akt,使之发生活化(即磷酸化),促进破骨细胞存活与骨吸收[13]。Huang[14]等利用siRNA干扰PI3K的p110β基因,发现下调该基因可显著减少磨损颗粒诱导的TNF-α释放和骨溶解。Green⁃field[15]等研究小组也报道敲除PI3Kγ基因能减少金属钛和聚乙烯磨损颗粒诱导的小鼠颅骨溶解反应。本研究结果显示TCP磨损颗粒植入小鼠颅顶后骨组织Akt信号分子发生活化,导致p-AktSer473和p-AktThr308蛋白表达水平明显增加;而LY294002干预能明显抑制上述Akt的活化,与Huang[14]和Greenfield[15]报道基本一致。
4 结论
PI3K/Akt信号通路参与调控TCP磨损颗粒诱导的假体周围骨溶解,抑制该通路可减少假体周围骨溶解和关节松动,可作为假体周围骨溶解和关节松动新的干预和治疗靶点。
[1]Dumbleton JH,Manley MT,Edidin AA.A literature re⁃view of the association between wear rate and osteolysis in total hip arthroplasty[J].J Arthroplasty,2002,17(5):649–661.
[2]Stea S,Visentin M,Granchi D,et al.Cytokines and oste⁃olysis around total hip prostheses[J].Cytokine,2000,12(10):1575–1579.
[3]Katsuyama E,Miyamoto H,Kobayashi T,et al.Interleu⁃kin-1 receptor-associated kinase-4(IRAK4)promotes in⁃flammatory osteolysis by activating osteoclasts and inhibit⁃ing formation of foreign body giant cells[J].J Biol Chem,2015,290(2):716-726.
[4]Zhang Y,Yan M,Yu A,et al.Inhibitory effects ofβ-tri⁃calciumphosphate wear particles on osteocytes via apoptot⁃ic response and Akt inactivation[J].Toxicology,2012,297(1-3):57-67.
[5]Langlois J,Zaoui A,Bichara DA,et al.Biological reac⁃tion to polyethylene particles in a murine calvarial mod⁃el is highly influenced by age[J].J Orthop Res,2016,34(4):574-580.
[6]李丽辉,杨杰,董洁琼,等.运动对去卵巢骨质疏松大鼠OPG、RANKL表达的影响[J].中国运动医学杂志,2013,32(11):991-996.
[7]李欣,丁树哲,卢健,等.耐力训练对衰老小鼠心肌Akt/ mTOR信号通路的影响[J].中国运动医学杂志,2010,1:38-41.
[8]Wang Z,Huang Z,Gan J,et al.The fibroblast expression of RANKL in CoCrMo-particle-induced osteolysis is me⁃diated by ER stress and XBP1s[J].Acta Biomater,2015, 24:352-360.
[9]Lange T,Schilling AF,Peters F,et al.Size dependent in⁃duction of proinflammatory cytokines and cytotoxicity of particulate beta-tricalciumphosphate in vitro[J].Biomate⁃rials,2011,32(17):4067-4075.
[10]Lange T,Schilling AF,Peters F,et al.Proinflammatory and osteoclastogenic effects of beta-tricalciumphosphate and hydroxyapatiteparticles on human mononuclear cells in vitro[J].Biomaterials,2009,30(29):5312-5318.
[11]Korkmaz Y,Baumann MA,Schröder H,et al.Localization of the NO-cGMP signaling pathway molecules,NOS III-phosphorylation sites,ERK1/2,and Akt/PKB in osteo⁃clasts[J].J Periodontol,2004,75(8):1119-1125.
[12]Hsu YH,Wu CY,Hsing CH,et al.Anti-IL-20 monoclo⁃nal antibody suppresses prostate cancer growth and bone osteolysis in murine models[J].PLoS One,2015,10(10):e0139871-e0139871.
[13]Cao H,Zhu K,Qiu L,et al.Critical role of AKT protein in myeloma-induced osteoclast formation and osteolysis [J].J Biol Chem,2013,288(42):30399-30410.
[14]Huang JB,Ding Y,Huang DS,et al.RNA interference targeting p110βreduces tumor necrosis factor-alpha pro⁃duction in cellular response to wear particles in vitro and osteolysis in vivo[J].Inflammation,2013,36:1041-1054.
[15]Greenfield EM,Tatro JM,Smith MV,et al.PI3Kγdele⁃tion reduces variability in the in vivo osteolytic response induced by orthopaedic wear particles[J].J Orthop Res,2011,29(11):1649-1653.
Roleof PI3K/Akt Signaling Pathway in the TCPWear Particles-induced CalvarialOsteolysis in M ice M odel
Zhang Yudi1,Yan Ming2,Yu Lihong1,Zhang Siye1,Zhuge Jianying1,Guo Jianheng1,Ding Liang1,Zhang Yun1
1College ofMedicine,Shaoxing University,Shaoxing 312000,China 2DepartmentofBiomedical Engineering,College ofLife Information Scienceand InstrumentEngineering,Hangzhou 310018,China
Zhang Yun,Email:zhangyunbme.happy@163.com
ObjectiveTo explore the role of the PI3K/Akt signaling pathway in the calvarial osteoly⁃sis induced by TCP wear particles in mice model.MethodsThirty-six male ICR mice were randomly divided into a sham group(n=12),TCP group(n=12)and a LY294002-treated group(n=12).A mu⁃rine calvarial model of osteolysis was established through implanting 30 mg of TCP particles onto the surface of bilateral parietal bones following the removal of the periosteum.On the second postoperative day,LY294002(5 mg·kg-1)was locally injected to the calvarium under the periosteum three times a week;mice in the sham group received local injection of normal saline(N.S.)in the calvarium,and theinjection time was consistent with that of LY294002.Two weeks later,the calvaria and periostea were obtained after the mice were executed.The calvarial osteolysis,bone mineral density(BMD)and bone mineral content(BMC)were analyzed using Micro-CT,Hematoxylin-Eosin(HE)staining was conducted to observe the inflammatrory response and formation of osteoclasts.Real-time PCR was applied to de⁃tect the mRNA level of tartrate-resistant acid phosphatase(TRAP),the marker of osteoclasts forma⁃tion,cathepsin K(CstK),receptor activator for nuclear factor-κB kigand(RANKL)and c-Fos.The re⁃lease of tumor necrosis factor-α(TNF-α),interleukin-6(IL-6)and IL-1βwere measured using en⁃zyme-linked immumsorbent assay(ELISA).ResultsMicro-CT and histological analysis indicated that LY294002,the specific inhibitor of PI3K,significantly prevented TCP wear particles-induced osteolysis and osteoclastogenesis,and increased BMD and BMC in the calvaria of mice.Real-time PCR data re⁃vealed LY294002 significantly suppressed the increase in mRNA level of osteoclastogenic genes such as TRAP,CstK,RANKL and c-Fos in the calvaria of TCP wear particles-implanted group.ELISA as⁃say showed that TCP wear particles-induced release of TNF-α,IL-1βand IL-6 was significantly inhib⁃ited by LY294002 treatment.Furthermore,LY294002 significantly attenuated TCP wear particles-trig⁃gered activation of Akt,and down-regulated the level of p-AktSer473 and p-AktThr308.Conclusion PI3K/Akt signaling pathway contributes to TCP wear particle-induced osteolysis,and can be developed as a new therapeutic target for the prevention and treatment of bone destruction diseases caused by wear debris.
TCP wear particles,osteolysis,osteoclasts,PI3K/Akt signaling pathway
2016.07.08
浙江省自然科学基金(No.LY17H060007;No.LY15H180012)
张云,Email:zhangyunbme.happy@163.com

