中华蜜蜂Takeout(AcTO1)基因的克隆和表达分析
陈艺杰解幸承吴 双吴珍红李显春,5缪晓青,3
(1福建农林大学蜂学学院;2福建农林大学蜂疗研究所;3天然生物毒素国家地方联合工程实验室,福州350002;4中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193;5 Department of Entomology and BIO5 Institute,The University of Arizona,Tucson,AZ 85721,USA)
中华蜜蜂Takeout(AcTO1)基因的克隆和表达分析
陈艺杰1,2,4解幸承4吴 双1,2,4吴珍红1,2李显春4,5缪晓青1,2,3
(1福建农林大学蜂学学院;2福建农林大学蜂疗研究所;3天然生物毒素国家地方联合工程实验室,福州350002;4中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193;5 Department of Entomology and BIO5 Institute,The University of Arizona,Tucson,AZ 85721,USA)
Takeout(TO)是一种昆虫节律性调控输出基因,广泛分布于涉及到化学感受和营养功能的相关组织。TO基因主要参与昆虫的生长发育、行为调节及多种生理代谢过程。为探究TO基因是否参与社会性昆虫的劳动分工,我们克隆并分析了中华蜜蜂Apis cerana TO基因的编码框序列,测定了该基因在哺育蜂和采集蜂各个组织部位的mRNA表达水平,旨在为深入研究该基因的功能提供参考。本研究通过RT-PCR的方法首次克隆获得AcTO1基因的cDNA序列,利用生物信息学软件分析了该基因的核苷酸序列和氨基酸序列,并利用荧光定量PCR(qPCR)技术检测了该基因在中华蜜蜂3种采集蜂(18日龄正常采集蜂、22日龄正常采集蜂和7日龄提前采集蜂)和2种哺育蜂(7日龄正常哺育蜂和22日龄超龄哺育蜂)头部、胸部和腹部的表达量。本研究克隆获得的中华蜜蜂TO(命名为AcTO1)基因的cDNA序列长度为1058 bp,开放阅读框(ORF)长度为738 bp,编码246个氨基酸,预测蛋白分子量为27.09 kDa,理论等电点为8.40。AcTO1蛋白的信号肽位于1-17位氨基酸,无跨膜结构,属于分泌型蛋白。AcTO1的氨基酸序列种含有一个JHBP超家族保守结构域。qPCR结果显示,AcTO1在3种采集蜂和2种哺育蜂的各组织均有表达,其中表达量由高到低依次为头部、胸部、腹部。AcTO1基因的表达具有组织依赖型,主要表达于头部,且所有采集蜂的头部表达量均高于哺育蜂,由此说明该基因可能参与蜜蜂的劳动分工。本研究克隆了中华蜜蜂takeout基因的全长cDNA序列,并分析了该基因的序列特征和表达谱,结果表明该基因可能参与调控蜜蜂的劳动分工。
蜜蜂;劳动分工;takeout基因;基因克隆
Takeout(TO) 蛋白最初在果蝇 drosophila melanogaster中被鉴定并命名[1]。随后,许多研究发现这类基因普遍存在于多种昆虫中,并在昆虫的生命活动中发挥着非常重要的作用。So等[2]研究发现这类基因可能与果蝇摄食行为的节律调控有关。Benito等[3]报道TO基因作为节律输出基因,其表达会随着节律转录因子PAR蛋白1(Pdp 1ε)水平的变化而变化,并发现低水平的Pdp1ε就可以激活TO基因的表达。另外,TO基因主要在果蝇的消化系统和触角等摄食有关的组织中表达,而且还可以通过饥饿诱导其表达,从而加强觅食活动[1,4]。Saito等[5]发现TO基因在桑蚕Bombyx mori中是作为一种转运信号分子参与调节营养代谢及行为活动。TO基因有助于冈比亚按蚊Anopheles gambiae对食物质量及营养状况做出不同反应[6]。TO基因可能调节埃及伊蚊Aedes aegypti对宿主或者食物的反应[7]。因此,TO基因在昆虫调控生物节律、摄食和营养平衡中起着重要作用。
蜜蜂是一种典型的高度社会化昆虫,该群体存在着合理的劳动分工[8]。例如,蜂王和雄蜂共同负责繁殖,而工蜂在巢内的职责会随着日龄的改变而变化。一般而言,刚出房后的工蜂主要负责清理巢房、泌蜡造脾、饲喂蜂王和小幼虫等巢内工作。此后,随着年龄的增长,工蜂主要在巢外承担采集花蜜、花粉、水、树胶以及巢门防卫等工作[9]。前期未发表的中华蜜蜂哺育蜂和采集蜂头部转录组测序结果表明,工蜂采集蜂TO基因的表达量显著高于哺育蜂。为探究TO基因在蜜蜂中的表达规律和相关生物学功能,本研究以中华蜜蜂Apis cerana为试验材料,基于转录组测序拼接结果,利用RT-PCR技术首次克隆获得中华蜜蜂AcTO1基因的cDNA序列,对该基因的核苷酸序列和氨基酸序列进行了分析,并利用qRT-PCR技术检测了该基因的时空表达谱,以期能为进一步阐述该基因的分子功能奠定理论基础。
1 材料与方法
1.1 供试昆虫
中华蜜蜂样本于2014年4~6月份采自福建省福州市北峰神蜂科技中蜂养蜂场。
1.1.1 蜜蜂的标记:选择群势较强、健康无病的正常蜂群,从中抽出封盖子较多的子脾,应保证封盖子将会在2日内全部羽化出房,置于人工培养箱恒温培养(34℃)。次日,选取羽化出房后的蜜蜂约4000只,采用无味无毒的油漆在背部标记后放回蜂群。
1.1.2 蜂群的组织:本试验需要组织2种蜂群,分别为正常蜂群和同龄群,每种蜂群均需3次生物学重复。正常蜂群:选择适宜群势大小的蜂群,蜂群中包含正常发育而来的哺育蜂、采集蜂和正在产卵的蜂王。同龄群:根据Whitfield等[10]的方法,将标记后的蜜蜂(至少3000只)放入准备好的观察箱,箱内有一只正在产卵的蜂王(提前育王)和一个含有蜂蜜和花粉的巢脾。在实验前阶段,做好蜂箱的保暖措施。
1.1.3 样品的收集:为排除年龄和发育相关因素的影响,鉴于蜜蜂的劳动分工随日龄变化而变化的特性,采样方法如下:在正常蜂群中,选取7日龄正常哺育蜂(YN:Age-matched/young nurses)、18日龄和 22日龄的正常采集蜂(OF:Age-matched/old foragers)。在同龄群中,选取7日龄提前发育的采集蜂(YF:Young/precocious foragers)和 22 日龄超龄哺育蜂(ON:Old/over-aged nurses)作为样品采集标准。哺育蜂是经油漆标记的正在饲喂蜂王或小幼虫的蜜蜂。采集蜂是经油漆标记的携带花粉归来的蜜蜂。各类型蜜蜂每日龄均取样30只左右,立即置于液氮中进行瞬时冷冻,随后转入-80℃冰箱冷冻保存备用。
1.2 总RNA的提取及cDNA第一链的合成
分别取上述3种采集蜂(18日龄正常采集蜂、22日龄正常采集蜂和7日龄提前采集蜂)和2种哺育蜂(7日龄正常哺育蜂和22日龄超龄哺育蜂)相应的头部、胸部和腹部3个组织,按照Wang等[11]人的方法提取总RNA,并合成cDNA第一链。
1.3 引物设计
以本课题组前期所获得的中华蜜蜂头部转录组测序数据库和NCBI数据库为基础,通过Blastn序列比对得到目的基因片段。使用Primer Premier 5.0软件在保守区设计引物扩增AcTO1基因的cDNA序列。根据克隆得到的序列预测该基因的开放阅读框(ORF),并在编码区用Beacon Designer软件设计特异性引物用于荧光定量PCR,其中内参基因选取β-actin和Rps18基因。所需的引物序列信息详见表1,均由北京华大基因科技有限公司合成。
1.4 AcTO1基因的cDNA克隆
以反转录后的中华蜜蜂cDNA样品为模板,利用表1中的克隆引物扩增AcTO1基因。PCR反应体系(20 μl) 如下:Ex Taq 0.1 μl,10×buffer 2 μl,dNTP 1.6 μl,正反向引物各 1 μl,cDNA 模板 1 μl,RNase-Free Water 13.3 μl。反应程序设置如下:95℃预变性 3 min;95℃变性 30 s,56℃退火 30 s,72℃延伸 30 s,共计 30个循环;72℃终延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测后,切取目的片段进行回收纯化,并将回收产物连接至pGM-T载体,随后转化至DH5α感受态细胞。经蓝白斑筛选鉴定,选取阳性克隆扩大培养,将菌液送至北京华大基因科技有限公司测序。

表1 本试验所用引物
1.5 AcTO1基因的序列分析
利 用 NCBI Blastn(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具进行核酸序列的同源性分析;利用在线软件 ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框(ORF);氨基酸序列通过Lasergene EditSeq工具预测。保守区分析利用在线软件 NCBI Conserved Domains Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。 利 用 Prot-Param(http://web.expasy.org/protparam/)预测蛋白的分子量和等电点等理化性质;利用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列;利用TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构;利用ProtScale(http://web.expasy.org/cgibin/protscale/protscale.pl利用)进行疏水性分析;利用SMART(http://smart.embl-heidelberg.de/)分析功能结构域;利用 PSORT II(http://psort.hgc.jp/form2.html)和LocTree 3(https://rostlab.org/services/loctree3/)进行亚细胞定位。
1.6 荧光定量PCR反应
以各样品的cDNA为模板,使用SuperReal PreMix Plus(SYBR Green)试剂进行荧光定量PCR。反应体系为20 μl:2×SuperReal PreMix Plus 10 μl,50×RO×Reference Dye△ 0.4 μl,正反向引物各 0.5 μl,cDNA 模板 2 μl,RNase Free Water 6.5 μl。反应条件:95℃预变性 15 min;95℃ 10 sec,60℃ 20 sec,72℃ 32 sec,共 40 个循环;最后为熔解曲线分析。每个样品均取3次生物学重复。
1.7 数据统计与分析
荧光定量结果用ABI 7500 Software v2.0.5软件进行分析处理。根据标准曲线及荧光曲线的Ct值,采用2-△△Ct法进行数据分析[12]。采用SPSS17.0软件进行单因素方差分析,选用Duncan's法做显著性分析,显著水平为P=0.05。所得结果均以平均数±标准误(Mean±SE)表示,并利用GraphPad Prism 5软件绘图。
2 结果
2.1 AcTO1基因的cDNA克隆与序列分析
以中华蜜蜂cDNA样品为模板进行PCR扩增,得到的目的产物片段大小为1058 bp(图1),这与预期结果一致,并将该基因提交至GenBank,登录号为KY792889。
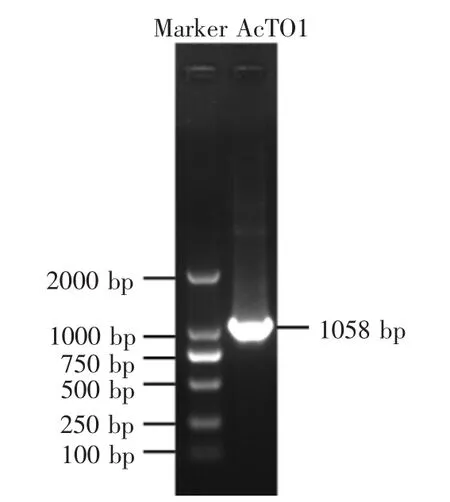
图1 PCR产物电泳分析
采用ORF Finder对所获得的序列分析表明,中华蜜蜂AcTO1基因的完整开放阅读框(ORF)为738 bp,共编码246个氨基酸。AcTO1蛋白分子式为C1219H1986N328O350S8,预测分子量为27.09 kDa,理论等电点为8.40,且该蛋白为碱性蛋白。在组成AcTO1蛋白的18种氨基酸中,亮氨酸(Lys)所占的比例最高,达到13.9%;带正电荷氨基酸总数(Arg+Lys)为24,带负电荷氨基酸总数(Asp+Glu)为26;总平均疏水系数(GRAVY)为 0.167,不稳定系数为36.79,脂溶系数为1115.67,说明该蛋白比较稳定。
利用SignalP 4.1对中华蜜蜂AcTO1蛋白的信号肽进行预测,结果显示信号肽均于1-17位氨基酸,剪切位点位于17位和18位氨基酸之间,无跨膜结构。在线NCBI结构域分析结果表明,AcTO1编码产物的第7-244位氨基酸之间存在一个JHBP superfamily的保守结构区域。疏水性分析显示,AcTO1的氨基酸序列中,第32位氨基酸Score值最低为-2.178,第8位氨基酸最高为3.133,平均疏水性为0.167。亚细胞定位结果表明,AcTO1蛋白可能存在于细胞外(22.2%)、液泡(11.1%)、内质网(33.3%)、线粒体(22.2%)和细胞核(11.1%)中,主要集中在分泌途径上,说明该蛋白属于分泌型蛋白。
2.2 中华蜜蜂AcTO1基因的mRNA时空表达谱分析
通过实时荧光定量PCR技术分析TO基因在中华蜜蜂2种哺育蜂(正常哺育蜂和超龄哺育蜂)和3种采集蜂(2种不同日龄的正常采集蜂和提前采集蜂)不同组织中mRNA水平的表达差异,结果如图2所示。TO基因在中华蜜蜂不同哺育蜂和采集蜂的头部、胸部和腹部中均有表达。但是,所有采集蜂和哺育蜂头部中的表达量均极显著高于其它组织(P<0.01)。因此我们将5种工蜂的头部组织的表达量进一步分析,结果发现3种正常采集蜂的头部表达量均高于2种哺育蜂,其中18和22日龄的采集蜂的头部表达量均显著高于7日龄正常哺育蜂和22日龄超龄哺育蜂。
3 讨论
Takeout蛋白家族在昆虫中被广泛研究,Sarov-Blat等[1]通过cDNA差减杂交技术首次鉴定得到了DmTO基因,并证明了该基因是果蝇生物节律和取食与饥饿之间的直接分子联系。随后,发现了这种蛋白普遍存在于昆虫中,并具有多种重要的功能。目前,关于TO基因的研究主要集中在果蝇、家蚕、白蚁等模式昆虫,而在蜜蜂中很少有相关报道[2,3,5]。为探究TO基因是否参与社会性昆虫的劳动分工,本文克隆并分析了中华蜜蜂Apis cerana TO基因的编码框序列,测定了该基因在哺育蜂和采集蜂各组织部位的mRNA表达水平,旨在为深入研究该基因的功能提供参考。

图2 takeout基因在中华蜜蜂不同发育阶段、不同组织中的表达量
分泌蛋白是指在细胞质核糖体上合成,并分泌到细胞外发挥作用的一类蛋白质。几乎所有的分泌蛋白都具有信号肽,为N端的15~35个氨基酸的疏水性序列,在蛋白的内质网-高尔基体-质膜分泌过程中具有重要作用[13]。信号肽是检测蛋白质是否为分泌蛋白的一个重要指标[14]。张松斗等[15]发现棉铃虫TO蛋白序列含有23个氨基酸的信号肽。通过序列分析发现中华蜜蜂TO蛋白的N末端具有17个氨基酸的信号肽序列。这些结果表明不同物种的TO蛋白均属于分泌蛋白。亚细胞定位软件PSORT II和LocTree 3预测结果也显示AcTO1蛋白主要集中在分泌途径上,与上述推断一致。此外,AcTO1蛋白的理论等电点pI为8.40,为碱性蛋白。AcTO1蛋白预测的期望跨膜螺旋数为0,所编码的蛋白为非跨膜蛋白,这与张松斗之前的报道一致[15]。氨基酸序列分析还发现中华蜜蜂AcTO1蛋白的氨基酸序列在N端位置有2个非常保守的Cys残基,说明该蛋白具有配体结合特性[16]。
基因的表达部位在一定程度上反应了该基因的功能。TO基因在昆虫内的表达具有组织特异性,比如许多研究通过原位杂交技术对其进行检测,TO基因主要表达于果蝇的前胃和嗉囊、冈比亚按蚊的触角、黑花蝇的触角和下唇须、家蚕的中肠和烟草天蛾的头部等组织[1,5,6,17,18]。这些结果表明TO基因表达具有组织特异性,同时也暗示着该基因功能的多样性。昆虫的头部是取食和感觉的中心,拥有口器和触角等相关器官;胸部是昆虫主要的活动中心,拥有大量的肌肉,足和翅着生在此。因此可以预测TO基因的表达量头部和胸部要高于腹部。经荧光定量PCR检测,中华蜜蜂的TO基因在头部表达量最高,腹部最低,这与预期一致。有意思的是,本文中TO基因在蜜蜂中的表达属于组织依赖型,主要表达于头部组织。So等[2]人表明TO基因参与调控生物节律和营养平衡。在蜂群中,哺育蜂在巢内较为黑暗的环境下进行与日节律无关的工作,而采集蜂在巢外进行与日夜节律密切相关的采集活动,这也表明蜜蜂的采集行为与日节律变化相关,因此我们推测TO基因可能参与调控蜜蜂的生物节律[19,20]。此外,Meunier等人[4]发现TO基因在果蝇调控摄食中起着重要作用。蜜蜂的采集行为也就是取食行为,所以进一步推测TO基因参与调控蜜蜂的采集行为。先前研究报道Per、For和Mvl等基因在采集蜂头部的表达量高于哺育蜂,表明这些基因可能与蜜蜂的采集行为有关[21-23]。本文中,TO基因在不同发育阶段的表达属于行为依赖型,暗示着该基因在蜜蜂不同发育阶段对不同行为的反应是不一样的。TO基因在所有的采集蜂头部的表达量都要高于哺育蜂。这些结果充分说明TO基因很可能参与调控蜜蜂的采集行为。
[1]Sarov-Blat L,So W V,Liu L,et al.The Drosophila takeout gene is a novel molecular link between circadian rhythms and feeding behavior[J].Cell,2000,101(6):647-656.
[2]So W V,Sarov-Blat L,Kotarski C K,et al.Takeout,a novel Drosophila gene under circadian clock transcriptional regulation[J].Mol Cell Biol,2000,20(18):6935-6944.
[3]Benito J,Hoxha V,Lama C,et al.The circadian output gene takeout is regulated by Pdp1 epsilon [J].P Natl Acad Sci USA,2010,107(6):2544-2549.
[4]Meunier N,Belgacem Y H,Martin J R.Regulation of feeding behaviour and locomotor activity by takeout in Drosophila [J].The Journal of Experimental Biology,2007,210(Pt 8):1424-1434.
[5]Saito K,Su Z H,Emi A,et al.Cloning and expression analysis of takeout/JHBP family genes of silkworm,Bombyx mori[J].Insect Mol Biol,2006,15(3):245-251.
[6]Justice R W,Dimitratos S,Walter M F,et al.Sexual dimorphic expression of putative antennal carrier protein genes in the malaria vector Anopheles gambiae [J].Insect Mol Biol,2003,12(6):581-594.
[7]Bohbot J,Vogt R G.Antennal expressed genes of the yellow fever mosquito(Aedes aegypti L.);characterization of odorant-binding protein 10 and takeout[J].Insect Biochem Molec,2005,35(9):961-979.
[8]Denison R,Raymond-Delpech V.Insights into the molecular basis of social behaviour from studies on the honeybee,Apis mellifera[J].Invertebrate neuroscience:IN,2008,8(1):1-9.
[9]Robinson G E.Regulation of division of labor in insect societies[J].Annual Review of Entomology,1992,37:637-665.
[10]Whitfield C W,Cziko A M,Robinson G E.Gene expression profiles in the brain predict behavior in individual honey bees[J].Science,2003,302(5643):296-299.
[11]Wang X Y,Bai S F,Li X,et al.Differential responses of Helicoverpa armigera C-type immunlectin genes to the endoparasitoid Campoletis chlorideae[J].Archives of Insect Biochemistry&Physiology,2017,94(3).
[12]Liu S S,Wang M,Li X C.Overexpression of Tyrosine hydroxylase and Dopa decarboxylase associated with pupal melanization in Spodoptera exigua[J].Sci Rep-Uk,2015,5:11273.
[13]赵亚华.基础分子生物学教程[M].北京:科学出版社,2007.
[14]彭佳师,龚继明.信号肽与蛋白质的分选转运 [J].植物生理学报,2011,47(1):9-17.
[15]张松斗,申忠健,马木提·赛丽蔓,等.棉铃虫HaTO-like基因的克隆、序列分析和表达特征 [J].应用昆虫学报,2016,53(5):962-971.
[16]Wojtasek H,Prestwich G D.Key disulfide bonds in an insect hormone binding protein:cDNA cloning of a juvenile hormone binding protein of Heliothis virescens and ligand binding by native and mutant forms[J].Biochemistry,1995,34(15):5234-5241.
[17]Du J,Hiruma K,Riddiford L M.A novel gene in the takeout gene family is regulated by hormones and nutrients in Manduca larval epidermis[J].Insect Biochem Mol Biol,2003,33(8):803-814.
[18]Fujikawa K,Seno K,Ozaki M.A novel Takeout-like protein expressed in the taste and olfactory organs of the blowfly,Phormia regina[J].The FEBS Journal,2006,273(18):4311-4321.
[19]Moore D,Angel J E,Cheeseman I M,et al.Timekeeping in the honey bee colony:integration of circadian rhythms and division of labor[J].Behav Ecol Sociobiol,1998,43(3):147-160.
[20]Bloch G,Toma D P,Robinson G E.Behavioral rhythmicity,age,division of labor and period expression in the honey bee brain[J].J Biol Rhythm,2001,16(5):444-456.
[21]Dan P T,Bloch G,Moore D,et al.Changes in period mRNA Levels in the Brain and Division of Labor in Honey Bee Colonies[J].P Natl Acad Sci USA,2000,97(12):6914-6919.
[22]Heylen K,Gobin B,Billen J,et al.Amfor expression in the honeybee brain:A trigger mechanism for nurse-forager transition[J].2008,54(10-11):1400-1403.
[23]Benshahar Y,Dudek N L,Robinson G E.Phenotypic deconstruction reveals involvement of manganese transporter malvolio in honey bee division of labor [J].Journal of Experimental Biology,2004,207(19):3281-3288.
Cloning and expressional analysis of a takeout gene in Apis cerana
Chen Yijie1,2,4,Xie Xingcheng4,Wu Shuang1,2,4,Wu Zhenhong1,2,Li Xianchun4,5,Miao Xiaoqing1,2,3
(1 College of Bee Science Fujian Agriculture and Forestry University;2 Apitherapy Institute of Fujian Agriculture and Forestry University;3 State and Local Joint Engineering Laboratory of Natural Biotoxin,Fuzhou 350002,China;4 State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193,China;5 Department of Entomology and BIO5 Institute,The University of Arizona,Tucson,AZ 85721,USA)
The takeout(TO)gene is a circadian clock-regulated output gene abundantly expressed in several tissues that are related to perception of chemical signals and nutrition acquisition in insects.TO protein is known to be involved in growth and development,behavior regulation and metabolism of the solitary insects.But it remains unclear whether TO protein is also involved in the division of labor in social insects.In order to address this general question and reveal its additional functions,we cloned the Apis cerana TO (AcTO1)gene and analyzed its expression levels in different tissues and developmental stages between nurse bees and forager bees.We obtained the cDNA sequence of AcTO1 by RT-PCR and analyzed its nucleotide and amino acid sequences using bioinformatics software.We also measured its expression levels in the head,thorax and abdomen of three types of forager bees (18-day old normal foragers,22-day old normal foragers,7-day old Young/precocious foragers)and two types of nurse bees (7-day old normal young nurses and 22-day old over-aged nurses)by real-time quantitative PCR (qRT-PCR).The AcTO1 cDNAsequence obtained by reverse transcriptase polymerase chain reaction (RT-PCR)was 1058 bp in length.It has an open reading frame (ORF)of 738 bp,encoding a protein of 246 amino acids.The predicted molecular weight of AcTO1 was 27.09 kDa and its theoretical isoelectric point was 8.40.AcTO1 protein contains a N-terminal signal peptide of 17 amino acids but lacks transmembrane domains,suggesting that AcTO1 was a secreted protein.AcTO1 protein also has an highly conserved JHBP (juvenile hormone binding protein)domain.In the three kinds of foragers and two kinds of nurses,AcTO1 expressed at the highest level in the head,followed by the thorax,and then the abdomen.Moreover,AcTO1 transcripts in the head were significantly higher in all the three kinds of forager bees than in the two kinds of nurse bees.Such expression profile implies that AcTO1 was probably associated with the division of labor between nurses and foragers.This study determined the sequence characteristics of AcTO1 and its expression profiles.The data suggest that AcTO1 may be involved in the division of labor between nurses and foragers.
honey bee;division of labor;takeout gene;gene cloning
国家蜂产业技术体系建设专项资金(CARS-45-KXJ19)
陈艺杰(1991-),男,硕士,研究方向为蜂产品医疗与保健
缪晓青(1959-),男,教授,研究方向为蜂学,E-mail:mxqsf88@126.com

