多系统萎缩患者血清尿酸水平分析
林志坚 董娇璇 陈旭辉 吴 军
北京大学深圳医院神经内科,广东 深圳 518036
多系统萎缩患者血清尿酸水平分析
林志坚 董娇璇 陈旭辉 吴 军
北京大学深圳医院神经内科,广东 深圳 518036
目的 探讨多系统萎缩患者血清尿酸水平及其与病情严重程度的相关性。方法 连续选取2012-06—2016-12在北京大学深圳医院神经内科就诊的多系统萎缩患者32例,详细进行病史采集及体格检查,并进行统一多系统萎缩评估量表(UMSARS)评估。另选择同期健康体检者50例为健康对照组,2组均测定空腹血清尿酸水平。结果 MSA-P组及MSA-C组的尿酸水平均低于对照组,差异有统计学意义(P<0.05);MSA-P组血清尿酸水平与MSA-C组比较,差异无统计学意义(P>0.05);MSA患者尿酸水平与UMSARS评分呈负相关(Pearsonr=-0.389,P<0.05),但与病程年限无相关性(P>0.05)。结论 MSA患者血清尿酸水平降低,低尿酸可能与MSA发病有关;尿酸与MSA病情严重程度呈负相关。
多系统萎缩;尿酸;氧化应激
多系统萎缩(multiple system atrophy,MSA)是成年期发病、散发性的神经系统变性疾病,临床表现比较复杂,可出现不同程度的自主神经功能障碍及对左旋多巴类药物反应不良的帕金森综合征、小脑性共经济失调等症状。MSA在人群中的发病率为1.9/10万~4.9/10万,平均发病年龄为54.2岁[1]。本病的发病机制尚未明确,可能与原发性少突胶质细胞病变或神经元本身α-突触核蛋白异常聚集有关,氧化应激反应可能参与发病。MSA公认的病理特征为少突胶质细胞的α-突触核蛋白包涵体[2-3]。依据临床表现的不同,将MSA分为两种临床亚型,其中以帕金森综合征为突出表现的临床亚型称为MSA-P,以小脑性共济失调为突出表现的称为MSA-C型。目前本病尚无有效的治疗手段。
尿酸(uric acid,UA)是嘌呤代谢的最终产物,研究发现,尿酸是人体内一种重要的抗氧化剂,能减轻体内的氧化应激反应,具有一定的神经保护作用[4]。国内外研究报道[5-6],帕金森病、阿尔茨海默病、肌萎缩侧索硬化等神经系统变性疾病患者血清UA水平下降。目前,国内少见MSA患者血清尿酸水平分析的相关报道,本研究探讨MSA患者血清UA水平及其与病情严重程度的相关性,以了解UA与MSA发病及病情进展的关系。现分析如下。
1 资料与方法
1.1 一般资料 连续选择2012-06—2016-12在北京大学深圳医院神经内科就诊的MSA患者32例为研究对象。MSA患者由2名有丰富经验的运动障碍疾病专家诊断,均符合依据2008年修订的Gilman诊断标准[7]。排除标准:(1) 合并严重心、肝、肾疾病;(2)合并其他神经系统变性疾病;(3)最近 3个月使用利尿药及影响肾功能的药物;(4)合并肿瘤或严重的精神疾病;(5)近3个月合并全身局部或广泛炎症患者;(6)患者本人或家属不同意入组。根据临床表现分型,MSA-P 11例,MSA-C 21例。选择同期本院健康体检者50例为正常对照组。2组性别、年龄及体重指数(body mass index,BMI)差异无统计学意义 (P>0.05),具有可比性。见表1。本研究已获北京大学深圳医院伦理管理委员会同意,所有入组的MSA患者及健康对照者均签署知情同意书。

表1 2组一般资料比较
1.2 研究方法 由神经内科专科医师对MSA患者进行详细的病史采集,记录人口学资料,并进行体格检查,根据临床表现将患者进行分型,即MSA-P型或者MSA-C型,使用统一多系统萎缩评估量表(unified multiple system atrophy rating scale,UMSARS)进行评分[8]。所有受试者在采血前均禁食12 h,清晨抽取空腹静脉血3 mL,送我院检验科使用日本OLYMPUS Au5400全自动生化仪以及配套试剂盒进行尿酸检测。

2 结果
2.1 各组血清尿酸水平、UMSARS评分、病程比较 MSA-P组和MSA-C组血清尿酸水平均低于对照组,差异有统计学意义(P<0.05),而MSA-P组与MSA-C 组血清尿酸水平差异无统计学意义(P>0.05)。见表2。
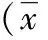
表2 各组血清尿酸水平比较±s)
注:与对照组比较,aP<0.05
2.2 双变量Pearson’s相关性分析 MSA患者血清尿酸水平与其UMSARS评分呈负相关(r=-0.389,P<0.05),与病程长短无相关性(r=0.183,P>0.05)。
3 讨论
MSA的概念自1969年首次被提出后,对其研究和认识不断深入。MSA发病率较低,50岁以上人群的发病率约为3/10万,>55岁患病率更高,为16.8/10万~28.7/10万,平均发病年龄54.2岁,无性别差异,平均存活期为8 a[1]。MSA主要的临床表现为不同程度的自主神经功能障碍,以及对左旋多巴类药物反应不良的帕金森综合征、小脑性共济失调,部分患者尚可出现喘鸣、认知障碍、锥体束征、睡眠障碍等[9]。MSA典型的影像学表现包括核磁共振T2像出现脑桥十字征,壳核外侧缘裂隙征、小脑中脚高信号、壳核低信号等,这些特征性的影像学表现有助于与帕金森病、进行性核上性麻痹等疾病鉴别[10]。依据临床表现不同,将MSA分为两种临床亚型,其中以帕金森综合征为突出表现的临床亚型称为MSA-P,以小脑性共济失调为突出表现的称为MSA-C型。MSA的病理标志为少突胶质细胞的α-突触核蛋白包涵体[2-3],病变主要累及纹状体-黑质系统、橄榄-脑桥-小脑系统和脊髓的中间内、外侧细胞柱和Onuf核。MSA病因不清,目前认为MSA的发病机制可能有两条途径[11]:(1)原发性少突胶质细胞假说,即少突胶质细胞变性,出现特征性的α-突触核蛋白包涵体,导致神经元髓鞘变性脱失,激活小胶质细胞,诱发氧化应激,进而导致神经元变性坏死;(2)神经元本身α-突触核蛋白异常聚集,造成神经元变性坏死。总之,氧化应激参与MSA的发病过程。
UA是嘌呤代谢的最终产物,是人体天然的水溶性抗氧化剂,能清除氧自由基、羟自由基以及其他活性自由基,并可减轻人体的氧化应激反应,其抗氧化、防止细胞溶解凋亡的作用强于抗坏血酸[11]。本研究发现,MSA组血清UA水平显著低于健康对照组,提示低血清UA水平可能参与MSA发病,低UA水平可能不能抑制机体的氧化应激反应,从而在某种程度上促成MSA,这也说明UA可能是MSA的保护因素。MSA的发病十分复杂,UA对其保护作用机制仍不明确。氧化应激促成神经元变性坏死可能是MSA发病的重要机制,抗氧化系统损伤后,神经系统自由基等高活性氧化分子生成增多,UA可以有效清除氧自由基、羟自由基等有害物质,阻断其对神经元的损害作用。UA除了具有直接的抗氧化作用外,在大脑生理浓度的UA也可以诱导神经元谷胱甘肽的合成,从而提高神经保护作用[12]。UA的这种神经保护作用在动物实验中已经被证实[13]。同时研究发现,帕金森病、阿尔茨海默病、肌萎缩侧索硬化等神经系统变性疾病患者血清UA水平下降[14-15]。本研究还发现,MSA-P组与MSA-C组的尿酸水平差异无统计学意义,MSA-P与MSA-C只是根据MSA患者的临床表现而人为区分的亚型,MSA-P亚型以帕金森综合征为主要表现,而MSA-C型以小脑性共济失调为主要表现,而这两型患者均存在自主神经功能损害,两亚型的发病机制本身可能无本质的区别,故尿酸水平无明显差异。
UMSARS是2004年欧洲多系统萎缩研究组(the european multiple system atrophy-Study group,EMSA-SG)建立的MSA评价量表[8,16],该量表由四部分组成:UMSARSⅠ病史回顾、UMSARSⅡ运动功能检查、UMSARSⅢ自主神经功能检查及UMSARS Ⅳ整体失能等级。许多研究已经确认了该量表的可靠性和有效性,UMSARS可较好反映MSA的病程进展,对于研究MSA的临床特征和病程具有重要意义,目前广泛应用于MSA的临床评估及临床科研[17]。本研究发现,MSA患者的血清尿酸水平与其UMSARS呈负相关,提示MSA患者的血清UA水平与其病情严重程度呈负相关,进一步说明UA对MSA的保护作用,可能阻止疾病的进展,也提示临床医师在MSA患者随访过程中要关注其UA变化。本研究还发现,MSA患者的血清UA水平与其病程年限无明显相关性,MSA的发病具有一定的异质性,不同患者的临床表现及病程进展各自迥异,病程年限不能代表MSA疾病的严重性,UA水平与其无明显相关性从某种意义上说明MSA临床及发病机制的复杂性。也有研究报道[18],高UA水平与低MSA发病率相关,但尿酸与MSA病程进展无关。我们推测研究结果的不同的原因在于选择的人群不同,UA检测方法不同,可能也与UA受干扰的因素较多有关。
综上所述,本研究提示MSA患者血清UA水平降低,可能在一定的程度上与其病情严重程度呈负相关,UA可能具有一定的神经保护作用,临床医师在MSA的诊治及随访过程中要注意关注其UA变化。本研究的不足在于样本量偏小,由于MSA是发病率较小的神经系统变性疾病,单中心所募集的MSA病例数有限,今后应开展多中心大样本的临床研究;其次,本研究观察的指标较为单一,今后应检测更多的参数,如炎性介质等,或者结合影像学指标进行研究。
[1] 吴江,贾建平主编.神经病学[M].3版.北京:人民卫生出版社,2015:377-381.
[2] Peeraully T.Multiple system atrophy[J].Semin Neurol,2014,34(2):174-181.
[3] Wong YC,Krainc D.α-synuclein toxicity in neurodegeneration:mechanism and therapeutic strategies[J].Nat Med,2017,23(2):1-13.
[4] Alvarez-Lario B,Macarrn-Vicente J.Is there anything good in uric acid[J].QJM,2011,104(12):1 015-1 024.
[5] Chahine LM,Stern MB,Chen-Plotkin A.Blood-based biomarkers for Parkinson'sdisease[J].Parkinsonism Relat Disord,2014,1:S99-103.
[6] Paganoni S,Zhang M,Quiroz Zárate A,et al.Uric acid levels predict survival in men with amyotrophic lateral sclerosis[J].J Neurol,2012,259(9):1 923-1 928.
[7] Gilman S,Wenning GK,Low PA,et al.Second consensus statement on the diagnosis of multiple system atrophy[J].Neurology,2008,71(9):670-676.
[8] Wenning GK,Tison F,Seppi K,et al.Development and validation of the Unified Multiple System Atrophy Rating Scale (UMSARS)[J].Mov Disord,2004, 19(12):1 391-1 402.
[9] Wenning GK,Geser F,Krismer F,et al.The natural history of multiple system atrophy:a prospective European cohort study[J].Lancet Neurol,2013,12(3):264-274.
[10] 林志坚,陈旭辉,车秀娟,等.磁共振成像在多系统萎缩诊断与鉴别诊断中的应用价值[J].神经损伤与功能重建,2014,9(1):40-43.
[11] Jellinger KA,Wenning GK.Multiple system atrophy:pathogenic mechanisms and Biomarkers[J].J Neural Transm (Vienna),2016,123(6):555-572.
[12] Aoyama K,Matsumura N,Watabe M,et al.Caffeine and uric acid mediate glutathione synthesis for neuroprotection.Neuroscience,2011,181:206-15.
[13] Cutler RG,Camandola S,Malott KF,et al.The Role of UricAcid and Methyl Derivatives in the Prevention of Age-Related NeurodegenerativeDisorders[J].Curr Top Med Chem,2015,15(21):2 233-2 238.
[14] Delgado-Alvarado M,Gago B,Navalpotro-Gomez I,et al.Biomarkers for dementia and mild cognitive impairment in Parkinson's disease[J].Mov Disord,2016,31(6):861-881.
[15] 张炎,缪桂华,罗蔚锋.尿酸水平和高血压病与帕金森病关系的病例对照研究[J].中国临床神经科学,2016,24(5):544-548.
[16] Geser F,Seppi K,Stampfer-Kountchev M,et al.The European Multiple System Atrophy-Study Group (EMSA-SG)[J].J Neural Transm (Vienna),2005,112(12):1 677-1 686.[17] 顾卫红,王国相,杨斯柳,等.统一多系统萎缩评估量表与病程的相关性分析[J].中华神经科杂志,2008, 41(5):332-334.
[18] Cao B,Guo X,Chen K,et al.Uric acid is associated with the prevalence but not disease progression of multiple systematrophy in Chinese population[J].J Neurol,2013,260(10):2 511-2 515.
(收稿2017-01-16)
Serum uric acid levels in patients with multiple system atrophy
LinZhijian,DongJiaoxuan,ChenXuhui,WuJun
DepartmentofNeurology,ShenzhenHospitalAffiliatedtoPekingUniversity,Shenzhen518036,China
Objective To explore the levels of serum uric acid and its relationship with the disease severity in patients with multiple system atrophy (MSA).Methods We consecutively selected 32 MSA patients in Shenzhen Hospital Affiliated to Peking University from June 2012 to December 2016.Detailed history taking and physical examination were executed for each patient,and the unified multiple system atrophy rating scale (UMSARS) was used.All of 50 healthy cases were selected as control group.Fasting serum uric acid levels of two groups were compared.Results The levels of serum uric acid in MSA-P group and MSA-C group were lower than those in the control group (P<0.05),but there was no difference between MSA-P group and MSA-C group (P>0.05).In the MSA group,the levels of serum uric acid had a negative correlation with UMSARS scores (Pearsonr=-0.389,P<0.05),but had no relationship with illness duration (P>0.05).Conclusion The low levels of serum uric acid may be related to the occurrence of MSA and to some extent have a negative correlation with disease severity of MSA.
Multiple system atrophy;Uric acid;Oxidative stress
深圳市科技研发基金项目,
R741
A
1673-5110(2017)12-0015-03
编号:JCYJ20130402114702121

