氟西汀对脑卒中后抑郁患者海马磁共振氢质子波谱影响的研究
郭志勇 谭西英 刘丽娇 王 宇 任玉红 徐祥辉 李智花 张东卫
1)新乡市第一人民医院神经内一科,河南 新乡 453000 2)河南省精神病医院,河南 新乡 453000
氟西汀对脑卒中后抑郁患者海马磁共振氢质子波谱影响的研究
郭志勇1)谭西英1)刘丽娇1)王 宇1)任玉红1)徐祥辉1)李智花1)张东卫2)
1)新乡市第一人民医院神经内一科,河南 新乡 453000 2)河南省精神病医院,河南 新乡 453000
目的 探讨氟西汀对脑卒中后抑郁患者海马氢质子磁共振波谱(1H-MRS)影响的特点。方法 以60例脑卒中后抑郁患者为研究组,研究组给予氟西汀抗抑郁治疗8周,以62名脑卒中患者为对照组。采用1H-MRS检测脑卒中后抑郁患者(研究组)治疗前后及脑卒中患者(对照组)双侧海马的N-乙酰基天门冬氨酸(NAA)、胆碱复合物(Cho)与肌酸复合物(Cr),以NAA/Cr值和Cho/Cr值进行统计分析。结果 研究组治疗前后左右侧海马NAA/Cr值(分别为1.22±0.31和1.19±0.42,1.46±0.35和1.43±0.41)均低于对照组(分别为1.69±0.33和1.66±0.47),差异有统计学意义(均P<0.05);研究组治疗前后左右侧海马Cho/Cr值(分别为1.58±0.39和1.59±0.46,1.55±0.43和1.53±0.42)高于对照组(分别为1.26±0.42和1.31±0.47),差异有统计学意义(均P<0.05);研究组治疗后左右侧海马NAA/Cr值(分别为1.46±0.35和1.43±0.41)均高于治疗前(分别为1.22±0.31和1.19±0.42),差异有统计学意义(均P<0.05)。结论 氟西汀可能改变脑卒中后抑郁患者海马神经元的代谢异常。
氟西汀;脑卒中后抑郁;磁共振波谱学; 海马
脑卒中后抑郁(post-stroke depression,PSD)是神经内科和精神科临床上常见的与脑卒中相关的一组疾病,多在脑卒中后2个月至2 a内发生,临床表现为抑郁心境及相应的行为异常,严重者可能出现自杀等意外,临床危险极大。PSD的病因学研究一直是脑科学研究的难点和热点,已有研究证实[1-2],脑卒中后抑郁的发生与海马的生化代谢异常关系密切。本研究主要探讨PSD患者氟西汀治疗前后的海马氢质子磁共振波谱(1H-MRS)特点,进而探讨脑卒中后抑郁发生及临床症状改善的可能机制。
1 对象和方法
1.1 研究对象 研究组:2011-06—2016-07在本院和河南省精神病医院住院及门诊随诊的PSD患者。入组标准:(1)有明确的脑卒中史及相应的神经功能缺失症状;(2)磁共振平扫海马无软化灶;(3)符合中国精神障碍分类与诊断标准第3版(CCMD-3)中卒中后抑郁的诊断标准;(4)至少7 d内未使用影响脑内生化代谢物的制剂及药物;(5)入组时Hamilton抑郁量表(HAMD)评分≥7分;(6)年龄50~80岁;(7)无磁共振(MRI)检查禁忌;(8)右利手。排除标准:(1)有抑郁症、癫痫、精神分裂症、颅内肿瘤等病史者及精神发育迟滞者;(2)长期应用影响脑内生化代谢的药物者;(3)意识障碍或存在明显的失语、失用等表现者;(4)因严重认知功能障碍不能配合检查者;(5)神经系统发育异常者;(6)伴严重躯体器质性疾病者;(7)药物或酒精依赖者。入组67例,期间脱落7例。男32例,女28例;年龄50~80(60.6±14.7)岁;受教育年限3~15(9.1±5.2)a;病程2~24(15.2±8.4)月;口腔温度36.6 ℃~37.3 ℃,平均36.8 ℃。HAMD量表总分为(16.3±4.8)分。
对照组:2011-06—2016-07在本院住院的脑卒中患者。影像学检查有相应的病灶及神经功能缺失症状,海马区无软化灶及占位性病变;经向本人及家属核实无抑郁症、癫痫、精神分裂症、颅内肿瘤、颅脑外伤、精神发育迟滞等病史;无认知功能障碍,HAMD评分<7分,无严重躯体器质性疾病;无药物或酒精依赖;无MRI检查禁忌;均为右利手。共入组65例,脱落3例;男30例,女32例;年龄50~80(61.3±13.8)岁;受教育年限3~15(8.8±5.7)a;口腔温度36.7 ℃~37.5 ℃。
所有入组对象均对本研究知情同意,并签署知情同意书。2组在性别构成、年龄、受教育年限、口腔温度等方面差异均无统计学意义(均P>0.05)。本研究获得新乡市第一人民医院伦理委员会批准。
1.2 方法
1.2.1 实验设计:由本院2位经过正规培训的副主任医师根据入组标准和排除标准确定患者组和对照组,研究组在入组当天及给药8周后分别进行HAMD量表测评和MRS检查,对照组于入组当天进行HAMD量表测评和MRS检查。研究组在服用氟西汀8周后分别完成1次HAMD量表和疗效指数(efficacy index,EI)测评。评估前对研究人员进行HAMD和EI培训,一致性检验的Kappa值分别为0.83和0.85。
1.2.2 给药方法:研究组于入组第2天开始给予晨服氟西汀胶囊[进口药品注册证号:H20070375;国药准字号J20080016;生产厂家:Patheon France;国内分包装厂:礼来苏州制药有限公司;商品名:百优解;规格:20 mg(以氟西汀计)/粒,28粒/盒]20 mg,连续不间断服用8周。
1.3 疗效及安全性评价
1.3.1 疗效评价:根据HAMD 17项减分率判断,计算公式为[(治疗前积分—治疗后积分)/治疗前积分]×100%。无效为<24%;有效为25%~49%;显著进步为50%~74%;痊愈为≥75%。
1.3.2 安全性评价:根据EI评定,EI=疗效分/不良反应分,一般认为EI>1.0认定药物安全有效)。疗效分4级:1=症状无变化;2=症状稍减轻;3=症状部分消失;4=症状完全消失。不良反应分4级:1=无不良反应;2=有轻度不良反应,但不影响患者功能;3=不良反应明显影响患者功能:4=发生严重甚至危及患者安全的不良反应。
1.4 MRI及1H-MRS检查方法 采用Philips achieva 1.5 T超导型磁共振成像系统,感兴趣区定位于双侧海马区。1H-MRS检查采用多体素2D 1H-MRS成像技术,1个体素设定为10 mm×10 mm×10 mm的体积。成像参数:TR为1 500 ms,TE为135 ms,平均采集4次,视野220 mm,成像时间7 min 12 s。信号经计算机自带软件处理后转换为数据和波谱图来反映N-乙酰基天门冬氨酸(NAA)、胆碱复合物(Cho)与肌酸复合物(Cr)的相对水平,数字以百万分之一(10-6)表示,并自动完成NAA/Cr、Cho/Cr的计算(见图1和图2)。
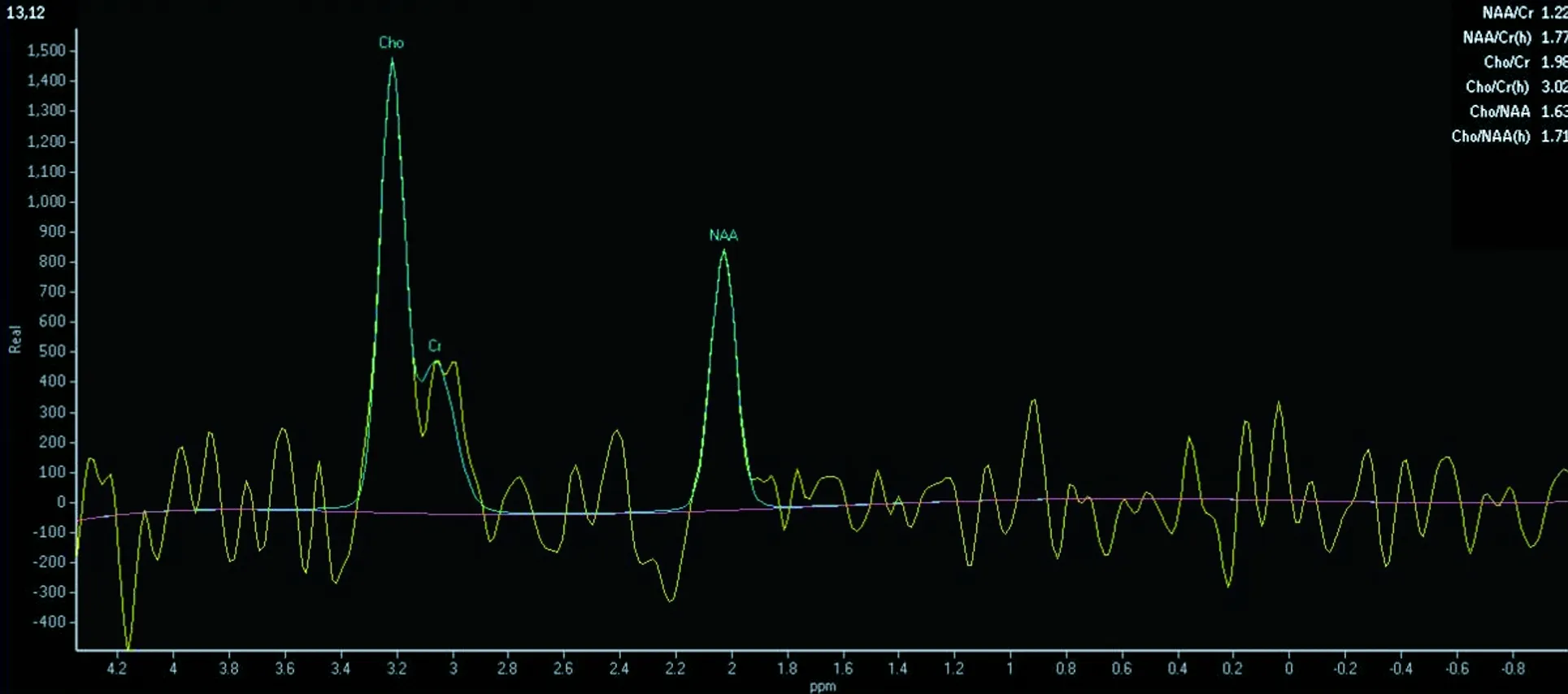
图1 治疗前波谱图

图2 治疗后波谱图
1.5 统计学分析 所有数据采用SPSS 16.0统计软件进行统计分析。计数资料采用卡方检验,组间比较采用独立样本t检验,组内比较采用配对t检验。检验水准均设定为ɑ=0.05,双侧检验。
2 结果
2.1 临床疗效及安全性评价 根据PSD患者治疗后的HAMD 17项减分率判断,60例入组病例经8周氟西汀治疗后临床痊愈21例,显著进步29例,有效6例,无效4例,总有效率93.33%。治疗过程中,1例服氟西汀4周时出现白细胞下降,2例出现心前区不适感,1例出现胃肠道不适感,1例四肢无力,1例在第4周出现转氨酶升高。以上6例均考虑与服用氟西汀有关,中断治疗,根据EI评定,54例EI>1.0,6例EI≤1.0,总安全有效率90.00%。
2.2 研究组治疗前后与对照组海马1H-MRS结果比较 卒中后抑郁患者治疗前后双侧海马NAA/Cr值均显著低于对照组,差异有统计学意义(均P<0.05),双侧海马Cho/Cr值均高于对照组,差异有统计学意义(均P<0.05);经氟西汀治疗后,卒中后抑郁患者双侧海马NAA/Cr值均较治疗前显著升高,差异有统计学意义(均P<0.05);而双侧海马Cho/Cr值均较治疗前差异无统计学意义(均P>0.05)。见表1。

表1 研究组治疗前后与对照组海马各研究指标比较±s)
注:研究组治疗前后与对照组相比,﹡P<0.05,研究组治疗前后相比,△P<0.05
3 讨论
随着医学的发展和人们对脑卒中认识的逐步深入,由脑卒中导致的致残率和病死率呈明显下降趋势,而PSD导致的心理障碍和行为异常却成为延缓病人恢复及社会功能减退的重要因素。多中心研究证实[3-4],PSD的发生率占脑卒中患者的40%~70%,且临床危害较大;Arseniou等[5]认为,有抑郁者较无抑郁者病死率高3~4倍。因此,对PSD患者的波谱分析及可能的药理学研究具有极大的理论和临床意义。
海马是参与情绪调节的颞叶边缘系统-额叶-皮层下结构的重要组成部分,是参与情绪调节的重要解剖部位之一。较多基础研究证实,海马的结构或功能异常可能在卒中后抑郁的发生发展中起着重要的作用。王少华等[6]对自建的PSD大鼠模型的研究认为,海马齿状回原位细胞代谢异常,主要表现为分化比例下降,新生细胞凋亡增加,胶质细胞增生等;Loubinoux等[1]强调海马的结构异常(尤其是物理性损伤)是PSD的常见的病理改变;Henn等[7]给予PSD大鼠持续的不良刺激,结果证实,应激能使其海马齿状回颗粒下层神经细胞的发生率大幅度下降,进而导致海马结构异常;由于受传统观念等影响导致的脑标本的有限性,有关PSD患者脑的研究受到很大限制,而20世纪90年代在临床广泛应用的质子磁共振波谱分析技术(1H-MRS),能在活体上检测感兴趣脑区(region of interest,ROI)神经递质浓度和某些物质的代谢情况,且具有非侵入性的、无损伤性的特点,成为脑结构或功能研究的有效手段。本单位已经完成了有关PSD患者海马质子波谱方面的研究[8],证实了卒中后抑郁患者存在海马神经元代谢的异常。通过复习文献,国内外尚未见有关新型抗抑郁药物对PSD患者海马1H-MRS影响的相关报道。
氟西汀是第一个进入中国市场的选择性 5-羟色胺再摄取抑制剂(SSRIs),通过抑制突触前膜相应的受体减少对5-羟色胺的再摄取作用,进而增加突触间隙5-羟色胺浓度而发挥抗抑郁作用。因对α1、α2、M1、M2受体及 H1受体无影响,故不良反应少,往往被作为其他新型抗抑郁药物研究的参考。本研究以海马作为研究脑区,在原有基础上研究氟西汀对PSD患者磁共振波谱各研究指标的影响,探讨新型抗抑郁药的疗效及安全性及是否存在神经修复的药理作用,并进一步从药理学角度探讨卒中后抑郁发生及症状改善的可能机制。
NAA为神经元的标志物,其波峰往往最高,其浓度降低具有病理学意义,往往反映了神经元的结构破坏、功能异常、代谢障碍及轴索的结构和(或)功能异常等[9-10]。Cho 是总胆碱含量,是乙酰胆碱的前体,主要存在于细胞膜、髓磷脂和脑内的脂质,主要参与细胞膜的合成与降解等[10],其浓度升高具有病理学意义,往往提示细胞膜、髓磷脂和脑内的脂质的更新异常、结构破坏等,亦与脑损伤、神经退行性变及反应性星状细胞和胶质细胞增生有关。通过复习文献,目前尚未见有关PSD患者经氟西汀治疗后海马NAA/Cr值和Cho/Cr值变化的文献报道。相关研究证实,短期的药物治疗可能改变感兴趣脑区的脑生化物质的代谢异常。Szulc等[11]以精神分裂症为研究对象,通过4周的非典型抗精神病药物(奥氮平)治疗,研究组左侧前额叶背外侧区NAA水平较治疗前显著升高,而颞叶、丘脑等其他脑区未见明显差异。而Beasley等[12]研究显示,经过利培酮治疗的精神分裂症患者4周后复查1H-MRS,研究组丘脑NAA水平较治疗前显著升高,差异有统计学意义。George等[13]在一项以躁狂症为研究对象的研究中证实,服用舍曲林8周后,患者组DLPFC区较治疗前NAA/Cr显著升高,升高的Cho/Cr值较治疗前明显降低。郑华等[14]以首发抑郁症为研究对象,患者组给药7周后复查1H-MRS,结果显示,NAA/Cr较治疗前显著升高,Cho/Cr值较治疗前显著降低。尽管上述研究与本研究可能存在研究对象、病程、感兴趣区选择、成像方式等的差异,但研究结果与本研究基本相近,一致提示某些药物可能改变感兴趣脑区生化物质代谢异常。而与上述研究结果不同的是,仍有部分研究显示药物治疗不能改变感兴趣脑区内生化物质的异常代谢。如Aoyama等[15]应用单体素成像技术对10例首发的精神分裂症患者的左侧额叶行双盲对照研究,结果显示,经氟哌啶醇治疗8周后,患者组左侧额叶和眶额叶NAA、Cho浓度较治疗前无差异,该项研究的入组对象较少,研究意义有限。而Szulc等[16]通过对58例慢性精神分裂症患者的研究证实,服用利培酮8周后双侧额叶、丘脑、胼胝体等脑区的NAA水平较治疗前无明显差异,甚至出现左侧前额叶较治疗前降低的现象;Szulc等分析认为,NAA值下降可能与典型抗精神病药的神经元毒性作用有关,亦可能与疾病的发展演变有关。本研究结果显示,双侧海马NAA/Cr值均较对照组显著降低,Cho/Cr值均较对照组显著升高,推测卒中后抑郁患者海马神经元不但存在大量破坏缺失、功能异常等,亦存在细胞膜脂代谢异常、神经细胞退行性变、星状细胞增多和反应性胶质细胞增生等。经8周的氟西汀治疗后,双侧海马的NAA/Cr值均较治疗前显著升高,一方面提示氟西汀具有改善甚至逆转海马生化代谢异常的作用,另一方面提示氟西汀无神经元毒性作用。而双侧海马Cho/Cr在治疗后较治疗前无显著差异,提示氟西汀对改善细胞膜脂代谢异常、抑制胶质增生等方面作用较差。目前尚未见相似的有关PSD患者药物治疗前后的1H-MRS研究,而氟西汀改善海马神经元的生化代谢异常的机制亦不清楚,尚需要扩大样本量进行多中心对照研究。
本研究结果证实氟西汀治疗卒中后抑郁具有疗效好及不良反应小等优点,值得临床推广应用。本研究尚有很多不足之处,如未根据患者抑郁程度分别研究等,计划进一步优化实验设计、扩大样本量、建立更科学的对照进行综合研究。
[1] Loubinoux I,Kronenberg G,Endres M,et al.Post-stroke depression:mechanisms,translation and therapy[J].J Cell Mol Med,2012,16(9):1 961-1 969.
[2] Warrington CD,Feeney DA,Ober CP,et al.Relative metabolite concentrations and ratios determined by use of 3-T region-specific proton magnetic resonance spectroscopy of the brain of healthy Beagles[J].Am J Vet Res,2013,74(10):1 291-1 303.
[3] Brown C,Hasson H,Thyselius V,et al.Post-stroke depression and functional independence:a conundrum[J].Acta Neurol Scand,2012,126(1):45-51.
[4] Huang Y,Chen W,Li Y,et al.Effects of antidepressant treatment on N-acetyl aspartate and choline levels in the hippocampus and thalami of post-stroke depression patients:a study using 1H magnetic resonance spectros-copy[J].Psychiatry Res,2010,182(1):48-52.
[5] Arseniou S,Arvaniti A,Samakouri M.Post-stroke depression:recognitionand treatment interventions[J].Psychiatrike,2011,22(3):240-248.
[6] 王少华,张志珺,郭怡菁,等.脑卒中后抑郁大鼠海马原位增殖的新生细胞存活和分化状态[J].中华神经科杂志,2008,41(9):614-617.
[7] Henn FA,Volmayr B.Neurogenesis and depression:etiology or epiphenomenon?[J].Biol Psychiatry,2004, 56(3):146-150.
[8] 郭志勇,谭西英,张新农,等.卒中后抑郁患者海马磁共振氢质子波谱分析[J].山东医药,2014,4(2):20-24.
[9] Long L,Song Y,Zhang L,et al.A case-control proton magnetic resonance spectroscopy study confirms cerebellar dysfunction in benign adult familial myoclonic epilepsy[J].Neuropsychiatr Dis Treat,2015,25(2):485-491.
[10] Carrera I,Richter H,Meier D,et al.Regional metabolite concentrations in the brain of healthy dogs measured by use of short echo time,single voxel proton magnetic resonance spectroscopy at 3.0 Tesla[J].Am J Vet Res,2015,76(2):129-141.
[11] Szulc A,Galińska-Skok B,Tarasów E,et al.Clinical and cognitive correlates of the proton magnetic resonance spectroscopy measures in chronic schizophrenia[J].Med Sci Monit,2012,18(6):390-398.
[12] Beasley CL,Dwork AJ,Rosoklija G,et al.Metabolic abnormalities in fronto-striatal-thalamic white matter tracts in schizophrenia[J].Schizophr Res,2009,109(1/3):159-166.
[13] George EO,Roys S,Sours C,et al.Longitudinal and prognostic evaluation of mild traumatic brain injury:A1H-magnetic resonance spectroscopy study[J].J Neurotrauma,2014,31(11):1 018-1 028.
[14] 郑华,王默力,段冬梅,等.氟西汀治疗首发抑郁症患者海马磁共振质子波谱变化的观察[J].中华保健医学杂志,2010,12(5):376-379.
[15] Aoyama N,Théberge J,Drost DJ,et al.Grey matter and social functioning correlates of glutamatergic metabolite loss in schizophrenia[J].Br J Psychiatry,2011,198(6):448-456.
[16] Szulc A,Konarzewska B,Galinska-Skok B,et al.Proton magnetic resonance spectroscopy measures related to short-term symptomatic outcome in chronic schizophrenia[J].Neurosci Lett,2013,28(5):37-41.
(收稿2017-03-11)
Effect of fluoxetine on hydrogen proton magnetic resonance spectroscopy of hippocampus in patients with post-stroke depression
GuoZhiyong*,TanXiying,LiuLijiao,WangYu,RenYuhong,XuXianghui,LiZhihua,ZhangDongwei
*DepartmentofNeurology,theFirstPeople’sHospitalofXinxiang,Xinxiang453000,China
Objective To explore the features of fluoxetine’s effect on hydrogen proton magnetic resonance spectroscopy(1H-MRS) of hippocampus in patients with post-stroke depression.Methods A total of 60 cases with post-stroke depression were collected as research group and were given fluoxetine for 8 weeks,and 62 cases with stroke were selected as control group.The levels of N-asparaginic acid (NAA),choline compound (Cho) and creatine compound (Cr) were detected by using1H-MRS and then the ratios of NAA to Cr (NAA/Cr) and of Cho to Cr (Cho/Cr) were calculated.Results In left and right hippocampus before and after treatment,the NAA/Cr ratios in the research group (1.22±0.31 and 1.19±0.42,1.46±0.35 and 1.43±0.41) were higher than those in the control group (1.69±0.33 and 1.66±0.47),and the differences were significant (allP<0.05).Similarly,the Cho/Cr ratios of left and right hippocampus before and after treatment in the research group (1.58±0.39 and 1.59±0.46,1.55±0.43 and 1.53±0.42) showed higher ratio than those in the control group (1.26±0.42 and 1.31±0.47),and the differences were significant (allP<0.05).Additionally,in the research group,the NAA/Cr ratios in bilateral hippocampus after treatment (1.46±0.35 and 1.43±0.41) were higher than those before treatment (1.22±0.31 and 1.19±0.42),and the differences were significant (allP<0.05).Conclusion Fluoxetine may change the abnormal metabolism of bilateral hippocampal neurons in post-stroke depression patients.
Fluoxetine;Post-stroke depression;Magnetic resonance spectroscopy;Hippocampus
2014年度新乡市重点科技攻关计划项目(编号:ZG14007)
R743.3
A
1673-5110(2017)12-0011-04

