虎杖苷通过PI3K/AKT/mTOR信号通路诱导人宫颈癌细胞凋亡的初步研究
潘纪红+王海滨+杜晓飞+刘江月+张代娟


[摘要] 通过观察虎杖苷对宫颈癌HeLa细胞体外生长的抑制作用,初步探讨其诱导凋亡的可能机制。不同浓度的虎杖苷(50,100,150 μmol·L-1)处理HeLa细胞后,采用MTT法检测虎杖苷对HeLa细胞增殖的抑制作用,AO/EB染色法荧光显微镜观察HeLa细胞凋亡的形态学变化;Annexin/PI双标记法检测HeLa细胞凋亡率;流式细胞仪分析HeLa细胞周期分布;RT-PCR和Western blot法检测HeLa细胞中PI3K,AKT,mTOR,P70S6K的mRNA和蛋白表达。结果显示,虎杖苷显著抑制HeLa细胞增殖,且具有一定剂量依赖性;虎杖苷能够引起HeLa细胞发生S期阻滞,促进细胞凋亡,显著下调HeLa细胞中PI3K,AKT,mTOR,P70S6K的mRNA和蛋白表达。表明虎杖苷具有抑制宫颈癌HeLa细胞增殖及诱导凋亡的作用,其机制可能与抑制PI3K/AKT/mTOR信号通路及其下游基因蛋白表达有关。
[关键词] 虎杖苷; 宫颈癌; HeLa细胞; PI3K/AKT/mTOR信号通路; 凋亡
[Abstract] To observe the effect of polydatin on proliferation and apoptosis of cervical cancer HeLa cells and explore its possible mechanism. The growth inhibitory effect was detected with MTT assay. After HeLa cells were treated with different concentrations (50, 100, 150 μmol·L-1) of polydatin, MTT assay was used to detect the inhibitory effect of polydatin on proliferation of HeLa cells; Acridine orange/ethidium bromide staining was used for morphological changes in apoptotic HeLa cells; Annexin/propidium iodide staining was applied to detect HeLa cell apoptotic rate. In addition, flow cytometry was employed to analyze apoptosis and cell cycle distribution; RT-PCR and Western blot assay were used to detect PI3K, AKT, mTOR, and P70S6K mRNA and protein expression levels. The results showed that polydatin significantly inhibited HeLa cells proliferation in a dose-dependent manner. Polydatin can cause S phase arrest for HeLa cells, promote cell apoptosis and decrease the mRNA and protein expression levels of PI3K, AKT, mTOR and P70S6K. It indicated that polydatin could inhibit proliferation and induce apoptosis of cervical cancer HeLa cells, and the mechanism may be associated with inhibiting the PI3K/AKT/mTOR signaling pathway and suppressing downstream gene expression.
[Key words] polydatin; cervical cancer; HeLa cell; PI3K/AKT/mTOR signaling pathway; apoptosis
宮颈癌是我国妇科最常见的恶性肿瘤,严重威胁广大妇女的生命健康。近年来发病率呈逐年上升趋势,且发病年龄不断年轻化。近年来对化疗在宫颈癌治疗中的应用进行了大量的研究,并取得了良好的效果[1]。常用的顺铂、五氟尿嘧啶等化疗药物费用昂贵,且毒性作用严重。因此,寻找高效低毒的化疗药物至关重要。目前,从传统中药等植物提取物中寻找毒性低、疗效高的抗癌活性成分并探讨其作用机制,已成为当今肿瘤治疗研究领域的热点。虎杖苷是从虎杖的干燥根茎中提取的单体,以往研究表明其在抗炎[2]、抗过敏[3]、改善微循环[4]等方面有显著作用,近年来有研究报道虎杖苷具有抗肿瘤作用,可以抑制鼻咽癌、肺癌、结肠癌细胞的增殖、分化[5-7]。然而其对宫颈癌细胞是否具有抑制作用,国内外未见相关报道。Rashmi和Husseinzadeh等[8-9]研究证实PI3K/AKT/mTOR信号通路在宫颈癌发生、发展过程中起到了重要的促进作用。本研究以宫颈癌HeLa 细胞为研究对象,观察虎杖苷对宫颈癌细胞的增殖抑制及诱导凋亡作用效果,并对其抗宫颈癌机制进行了初步研究。
1 材料
1.1 药品与仪器 虎杖苷(上海乔羽生物科技有限公司)。RPMI1640培养液、胎牛血清(美国Gibco);细胞裂解液(武汉博士德生物工程有限公司);MTT(美国Sigma公司);吖啶橙/溴化乙锭双荧光凋亡染色试剂盒(上海铭博生物科技有限公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海前尘生物科技有限公司);兔抗人PI3K,AKT,P-AKT,P70S6K,鼠抗人mTOR(CST,美国);FC-500流式细胞仪(美国Beckma公司);转膜仪、凝胶成像分析仪(美国Bio-Rad司)。
1.2 细胞株 宫颈癌HeLa细胞株由潍坊医学院实验中心提供。
2 方法
2.1 细胞培养 以RPMI1640为细胞培养液(内含10%胎牛血清、l00 U·mL-1青霉素和0.1 g·L-1链霉素),在37 ℃,饱和湿度和5%CO2的细胞培养箱中培养HeLa细胞。
2.2 MTT法细胞增殖抑制实验 取对数生长期的HeLa细胞处理后接种于96孔板,随机分为空白对照组(A组)、阴性对照组(B组)、虎杖苷低剂量组(C组,50 μmol·L-1)、中剂量组(D组,100 μmol·L-1)、高剂量组(E组,150 μmol·L-1)。C,D,E组加入不同浓度虎杖苷10 μL,B组加入等体积DMSO孵育24 h后,各组加入MTT(0.5%),继续培养4 h后弃上清液,加入150 μL DMSO,用酶标仪490 nm测定A。抑制率=[(A阴性对照孔-A实验孔)/(A阴性对照孔-A空白对照孔)]×100%。
2.3 AO/EB双荧光染色法检测细胞凋亡形态学改变 按常规制备细胞爬片,置于培养箱内培养,分组同MTT实验,24 h后按试剂盒说明书操作,荧光显微镜观察细胞形态变化并拍照。
2.4 Annexin V-FITC/PI双染法检测细胞凋亡率 取对数生长期细胞处理后接种于6孔板,分组处理同MTT实验,48 h后,制成单细胞悬液。按照试剂盒说明进行操作,用FACScan进行FCM定量检测。
2.5 流式细胞仪分析细胞周期 取对数生长期HeLa细胞,分组处理同MTT实验,调整细胞浓度1×1060个/mL,用1 mL PBS 重悬,滴加到4 mL预冷70%乙醇中,4 ℃过夜固定,离心弃上清,PBS洗3次,加入500 μL RNaseA/PI(50 mg·L-1),室温避光30 min,上流式细胞仪分析。
2.6 RT-PCR检测PI3K,AKT,mTOR,P70S6K的mRNA表达 取对数生长期HeLa细胞,分组处理同MTT实验,提取总RNA后合成cDNA,引物序列PI3K:上游5′-CTGTCAATCGGTGACTGTGTGG-3′,下游5′-AAACAGGTCAATGGCTGCATCATA-3′;AKT:上游5′-CTTGCTTTCAGGGCTGCTCA-3′,下游5′-TACAGGTGCTGCGACACGATAC-3′;mTOR:上游5′-AGAAACTGCACGTCAGCACCA-3′,下游5′-CCATTCCAGCCAGTCATCTTTG-3′; P70S6K:上游5′-CTCAGTGAAAGTGGCAATCAGGTC-3′,下游5′-GCTGCCAATAAATCTTCGAGGTG-3′。GAPDH为内参,进行定量PCR扩增。
2.7 Western blot法检测PI3K,AKT,mTOR,P70S6K的蛋白表达 取对数生长期HeLa细胞,分组处理同MTT实验,提取总蛋白,SDS-PAGE电泳分离蛋白,转膜后加一抗(1∶500)4 ℃过夜,TBST洗膜3次后二抗(1∶2 000)孵育1 h,ECL化学发光法显色,暗室曝光显影,图像分析。
2.8 统计学方法 计量资料以±s表示,采用单因素方差分析,组间比较用SNK-q检验,采用SPSS 18.0软件进行统计学分析,P<0.05为差异有统计学意义。
3 结果
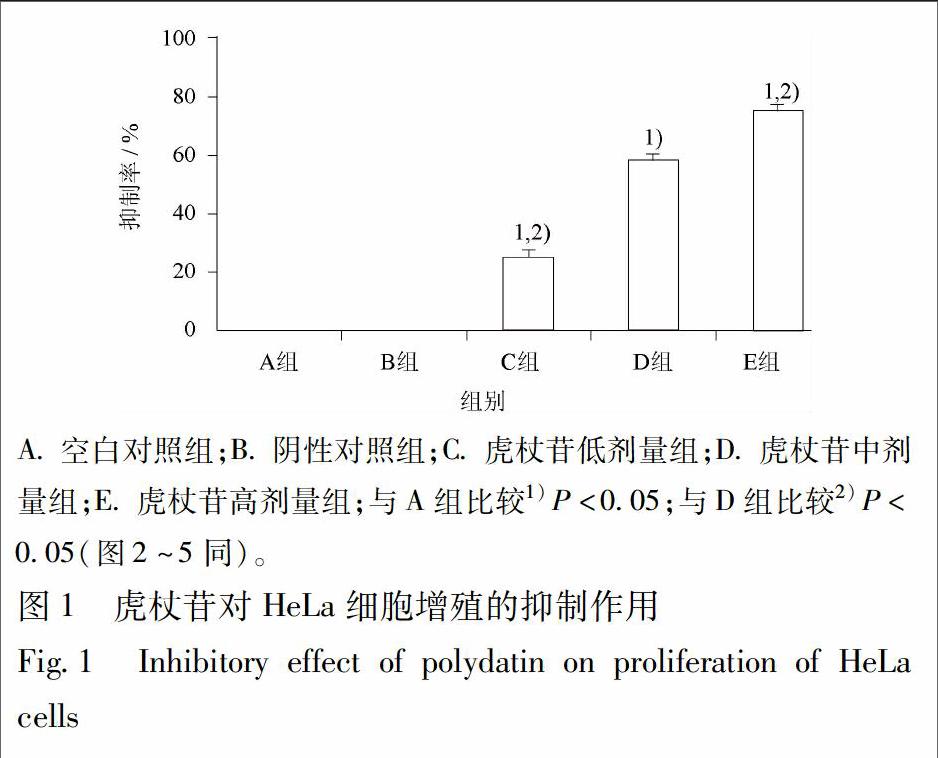
3.1 虎杖苷对HeLa细胞增殖的抑制作用 与A组比较,B组细胞的增殖无明显变化;虎杖苷低、中、高剂量各组细胞的增殖明显受抑制(P<0.05),与虎杖苷中剂量组比较,低剂量组的细胞增殖抑制作用明显减弱(P<0.05),高剂量组的细胞增殖抑制作用明显增强(P<0.05),差异有统计学意义,说明虎杖苷对HeLa细胞增殖呈明显剂量依赖性抑制作用(图1)。
3.2 虎杖苷诱导HeLa细胞凋亡的形态学变化 A组、B组细胞均呈圆形,大小一致,核质体染成均匀绿色,随着虎杖苷浓度增加,HeLa细胞凋亡数量和结构均发生明显改变。C组出现少量核固缩,D组细胞形态不规则,部分细胞出现染色质浓缩呈斑块状,核固缩,细胞呈新月形等,E组细胞形态发生明显的变化,凋亡细胞明显增多,染色質浓缩,细胞核碎裂呈点状或分叶状,细胞膜完整和膜泡状突起等典型的凋亡形态细胞(图2)。说明虎杖苷诱导HeLa细胞凋亡呈明显剂量依赖性。
3.3 虎杖苷对HeLa细胞凋亡率和细胞周期的影响 虎杖苷可促进宫颈癌HeLa细胞凋亡,随着虎杖苷剂量的增大,HeLa细胞凋亡率显著增加,各组间差异有显著性(P<0.05),虎杖苷诱导HeLa细胞凋亡呈明显剂量依赖性。细胞周期检测结果显示,A,B组细胞周期无明显变化;虎杖苷低、中、高剂量组细胞均出现G0/G1期细胞的百分比逐渐降低而S期细胞的百分比逐渐增加,呈现S期阻滞作用(P<0.05),与虎杖苷中剂量组比较,低剂量组的S期阻滞作用明显减弱(P<0.05),高剂量组的S期阻滞作用明显增强(P<0.05),说明虎杖苷对HeLa细胞S期阻滞作用呈明显剂量依赖性(表1)。
3.4 虎杖苷对HeLa细胞PI3K,AKT,mTOR,P70S6K的mRNA表达的影响 与A组比较,B组细胞PI3K,AKT,mTOR,P70S6K的mRNA表达无明显变化;虎杖苷低剂量、中剂量、高剂量各组细胞PI3K,AKT,mTOR,P70S6K的mRNA表达水平明显降低(P<0.05),不同剂量间PI3K,AKT,mTOR,P70S6K的mRNA表达有明显差异(P<0.05),说明虎杖苷降低HeLa细胞PI3K,AKT,mTOR,P70S6K的mRNA表达呈明显剂量依赖性(图3)。
3.5 虎杖苷對HeLa细胞PI3K,AKT,mTOR,P70S6K的蛋白表达的影响 与A组比较,B组细胞PI3K,AKT,mTOR,P70S6K蛋白表达无明显变化;虎杖苷低剂量、中剂量、高剂量各组细胞PI3K,AKT,mTOR,P70S6K蛋白表达水平明显降低(P<0.05),不同剂量间PI3K,AKT,mTOR,P70S6K蛋白表达有明显差异(P<0.05),说明虎杖苷降低HeLa细胞PI3K,AKT,mTOR,P70S6K蛋白表达呈明显剂量依赖性(图4)。
4 讨论
虎杖苷是植物虎杖中提取的一种天然活性成分,属于芪类化合物,在植物中分布广泛且含量高。可溶于热水、乙醇、乙酸乙酷、丙酮,具有多种药理学作用。研究表明[10-12]虎杖苷能够显著保护心肌细胞、血管平滑肌细胞,具有抗血小板聚集及改善微循环等作用,此外,虎杖苷还具有抗氧化、保护肝细胞等作用。虎杖苷能够显著抑制乳腺癌、肺癌、肝癌、肾癌等多种癌细胞生长[13-14]。本研究首先采用MTT法检测不同剂量虎杖苷对宫颈癌HeLa细胞增殖的抑制作用,结果发现虎杖苷能够有效抑制HeLa细胞增殖,这种抑制作用呈剂量依赖性。
研究发现细胞周期调控紊乱是肿瘤发生、发展的重要机制之一。细胞周期是高度有组织的时序调控过程,受到DNA损伤检控点、DNA复制检控点和纺锤体检控点等细胞周期检控点的精确调控。在严重的DNA损伤状态下,细胞周期阻滞可导致细胞凋亡。肿瘤细胞的细胞周期调控紊乱是肿瘤的特征之一,调控细胞周期进程是控制肿瘤细胞生长的一个有效的方法[15-16]。本研究采用流式细胞术检测了不同剂量虎杖苷干预HeLa细胞的细胞周期变化,结果显示虎杖苷可引起HeLa细胞发生S期阻滞,阻断HeLa细胞由S期向G2/M期的进程,阻滞细胞的有丝分裂,促使细胞调亡。
凋亡是多细胞生物体的程序性死亡,在机体稳态调节中起重要作用,凋亡的调控失衡是多种疾病如神经退行性病变、恶性肿瘤的重要发病机制。诱导凋亡是抗肿瘤药物的主要作用机制之一,因此,诱导凋亡可作为筛选新的抗肿瘤药的一个指标及评价抗肿瘤药物临床效力一种方法。本研究通过TUNEL实验观察不同剂量虎杖苷干预HeLa细胞后,HeLa细胞的凋亡情况,研究结果显示不同剂量虎杖苷均可诱导HeLa细胞凋亡,且凋亡率随着虎杖苷干预浓度的增加而增高,呈现明显剂量依赖性,表明诱导HeLa细胞凋亡是虎杖苷发挥抗宫颈癌作用的机制之一。PI3K/AKT/mTOR信号通路被认为是癌细胞存活的首要通路,有“抗细胞调亡途径”之称。AKT处于该信号通路的核心位置,活化的AKT通过启动下游底物发挥促细胞增殖、抑制细胞调亡、调控细胞周期、促进血管生成及化疗耐药等效应,参与肿瘤的发生和发展[17-19]。mTOR是PI3K-AKT的下游靶点,主要通过PI3K-AKT途径被激活。活化的AKT激活mTOR后,通过活化其下游蛋白P70S6K,促进肌动蛋白的细丝重构,进而实现肿瘤的侵袭与转移。PI3K/AKT/mTOR信号通路中的关键因子mTOR与其下游蛋白P70S6K在宫颈癌中表达均显著增加[20]。 本研究RT-PCR和Western blot结果发现,虎杖苷呈现明显剂量依赖性抑制HeLa细胞PI3K,AKT,mTOR,P70S6K mRNA和蛋白表达水平,剂量越大其mRNA和蛋白表达量越低。因此,推测虎杖苷抑制HeLa细胞生长和促进细胞调亡,其重要的分子作用机制可能在于虎杖苷可通过抑制PI3K/AKT/mTOR信号通路的关键节点蛋白AKT的表达,继而影响其下游靶基因mTOR和P70S6K的表达水平,从而抑制宫颈癌HeLa细胞的生长。
综上所述,虎杖苷能有效抑制宫颈癌HeLa细胞增殖并诱导细胞凋亡,将细胞阻滞在S期,其机制可能是与抑制PI3K/AKT/mTOR信号通路及其下游基因蛋白表达有关。
[参考文献]
[1] Crafton S M, Salani R. Beyond chemotherapy: an overview and review of targeted therapy in cervical cancer [J]. Clin Ther, 2016, 38(3): 449.
[2] Lanzilli G, Cottarelli A, Nicotera G, et al. Anti-inflammatory effect of resveratrol and polydatin by in vitro IL-17 modulation [J]. Inflammation, 2012, 35(1): 240.
[3] Yang B, Li J J, Cao J J, et al. Polydatin attenuated food allergy via store-operated calcium channels in mast cell [J]. World J Gastroenterol, 2013, 19(25): 3980.
[4] Wang X, Song R, Chen Y, et al. Polydatin—a new mitochondria protector for acute severe hemorrhagic shock treatment [J]. Expert Opin Investing Drugs, 2013, 22(2): 169.
[5] Liu H, Zhao S, Zhang Y, et al. Reactive oxygen species-mediated endoplasmic reticulum stress and mitochondrial dysfunction contribute to polydatin induced apoptosis in human nasopharyngeal carcinoma CNE cells[J]. J Cell Biochem, 2011, 112(12): 3695.
[6] Zhang Y, Zhuang Z, Meng Q, et al. Polydatin inhibits growth of lung cancer cells by inducing apoptosis and causing cell cycle arrest [J]. Oncol Lett, 2014, 7(1): 295.
[7] De Maria S, Scognamiglio I, Lombardi A, et al. Polydatin, a natural precursor of resveratrol, induces cell cycle arrest and differentiation of human colorectal Caco-2 cell[J]. J Transl Med, 2013, 11: 264.
[8] Rashmi R, Deselm C, Helms C, et al. AKT inhibitors promote cell death in cervical cancer through disruption of mTOR signaling and glucose uptake[J]. PLoS ONE, 2014, 9(4): e92948.
[9] Husseinzadeh N, Husseinzadeh H D. mTOR inhibitors and their clinical application in cervical, endometrial and ovarian cancers: a critical review[J]. Gynecol Oncol, 2014,133(2): 375.
[10] Ince S, Arslan Acaroz D, Neuwirth O, et al. Protective effect of polydatin, a natural precursor of resveratrol, against cisplatin-induced toxicity in rats[J]. Food Chem Toxicol, 2014, 72: 147.
[11] Wang X, Song R, Chen Y, et al. Polydatin: a new mitochondrial protector for acute severe hemorrhagic shock treatment[J]. Expert Opin Investing Drug, 2013, 22(2): 169.
[12] Wang X, Song R, Bian H N, et al. Polydatin, a natural polyphenol, protects arterial smooth muscle cells against mitochondrial dysfunction and lysosomal destabilization following hemorrhagic shock[J]. Am J Physiol Regul Integrcomp Physiol, 2012, 302(7): R805.
[13] Zhang Y, Zhuang Z, Meng Q, et al. Polydatin inhibits growth of lung cancer cells by inducing apoptosis and causing cell cycle arrest[J]. Oncol Lett, 2014, 7(1): 295.
[14] 单中杰,郭亮,侯菁岚,等.白藜芦醇对人肾细胞癌7860细胞周期、凋亡及PDCD5mRNA表达的影响[J].郑州大学学报:医学版, 2012, 47(2): 182.
[15] Grana X, Reddy P. Cell cycle control in mammalian cells: role of cyclins, cyclin-dependent kinases (CDKs), growth suppressor genes and cyclin-dependent kinase inhibitors (CDKIs) [J]. Oncogene, 1995, 11(2): 211.
[16] Pavletich N P. Mechanisms of cyclin-dependent kinase regulation: structures of cdks, their cyclin activators, and CIP and INK4 inhibitors[J]. J Mol Biol, 1999, 287(5):8218.
[17] Song G, Ouyang G, Bao S. The activation of AKT/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59.
[18] Martelli A M, Evangelisti C, Chiarini F, et al. The phosphatidylinositol 3-kinase/AKT/mTOR signaling network as a therapeutic target in acute myelogenous leukemia patients[J]. Oncotarget, 2010, 1(2): 89.
[19] 徐碧云.Alet抑制劑的研究进展[J].中国现代应用药学,2016,33(2):250.
[20] 冀静,顾婷婷,郑鹏生.MTOR/P70S6K信号通路在宫颈癌组织中的表达及其临床意义[J].西安交通大学学报:医学版, 2010, 3199(1): 10.
[责任编辑 张宁宁]

