秸秆的生物降解机理及其功能微生物菌群研究进展
薛林贵, 杨蕊琪, 马高高, 李国强, 李文伟, 莫天录
1. 兰州交通大学化学与生物工程学院, 甘肃省极端环境微生物资源与工程重点实验室, 兰州 730070 2. 甘肃省有色金属地质勘查局兰州矿产勘查院, 兰州 730030
秸秆的生物降解机理及其功能微生物菌群研究进展
薛林贵1,*, 杨蕊琪1, 马高高2, 李国强1, 李文伟1, 莫天录1
1. 兰州交通大学化学与生物工程学院, 甘肃省极端环境微生物资源与工程重点实验室, 兰州 730070 2. 甘肃省有色金属地质勘查局兰州矿产勘查院, 兰州 730030
秸秆对人类社会发展具有极其重要的作用, 特别是在当今能源紧缺的背景下, 寻找新型可再生能源显得尤为重要。通过对秸秆生物降解机制的简单介绍, 以及对秸秆降解原理及微生物菌群研究状况的详细阐述, 为今后秸秆的高效降解及工业化大规模降解的研究和利用提供理论基础。
秸秆; 生物降解; 功能菌群; 研究进展
1 前言
进入21世纪以来, 随着经济的快速发展以及日益突出的能源和环境问题, 使人类深刻认识到现有的能源结构已不能适应整个社会的可持续发展, 于是人们将目光转向再生资源, 而生物能源的开发和利用便开始被全世界重视[1–2]。生物资源主要包括农作物秸秆和林业废弃物。我国有丰富的农林生物资源, 仅农作物秸秆就占世界秸秆产量的30%[3–4]。然而农作物秸秆等残留物中只有约 27.5%被利用, 其余大部分则以堆积、丢弃以及焚烧的方式倾入环境中(图1), 对环境造成大量污染。若能有效利用秸秆,不仅能缓解能源危机, 同时可避免环境污染[5–6]。对于秸秆降解, 微生物群落起着至关重要的作用, 微生物自身产生酶通过发酵与降解环境相互作用形成具有特定功能的菌群, 利用各自的功能及特性实现降解, 且其种类、数量、分布及其消长变化对降解具有重要的影响[7]。因此, 对秸秆降解中功能微生物菌群及其演替规律的研究显得尤为必要。本文拟就秸秆生物降解机理及功能微生物群落在秸秆降解研究方面进行综述, 为今后该领域研究发展提供借鉴。
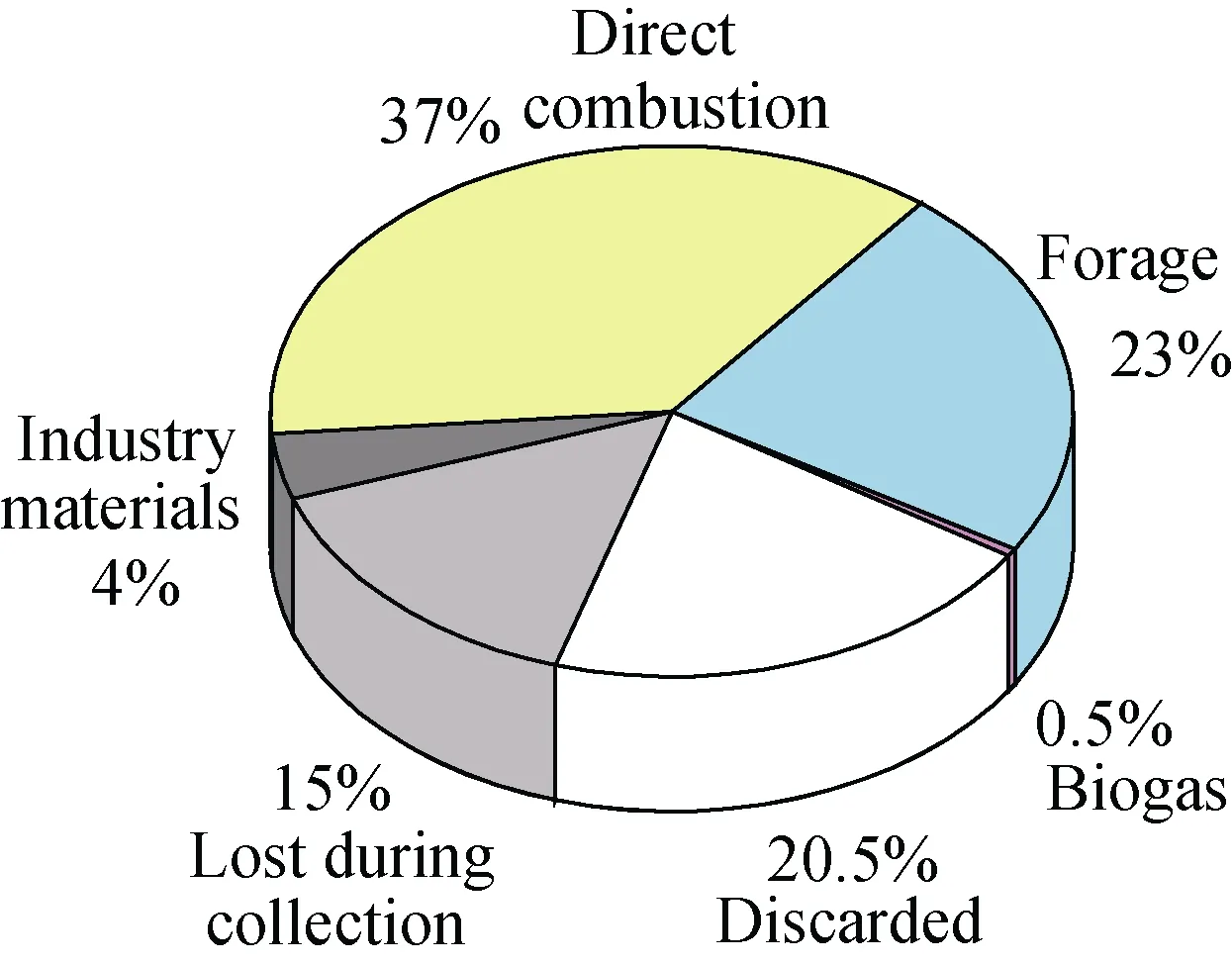
图1 中国农作物残留物利用情况[6]Fig. 1 Utilization of agricultural crop residues in China
2 秸秆的基本组成及降解机理研究
2.1 秸秆的主要组成成分
秸秆, 主要由纤维素、半纤维素和木质素三种高分子聚合物组成(表1)。纤维素由成千上万个葡萄糖残基通过β–1, 4–糖苷键链接而成的复杂多糖, 它与蛋白质、木质素、半纤维素以及矿物元素等物质紧密结合而难以水解; 半纤维素是一种杂多糖, 其成分有戊糖(D–木糖和 L–阿拉伯糖)、六碳糖(D–葡萄糖, D–甘露糖, D–半乳糖)、糖醛酸以及各种O–甲基糖; 木质素是由苯基丙烷()结构单元通过C–C键连接而成的芳香族高分子聚合物, 因含大量苯环结构而难以水解(图2)[8–9]。
2.2 秸秆的降解机理
秸秆在降解时需要预处理: 破坏木质纤维素结构, 除去木质素, 将纤维素、半纤维素暴露以利于水

表1 几种农作物秸秆的各成分含量[10]Tab. 1 The component contents of several kind of agricultural residues

图2 纤维素、半纤维素和木质素在细胞壁中的结构图[8]Fig. 2 Structure of cellulose, hemicellulose and lignin in the cell wall
解。国内外学者对此过程进行了许多物理及化学方面的研究, 但都存在较大的缺陷, 而利用生物法同样可达到降解的效果, 其成本低、安全环保、易操作等优点成为目前研究的热点[11–12]。
2.2.1 木质素的降解机理
降解木质素的主要功能酶有: 木质素过氧化物酶(lignin peroxidase)、锰过氧化物酶(mnlignin peroxidase)和漆酶(laccase)。因不同菌种分泌的酶有所不同, 故对木质素的降解需要多种菌株相互作用。目前对木质素的降解研究都是以白腐真菌为主要对象, 其中黄孢原毛平革菌(Phanerochete chrysosporium)已成为研究的模式菌株, 降解机理: 以功能酶为主, 催化木质素产生化学不稳定的自由活性中间体, 再发生一系列自发降解反应, 最终形成小分子物质[13]。其中木质素过氧化物酶(LiP)能够氧化非酚型化合物,使苯丙基结构中的Cα–Cβ键断裂及芳香环的打开(图3)。锰过氧化物酶(MnP)与LiP一样, 可预先催化木质素以促进氧化能力更强的LiP作用。漆酶(laccase)属于多酚氧化酶, 可使木质素中的苯酚结构单元失去电子被氧化, 产生含苯氧基的自由活性基团, 从而使芳香基及Cα–Cβ键裂解。研究发现真菌laccase酶对木质素既有解聚作用又有聚合作用, 故需要与MnP酶及LiP酶同时作用, 才能达到对木质素的高效降解[13–15]。
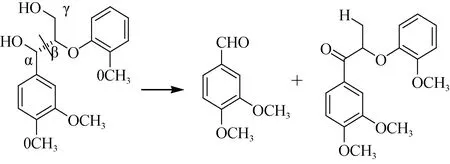
图3 Cα–Cβ键的断裂及Cα的氧化作用[14]Fig. 3 Cα–Cβcleavage and Cα oxidation in the degradation of lignin
2.2.2 纤维素的降解机理
关于纤维素的降解机理说法很多, 目前被大多数学者认同的是: 纤维素的降解是由外切葡聚糖纤维二糖水解酶(CBH)、内切葡聚糖酶(EG)以及纤维二糖酶(CB)或β–葡萄糖苷酶(BG)三种酶相互作用的结果。首先 EG对纤维素分子内的无定型区发动攻击, 随机将β–1, 4糖苷键水解, 形成CBH所需的游离末端; 然后CBH从多糖链的还原端或非还原端切下纤维二糖, 同时对纤维素分子内的结晶区、无定型区及羧甲基纤维素进行裂解; 最后由CB或者BG将纤维二糖水解成葡萄糖, 三种酶必须同时存在才能水解天然纤维素[16]。目前对纤维素的降解机制仍是亟需研究的热点问题。
2.2.3 半纤维素的降解机理
半纤维素是由几种不同类型单糖(五碳糖和六碳糖)构成的杂多糖, 包括木糖、阿拉伯糖、甘露糖和半乳糖等, 其主要结构形式是木聚糖[16],, 故完全水解需要内切–β–1, 4–D木聚糖酶、β–木糖苷酶以及几种辅助酶(α–L–阿拉伯糖苷酶、α–D–葡萄糖醛酸酶、乙酰酯酶、阿魏酸酯酶以及对香豆酸酯酶)等多种酶的协调作用, 而许多微生物能够分泌完整的木聚糖降解酶系统(表2), 如青霉菌(Penicillium)[8]。总之, 不同菌种分泌的酶有所不同, 故对秸秆的高效降解需要多种菌株相互配合作用。
3 秸秆降解中功能微生物菌群的研究
近年来, 秸秆的生物降解研究大大增加, 以缓解能源和资源紧缺问题。自然界中存在多种能够降解秸秆的需氧和厌氧微生物, 并且微生物种类不同,对秸秆的降解作用也不同[17–20], 这些降解菌通过共生或营养作用, 提高了酶活产量, 促进秸秆的降解。
3.1 秸秆降解的微生物菌群
目前已知能降解秸秆的微生物类群有细菌、放线菌及真菌等, 其中起主导作用的是真菌, 因为真菌产生的酶活力比细菌和放线菌高[21]。在整个降解过程中, 降解的成分不同微生物的种类也不同。其中就降解木质素的微生物而言, 研究最多的是木腐菌属的白腐菌[22]。Zeng等[23]使用固态发酵的方法,研究白腐菌预处理对小麦秸秆降解效果时发现, 黄孢原毛平革菌在补充无机盐的情况下, 可以显著提高降解率。除此之外, 细菌、放线菌也能降解木质素, 但相对降解能力较弱(表3)[19]。降解纤维素的微生物以霉菌为主(表4), 包括黑曲霉(Aspergillus niger)、青霉(Penicillium)以及木霉(Trichoderma)等[18], 因Trichoderma和Aspergillus niger含有完全水解天然纤维素所必须的三种纤维素酶组分故而得到了广泛的应用, 它们也能够很好的降解半纤维素[22]。

表2 各功能酶的作用机理[8,16]Tab. 2 The mechanism of the functional enzyme

表3 木质素降解菌群Tab. 3 The microbial community for lignolytic degradation

表4 纤维素降解菌群Tab. 4 The microbial community for cellulosic degradation
3.2 影响菌群降解秸秆的环境因素研究
秸秆降解微生物的生态分布随时间推移及环境条件的不同而发生变化, 尤其是细菌和真菌群落的动态变化最为显著[26]。同时人工接种外源微生物对降解菌群也有着不可忽视的影响。
3.2.1 时间
秸秆降解微生物起初以白腐真菌和无芽孢细菌为主攻击秸秆, 使秸秆难降解组分暴露以及一些易水解物质被先降解; 后以芽孢细菌和纤维素分解细菌为主开始活动; 后期微生物则以某些真菌、放线菌以及变形菌类群为主[26–27]。沈德龙等[28]采用传统培养及 PCR–DGGE技术研究得出在水稻腐解过程中微生物数量变化先升后降, 细菌数量始终占据优势, 其中参与腐解的微生物多达30种, 而不同阶段真菌菌落的动态变化差异较大。郁红艳等[29]采用Biolog方法对不同阶段细菌群落的动态变化进行研究得出降解初期细菌菌落丰富、生长快速, 整个群落结构发生着剧烈变化, 降解易降解物质; 到了中后期, 细菌活性下降, 群落变化趋于稳定。可见在降解中对木质纤维素进行降解的微生物包括嗜温细菌、真菌及放线菌。
3.2.2 温度
随着降解过程中温度的不断变化, 微生物的优势种群也发生着变化, 反应初期微生物处在温度不是很高的降解环境中, 因此嗜温细菌和真菌大量繁殖, 这些微生物在降解过程中释放出代谢热量, 使得环境温度逐渐升高, 从而嗜热微生物数量逐渐增多[30]。研究表明,占主导地位的嗜热菌为青霉菌、曲霉属和酵母菌, 以及放线菌和一些耐热的产芽孢细菌, 降解木质素的真菌也在这一阶段大量增多30–32]。Khalil等[33]发现在降解过程中随着温度升高,中温真菌的数量在逐渐减少, 嗜热真菌的数量逐渐增多并达到峰值, 当温度升到50℃时真菌开始减少,温度升到 62℃以上时真菌彻底消失, 当温度下降时真菌数量再次开始增多, 所以降解中温度的影响不可忽略。
3.2.3 气候条件
气候条件的变化对秸秆腐解也有很大影响, 尤其是降雨量, 其降水量的多少致使土壤含水量发生变化, 从而影响了微生物菌群的活性[34]。王晓玥等[35]利用Biolog方法研究不同气候条件下小麦和玉米秸秆腐解过程中的微生物群落变化时, 发现腐解微生物的碳源代谢活性表现出随气候变化的规律, 降雨量的增加与微生物群落呈负相关。Dilly等[36]通过梯度凝胶电泳(DGGE)研究细菌群落变化时发现年均温和降雨量有差异的德国南、北、中部地区秸秆腐解微生物群落具有不同表现。因此气候条件对秸秆腐解微生物的影响绝不次于腐解时间以及温度对秸秆降解的影响。
3.2.4 人工接种微生物
为了加快秸秆的降解, 国内外学者对秸秆降解中微生物的群落动态变化进行了一系列的研究, 表明人工接种外源微生物能够影响秸秆的降解, 加快秸秆降解速度[37]。然而人工接种外源微生物同时也会引起不一样的微生物群落演变, Zhao等[38]将微生物肥料接种到含有滤纸的土壤中发现滤纸的分解明显加快同时不同时期的细菌及真菌群落结构组成也受到了影响。Kausar等[39]将黑曲霉和木霉接种到稻草堆肥中发现稻草的分解明显加快, 其中在三周的降解过程中C/N比率从29.3减少到19.5。李培培等[40]选用三种促分解菌剂ND、NK 和 NS接种于玉米秸秆还田地中探究促分解菌剂对秸秆的分解效果及对土壤菌群结构的影响发现, 接种菌剂在早期对土壤细菌和真菌的群落结构会产生较大的影响, 且秸秆有效分解的速度也较快, 而随接种时间的推进, 土壤微生物群落的影响不明显, 促进效果也逐渐减弱。可见人工接种外源微生物对土壤土著微生物群落结构的影响只是暂时和局部的, 不会对原有种群产生负面影响, 但是在实践中也不该盲目接种外源微生物以促进降解。
3.2.5 其它因素
其它环境因素也会或多或少的影响秸秆的腐解,如土壤pH从5.2到4.4的差别下, 分解凋落物的微生物量逐渐变化, 微生物的优势种群也发生着变化[41]。刘海静等[42]在研究不同无机营养元素对秸秆降解菌株降解效果的影响中发现, Ca、Mg、Mn、Fe、Mo等元素能明显增进菌株对秸秆的降解, 可见无机营养元素的添加促进了秸秆微生物的降解。于建光等[43]在研究秸秆腐熟剂的施用效果时发现, 腐熟剂以不同方法施入土壤后, 土壤的微生物群落组成与活性相应地发生变化, 当腐熟剂与尿素配合施用时, 加快了小麦秸秆的腐解速度。所以在研究秸秆降解时任何影响降解的因素都应加以考虑, 在考虑全面的基础上才能更好地发挥降解作用。
总之, 整个降解过程中随着时间的推移以及外界环境的变化, 微生物群落的消长变化在重复进行着, 微生物的种类、数量、分布及其消长变化等对秸秆降解有着重大的影响。因此在对秸秆降解的微生物研究中, 对群落的变化与秸秆物质代谢、能量代谢过程的相关性应着重考虑, 使秸秆的生物降解过程能够更加明了准确, 为进一步开展将代谢类型不同的微生物进行适当组合并混合协同培养的应用研究工业规模研究奠定理论基础。
4 秸秆降解微生物菌群的利用研究
目前, 对微生物菌群的研究已经广泛渗入到各个领域, 包括环境科学, 生态学及环境工程等, 科研工作者们也开始着手秸秆降解微生物菌群的利用研究。尤其是对秸秆生物质能源的研究。
4.1 菌群在秸秆生物质能源利用中的应用研究
秸秆制造生物燃料的过程主要是微生物将纤维素及半纤维素降解成小分子糖类物质, 再通过发酵生成生物燃料。在对秸秆发酵生成生物燃料的研究中, 以细菌及酵母的研究较多, 而对菌群降解秸秆生成燃料的研究较少。王晓明等[44]采用酿酒酵母及毕赤酵母混合发酵膨化秸秆酶解液对乙醇产量进行研究发现, 单用酿酒酵母只能利用葡萄糖, 而混合发酵可同时利用葡萄糖和木糖, 葡萄糖的存在使毕赤酵母对木糖的利用产生抑制, 故在混菌发酵时葡萄糖的快速利用缩短了对木糖代谢的抑制, 使原料的利用率提高。Sakamoto等[45]以水稻秸秆为原料,构建重组了一个可表达多种外源酶的酿酒酵母, 使乙醇收益率(每克乙醇/每克水解稻草消耗的总糖)提高为0.41 g·g-1相当于82%的理论产量。Wu等[46]构建了一个由纤维素分解菌、产甲烷菌和非纤维素分解菌组成的微生物菌群, 该菌群能稳定地保持高效的纤维素分解, 不易退化, 且成功发酵产生甲烷。
4.2 困难和问题
虽然秸秆降解生成生物燃料被看作未来发展的方向, 但是就目前的情况来看, 此项技术并未取得实质性的突破, 许多研究只局限在筛选菌种这一阶段, 也有部分企业将其试图应用于工业化生产, 但过高的成本以及低转化率等问题阻碍了产业化进程[47]。并且微生物菌群混合使用在秸秆降解生成生物能源的研究欠缺, 菌群间的相互关系及作用机理的了解还不够深入, 尤其是菌群混合发酵降解秸秆生成燃料过程中, 会产生一系列的抑制化合物如肉桂酸[48]、乙酸[49]等, 会抑制酵母的生长和代谢, 这些因素均影响着生物质能源的利用, 故对混合体系中不同菌种间的协同性及其组合的考虑, 有待于进一步研究。
4.3 途径与措施
针对利用秸秆生成生物燃料成本高的问题, 笔者认为今后该领域的研究应从生理、代谢、遗传等角度, 并结合自然环境所形成的生物系统对菌间关系及作用机制进行深入研究, 探究最佳降解条件,并对微生物群落降解过程中各种酶活性变化与酶间关系进行深入研究, 从而使酵母生长和代谢的抑制以及生物燃料产率低的问题得以解决, 使秸秆降解体系达到最佳生态水平。同时也可设计新型生物反应器或微生物法复合处理技术, 例如固定化微生物技术, 提高秸秆的降解率以及生物燃料产率, Viola等[50]以麦秸为原料, 设计了一种特殊的生物反应器,这种反应器可以保持不同温度, 且具有多孔介质分离装置, 达到溶质分散的目的, 利用酶水解及发酵同时进行降解秸秆, 最终使乙醇产率提高 20%。可见若能将生物反应器技术与微生物菌群很好结合利用, 则有助于生物质能源的工业化生产。
5 展望
随着现代微生物技术的发展, 目前对秸秆降解微生物的分离、鉴定以及微生物功能菌群的变化规律的研究进展迅速, 降解秸秆的潜在菌种资源也在逐年增加, 故在进一步全面了解秸秆降解过程中各种微生物的消长和变化规律基础上, 将会在今后利用各种分子和基因工程技术, 构建出既具有混合培养功能, 能够分泌全面降解酶系的菌株, 又具有高效分泌能力, 代谢稳定且易调控的工程菌, 实现秸秆降解多种酶系统的再现和模拟。笔者所在课题组多年来从事微生物降解菌种及菌群方面的研究, 因此也积累了大量有关降解功能微生物菌群制备、培养及复合处理技术方面的研究经验。我们今后拟进一步开展秸秆的微生物降解菌群及其作用机制方面的深入研究, 特别对其中的优势菌株进行深入研究, 以获得经济高效、易于培养和大规模应用的微生物菌群制剂, 从而解决从摇瓶培养到工业化大规模生产的过渡, 以实现秸秆的现场大规模微生物降解应用。
总之, 对秸秆的生物降解研究应跨出传统阶段,利用现代高新技术与传统技术相结合的方法实现对木质纤维素的高效降解, 并实现大规模工业生产,相信秸秆降解的工业化将对全世界绿色能源的开发及利用发挥巨大的作用。
[1] QI Limei, ZHOU Baoping. Study on biomass energy utilization[J]. Advanced Materials Research, 2012, 512–515:562–565.
[2] ZHAO Xingang, WAN Guan. Current situation and prospect of China's geothermal resources[J]. Renewable and Sustainable Energy Reviews, 2014, 32: 651–661.
[3] LI Xia, HUANG Yongmei, GONG Jirui, et al. A study of the development of bioenergy resources and the status of eco–society in China[J]. Energy, 2010, 35(11): 4451–4456.
[4] 杜谋涛, 袁晓东, 郭和军. 我国生物质秸秆资源利用现状及展望[J]. 能源与环境, 2008, (2): 76–79.
[5] LIU H, JIANG G M, ZHUANG H Y, et al. Distribution,utilization structure and potential of biomass resources in rural China: With special references of crop residues[J].Renewable and Sustainable Energy Reviews, 2008, 12(5):1402–1418.
[6] ZHUANG Huiyong, ZHANG Yanru. The status quo and prospect of biomass power generation in China[J].Engineering Sciences, 2009, 7(2): 65–71.
[7] 王佳佳, 奚永兰, 常志州, 等. 麦秸不同部位生物降解速率差异[J]. 农业资源与环境学报, 2015, 32(1): 74–80.
[8] SAHA B C. Hemicellulose bioconversion[J]. Journal of Industrial Microbiology and Biotechnology, 2003, 30(5):279–291.
[9] IBRAHEEM O, NDIMBA BK. Molecular adaptation mechanisms employed by ethanologenic bacteria in response to lignocellulose derived inhibitory compounds[J].International Journal of Biological Sciences, 2013, 9(6):598–612.
[10] 赵蒙蒙, 姜曼, 周祚万. 几种农作物秸秆的成分分析[J].材料导报B: 研究篇, 2011, 25(8): 122–125.
[11] NILADEVI K N, SUKUMARAN R K, PREMA P.Utilization of rice straw for laccase production by Streptomyces psammoticus in solid–state fermentation[J].Journal of Industrial Microbiology and Biotechnology,2007, 34(10): 665–674.
[12] PARK J Y, SHIROMA R, et al. A novel lime pretreatment for subsequent bioethanol production from rice straw–calcium capturing by carbonation (CaCCO) process[J].Bioresource Technology, 2010, 101(17): 6805–6811.
[13] 郁红艳, 曾光明, 胡天觉, 等. 真菌降解木质素研究进展及在好氧堆肥中的研究展望[J]. 中国生物工程杂志,2003, 23(10): 57–61.
[14] XIA Z Y, YOSHIDA T, FUNAOKA M. Enzymatic degradation of highly phenolic lignin–based polymers(lignophenols)[J]. European Polymer Journal, 2003, 39:909–914.
[15] 陈立祥, 章怀云. 木质素生物降解及其应用研究进展[J].中南林学院学报, 2003, 23(1): 79–85.
[16] 王士强, 顾春梅, 赵海红. 木质纤维素生物降解机理及其降解菌筛选方法研究进展[J]. 华北农学报, 2010, 25:313–317.
[17] 文少白, 李勤奋, 侯宪文, 等. 微生物降解纤维素的研究概况[J]. 中国农学通报, 2010, 26(1): 231–236.
[18] OKUNOWO W O, GBENLE G O, OSUNTOKI A A, et al.Production of cellulolytic and xylanolytic enzymes by a phytopathogenic myrothecium roridum and some avirulent fungal isolates from water hyacinth[J]. African Journal of Biotechnology, 2010, 9(7): 1074–1078.
[19] 陈跃辉. 细菌Novosphingobium sp. B–7和Comamonas sp.B–9降解木质素及其降解基因研究[D]. 长沙: 中南大学,2013.
[20] 陈昕, 姜成浩, 罗安程. 秸秆微生物降解机理研究[J].安徽农业科学, 2013, 41(23): 9728–9731, 9740.
[21] XU Chengjiao, CAO Guangli, ZHAO Lei, et al. A dual–chamber reactor to assess the saccharification capability of the cellulytic microflora from straw waste[J]. Royal Societyof Chemistry, 2014, 4(19): 9617–9621.
[22] LU Lunwen, Study on biodegradation of corn straw[J].Advanced Materials Research, 2011, 301–303: 280–284.
[23] ZENG Jijiao, SINGH D, CHEN Shulin. Biological pretreatment of wheat straw by Phanerochaete chrysosporium supplemented with inorganic salts[J]. Bioresource Technology,2011, 102(3): 3206–3214.
[24] SANCHEZ C. Lignocellulosic residues: Biodegradation and bioconversion by fungi[J]. Biotechnology Advances,2009, 27: 185–194.
[25] GAI Y P, ZHANG W T, MU M Z, et al. Involvement of ligninolytic enzymes in degradation of wheat straw by Trametes trogii[J]. Journal of Applied Microbiol, 2014,117(1): 85–95.
[26] BASTIAN F, BOUZIRI L, NICOLARDOT B, et al. Impact of wheat straw decomposition on successional patterns of soil microbial community structure[J]. Soil Biology and Biochemistry, 2009, 41(2): 262–275.
[27] 谢茂芳, 吴坤, 薛保国. 参与玉米秸秆降解的真菌类型研究[J]. 河南农业科学, 2012, 41(12): 81–84.
[28] 沈德龙, 刘甲锋, 李力, 等. 复合菌系 RSS–4腐解稻秆过程中的菌系动态变化[J]. 微生物学杂志, 2011, 31(5):1–6.
[29] 郁红艳, 曾光明, 习兴梅, 等. 蔬菜–秸秆废物堆肥化中细菌群落变化研究[J]. 微生物学报, 2007, 47(1): 98–102.
[30] PETRIC I, SELIMBASIC V. Composting of poultry manure and wheat straw in a closed reactor: optimum mixture ratio and evolution of parameters[J]. Biodegradation, 2008, 19(1): 53–63.
[31] HUA Binbin, LU Yucai, WANG Jungang, et al. Dynamic changes in the composite microbial system MC1 during and following its rapid degradation of lignocellulose[J].Applied Biochemistry and Biotechnology, 2014, 172:951–962.
[32] 陈芙蓉, 曾光明, 郁红艳, 等. 堆肥化中木质素的生物降解[J]. 微生物学杂志, 2008, 28(1): 88–93.
[33] KHALIL A I, BEHEARY M S, SALEM E M. Monitoring of microbial population and their cellulolytic activities during the composting of municipal solid waste[J]. World Journal of Microbiology and Biotechnology, 2001, 17:155–161.
[34] KIMURA M, ASAKAWA S. Comparison of community structures of microbiota at main habitats in rice field ecosystems based on phospholipid fatty acid analysis[J].Biology and Fertility of Soils, 2006, 43(1): 20–29.
[35] 王晓玥, 蒋瑀霁, 隋跃宇, 等. 田间条件下小麦和玉米秸秆腐解过程中微生物群落的变化–BIOLOG分析[J]. 土壤学报, 2012, 49(5): 1003–1011.
[36] DILLY O, BLOEM J, VOS A, et al. Bacterial diversity in agricultural soils during litter decomposition[J]. Applied and Environmental Microbiology, 2004, 70(1): 468–474.
[37] 韩丽娜, 王泽槐, 李建国. 接种外源微生物菌剂对香蕉茎秆堆肥的影响[J]. 环境工程学报, 2012, 6(11):4215–4222.
[38] ZHAO Yong, LI Wu, ZHOU Zhihua, et al. Dynamics of microbial community structure and cellulolytic activity in agricultural soil amended with two biofertilizers[J].European Journal of Soil Biology, 2005, 41(1/2): 21–29.
[39] KAUSAR H, SARIAH M, MOHD S H, et al. Development of compatible lignocellulolytic fungal consortium for rapid composting of rice straw[J]. International Biodeterioration& Biodegradation, 2010, 64(7): 594–600.
[40] 李培培, 张冬冬, 王小娟, 等. 促分解菌剂对还田玉米秸秆的分解效果及土壤微生物的影响[J]. 生态学报, 2012,32(9): 2847–2854.
[41] MERILA P, MALMIVAARA–L M, SPETZ P, et al. Soil organic matter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest[J]. Applied Soil Ecology, 2010, 46(2): 259–267.
[42] 刘海静, 任萍. 无机营养元素对小麦秸秆降解菌降解效果的影响[J]. 中国农学通报, 2013, 29(6): 30–37.
[43] 于建光, 常志州, 黄红英, 等. 秸秆腐熟剂对土壤微生物及养分的影响[J]. 农业环境科学学报, 2010, 29(3):563–570.
[44] 王晓明, 邵丽杰, 曹焱鑫, 等. 双酵母发酵膨化秸秆酶解液产乙醇研究[J]. 化学工程, 2015, 43(1): 5–9.
[45] SAKAMOTO T, HASUNUMA T, HORI Y, et al. Direct ethanol production from hemicellulosic materials of rice straw by use of an engineered yeast strain codisplaying three types of hemicellulolytic enzymes on the surface of xylose–utilizing Saccharomyces cerevisiae cells[J]. Journal of Biotechnology, 2012, 158(4): 203–210.
[46] WU J M, MA A Z, CUI M M, et al. Bioconversion of cellulose to methane by a consortium consisting of four microbial strains[J]. Environmental Science, 2014, 35(1):327–333.
[47] 卢暄. 秸秆制燃料乙醇技术国内研发、中试现状及其产业化讨论[J]. 化学工业, 2011, 29(9): 26–43.
[48] TOMEK J K, CASTILLO S R C, CORDOBA V P F, et al.Removal and upgrading of lignocellulosic fermentation inhibitors by in situ biocatalysis and liquid–liquid extraction[J]. Biotechnology and Bioengineering, 2015, 112:627–632.
[49] ISMAIL K S, SAKAMOTO T, HASUNUMA T, et al. Zinc,magnesium, and calcium ion supplementation confers tolerance to acetic acid stress in industrial Saccharomyces cerevisiae utilizing xylose[J]. Biotechnology Journal, 2014,9(12): 1519–1525.
[50] VIOLA E, ZIMBARDI F, VALERIO V, et al. Use of a two–chamber reactor to improve enzymatic hydrolysis and fermentation of lignocellulosic materials[J]. Applied Energy,2013, 102: 198–203.
Progress in research of straw biodegradation mechanisms and functional microbial flora
XUE Lingui1,*, YANG Ruiqi1, MA Gaogao2, LI Guoqiang1, LI Wenwei1, MO Tianlu1
1. College of Chemical and Biology Engineering, Key Laboratory of Extreme Environmental Microbial Resources and Engineering Gansu Province, Lanzhoujiaotong University, Lanzhou 730070, China 2. Gansu Nonferrous Metal Geological Exploration Bureau, Lanzhou Mineral Prospecting Institution, Lanzhou 730030, China
Straw plays an essential factor for the development of human society. Finding the new renewable energy is an important subject under the background of current scenario of energy shortage. Here we made a brief induction of the relationship between the straw biodegradation mechanism and microbiology diversity and provided the theoretical foundation for the industrial application of biodegradation of straw.
straw; biodegradation; functional microbial flora; research progress
10.14108/j.cnki.1008-8873.2017.03.028
Q939.9
A
1008-8873(2017)03-193-07
薛林贵, 杨蕊琪, 马高高, 等. 秸秆的生物降解机理及其功能微生物菌群研究进展[J]. 生态科学, 2017, 36(3): 193-199.
XUE Lingui, YANG Ruiqi, MA Gaogao, et al. Progress in research of straw biodegradation mechanisms and functional microbial flora[J]. Ecological Science, 2017, 36(3): 193-199.
2015-10-03;
2015-12-01
国家自然科学基金项目(No: 31260135); 教育部长江学者和创新团队发展计划项目(No: IRT0966)
薛林贵(1964—), 男, 博士, 教授, 主要从事微生物生理、微生物工程方面的研究工作
*通信作者:薛林贵, E-mail: xuelg@mail.lzjtu.cn

