MicroRNA-187在胶质瘤中的表达及对预后判断的价值
高未华 樊锐太
(郑州大学第一附属医院 放疗科 河南 郑州 450052)
MicroRNA-187在胶质瘤中的表达及对预后判断的价值
高未华 樊锐太
(郑州大学第一附属医院 放疗科 河南 郑州 450052)
目的 探讨microRNA-187(miR-187)在不同级别胶质瘤的表达及其与临床病理参数和预后的关系。方法 收集郑州大学第一附属医院53例不同病理级别的胶质瘤及10例正常脑组织标本,通过qRT-PCR检测miR-187的表达水平;分析miR-187表达量与胶质瘤患者临床病理参数的相关性;通过Kaplan-Meier分析及log-rank检验评价不同表达水平与生存期的关系。结果 与正常脑组织相比,miR-187低表达于胶质瘤组织(P<0.05),miR-187在胶质瘤组织中的表达水平与肿瘤大小、WHO分级、KPS评分和增殖分数Ki-67相关(P<0.05),与患者的年龄,性别及肿瘤部位无关(P>0.05),在生存分析中,低表达miR-187的胶质瘤患者预后较差。结论 miR-187在胶质瘤细胞中的表达水平显著降低,与肿瘤大小、WHO分级、增殖分数Ki-67和KPS评分及预后密切相关。miR-187在胶质瘤的诊断与治疗中有重要意义,可能作为新型胶质瘤预后相关的分子靶标。
胶质瘤;miR-187;预后
胶质瘤是最常见的中枢神经系统肿瘤,年发病率为4~5/10万,具有高侵袭性、高死亡率的特点,不同病理类型的胶质瘤预后存在差异,其中间变型星形细胞瘤中位生存期为2~5 a,而恶性程度最高的胶质母细胞瘤仅为12~15个月[1]。近年来,采用手术结合放化疗的综合疗法显著提高了胶质瘤的治疗效果,但其预后仍不容乐观,进一步探索与胶质瘤诊断与预后相关的新型生物标记物,会为胶质瘤的精确治疗提供新的思路。
MicroRNA(miRNA)是一类内源性非编码单链小分子RNA,其在转录后水平上调节靶基因的表达,参与多种生理和病理功能的调控[2]。目前有研究表明,miR-187的异常表达与乳腺癌[3]、前列腺癌[4]、肾癌[5]及结直肠癌[6]等多种肿瘤相关,而miR-187在胶质瘤中的作用尚无报道。故本文旨在研究miR-187在胶质瘤不同病理级别中的表达水平及预后价值,为进一步探索脑胶质瘤基因治疗的潜在靶点提供方向。
1 资料和方法
1.1 实验材料
1.1.1 标本收集 运用随机抽样方法选取郑州大学第一附属医院2013年9月至2014年9月胶质瘤标本53例,其中男35例,女18例,中位年龄为52岁(38~79岁)。根据WHO分级,其中低级别胶质瘤22例,Ⅰ级6例,均为脑膜瘤。Ⅱ级16例,包括弥漫性星形细胞瘤9例,少突胶质细胞瘤7例。高级别胶质瘤31例,Ⅲ级17例,包括间变性少突胶质细胞瘤10例,混合性胶质细胞瘤7例。Ⅳ级14例,均为胶质母细胞瘤。另选取同期因脑出血、脑外伤切除的正常脑组织10例作为对照组。每例标本先经液氮临时保存,然后-80 ℃储存以备提取组织总RNA。所有标本均经病理学证实,入组患者术前均未进行过放化疗等治疗。本研究获得医院伦理委员会批准。
1.1.2 主要试剂及仪器 TRIzol总RNA提取试剂购于美国thermo公司;miRNA反转录试剂盒及SYBR Premix Ex TaqTM Ⅱ购自日本TAKARA公司;Real-time PCR引物购自上海生工合成;荧光定量PCR仪购于赛默飞世尔科技公司。
1.2 Real-time PCR 分别取液氮中保存的胶质瘤组织,正常脑组织,用TRIzol提取总RNA,提取后使用核酸定量仪测定浓度及纯度,而后置于-80 ℃的冰箱中保存,所有操作参照说明书及参考文献。用miRNA cDNA第一链合成试剂盒进行逆转录。PCR扩增的步骤如下:95 ℃ 10 min预变性,95 ℃ 15 s后60 ℃ 10 s,进行40个循环,于4 ℃保存。每个样品3个重复孔,目的产物的量通过公式2-△△CT计算。
1.3 统计学方法 应用SPSS 17.0统计学软件分析数据,采用GraphPad Prism绘制统计图,组间对比采用t检验,相关性分析采用χ2检验,利用Kaplan-Meier法及Log-Rank检验进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-187低表达于胶质瘤组织 利用Real-time PCR技术检测不同级别的胶质瘤组织和正常脑组织中miR-187的相对表达量,结果表明,脑胶质瘤组织,正常脑组织中miR-187的表达量分别为(0.836 8±0.604 2)比(2.406 2±0.944 1),与正常脑组织相比,miR-187在脑胶质瘤中低表达(P<0.05,t=5.065)。且miR-187在高级别胶质瘤中的表达明显低于低级别胶质瘤(P<0.05,t=2.043)。
2.2 miR-187表达与胶质瘤相关性分析 根据miR-187表达水平对53例胶质瘤组织样本分组,表达量的平均数为0.836 8,高表达组指miR-187表达水平高于平均水平的患者,共30例,其余为低表达组,共23例。结果提示,胶质瘤组织中miR-187的表达水平与肿瘤大小、WHO分级、增值分数Ki-67和KPS评分密切相关,差异有统计学意义(P<0.05),与患者的年龄,性别及肿瘤部位差异无统计学意义(P>0.05)。见表1。
2.3 miR-187表达与患者预后的关系 53例胶质瘤患者随访截止至2016年3月或死亡,低表达组中位生存期为12.4个月,高表达组为23.1个月。结果显示,miR-187高表达组的预后明显优于低表达组,差异有统计学意义(HR=2.532,95%CI:1.206~5.313,P<0.05)。见图1。
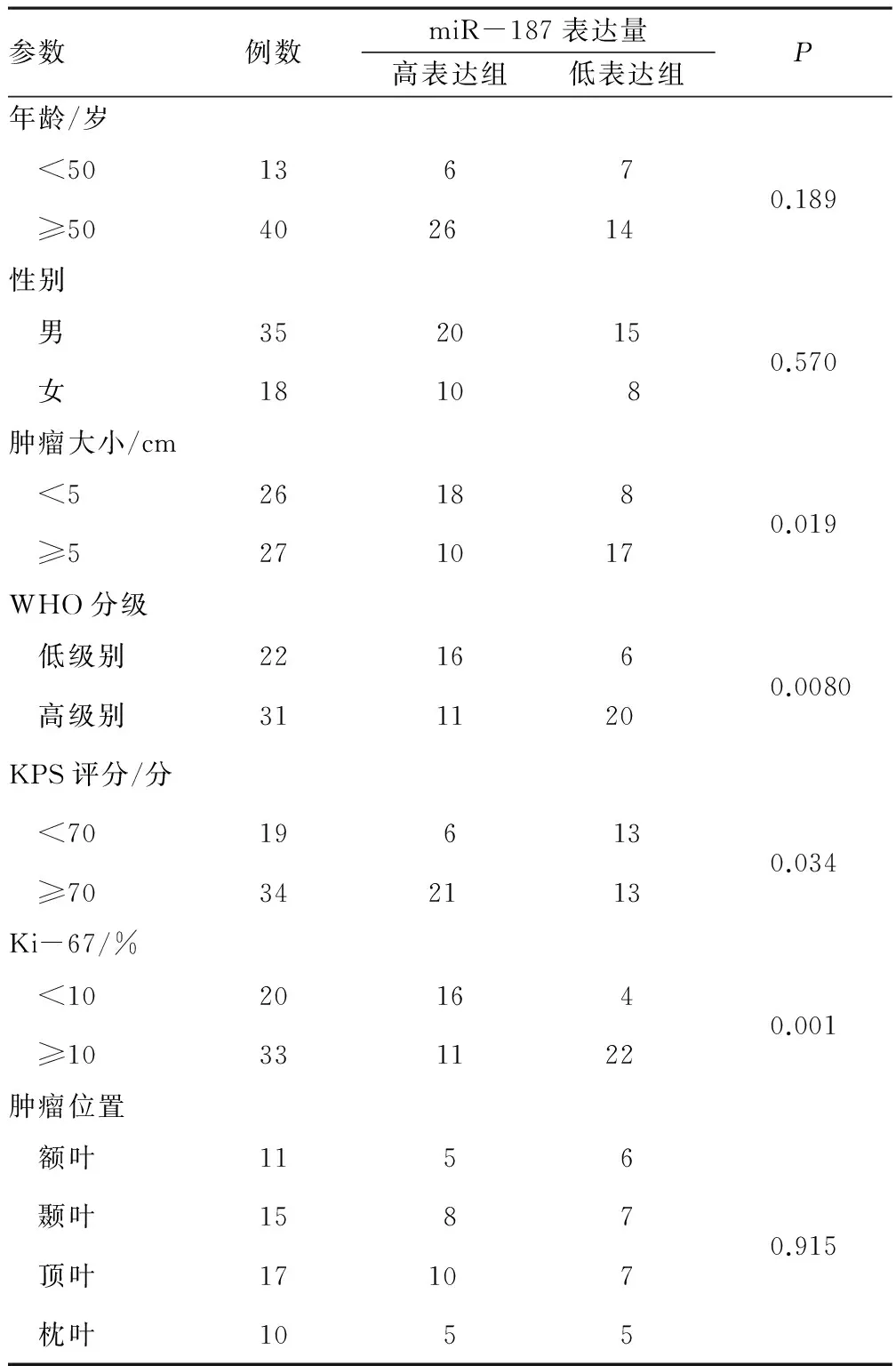
表1 胶质瘤患者miR-187表达量与临床病理参数的相关性
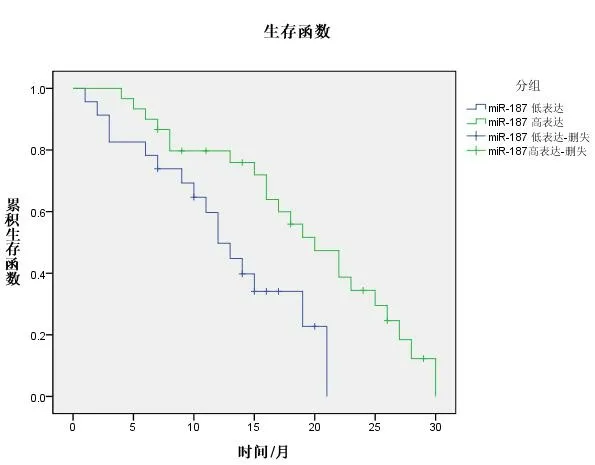
图1 miR-187高/低表达组胶质细胞瘤患者的K-W曲线
3 讨论
miRNA是核苷酸片段构成的内源性非编码单链小分子RNA,通过与细胞内特定mRNA的3’-UTR 碱基配对结合,影响蛋白质的翻译过程,调节相关蛋白质在生命体中的表达水平[7],在细胞的生长、分化、增殖和凋亡等过程中均发挥着重要作用。目前已明确肿瘤细胞中存在多种miRNA分子片段,不同miRNA产生的生物学效应也不一样,表达水平也存在差异。在胶质瘤细胞中miR-210、miR-155、miR-132和miR-200a显示高表达,而miR-34a、miR-206、miR-200b和miR-134显示低表达[8]。
目前研究发现,miR-187可能具有细胞或器官特异性[9],在不同组织、器官中表达存在差异。miR-187在卵巢癌中高表达与较好的生存率相关,但在宫颈癌HeLa细胞中,miR-187过表达将诱使细胞失活甚至凋亡[10],不同的肿瘤类型中miR-187表达水平的差异提示我们需要进一步证实miR-187在其他肿瘤中的表达变化与发病机理。虽然已有学者针对一些miRNA在胶质瘤发生发展中的影响进行了研究,但miR-187在胶质瘤中的表达情况并不明了。
研究证实,在肺癌细胞中miR-187通过阻碍细胞从G1向S期转化阻止癌症进展,其中B7-H3被证实是miR-187的转录产物,B7-H3是一类通过激活jak2/STAT3通路的致癌基因,可促进肿瘤增殖与转移,miR-187通过沉默B7-H3使细胞周期停止于G0/G1期,从而减缓细胞增殖[11]。同时也有研究发现miR-187可抑制晚期结直肠癌细胞的上皮间质化转变,从而提高患者生存率[12]。近年来,miR-187在各种实体肿瘤中的生物学特性逐渐被重视,随着其调控机制及对细胞增殖、凋亡、侵袭和转移的研究不断深入,其医学价值不断提升。本课题首次探索miR-187在脑胶质瘤组织中的表达情况,进一步明确其生物学特性,利用其高度敏感性及特异性的优势,探究其能否成为临床上指导治疗,提示预后的生物学指标,为今后进一步明确miR-187在胶质瘤细胞中的分子生物学机制打下了夯实的基础,给脑胶质瘤的临床诊疗工作提供新的思路。
本研究通过qRT-PCR分析了miR-187在不同级别的脑胶质瘤及正常脑组织的表达情况,深入探讨miR-187在脑胶质瘤中的表达水平与各项临床病理参数之间的关系。经过统计学分析,发现miR-187在高级别胶质瘤组织(WHO Ⅲ、Ⅳ级)的表达水平明显低于低级别胶质瘤(WHO Ⅰ、Ⅱ级)和正常脑组织(P<0.05)。随着胶质瘤病理级别的增高,miR-187的表达水平显著性降低,提示miR-187与脑胶质瘤的发生发展密切相关。相关性统计分析显示,miR-187与胶质瘤的恶性程度负相关,胶质瘤组织引起miR-187表达水平受到抑制,且随着胶质瘤恶性程度增加,miR-187受抑制程度也逐渐增大。与此同时,miR-187与肿瘤大小、增殖分数Ki-67负相关,与KPS评分正相关。肿瘤形态越大,Ki-67数值越高意味着miR-187表达水平相对越低,而身体情况较好,KPS评分较高的患者其miR-187表达水平也相对较高(P<0.05)。Kaplan-Meier分析结果进一步验证了miR-187表达水平越低,提示生存预后越差。基于目前的研究成果,我们有理由推断miR-187表达水平越低,抑制肿瘤细胞凋亡、转移及侵袭的能力越差,胶质瘤患者预后也越差。
综上,本研究首次证实了miR-187在人胶质瘤组织中低表达且与预后相关。胶质瘤中miR-187低表达意味着生存率低,提示miR-187可能成为胶质瘤侵袭及预后特异标志物及治疗靶点,为胶质瘤的诊治提供了新的实验依据及方向,但miR-187在胶质瘤中低表达相关分子机制仍不明确,因此,其下游靶基因是本课题进一步的研究方向。
[1] Zhao W,Wang C,Wang J,et al.Relationship between cacyBP/SIP expression and prognosis in astrocytoma[J].J Clin Neurosci,2011,18(9):1240-1244.
[2] Zen K,Zhang C Y.Circulating microRNAs: a novel class of biomarkers to diagnose and monitor human cancers [J].Med Res Rev,2012,32(2):326-348.
[3] Mulrane L,Madden S F,Brennan D J,et al.MiR-187 is an independent prognostic factor in breast cancer and confers increased invasive potential in vitro[J].Clin cancer Res,2012,18(24):6702-6713.[4] Casanova-Salas I,Masia E,Arminan A,et al.MiR-187 Targets the Androgen-Regulated Gene ALDH1A3 in Prostate Cancer [J].PLoS One,2015,10(5):e0125576.
[5] Zhao J,Lei T,Xu C,et al.Micro RNA-187,down-regulated in clear cell renal cell carcinoma and associated with lower survival,inhibits cell growth and migration though targetingB7-H3[J].Biochem Biophys Res Commun, 2013,438(2):439-444.
[6] Zhang F,Luo Y,Shao Z,et al.MicroRNA-187,a downstream effector of TGFβ pathway,suppresses Smad-mediated epithelial-mesenchymal transition in colorectal cancer [J].Cancer Lett,2016,373(2):203-213.
[7] Liu X,Zheng Q,Vrettos N,et al.A MicroRNA precursor surveillance system in quality control of MicroRNA synthesis[J].Mol Cell,2014,55 (16):868-879.
[8] Lai N S,Dong Q S,Ding H,et al.MicroRNA-210 overexpression predicts poorer prognosis in glioma patients[J].J Clin Neurosci,2014,21(5):755-760.
[9] Zhao J,Lei T,Xu C,et al.MicroRNA-187,down-regulated in clear cell renal cell carcinoma and associated with lower survival,inhibits cell growth and migration though targetingB7-H3[J].Biochem Biophys Res Commun,2013,438(2):439-444.
[10] Park S Y,Lee J H,Ha M,et al.MiR-29 miRNAs activate p53 by targeting p85 alpha and CDC42[J].Nat Struct Mol Biol,2009,16 (1):23-29.
[11] Sun C,Li S,Yang C,et al.MicroRNA-187-3p mitigates non-small cell lung cancer (NSCLC) development through down-regulation of BCL6[J].Biochem Biophys Res Commun, 2016,471(1):82-88.
[12] Zhang F,Luo Y,Shao Z,et al.MicroRNA-187,a downstream effector of TGFβ pathway,suppresses Smad-mediated epithelial-mesenchymal transition in colorectal cancer [J].Cancer Lett,2016,373(2):203-213.
Expression of microRNA-187 in glioma tissue and its value in predicting prognosis
Gao Weihua, Fan Ruitai
(DepartmentofRadiotherapy,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To investigate the prognostic roles of ectopic expression of miR-187 in glioma, and the relationship between miR-187 expression level and clinical significance.Methods The specimens from the First Affiliated Hospital of Zhengzhou University were collected, including 53 glioma tissues, 10 cases of normal brain tissues. Quantitative real-time polymerase chain reaction (qRT-PCR) was used to measure the expression of miR-187 in all specimens. In addition, the clinical pathological features of gliomas were reviewed, and the correlation between the features and the expression of miR-187 were analyzed. Survival curves of the patients were calculated using the Kaplan-Meier method and the data were analyzed with the log-rank test.Results The results revealed that miR-187 expression level in glioma tissues was significantly lower than those in normal brain tissues (P<0.05). Moreover, higher expression of miR-187 was significantly associated with larger tumor size, higher WHO grade, lower Karnofsky performance score (KPS), and higher percentage of Ki-67(P<0.05).Conclusion MiR-187 down-regulation was associated with negatively pathological grade, large tumor, over-expression of Ki-67, and low KPS. It is the first data to prove that expression level of miR-187 may be a novel and valuable prognostic factor in glioma.
miR-187;glioma;prognosis
R 739.41
10.3969/j.issn.1004-437X.2017.08.006
2016-12-03)

