柑橘黄龙病蒸汽快速热处理升温特性及田间防治效果
贾志成,Ehsani Reza,郑加强,许林云,周宏平,丁 锐
(1. 南京林业大学机械电子工程学院,南京 210037;2. 美国佛罗里达大学柑橘研究与教育中心,莱克艾尔弗雷德 33850)
柑橘黄龙病蒸汽快速热处理升温特性及田间防治效果
贾志成1,2,Ehsani Reza2,郑加强1※,许林云1,周宏平1,丁 锐1
(1. 南京林业大学机械电子工程学院,南京 210037;2. 美国佛罗里达大学柑橘研究与教育中心,莱克艾尔弗雷德 33850)
为了深入了解柑橘黄龙病湿热蒸汽快速热处理时韧皮部的升温特性,针对柑橘黄龙病细菌位于韧皮部的特点,构建了室内和田间试验装置,主要包含加热罩、湿热蒸汽发生装置、树体表面和韧皮部温度采集装置。通过比较热处理前后韧皮部温度变化,作物恢复程度差异和黄龙病病菌浓度变化,分析获取湿热蒸汽快速热处理合理参数组合。室内试验选用1 a生柑橘树,研究了树体表面温度为55~65℃,蒸汽输送压力为0.015和0.03 MPa,不保温和保温处理30 s对于韧皮部升温和作物恢复的影响。试验结果:树体表面温度为65 ℃及以上时,作物都因热损而死亡,采用60 ℃作为热处理温度阈值,有利于韧皮部温度提高。较高的蒸汽输送压力(如0.03 MPa),虽有利于作物所在环境温度的快速升高,但其作用于韧皮部的传热时间短,韧皮部温度并没有得到有效提高,而加热后的30 s保温处理普遍有利于韧皮部温度提高。田间试验选用9 a生柑橘树,研究了树体表面温度为60 ℃,蒸汽输送压力为0.03 MPa,保温时间30 s的组合参数对于黄龙病病菌浓度和作物恢复的影响。试验结果:4棵染病柑橘树经过热处理,其中2棵恢复到未染病状态,2棵病菌浓度降低。2棵未经过热处理的染病柑橘树,其病菌浓度没有变化。室内和田间试验结果表明:湿热蒸汽快速热处理能有效促进染病柑橘树的生命力恢复,明显降低病菌浓度;对于柑橘黄龙病田间湿热蒸汽快速热处理,不能只关注树体表面温度的快速提高,而应关注韧皮部温度的有效提高;热处理应考虑直接蒸汽加热和关闭蒸汽后保温的综合影响,为了增加韧皮部传热,应尽量选取较高升温上限和较低输送压力。研究结果为柑橘黄龙病田间热处理防治提供参考。
病害防治;热处理;温度;柑橘黄龙病;韧皮部;升温特性
0 引 言
柑橘黄龙病(citrus huanglongbing,HLB)是由韧皮部杆菌属类细菌(Candidatus Liberibacter Spp.)引起的一种毁灭性柑橘病害,在全球40多个国家和地区均有分布[1-5],由于其危害严重和致死率高被称为柑橘“癌症”。世界主要柑橘产区长期经受黄龙病危害,巴西圣保罗州黄龙病感染率达到53.4%,研究表明如果对黄龙病不加以植物检疫控制,未来20 a后,该州因黄龙病造成的经济损失累计将达到89.70亿美元,产量将锐减45.3%[6-7]。美国佛罗里达州已遍布亚洲木虱和黄龙病[8]。中国柑橘果园90%位于山地,立地条件差[9-11]。现有柑橘栽培的19个省、区中有11个遭受黄龙病危害[12-14]。
利用热处理方法防治柑橘病害由来已久,主要用于嫁接脱毒,近年来开始应用于田间防治。按传热介质可分为干热空气热处理、热水热处理和湿热蒸汽热处理。骆学海对染病柑橘芽条用48 ℃热水,对病苗用47 ℃热水进行6 min间歇处理消毒,证明热水脱毒有效[15]。林孔湘发现利用饱和水蒸气在短时间内可有效破坏黄龙病病菌致病力且不损伤芽条生命力,证明在湿热空气中,芽条过热致死温度与黄龙病病菌耐受温度间有明显差距[16-17]。Doud等使用田间移动温室进行太阳光照热处理[18-20],大部分染病柑橘树表现出恢复性生长,9个月后检测发现黄龙病病菌浓度降低。Hoffman M T等使用温度可控的生长室进行干热空气热处理,发现黄龙病病菌浓度降低且所有存活柑橘树长势旺盛,而未经处理的仍高度感染[21]。
美国佛罗里达大学柑橘研究与教育中心对感染黄龙病的成年柑橘树进行红外热处理。结果表明大部分染病柑橘树病情得到缓解,长势良好。热处理后柑橘树的生理恢复程度和PCR病理分析结果表明,55 ℃是干热空气热处理较佳环境温度,但存在加热慢,热效率低,热伤害明显的缺点[22]。为了提高热处理田间应用效率,进一步采用工业湿热蒸汽作为传热介质,成功将热处理时间缩短至1~2 min,且经热处理后的染病柑橘树大部分呈现恢复性生长[19,22-24]。上述研究结果表明,使用不同传热介质对于柑橘黄龙病进行热处理都能够起到一定的防治效果。其中,光照热处理由于受气候影响,处理耗时,不适合田间快速应用。
本文研究目的是针对湿热蒸汽传热介质,通过室内模拟田间封闭环境内柑橘作物快速热处理,分析快速热处理时封闭环境内致死温度上限,蒸汽输送压力和保温时间对韧皮部升温的影响,进而开展田间热处理防治试验,为柑橘黄龙病的田间快速热处理参数选择和方案确定提供依据。
1 试验装置及方法
1.1 黄龙病快速热处理原理、方法、测定指标和温度采集装置设计
柑橘黄龙病快速热处理是利用移动加热罩罩住染病柑橘作物,通入干热空气、湿热水雾或湿热蒸汽等传热介质,使罩内温度快速升温。热量通过介质,透过树皮,传递到韧皮部区域,在2~5 min内使韧皮部温度高于病菌耐热温度极限,抑制甚至杀灭病菌,使柑橘作物恢复生机。初步测试发现,田间湿热蒸汽快速热处理时黄龙病病菌的耐热温度上限约为55 ℃,成年柑橘树生理耐热温度上限约为65 ℃。当然,这还取决于对热损程度的判断和接受程度。该方法利用植物本体与致病菌耐热温度上限差,通过快速传递热量抑制甚至杀灭位于韧皮部的黄龙病病原细菌,不使用农药、抗生素等化学物质,经济环保,且不受气候条件影响[25]。本文采用的1 a生柑橘树,树皮及韧皮部整体厚度平均值仅为0.6 mm,截取枝干直径平均值为6 mm。所用9 a生柑橘树树皮及韧皮部整体厚度平均值为1.3 mm,截取枝干直径平均值为16 mm。树皮与韧皮部整体厚度仅占截取枝干直径的1/10甚至更少,这为热量有效传递到韧皮部提供了条件。
为了提高热处理传热效果,同时减少对田间柑橘作物的热伤害,首先在室内对湿热蒸汽快速热处理效果的影响因素进行测试,以确定合理参数组合。然后进行田间湿热蒸汽快速热处理试验,根据热处理前后黄龙病病菌浓度变化和作物恢复情况,对热处理效果进行验证。病菌浓度检测采用实时荧光定量聚合酶链式反应,(polymerase chain reaction-PCR),PCR实质是特异性片段的体外酶促合成反应。通过已公布的黄龙病菌核酸序列,设计特异性引物对,体外离体对目的片段进行克隆。扩增时加入荧光染料,荧光染料与扩增形成的产物结合而发出荧光被检测器实时检测。由于初始模板量不同,反应管内的荧光物质达到设定的可检测阈值时所经历的循环数不同,因此,Ct值(cycle threshold value, Ct)可用于判定检测样品的初始菌量。一般Ct数值越低,意味着越容易检测到,即病菌浓度越高,通常Ct值高于32可视为未感染[26-30]。
鉴于柑橘黄龙病致病菌所处位置比较特殊,即只存在于韧皮部,本文设计了树体表面及韧皮部温度测试装置,由意大利Arduino公司的Mega2560控制开发板和美国Adafruit公司的AD8495模拟输出放大电路构成,具有16通道。通过编程和水浴校准,连接美国Omega公司的微型铜-康铜T型热电偶,导线直径为0.25 mm,测温范围−200~260 ℃,测温精度为0.01 ℃。加热罩内环境温度监测装置由美国Omega公司的RDXL12SD12通道温度记录仪和铜-康铜T型热电偶构成,导线直径为0.51 mm,测温范围−200~260 ℃,测温精度为0.01 ℃。
韧皮部温度测试方法:柑橘作物的韧皮部与树皮紧密相连,从树体表面很难区分,因此将枝干截断,在截面上韧皮部和木质部的分界处,选取圆周对称位置,采用0.3 mm的微型钻头开2~3个20 mm的深孔。为避免端部传热影响,钻孔时应确保钻孔沿分界面往下且避免穿透树皮。在钻孔内埋入微型T型热电偶直至钻孔底部,在端面处用绝热胶密封,以确保热电偶所测试的韧皮部温度变化只来源于透过树皮表面传热,如图1所示。

图1 热处理时韧皮部温度测试示意图Fig.1 Diagram of outer and inner bark temperature testing
1.2 室内湿热蒸汽快速热处理试验装置及方法
1.2.1 室内湿热蒸汽快速热处理试验装置设计
室内湿热蒸汽快速热处理试验装置如图2所示,加热罩采用密闭金属柜,使用120 ℃的饱和湿热蒸汽作为传热介质,输出压力范围为0~0.5 MPa。为达到向柜内均匀快速输送蒸汽的目的,柜内设置3根呈品字形布置的蒸汽输送管路,其中1根管路位于柜体后部中间位置,安装呈90°夹角的两列喷头,每列按柜体高度均布4个喷头。2根管路位于柜体内左右两端位置,每列按柜体高度均布4个喷头,面向柜体中心。室内环境温度为30 ℃。使用时,设置蒸汽输送压力后,湿热蒸汽由柜体上端的总管道输入,通过Y形支管分别输送至3根内部蒸汽管路,打开开关,将湿热蒸汽快速输送至柜内空间,升到指定温度后迅速关闭蒸汽输送阀门,完成热处理后打开柜门,待完全冷却后,继续进行下一组热处理。整套装置使用湿热蒸汽作为传热介质,压力可调,温度可测,热处理迅速。
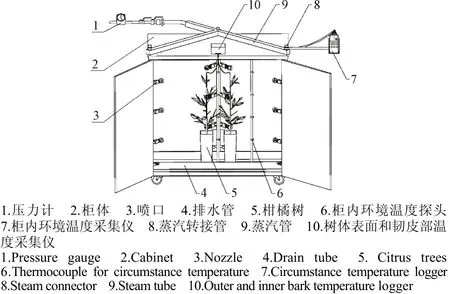
图2 室内湿热蒸汽快速热处理试验装置示意图Fig.2 Diagram of indoor testing system of rapid steam treatment
1.2.2 室内湿热蒸汽快速热处理试验和数据处理方法
室内湿热蒸汽快速热处理试验对象为1 a生染病柑橘树,设置湿热蒸汽输送压力,开始输送蒸汽加热直到指定的柜内环境温度上限(55~65℃)后,停止加热,同时记录树体表面和韧皮部温度变化,分析湿热蒸汽快速传热对升温速度和升温上限的影响。
树体表面和韧皮部温度测试布置如图3所示,在已经选取的用于韧皮部温度测量的枝干外表面,捆绑1个微型T型热电偶以测量该枝干树体表面温度。热电偶测点位置尽量贴近树皮但不和树皮接触。
试验时,16通道微型热电偶温度记录仪记录树体表面和韧皮部温度。计算每次升温差值和升温时间平均值。在达到设定环境温度前提下,对韧皮部温度的升温曲线及升温差值进行比较,分析升温速度和传热效果。持续观察热处理后苗木存活情况,分析湿热蒸汽快速热处理时韧皮部温度变化。
根据目前国内外研究现状[19,22-24],初步设定主要试验参数为树体表面温度、热处理后保温时间和湿热蒸汽输送压力。树体表面温度设为55,60和65 ℃,湿热蒸汽输送压力设为0.015和0.03MPa,保温时间设为0和30 s。

图3 室内湿热蒸汽快速热处理树体表面和韧皮部温度测试实物图Fig.3 Inner and outer bark temperature test of indoor rapid steam treatment
试验时,每2棵为1组,每一温度区间按照输送压力和保温参数组合,分别做4组热处理,3个温度区间共计12组24棵柑橘树。调节湿热蒸汽输送压力为0.015和0.03 MPa。打开开关,进行室内湿热蒸汽快速热处理,同时记录温度。当树体表面升温至55,60和65 ℃时,停止加热,分别做不保温和保温30 s处理,关闭温度记录仪。为了消除热处理后残余热量的影响,每组试验结束后冷却15 min再进行下一组试验。
1.3 田间湿热蒸汽快速热处理试验装置及方法
1.3.1 田间湿热蒸汽快速热处理试验装置设计
田间试验装置如图4所示,采用美国Sioux公司蒸汽机(型号为SF-20),加热罩由涤纶材料制成,尺寸为3 m×3 m×3 m(长×宽×高)。

图4 田间湿热蒸汽快速热处理试验装置实物图Fig.4 Field testing system of rapid steam treatment
作业时,卡车将田间试验系统运载至热处理现场,液压缸驱动加热罩覆盖柑橘树,蒸汽机启动,湿热蒸汽快速输送至罩内空间,完成热处理后迅速收回,继续移至下一棵柑橘树进行热处理。整套系统使用120 ℃的饱和蒸汽作为传热介质,输出压力在0~0.1 MPa之间可调,可在1~3 min内完成对一棵成年柑橘树的田间热处理,适合于平原大面积果园。
1.3.2 田间湿热蒸汽快速热处理试验方法
田间湿热蒸汽快速热处理试验选用4棵感染黄龙病的9 a生柑橘树,移动加热罩罩住树体,开始输送湿热蒸汽进行加热。根据室内湿热蒸汽快速热处理和田间热处理早期测试结果,设定试验参数组合。当罩内加热到指定温度后,停止加热并保温。记录树体表面和韧皮部温度变化,分析蒸汽快速传热对升温速度和升温上限的影响。同时选取2棵感染黄龙病且未经热处理,2棵健康的9a生柑橘树作为参照。
田间湿热蒸汽快速热处理时树体表面和韧皮部温度测试布置如图5所示。

图5 田间湿热蒸汽快速热处理时树体表面和韧皮部温度测试实物图Fig.5 Inner and outer bark temperature test of field rapid steam treatment
2 室内湿热蒸汽快速热处理试验结果分析
2.1 升温上限55 ℃的升温曲线
试验参数组合设置:树体表面升温上限为55 ℃,蒸汽输送压力为0.015和0.03 MPa,保温时间为30 s。每组试验数据取平均值,4组试验升温曲线如图6所示。

图6 室内湿热蒸汽快速热处理树体表面升温至55℃时升温曲线Fig.6 Heating curve of indoor rapid steam treatment till outer bark temperature was 55℃
压力0.015 MPa,当树体表面升温至55 ℃时即停止输送蒸汽且不进行保温:韧皮部由34 ℃升温至44 ℃为止;保温30 s的热处理:树体表面首先升温至55 ℃,韧皮部由36 ℃升温至50 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至58 ℃,韧皮部继续升温至56 ℃。
压力0.03 MPa,当树体表面升温至55 ℃时即停止输送蒸汽且不进行保温:韧皮部由30 ℃升温至40 ℃为止;保温30 s的热处理:树体表面首先升温至55 ℃,韧皮部由31 ℃升温至38 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至58 ℃,韧皮部继续升温至51 ℃。经观察,经过热处理和保温处理的柑橘树都生长正常。
2.2 升温上限60℃的升温曲线
试验参数组合设置:树体表面升温上限为60 ℃,蒸汽输送压力为0.015和0.03 MPa,保温时间为30 s。每组试验数据取平均值,4组试验升温曲线如图7所示。
压力0.015 MPa,当树体表面升温至60 ℃时即停止输送蒸汽且不做保温:韧皮部由34 ℃升温至56 ℃为止;保温30s的热处理:树体表面首先升温至60 ℃,韧皮部由31 ℃升温至56 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至63 ℃,韧皮部继续升温至61 ℃。
压力0.03 MPa,当树体表面升温至60 ℃时即停止输送蒸汽且不做保温:韧皮部由32 ℃升温至50 ℃为止;保温30 s的热处理:树体表面首先升温至60 ℃,韧皮部由32 ℃升温至43 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至64 ℃,韧皮部继续升温至55 ℃。经观察,经过热处理但不做保温处理的柑橘树都生长正常,经过热处理及后续保温处理的柑橘树有轻微热损伤。
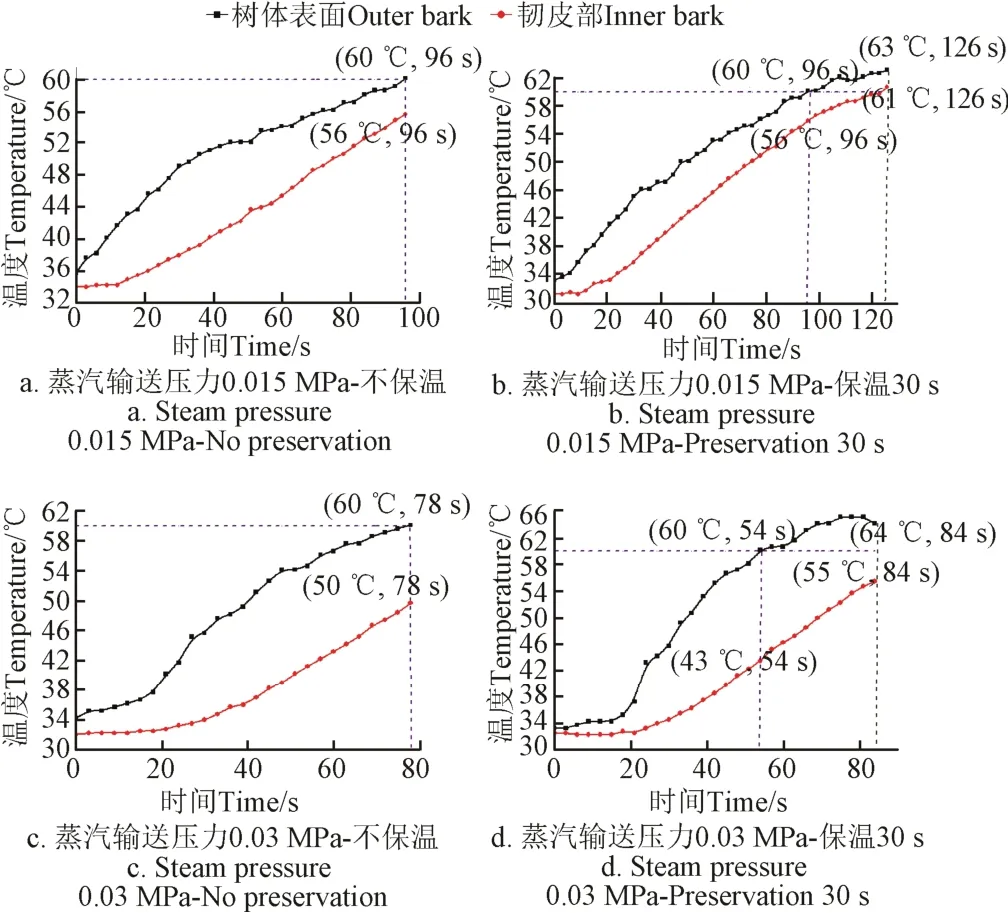
图7 室内湿热蒸汽快速热处理树体表面升温至60 ℃时升温曲线Fig.7 Heating curve of indoor rapid steam treatment till outer bark temperature was 60 ℃
2.3 升温上限65 ℃的升温曲线
试验参数组合设置:树体表面升温上限为65 ℃,蒸汽输送压力为0.015和0.03 MPa,保温时间为30 s。每组试验数据取平均值,4组试验升温曲线如图8所示。
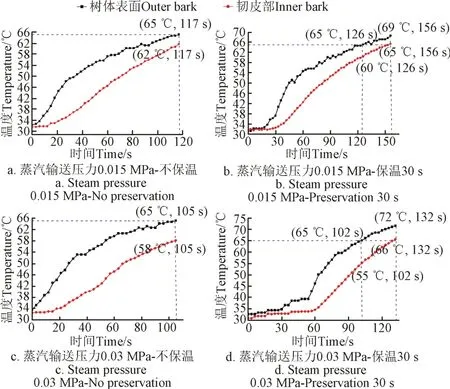
图8 室内湿热蒸汽快速热处理树体表面升温至65 ℃时升温曲线Fig.8 Heating curve of indoor rapid steam treatment till outer bark temperature was 65 ℃
压力0.015 MPa,当树体表面升温至65 ℃时即停止输送蒸汽且不进行保温:韧皮部由32 ℃升温至62 ℃为止;保温30s的热处理:树体表面首先升温至65 ℃,韧皮部由32 ℃升温至60 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至69 ℃,韧皮部继续升温至65 ℃。
压力0.03 MPa,当树体表面升温至65 ℃时即停止输送蒸汽且不进行保温:韧皮部由32 ℃升温至58 ℃为止;保温30 s的热处理:树体表面首先升温至65 ℃,韧皮部由31 ℃升温至55 ℃,停止输送蒸汽但继续保温30 s,树体表面继续升温至72 ℃,韧皮部继续升温至66 ℃。经观察,热处理后的柑橘树都因严重热损伤而死亡。
2.4 室内湿热蒸汽快速热处理时蒸汽输送压力对韧皮部升温影响分析
在相同蒸汽输送压力条件下,树体表面温度取值越高,所需加热时间越长,韧皮部温度增加越大。在达到相同树体表面温度时,蒸汽输送压力越高,树体表面升温时间越短,但韧皮部温度增加反而减少。
具体分析原因:热处理需要使热量透过树皮到达韧皮部,这需要一定的时间,而树体表面温度的提高则相对迅速。因此,输送压力越大,仅仅是加速了树体表面温度升高,并不利于韧皮部温度的提高。也就是说,输送压力不是越大越好,应以韧皮部温度有效提高作为依据。仅以本文中研究的1 a生柑橘树为例,树体表面温度选取生理承受上限60 ℃,输送压力选取较低的0.015 MPa,是有效提高韧皮部温度的较优参数组合。
2.5 室内湿热蒸汽快速热处理后保温处理对韧皮部升温影响分析
不同树体表面温度和蒸汽输送压力下,保温都能明显提高韧皮部温度。其中,树体表面温度升至相同温度条件下,蒸汽输送压力越高,关闭阀门后开始保温处理,经过相同时间保温后,韧皮部升温效果越明显。具体分析原因,应该是树体表面温度升至相同温度条件下,较高输送压力加热后残留的热量更多,保温效果更好。
2.6 室内湿热蒸汽快速热处理时树体表面温度、蒸汽输送压力和保温时间的参数组合对韧皮部升温影响分析
为检验个体差异对结果的影响,采用协方差分析室内湿热蒸汽快速热处理的树体表面温度、蒸汽输送压力和保温时间的参数组合对韧皮部升温影响的差异显著性。树体表面温度对结果有显著性影响(P=0.018);蒸汽输送压力对结果有显著性影响(P=0.036);加热前韧皮部温度(个体差异)对最终结果没有显著性影响(P=0.986)。
对于本文研究的1 a生柑橘树而言,当不进行保温处理时,鉴于韧皮部的升温效果,60 ℃-0.015 MPa是较优热处理参数,当进行30s的保温处理后,在同样温度上限(60 ℃)的情况下,虽然较高蒸汽输送压力(0.03 MPa)下保温后韧皮部升温效果更明显,但考虑树体表面温度,蒸汽输送压力和保温时间的综合热处理对韧皮部升温的总体提高效果,60 ℃-0.015 MPa-30 s是1 a生柑橘树热处理的较优组合参数。
3 田间湿热蒸汽快速热处理试验及黄龙病防治效果分析
3.1 田间快速湿热蒸汽热处理试验结果分析
根据室内湿热蒸汽快速热处理结果,选取60 ℃为树体表面温度上限,根据田间热处理耗时的初步测试,考虑到田间和室内热处理时加热罩的密封性差异,设定蒸汽输出压力为全压的1/3,即0.03 MPa,设定保温时间为30 s。现场田间环境温度为33 ℃,相对湿度为43%。4次试验数据取平均值,田间热处理加热前后和保温前后韧皮部温度变化如图9所示。

图9 田间快速湿热蒸汽热处理树体表面加热至60 ℃时韧皮部升温曲线Fig.9 Heating curve of field rapid steam treatment till outer bark temperature was 60 ℃
当4棵染病柑橘树树体表面升温至60 ℃时即停止输送蒸汽且进行保温30 s的热处理:首先树体表面温度平均升温至60 ℃,平均耗时为87 s,满足快速热处理要求。韧皮部加热前后平均升温差值为21 ℃,停止输送蒸汽但继续保温30 s,韧皮部保温前后平均升温差值为4.5℃。
3.2 热处理前后黄龙病病菌浓度比较
对经过热处理的4棵染病柑橘树,同时对未经热处理的2棵染病柑橘树和2棵健康柑橘树,在热处理前10 d和热处理后40 d,分别进行采样并送至美国农业部南方园艺诊断实验室进行qPCR测试,Ct值>32诊断为未感染,对比测试结果如表1所示。

表1 田间湿热蒸汽快速热处理前后黄龙病病菌浓度对比Table 1 Ct value comparison before and after field rapid steam treatment
由表1可知,经过田间快速湿热蒸汽热处理的感染黄龙病的4棵9 a生柑橘树,其Ct值明显提高,表明病菌浓度有显著降低。其中,2棵从染病恢复到健康,Ct值分别从27.23和26.38升高到35.81和35.69,2棵病菌浓度明显降低,Ct值分别从23.35和23.12升高到29.80和28.96,长势明显好转,萌发了大量新芽。同期未经蒸汽热处理的2棵染病柑橘树,其Ct值没有显著变化,Ct值仅分别从24.26和25.03变化到24.03和24.39,长势依旧衰弱。同期健康柑橘树Ct值没有显著变化,Ct值仅分别从39.55和39.63变化到39.07和38.72,依然保持健康状态。
4 结 论
1)本文所研究的1 a生柑橘树,其湿热蒸汽快速热处理致死温度阈值为60 ℃,实际热处理树体表面温度为60 ℃,蒸汽输送压力为0.015 MPa,保温时间为30 s。9 a生柑橘树,田间热处理温度-压力-保温时间组合为60 ℃−0.03 MPa-30 s。
2)黄龙病田间湿热蒸汽快速热处理不能仅关注树体表面温度的快速提高,而应关注韧皮部温度的有效提高。综合考虑湿热蒸汽快速直接热处理和关闭蒸汽后保温热处理对韧皮部温度的总体影响。
3)经田间湿热蒸汽快速热处理后的4棵染病柑橘树,Ct值都有明显提高。其中,2棵Ct值分别从23.35和23.12升高到29.80和28.96,另2棵Ct值从27.23和26.38升高到35.81和35.69,且长势都明显好转。而同期未经热处理的染病柑橘树,Ct值没有显著变化,长势依旧衰弱。
本文针对湿热蒸汽介质传热,从植物传热的角度分析柑橘作物的蒸汽快速热处理,未来还需要研究其他传热介质和作物热处理后的果实生长及持续效果研究。此外,还可根据国内作业环境和不同作物选用小型蒸汽发生装置和载具,开展进一步的研究和修正。
致谢:本文研究由江苏高校优势学科建设工程资助项目(PAPD),美国农业部项目(Steam-generated supplementary heat thermotherapy as an immediate treatment for prolonging productivity of HLB-infected citrus trees),中国“十二五”农村领域国家科技计划课题(2014BAD08B04),江苏省研究生培养创新工程(CXZZ11_0513)资助。感谢Sherrie Buchanon, Fazly Bin Mail,Roy Sweeb和Saman Souri等人对我试验的帮助。
[1] Bové J M. Huanglongbing: A destructive, newly emerging, century old disease of citrus[J]. Journal of Plant Pathology, 2006, 88(1): 7-37.
[2] Bové J M. Huanglongbing or yellow shoot, a disease of Gondwanan origin: Will it destroy citrus worldwide[J]. Phytoparasitica, 2014, 42(5): 579-583.
[3] Wang N, Trivedi P. Citrus huanglongbing: A newly relevant disease presents unprecedented challenges[J]. Phytopathology, 2013, 103(7): 652-665.
[4] Gasparoto M, Coletta H, Bassanezi R, et al. Influence of temperature on infection and establishment of ‘Candidatus Liberibacter americanus’ and ‘Candidatus Liberibacter asiaticus’ in citrus plants[J]. Plant Pathology, 2012, 61(4): 658-664.
[5] Lee J A, Halbert S E, Dawson W O, et al. Asymptomatic spread of huanglongbing and implications for disease control[J]. Proceedings of the National Academy of Sciences, 2015, 112(24): 7605-7610.
[6] de Miranda S H G, de Oliveira Adami A C, Bassanezi R B. Economic impacts of huanglongbing disease in São Paulo State[C]//Poster presented at the International Association of Agricultural Economists (IAAE) Triennial Conference, Foz do Iguaçu, Brazil: International Association of Agricultural Economists, 2012.
[7] Bassanezi R B, Montesino L H, Gasparoto M C G, et al. Yield loss caused by huanglongbing in different sweet orange cultivars in São Paulo, Brazil[J]. European Journal of Plant Pathology, 2011, 130(4): 577-586.
[8] USDA. National quarantine map[EB/OL]. 2014-05-22. http://www.aphis.usda.gov/plant_health/plant_pest_info/citrus_ greening/downloads/pdf_files/nationalquarantinemap.pdf.
[9] 洪添胜,张衍林,宋淑然,等. 山地果园运输与喷雾机械的研究与应用[J]. 现代农业装备,2014(5):21-27. Hong Tiansheng, Zhang Yanlin, Song Shuran, et al. Research and application of mountainous orchard transportationand spray machinery[J]. Modern Agricultural Equipment, 2014(5): 21-27. (in Chinese with English abstract)
[10] 范国成,刘波,吴如健,等. 中国柑橘黄龙病研究30年[J].福建农业学报,2009,24(2):183-190. Fan Guocheng, Liu Bo, Wu Rujian, et al. Thirty years of research on citrus Huanglongbing in China[J]. Fujiau Journal of Agricultural Sciences, 2009, 24(2): 183-190. (in Chinese with English abstract)
[11] 陈凯男,李充璧. 柑橘黄龙病研究概况[J]. 浙江农业科学,2015,56(7):1048-1050. Chen Kainan, Li Chongbi. Research overview on citrus huanglongbing disease[J]. Journal of Zhejiang Agricultural Sciences, 2015, 56(7): 1048-1050. (in Chinese with English abstract)
[12] 梅慧兰,邓小玲,洪添胜,等. 柑橘黄龙病高光谱早期鉴别及病情分级[J]. 农业工程学报,2014,30(9):140-147. Mei Huilan, Deng Xiaoling, Hong Tiansheng, et al. Early detection and grading of citrus huanglongbing using hyperspectral imaging technique[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(9): 140-147. (in Chinese with English abstract)
[13] 罗守进. 柑橘几种主要病虫害的识别与防治[J]. 农业灾害研究,2014,4(10):28-33,47. Luo Shoujin. Identification and control methods of the main diseases and insect pests of citrus[J]. Journal of Agricultural Catastrophology, 2014, 4(10): 28-33, 47. (in Chinese with English abstract)
[14] 吴越,周常勇. 柑橘黄龙病防控研究进展[J]. 中国果树,2013(4):77-81.
[15] 骆学海. 柑桔黄龙病热水间歇消毒试验[J]. 华南农业大学学报:自然科学版,1983,4(1):97-103. Lo Xuehai. Studies on the sterilieation effect of the intermittent hot water treatment on citrus budwood and nursling infected with citrus yellow shoot[J]. Journal of South China Agricultural University: Natural Science Edition, 1983, 4(1): 97-103. (in Chinese with English abstract)
[16] 林孔湘. 柑桔黄梢(黄龙)病的进一步研究[J]. 植物保护学报,1963,2(3):243-251. Lin Kunghsiang. Further studies on citrus yellow shoot[J]. Journal of Plant Protection, 1963, 2(3): 243-251. (in Chinese with English abstract)
[17] 林孔湘,郑儒钰. 柑桔黄梢(龙)病毒和柑桔枝条组织耐热力的初步研究[J]. 植物病理学报,1964,7(1):61-65. Lin Kunghsiang, Zheng Ruyu. A preliminary study on the resistance of yellow shoot virus and citrus budwood tissue to heat[J]. Acta Phytopathologica Sinica, 1964, 7(1): 61-65. (in Chinese with English abstract)
[18] Doud M, Zhang M Q, Powell C A, et al. Thermotherapy and chemotherapy to control citrus HLB in the field[J]. Journal of Citrus Pathology, 2014, 1(1): 213-221.
[19] Foundation C R A D. Thermal-Therapy-Day-Summary [EB/OL]. 2014-04-30. http://citrusrdf.org/thermal-therapyfor-citrus-trees-affected-by-huanglongbing-hlb.
[20] Duan Yongping, Doud M. How to Live with HLB?[EB/OL]. 2014-04-30.http://stlucie.ifas.ufl.edu/media/2014/ARS_Duan _Thermo%20field%20day%202014.pdf
[21] Hoffman M T, Doud M S, Williams L, et al. Heat treatment eliminates’ Candidatus Liberibacter asiaticus’ from infected citrus trees under controlled conditions[J]. Phytopathology, 2013, 103(1): 15-22.
[22] Leavitt Stefani. Treatment of HLB-affected Citrus Using a Supplemental Heating System[D]. Gainesville, FL: University of Florida, Graduate School, 2015.
[23] Al-Jumaili A, Ehsani R. Mobile batch heat treatment system for treating HLB-infected citrus trees[C]//ASABE Annual International Meeting, 2015.
[24] Ehsani R, Corcuera, J I R D Khot L. The potential of thermotherapy in combating HLB[EB/OL]. 2013-09-01. http://www.crec.ifas.ufl.edu/extension/trade_journals/2013/ 2013_September_Thermo.pdf.
[25] 贾志成,郑加强,黄雅杰,等. 柑橘黄龙病热处理防治技术研究进展[J]. 农业工程学报,2015,31(23):1-9. Jia Zhicheng, Zheng Jiaqiang, Huang Yajie, et al. Thermotherapy for citrus huanglongbing-review and prospect[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(23): 1-9. (in Chinese with English abstract)
[26] 王爱民,邓晓玲. 柑桔黄龙病诊断技术研究进展[J]. 广东农业科学,2008,(6):101-103.
[27] 黄伟锋,洪添胜,吴伟斌,等. 柑橘黄龙病检测方法研究进展[J]. 广东农业科学,2012(16):60-64. Huang Weifeng, Hong Tiansheng, Wu Weibin, et al. Advances in detection technique of citrus Huanglongbing[J]. Guangdong Agricultural Sciences, 2012(16): 60-64. (in Chinese with English abstract)
[28] Liao H L, Burns J K. Gene expression in Citrus sinensis fruit tissues harvested from huanglongbing-infected trees: comparison with girdled fruit[J]. Journal of experimental botany, 2012, 63(8): 3307-3319.
[29] 卢乃会,李强有,张曼其,等. 柑橘黄龙病分子生物学检测方法研究进展[J]. 现代农业科技,2016(12):130-131. Lu Naihui, Li Qiangyou, Zhang Manqi, et al. Reseach progress in molecular detection technique of citrus huanglongbing[J]. Modern Agricultural Science and Technology, 2016(12): 130-131. (in Chinese with English abstract)
[30] GB/T 28062-2011,柑橘黄龙病菌实时荧光PCR检测方法[S].
Heating characteristics and field control effect of rapid citrus huanglongbing steam heat treatment
Jia Zhicheng1,2, Ehsani Reza2, Zheng Jiaqiang1※, Xu Linyun1, Zhou Hongping1, Ding Rui1
(1. College of Mechanical and Electronic Engineering, Nanjing Forestry University, Nanjing 210037, China; 2. Citrus Research and Education Center, University of Florida, Lake Alfred 33850, USA)
The citrus Huanglongbing (HLB), caused by the bacterium limited in the phloem, Candidatus Liberibacter spp, is a highly destructive citrus disease for the worldwide citrus industry. Until now, the field thermotherapy has showed effect in HLB control. However, all sorts of thermotherapies only focus on the canopy temperature without considering the inner bark or phloem temperature. In this study, indoor and field steam treatment system consists of enclosure, circumstance temperature monitoring system, outer and inner bark temperature testing system. Temperature distribution of outer and inner bark when heating up with different steam supplying pressure and heat preserving time showed that: 1) For the 1-year-old plants, the 65 ℃ was the deadly outer temperature limit. The confirmation of deadly outer bark temperature was the most important in field heat treatment. Based on the inner bark temperature increasing effect, the outer temperature of 60 ℃ was better than lower temperature for inner bark temperature increasing. For achieving the higher outer temperature, more heating time is needed, which allows more heat transfer from the outer to inner bark. For the 9-year-old plants, the 60 ℃ was the better outer temperature without obvious heat damage to the plants. 2) For effective control of HLB, the inner bark temperature was more important than the outer bark temperature. The heat preserving time following steam treatment is beneficial for inner bark temperature increasing. The preserving temperature increase from the treatment with higher transfer pressure was higher than lower pressure. However, based on the total heating effect of inner bark, comprehensively considering the temperature increase from treatment and the following heat preserving, the lower pressure was the better choice. 3) For the 9-year plants, after field heat treatment with the 60 ℃-0.03 MPa-30 s, the results of quantitative polymerase chain reaction (qPCR) after treatment showed significant change in the ‘Ca.L.asiaticus’ bacterial titer, combined with vigorous growth from all 4 treated infected trees. The qPCR testing also confirmed that 2 previously infected plants with heat treatment showed no detectable levels of‘Ca.L.asiaticus’, while untreated infected plants remained highly infected. 4) Based on the steam treatment, it was concluded that the procedure should be as follows: Based on the inner bark temperature increase, first of all, confirm the deadly outer temperature of the specific plant; then, compare the heating effect with different combination of the steam supplying pressure and the following heat preserving time. As a conclusion, from the view of heat transfer, the best steam treatment parameters should be determined based on the analysis of inner bark temperature increase.
disease control; heat treatment; temperature; citrus huanglongbing (HLB); phloem; heating characteristics
10.11975/j.issn.1002-6819.2017.11.028
S3; S432
A
1002-6819(2017)-11-0219-07
贾志成,Ehsani Reza,郑加强,许林云,周宏平,丁 锐. 柑橘黄龙病蒸汽快速热处理升温特性及田间防治效果[J]. 农业工程学报,2017,33(11):219-225.
10.11975/j.issn.1002-6819.2017.11.028 http://www.tcsae.org
Jia Zhicheng, Ehsani Reza, Zheng Jiaqiang, Xu Linyun, Zhou Hongping, Ding Rui. Heating characteristics and field control effect of rapid citrus huanglongbing steam heat treatment[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(11): 219-225. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.11.028 http://www.tcsae.org
2017-01-05
2017-03-03
江苏高校优势学科建设工程资助项目(PAPD);“十二五”农村领域国家科技计划课题(2014BAD08B04);美国农业部项目(Steam-generated supplementary heat thermotherapy as an immediate treatment for prolonging productivity of HLB-infected citrus trees),江苏省研究生培养创新工程(CXZZ11_0513)
贾志成,男,江苏南京人,讲师,博士生,2014年赴美国佛罗里达大学柑橘研究与教育中心研修,主要从事植物病虫害物理防治技术研究。南京 南京林业大学机械电子工程学院,210037。Email:jzcnfu@gmail.com※通信作者:郑加强,男,浙江温州人,教授,博士,博士生导师,主要从事植保机械和农林智能测控技术研究。南京 南京林业大学机械电子工程学院,210037。Email:jqzheng@njfu.edu.cn

