春上枝头洗发水质量控制研究
陈萍,李娜,薛佩芸,赵宏
(1.陕西中医药大学,陕西咸阳712046;2.陕西省中医药研究院,陕西西安710003;3.苏州春上枝头化妆品有限公司,江苏苏州215300)
·实验研究·
春上枝头洗发水质量控制研究
陈萍1,2,李娜1,薛佩芸1,赵宏3
(1.陕西中医药大学,陕西咸阳712046;2.陕西省中医药研究院,陕西西安710003;3.苏州春上枝头化妆品有限公司,江苏苏州215300)
目的研究春上枝头洗发水的质量控制方法。方法采用薄层色谱法对方中人参、丹参、川芎、当归、何首乌、苦参进行鉴别;采用加水稀释及柱层析除杂法制备测定样品;采用紫外分光光度法(UV法)测定总皂苷含量,绘制标准曲线,制订回归方程,计算人参总皂苷含量。结果薄层色谱鉴别灵敏、专属性好、准确性高、重复性好。总皂苷(以人参皂苷Re计)进样量在0.101~0.606 mg范围内与吸光度线性关系良好(r=0.999 3);平均回收率为94.87%~98.57%,RSD为0.70%~4.82%(n=6)。结论该方法可用作春上枝头洗发水的质量控制方法。
春上枝头洗发水;薄层色谱鉴别;人参总皂苷;含量测定
春上枝头洗发水由人参、丹参、女贞子、川芎、当归、白芷、何首乌、补骨子、苦参、侧柏叶、土荆皮、旱莲草、桑叶组方,其传承了清代外治吴师机所著《理论骈文》[1-2]中“各种汤剂都可以制成外用之方”之洗法,采用高压渗漉萃取工艺[3]、微乳靶向给药技术[4]研制而成,具有洗发、养发、护发、控油、固根、密发、生发功效的外洗产品。方中人参具有抗癌、护肤、护发功能[5],其主要活性物质人参皂苷类[6](人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Re、人参皂苷Rd及其苷元)的羟基与头发角朊中的亲水基团生成氢键,大量皂苷被吸入头发纤维内部而起到护发作用,人参中多种活性多肽、氨基酸、有机酸、糖等重要营养物质,在养护洗发水产品中能增加头皮营养、保护头发、增强发质[7-9],还可以防止与减少脱发,促进头发生长发育[10],从而减少断发和脱发。本研究中采用紫外分光光度法(UV法)测总皂苷含量,以人参总皂苷为本品的定量质控指标;采用薄层色谱(TLC)法对人参、丹参、川芎等组方药材进行了定性鉴别研究,拟控制洗发水的质量。现报道如下。
1 仪器与试药
1.1 仪器
U-2910型紫外分光光度计(日本日立公司);AG285型双量程电子天平(美国梅特勒-托利多公司);101型电热鼓风恒温烘箱(北京市永光明医疗仪器厂);SK2200H型超声清洗仪(昆山市超声仪器有限公司);溶剂过滤器(Millipore);HH-S4型恒温水浴锅(上海科伟仪器公司);BP211D型电子天平(美国梅特勒公司,十万分之一),PB1502-S型天平(美国梅特勒公司,千分之一);SYNSV0000型纯水机(Millipore)。
1.2 试药
对照品:人参皂苷Rg1(批号为913-9960),人参皂苷Re(批号为120955-200607,供含量测定用),人参皂苷Rb1(批号为121028-200608),拟人参皂苷F11 (批号为110841-200404),丹参酮ⅡA(批号为121117-200605),阿魏酸对照品(批号为110773-201012,供含量测定用),人参皂苷Re对照品(批号为110754-200421,供含量测定用),均购于中国食品药品检定研究院。
对照药材:人参对照药材(批号为0719-9905),三七对照药材(批号分别为0941-9803,120941-200506),西洋参对照药材(批号为0997-9804),黄芪对照药材(批号为121462-200702),川芎对照药材(批号为120918-200809),当归(批号为120927-201315),何首乌(批号为120934-20140),苦参(批号为121019-201407),均购自中国食品药品检定研究院。
试剂:甲醇、乙腈(Fisher)为色谱纯,三氧化二铝、香草醛、亚硝酸钠、硝酸铝、氢氧化钠、冰乙酸、高氯酸、乙醚、乙醇等均为分析纯,水为超纯水。自制硅胶G板、GF254板(薄层层析硅胶,青岛海洋化工有限公司)。
供试品:规格为每瓶120mg,批号分别为20170312,20170316,20170320,由陕西省中医医院制剂中心提供。
2 方法与结果
2.1 TLC鉴别
2.1.1 人参
取本品内容物10 g,加水30mL,超声处理20min,加乙醚50m L萃取,弃去乙醚液,下层溶液继以水饱和的正丁醇50m L轻摇萃取,放置分层,吸取上清液,加3倍量以正丁醇饱和的水(150m L),摇匀,放置分层,取正丁醇层,置蒸发皿中,蒸干,残渣加甲醇4m L使溶解,作为供试品溶液。再依据处方,取不含人参的其他药材,按照洗发水制备工艺和供试品溶液的制备方法制备缺人参的阴性溶液,作为阴性对照品溶液。另取人参对照药材,同供试品溶液制备方法制成对照药材溶液。再取三七皂苷R1,加甲醇制成每1m L含0.5 mg的溶液,作为对照品溶液。按2015年版《中国药典(一部)》通则(0502)试验[11],吸取上述4种溶液各2μL,分别点于同一以0.3%羧甲基纤维素钠为黏合剂的硅胶G板上,以三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶22∶10)10℃以下放置的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,分别置日光及紫外灯(365 nm)下检视。
供试品溶液色谱中,在与对照品溶液色谱相应位置上显相同颜色的斑点;置紫外光(365 nm)下检视,显相同的荧光斑点。阴性对照品溶液无此斑点,故将其列入标准正文中。由于三七、西洋参均含有人参类皂苷,本研究中进行了人参、三七、西洋参三者的薄层色谱鉴别比较,以保证产品的质量。色谱图见图1和图2。
2.1.2 丹参
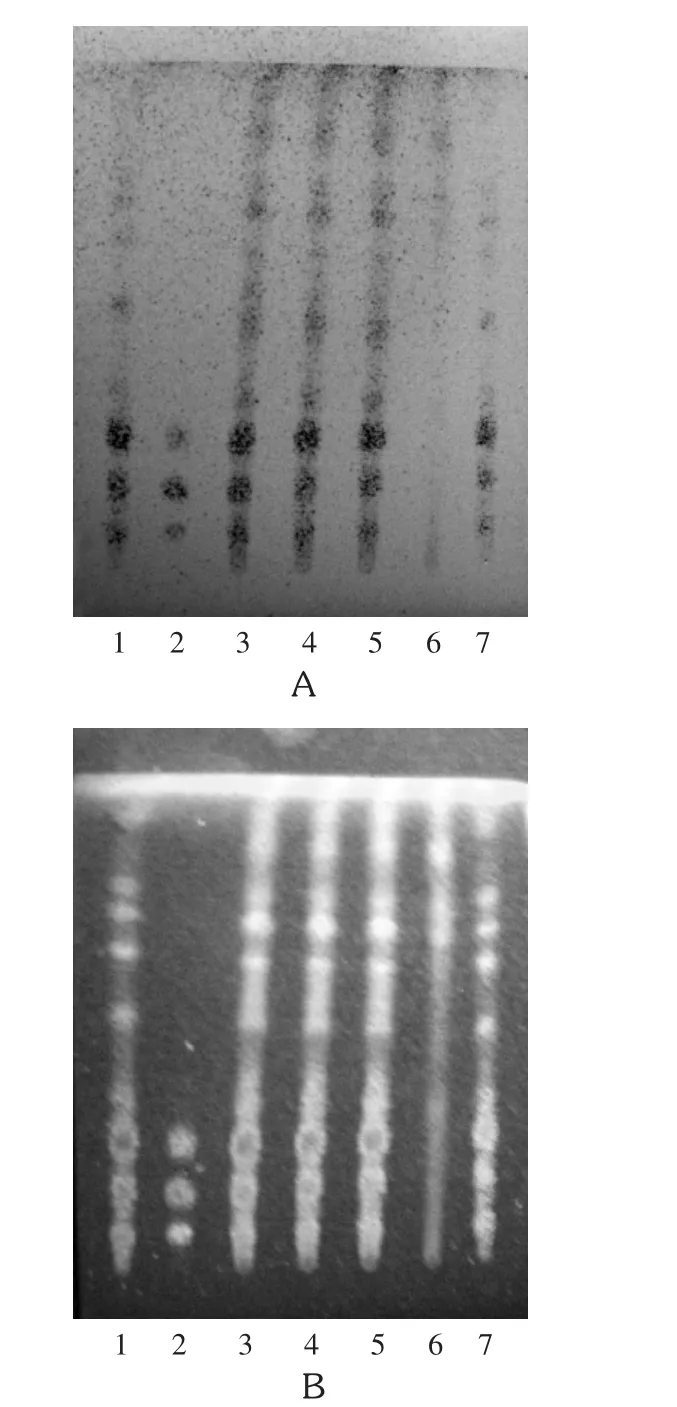
1.人参对照药材溶液2.混合对照品溶液(Rg1+Rb1+R1)3-5.供试品溶液(批号20170312,20170316,20170320)6.阴性对照品溶液7.人参药材溶液A.日光检视B.紫外灯(365 nm)检视图1人参薄层色谱图
1.混合对照品溶液(R1+Rb1+Rg1+Re)2.人参药材溶液3.西洋参药材溶液4.拟人参皂苷F11对照品溶液5.三七药材溶液6.三七皂苷R1对照品溶液图2人参与三七、西洋参薄层色谱图(365 nm紫外灯检视)
取本品内容物10 g,置具塞三角瓶中,加水10m L,超声处理20min,加乙酸乙酯12mL,密塞,振摇10min,放置1 h静置分层,分取乙酸乙酯层约5 m L作为供试品溶液。另取丹参酮ⅡA对照品,加乙酸乙酯制成每1m含1 mg溶液,作为对照品溶液。再取丹参对照药材,同供试品溶液制备方法制成对照药材溶液。再按洗发水制备方法制成缺丹参药材的制剂,按供试品溶液制备方法制成阴性对照品溶液。按2015年版《中国药典(一部)》通则(0502)试验,吸取上述4种溶液各5μL,分别点于同一硅胶G薄层板上,以二甲苯-乙酸乙酯(9∶1)为展开剂展开,晾干。
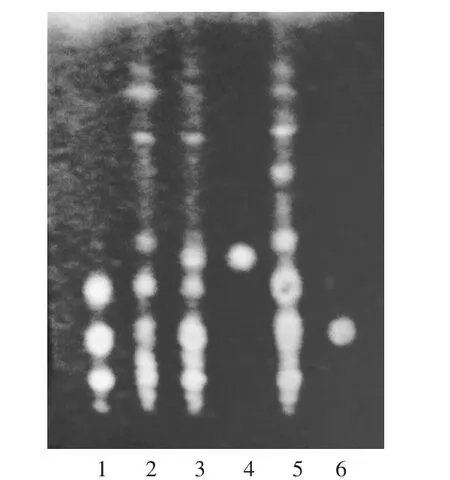
供试品溶液色谱中,在与对照品溶液色谱相应位置上显相同的暗红色斑点,而阴性对照无干扰,故收入标准正文。色谱图见图3。
1,7.丹参对照药材溶液2.丹参酮ⅡA对照品溶液3-5.供试品溶液(批号20170312,20170316,20170320)6.阴性对照品溶液图3丹参薄层色谱图(日光检视)
2.1.3 川芎与当归
取本品内容物10 g,加乙醚30mL,置水浴上加热回流10min,取出,放冷,分取乙醚层,挥去乙醚至约5m L作为供试品溶液。分别取川芎、当归对照药材1 g,按供试品溶液制备方法,分别制成对照药材溶液。再按洗发水的制备方法制成缺川芎、当归药材的制剂,按供试品溶液的制备方法制成双阴性对照品溶液。按2015年版《中国药典(一部)》通则(0502)试验,分别吸取上述4种溶液各10μL,分别点于同一硅胶GF254薄层板上,以正己烷-乙酸乙酯(3∶1)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。
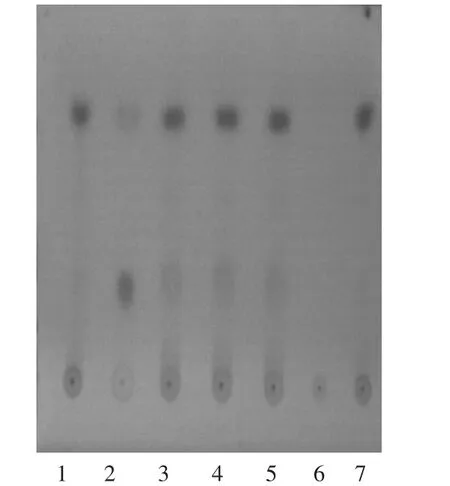
供试品色谱中,在与对照药材相应位置上显相同颜色的斑点,双阴性对照无干扰,该方法纳入质量标准中。色谱图见图4。
2.1.4 何首乌
取本品内容物10 g,置具塞三角瓶中,加水10m L,超声处理20 min,加乙酸乙酯12 mL,密塞,振摇10 min,静置1 h分层,分取乙酸乙酯层约5 m L作为供试品溶液。取何首乌对照药材2 g,同法制成对照药材溶液。再按洗发水的制备方法制成缺何首乌药材的制剂,按供试品溶液制备方法制成阴性对照品溶液。取何首乌对照药材,按供试品溶液制备方法,制成对照药材溶液。按2015年版《中国药典(一部)》通则(0502)试验,吸取上述3种溶液各5μL,分别点于同一用0.5%氢氧化钠溶液制备的硅胶G薄层板上,以甲苯-乙酸乙酯-甲酸(5∶2∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
1.川芎对照药材溶液2-4.供试品溶液(批号20170312,20170316,20170320)5.缺川芎、当归双阴性对照品溶液6.当归对照药材溶液图4川芎、当归薄层色谱图(254 nm紫外灯检视)
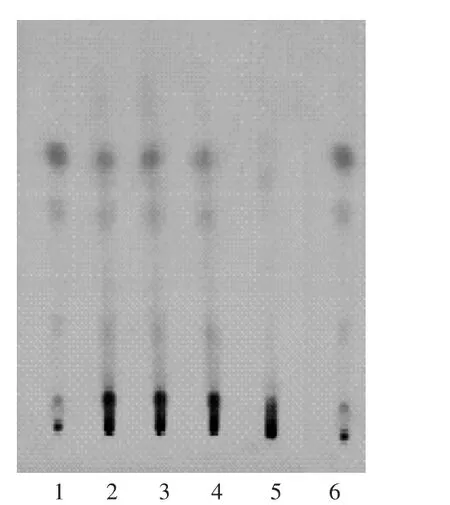
供试品溶液色谱中,在与对照品溶液色谱相应位置上显相同橙色荧光斑点,置氨气中熏后,斑点变为橙红色,阴性对照无干扰,色谱图见图5。
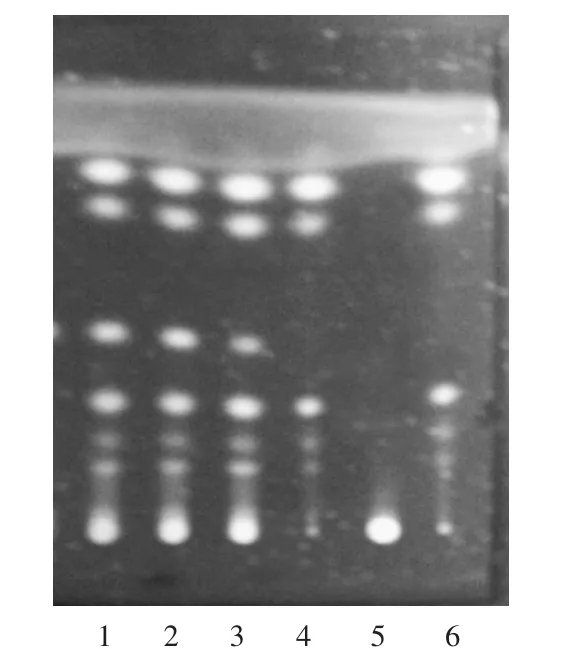
1-3.供试品溶液(批号20170312,20170316,20170320)4.何首乌对照药材溶液5.阴性对照品溶液6.何首乌药材溶液图5何首乌薄层色谱图(365 nm紫外灯检视)
2.1.5 苦参
取本品20 g,加水20mL,加氯仿50mL、浓氨试液1.0m L,振摇提取,取氯仿液,蒸干,残渣加氯仿1m L使溶解,作为供试品溶液。取苦参对照药材1 g,按供试品溶液制备方法,分别制成对照药材溶液。再按洗发水的制备方法制成不含苦参药材的制剂,按供试品溶液制备方法制成阴性对照品溶液。按2015年版《中国药典(一部)》通则(0502)试验,吸取上述3种溶液各2μL,分别点于同一以0.4%羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以氯仿-甲醇-浓氨(8∶2∶0.2)为展开剂,展开,取出,晾干,依次喷以碘化铋钾试液和亚硝酸钠乙醇试液。
供试品溶液色谱中,在与对照品溶液色谱相应位置上,显相同橙红色斑点,阴性对照无干扰,该法纳入质量标准中,色谱图见图6。
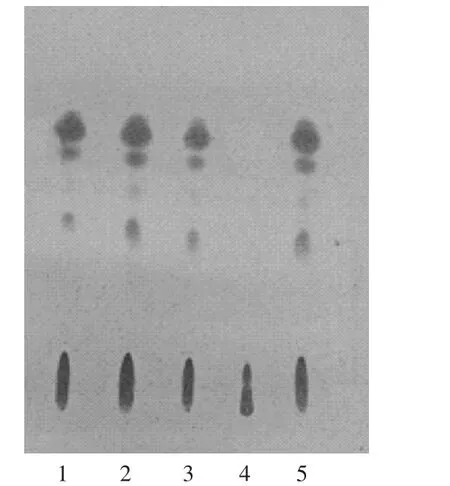
1-3.供试品溶液(批号20170312,20170316,20170320)4.阴性对照品溶液5.苦参对照药材溶液图6苦参薄层色谱图(日光检视)
2.2 总皂苷含量测定
2.2.1 溶液制备
对照品溶液:称取人参皂苷Re对照品50.48 mg,精密称定,用甲醇溶解并定容至50m L,即得每1m L含人参皂苷Re 1.01mg的对照品溶液。
供试品溶液:取春上枝头洗发水5 g,精密称定,置100m L容量瓶中,用水溶解并稀释至100 mL刻度。样品净化,用15mL层析管,内装8m LAmberlite-XAD-2大孔树脂,加上1 cm中性氧化铝。柱预先活化,先用25 m L 75%乙醇洗柱,弃去洗脱液,再用25 m L水洗柱,弃去洗脱液。在活化后的柱上精密加入1 m L已处理好的试样溶液,用25 m L水洗柱,弃去淋洗液,用25 mL 75%乙醇洗脱人参皂苷,收集洗脱液置50mL容量瓶中,并用75%乙醇稀释至50m L刻度,作为供试品溶液。
2.2.2 检测波长选择
精密移取人参皂苷Re对照品溶液和供试品溶液各0.1m L于具塞试管中,氮气吹干溶剂,分别加入新配制的5%香草醛-冰乙酸溶液0.2m L,高氯酸0.8m L,溶液呈玫瑰红色,在60℃的水浴中加热15min,冰水冷却,加入冰乙酸5m L,摇匀,放置20min,以随行试剂为空白,在400~700 nm波长下扫描,确定最大吸收波长为590 nm,详见图7。
2.2.3 方法学考察

A.人参皂苷Re B.样品图7紫外-可见光谱扫描图
标准曲线制备:分别精密量取上述对照品溶液0.10,0.15,0.20,0.25,0.30,0.40,0.60 m L,置具塞试管中,氮气吹干溶剂,加入新配制的5%香草醛-冰乙酸溶液0.2m L,高氯酸0.8m L,溶液呈玫瑰红色,在60℃水浴中加热15min,冰水冷却,加入冰乙酸5mL,摇匀,放置20min,随行试剂为空白,照分光光度法,在590 nm波长处测定吸收度,以吸光度为纵坐标(Y)、质量浓度为横坐标(X)绘制标准曲线。结果表明,总皂苷进样量在0.101~0.606mg范围内与峰面积线性关系良好,回归方程为Y=0.002 5X-0.073 9,R2=0.999 3(n=7)。
检测限确定:根据《保健食品卫生检验方法理化部分总则》GB/T5009.1-2003附录A中的要求,本标准方法的检出限为0.002 5 g/100 g。
精密度试验:取供试品溶液(批号为20170312)0.1mL置具塞试管中,按标准曲线制备项下方法操作,连续测定6次。结果的RSD为0.1%(n=6),表明仪器精密度良好。
重复性试验:对照品重复性试验,取上述人参皂苷Re对照品溶液(1.01 mg/mL)40μL,并依法测定吸光度,测得RSD为1.78%,说明方法重复性良好。供试品重复性试验,取上述供试品溶液(批号为20170312)0.1m L,并按标准曲线制备项下方法重复测定6次,测得RSD为3.68%,说明方法重复性良好。
稳定性试验:取供试品溶液(批号为20170312)0.1mL置具塞试管中,按标准曲线制备项下方法操作,每隔1 h测定1次吸光度,连续测定6 h,观察其稳定性。结果的RSD为1.2%(n=6),表明供试品溶液在6 h内显色稳定。
方法重复性试验:取样品(批号为20170312)6份,精密称定,按2.2.1项下供试品溶液制备方法制备样品,并按标准曲线制备项下方法测定吸光度,计算。测得样品含人参皂苷Re 5.52mg/g,结果的RSD为3.97% (n=6),表明方法重复性良好。
加样回收试验:按上述检验方法,选用3个空白样品,分别加入3个水平的人参皂苷Re对照品溶液(1.01 g/L)各20,40,80μL,按标准曲线制备项下方法依次分析,重复6次。结果见表1。

表1 加样回收试验结果(n=6)
2.2.4 样品含量测定
取3批样品(批号为20170312,20170316,20170320)各3份,精密称定,按2.2.1项下方法制备供试品溶液。分别吸取供试品溶液各0.1m L置具塞试管中,氮气吹干溶剂,加入新配制的5%香草醛-冰乙酸溶液0.2mL,高氯酸0.8 m L,溶液呈玫瑰红色,在60℃水浴中加热15min,冰水冷却,加入冰乙酸5m L,摇匀,放置20min,于590 nm波长处与标准管采用比色法测定。3批样品人参总皂苷含量分别为5.42,6.32,4.83mg/g。
根据多批样品实测数据,考虑到药材来源、制剂生产、贮藏等可能的误差因素,结合现行药典,暂定本品含总皂苷以人参皂苷Re计每克不得少于4.0mg。
3 讨论
依据皂苷理化性质及文献[12-15],分别采用热回流、超声方法。结果表明,回流、超声测得人参皂苷含量基本一致,故确定室温加水溶解及过柱除杂质法,提取率最高且其他组分干扰小。本研究中对女贞子、白芷、补骨子、侧柏叶、土荆皮、旱莲草、桑叶进行了薄层色谱鉴别,但阴性样品存在干扰,故暂不能纳入指控标准,有待进一步研究。
目前,对多效天然植物洗发液大多以配方、工艺研究为主,对洗发类产品中植物的定性鉴别缺乏依据,本研究中提升了药用洗发液的定性定量质控标准,但还需对作用机制进行深入研究。
随着市场的发展、竞争的加剧以及消费群体需求的不断提高,开发具有性能突出与功能奇特的洗发液乃是大势所趋,集养发、柔软、护发、美观和药物治疗等的产品会更加引人注目,研制的洗发产品市场缺口较大,今后的社会效益、经济效益显著。
[1]吴师机.理论骈文:外治医说[M].北京:人民卫生出版社,1956:1-2.
[2]王军,曹建春.理瀹骈文(中医经典诵读丛书)(新校版)[M].北京:人民军医出版社,2006:7-9.
[3]陈瑞战.超高压提取人参皂苷工艺及机理研究[D].长春:吉林大学,2005.
[4]寇欣.微乳给药系统的研究进展[J].天津药学,2005,17(6):49-52.
[5]朱炳泉.人参的抗癌、护肤、护发三功能[J].人人健康,1988(1):10-11.
[6]杨启辉.人参与美容化妆品[J].中国化妆品,1997(4):32.
[7]逄世峰,李亚丽,许世泉,等.人参不同部位人参皂苷类成分研究[J].人参研究,2015,27(1):5-8.
[8]万玉华,蒋日琼,刘丹丹,等.人参活性物质的提取及人参柔顺洗发水的研制[J].香料香精化妆品,2011(5):29-32.
[9]孙旭.鲜人参在洗护产品中的应用[J].口腔护理用品工业,2011,21(6):42-44.
[10]张瑞,闫梅霞,许世泉,等.人参美容护发功效研究现状[J].日用化学工业,2014,44(3):163-166.
[11]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:8.
[12]杨云,冯卫生.中药化学成分提取分离手册[M].北京:中国中医药出版社,1998:89-91.
[13]张娟,路金才.皂苷的提取方法及含量测定研究进展[J].中国现代中药,2006,8(3):25-28.
[14]岳展鹏,王贤英.紫外分光光度法测定参芪三七胶囊中总皂苷含量[J].中国药业,2017,26(1):22-24.
[15]万玉华,张榕文,徐静,等.人参柔顺洗发水中人参皂苷的鉴别和含量测定[J].日用化学工业,2011,41(5):384-387.
Quality Control of Chunshangzhitou Sham poo
Chen Ping1,2,Li Na1,Xue Peiyun1,Zhao Hong3
(1.Shaanxi University of Chinese Medicine,Xianyang,Shaanxi,China 712046;2.Shaanxi Province Chinese Medicine Research Institute, Xi′an,Shaanxi,China 710003;3.Suzhou Chunshangzhitou Cosmetics Limited,Suzhou,Jiangsu,China 215300)
Ob jective To study the quality control of Chunshangzhitou shampoo.M ethods Thin Layer Chromatography(TLC)was used to identify Panax Ginseng,Salvia Miltiorrhiza,Ligusticum Chuanxiong,Angelia Sinensis,Fallopia Multiflora and Sophora Flavescens.The samples were prepared by dilution with water and purified by column chromatography.The content of total saponins in Chunshangzhitou shampoo was determined by UV,the standard curve was drawn and the regression equation was developed to calculate the total Ginseng saponin content.Results The identification by TLC was sensitive,good specificity,high accuracy and good repeatability,the total recovery rate saponins(Ginsenoside Re)was linear in the range of 0.101-0.606 mg(r=0.999 3),the average was 94.87%-98.57%,RSD was 0.70%-4.82%(n=6).Conclusion The method can be used for quality control of the Chunshangzhitou shampoo.
Chunshangzhitou shampoo;TLC;total Ginseng saponins;content determination.
R284.2
A
1006-4931(2017)09-0005-05
2017-01-10;
2017-02-29)
10.3969/j.issn.1006-4931.2017.09.002
陕西省中医药管理局科研项目[zy20]。
陈萍(1964-),女,研究员,研究生导师,研究方向为中药精细化学与中药新药,(电子信箱)cp3049033@163.com。

