PRLR和ITGB1基因多态性对大白猪繁殖性能的影响
沈永巧,胡九英,孙敬礼,鲁慧文,汪德明,黄涛*
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆正大食品有限公司,新疆 五家渠 831301)
PRLR和ITGB1基因多态性对大白猪繁殖性能的影响
沈永巧1,胡九英2,孙敬礼1,鲁慧文1,汪德明2,黄涛1*
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆正大食品有限公司,新疆 五家渠 831301)
为了研究PRLR和ITGB1基因多态性对大白猪繁殖性能的影响,本研究采用PCR-RFLP技术检测基因多态性,并将基因型与母猪繁殖性能进行关联分析。结果显示:对于PRLR基因,初产母猪各基因型间的繁殖性状差异均不显著(P>0.05);经产母猪的总产仔数、活仔数和健仔数均呈现AA>AB>BB的趋势,AA型比 BB型、AB型总仔数分别多 0.55头(P<0.05)、0.13头,AA型、AB型比 BB型活仔数分别多0.59头 (P<0.05)、0.43头(P<0.05),AA型比BB型健仔数多0.5头(P<0.05)、0.26头。对于ITGB1基因,初产母猪和经产母猪各基因型间的个体繁殖性状虽有差异,但差异不显著(P>0.05)。对于合并基因型,初产母猪ABCC型比BBTT型个体的初生窝重多1.35头(P<0.05);经产母猪AACC型相对于BBCC和BBTC型,健仔数分别多1.07头(P<0.05)和0.71头(P<0.05),AACC型个体总仔数和活仔数分别比BBCC型多1.31和1.39头、比BBTT型多0.77头和0.64头,差异均显著(P<0.05)。
猪;PRLR;ITGB1;繁殖性能
猪是最重要的肉用经济动物之一,我国养猪历史悠久,自古以来我国猪的存栏量均排名世界第一。母猪的繁殖性状是影响养猪业生产发展的一个重要的经济性状,科研工作者们正在努力提高猪的繁殖性能,其中如何提高母猪繁殖力以及育种效率一直是备受关注的问题。在猪的育种与生产中,降低背膘厚,提高日增重,改良繁殖性能是科学研究和养猪生产中的主要任务[2]。但繁殖性状是一个低遗传力的性状,常规选育进展缓慢,利用分子标记进行辅助选择,是较快改善猪繁殖性能的有效途径。大量文献[3-10]显示催乳素受体(prolactin receptor,PRLR)基因、整合素 β1(Integrinβ1,ITGB1)基因等均会不同程度地影响着猪的繁殖效率。
ITGB1基因是整合素家族成员之一,为胚胎着床期间重要的粘附分子,其与滋养层细胞侵润子宫内膜和子宫容受性改变密切相关[3]。研究[4-5]发现,在介导滋A养层细胞黏附以及迁移的整合素中,整合素β1具有非常重要的作用。分泌期子宫内膜中整合素β1表达水平的降低,可能会影响子宫内膜对胚泡的识别、粘附,导致子宫内膜容受性的降低,使着床失败,引起不孕[6-7]。
催乳素受体(prolactin receptor,PRLR)基因是影响母猪繁殖性能的主效基因之一,包括10个外显子和9个内含子[8],PRLR的突变可以提高窝产子数和窝产活子数,降低木乃伊率。王立辛等[9]报道,PRLR基因在长白、大白和杜洛克群中基因频率及基因型频率情况,长白群中AB的基因频率最高,杜洛克群中AA的基因频率最高,A等位基因在各种群中占主导地位。冯富彦等[10]研究表明,在豫南黑猪、杜洛克猪、长白猪、大约克夏猪4个种猪的PRLR基因中,AB基因型频率明显高于BB基因型频率,而A基因频率明显高于B基因频率,并呈现出AB>BB,A>B的趋势。
近年来,PRLR是报道较多的影响猪繁殖性能的主效基因,由于受试验群体种类以及饲养环境等的影响,研究结果并不一致;而有关猪整合素β1基因的研究相对较少,主要集中在人和小鼠。
因此,本研究对PRLR和ITGB1基因进行多态性检测,并分析候选基因多态性对大白母猪总仔数、活仔数、健仔数、死胎、木乃伊以及初生窝重等繁殖性状的影响,以期为其用于分子育种提供数据。
1 材料与方法
1.1 材料
本研究所选用大白猪685头均来自新疆正大食品有限公司下属猪场。每个个体用耳号钳采集耳组织样本,放入含有70%乙醇的1.5 ml EP管中,带回实验室备用。统计采样母猪2014-2016年各胎次的总产仔数、产活仔数、健仔数等有效产仔数记录共2849胎,其中初产胎次685胎。
主要仪器:RT-PCR仪、DYY-4稳流稳压电泳仪、恒温水浴锅、台式恒温振荡器、电泳凝胶成像系统、微波炉、台式高速离心机;主要试剂:2×Es Taq MasterMix(含染料),购自 CWBIO公司;Marker DL2000、血液/细胞/组织基因组DNA抽提试剂盒,购自TIANGEN公司;限制性内切酶MspⅠ,购自Takara-宝生物工程有限公司。
1.2 方法
1.2.1 基因组DNA的提取
采用血液/细胞/组织基因组DNA抽提试剂盒提取基因组DNA溶于TE中,测定浓度,并稀释至50 ng/μL。置于-20℃冰箱中保存,备用。
1.2.2 引物的设计与合成
PRLR基因与ITGB1基因PCR扩增引物由生工生物工程(上海)股份有限公司合成。PRLR基因:F:5'-CGTGGCTCCGTTTGAAGAACC-3';R:5'-CTGAAAGGAGTGCATAAAGCC-3'。 ITGB1 基 因 :F:5'-GACGTTGATGATTGCTGGTTGTA-3';R:5'-GAAACTGCCAATTGCCCTAAGC-3'。
1.2.3 PCR扩增
2个基因的PCR反应体系和扩增程序均相同。PCR 反应体系:2×EsTaq Master Mix 6.5 μL,去离子水 7.2 μL,上、下游引物各 0.4 μL,模板 DNA 0.5 μL,共 15 μL。
扩增程序为:94℃预变性4 min;94℃变性30 s,60 ℃退火 30 s,72 ℃延伸 30 s,35 个循环;72 ℃延伸10 min;4℃保存60 min。4%琼脂糖凝胶电泳检测,UVP凝胶成像系统照相保存。
1.2.4 RFLP酶切
PRLR基因酶切反应体系为15.5 μL,包括PCR产 物 13 μL、AluⅠ 酶 0.3 μL、10×Buffer1.5 μL,37℃酶切4 h。ITBG1基因酶切反应体系10 μL,包括 PCR 产物 4 μL、RsaⅠ酶 0.4 μL、10×Buffer 1 μL、双蒸水 4.6 μL,37 ℃酶切 2.5 h。酶切产物经4%琼脂糖凝胶电泳拍照保存,统计分析基因型。
1.2.5 统计分析方法
统计PRLR基因和ITGB1基因各基因型检出数,并根据数据计算基因频率、基因型频率、多态信息含量、有效等位基因数、群体杂合度和X2值[11-12]。并对基因型分布进行Hardy-Weinberg平衡检验,进行基因效应的估计[13],根据影响大白猪繁殖性能的因素,选用SAS 9.1软件再配合以下模型进行最小二乘方差分析GLM(general linear model),比较大白猪的总仔数、活仔数、健仔数、死胎数、木乃伊以及初生窝重等繁殖性状在各基因型间表现的差异显著性,显著性检验选用邓肯法。
Y=群体均值+年度效应+胎次效应+季度效应+随机残差。
2 结果与分析
2.1 PCR-RFLP分析结果
2.1.1 PRLR基因PCR-RFLP分析结果
将PCR产物酶切后电泳,结果(图1)显示有3种基因型,分别为85、59和19 bp为AA 型;104、59和19 bp为AB型;104和59 bp为BB型。

图1 PRLR基因多态性检测结果Fig.1 The genotying results of PRLR gene
2.1.2 ITGB1基因PCR-RFLP分析结果
将PCR产物酶切后电泳,结果(图2)显示:检测到3种基因型。22和 114 bp为 CC型;22、114和136 bp为TC型;136 bp为TT型。

图2 ITGB1基因多态性检测结果Fig.2 The genotyping results of ITGB1 gene
2.2 PRLR和ITGB1基因多态座位基因频率及基因型频率的统计分析
用Excel表格统计基因型,分别计算2个多态座位的基因频率、基因型频率以及群体遗传特性,结果(表 1)显示:对于 ITGB1基因,T基因为优势基因;对于PRLR基因,A基因为优势基因。
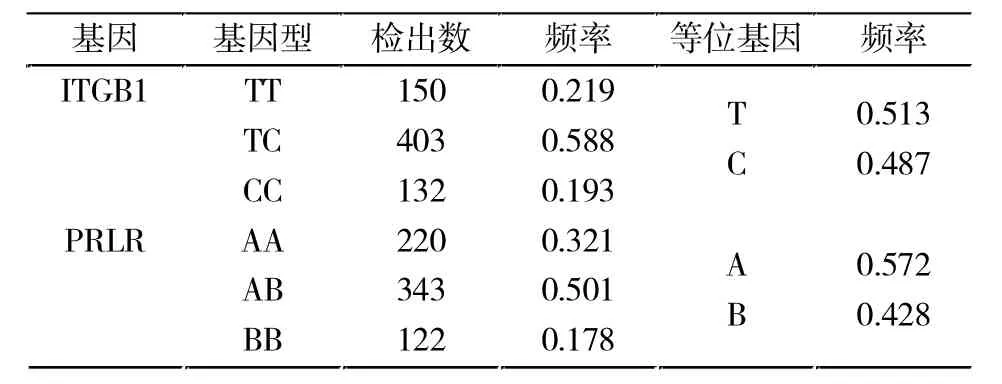
表1 PRLR和ITGB1基因的分布频率Tab.1 The genotype and allele frequencies of PRLR and ITGB1 genes
2.3 PRLR和ITGB1基因的群体遗传特性
在 PRLR和ITGB1基因座上,大白猪群体的多态信息含量分别为0.370和0.375,处于 0.25-0.5,属中度多态。χ2独立性检验表明ITGB1基因不符合哈迪-温伯格平衡。

表2 基因多态信息含量、杂合度、有效等位基因数及X2检验Tab.2 Data ofPIC,H,NeandX2test
2.4 PRLR基因和ITGB1基因多态性与大白猪繁殖性能的相关性分析
2.4.1 PRLR基因多态性对大白猪繁殖性能的影响
PRLR不同基因型大白猪繁殖性能的比较结果见表1。

表3 PRLR不同基因型大白猪繁殖性能比较Tab.3 The influence of PRLR genotypes on reproduction performance in Yorkshire sow
初产母猪的总仔数、死胎数和初生窝重呈现AA<AB<BB的趋势,但差异均不显著(P>0.05)。经产母猪总仔数、活仔数和健仔数依次呈现AA>AB>BB的趋势,AA型比BB型、AB型个体的总仔数多 0.55(P<0.05)头、0.13头,AA型和 AB型比 BB型个体的活仔数多0.59头和0.43头,AA型比BB型个体的健仔数多0.5头,基因型间的差异达到显著水平(P<0.05)。
2.4.2 ITGB1基因多态性对大白猪繁殖性能的影响
ITGB1基因在大白猪中同样扩增出3种基因型,初产母猪和和经产母猪各基因型间的繁殖性状虽有差异,但未呈现规律性变化,基因型间的繁殖性状差异均不显著(P>0.05)。

表4 ITGB1不同基因型大白猪繁殖性能比较Tab.4 The influence of ITGB1 genotypes on reproduction performance in Yorkshire sow
2.4.3 PRLR和ITGB1合并基因与大白猪繁殖性能相关性分析
PRLR和ITGB1基因合并基因型与母猪繁殖性能关联分析结果(表5)表明,初产母猪中,ABCC型比BBTT型个体的初生窝重多1.35头(P<0.05),不同基因间其他繁殖性状均无显著差异(P>0.05)。
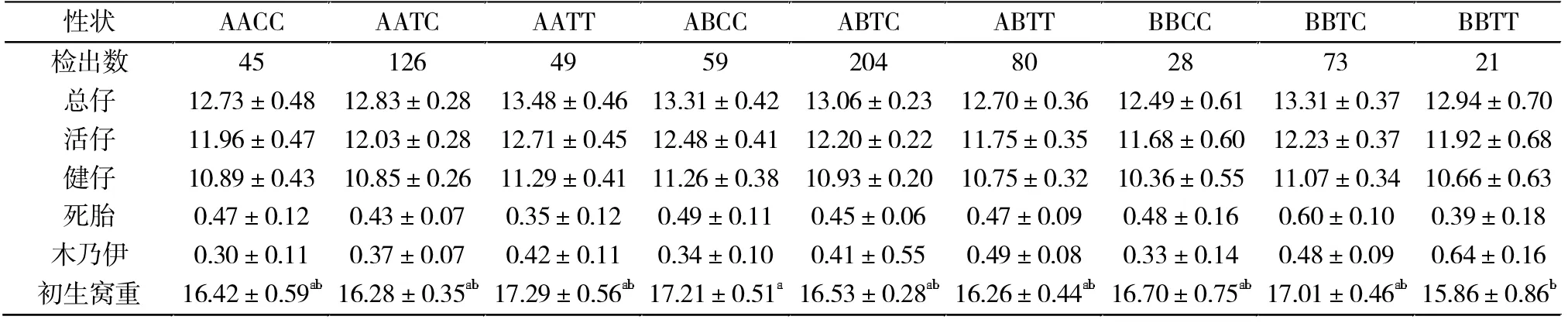
表5 PRLR和ITGB1合并基因位点与大白猪繁殖性能相关性分析(初产母猪)Tab.5 the influence of PRLR and ITGB1 merge gene and their relationship with reproduction performance in Yorkshire sow(primiparous sows)
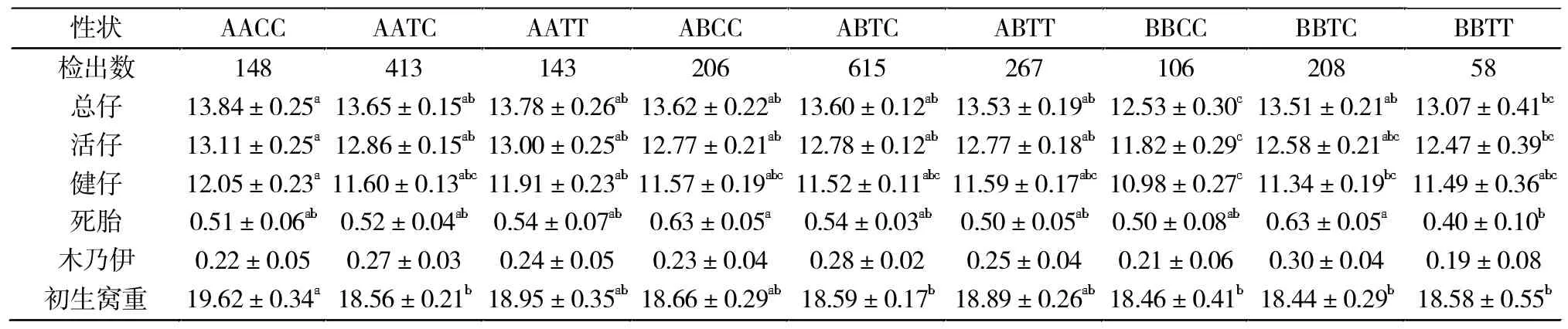
表6 PRLR和ITGB1合并基因位点与大白猪繁殖性能相关性分析(经产)Tab.6 Polymorphism of PRLR and ITGB1 merge gene and their relationship with reproduction performance in Large White sow(multiparous sows)
经产母猪中,AACC型总仔数和活仔数最高,分别比BBCC型多1.31和1.39头、比BBTT型多0.77头和0.64头,差异均显著(P<0.05);BBCC型总仔数和 活 仔 数 显 著 低 于 AATC、AATT、ABCC、ABTC 和ABTT型个体(P<0.05);AACC型健仔数比BBCC和BBTC型个体多1.07头和0.71头,差异均显著(P<0.05);BBTT型个体死胎数比ABCC和BBTC型个体都少 0.23 头(P<0.05),AATC、ABTC、BBCC、BBTC 和BBTT型个体初生窝重分别比AACC少1.06、1.03、1.16、1.18和 1.04头,有显著性差异(P<0.05)。
3 讨论
3.1 PRLR基因对大白猪繁殖性能的影响
PRLR基因即催乳素受体基因,能够在哺乳动物的乳腺、黄体、卵巢等多种组织中表达。诸多研究已证实PRLR基因对猪繁殖性能有显著影响。Vincent等[14]分析PRLR基因在大白-梅山、大白(2个不同来源)、长白、皮特兰、杜洛克6个品系中的遗传效应,发现PRLR基因的A等位基因能显著提高产仔数,本研究中,经产母猪AA型比BB型、AB型个体的总仔数多0.55(P<0.05)头、0.13头,AA型和AB型比BB型个体的活仔数多0.59头和0.43头,AA型比BB型个体的健仔数多0.5头,发现A等位基因也能显著提高母猪产仔数;施启顺等[15]分析了此位点在大白猪、长白猪中的遗传效应,结果表明,A等位基因可能对猪繁殖性状更有利;冯富彦等[10]等在豫南黑猪,杜洛克猪,长白猪,大约克夏猪4个种猪的PRLR基因中发现A基因频率明显高于B基因频率,并呈现出AB>BB,A>B的趋势。王立辛等[9]报道,PRLR基因在长白、大白和杜洛克群中A等位基因在各种群中占主导地位。外种猪[16]和我国地方猪种[17]中均有研究显示A等位基因与优良繁殖性能相关。本实验中的经产母猪总仔数、活仔数和健仔数依次呈现AA>AB>BB的趋势,说明AA型可能对猪繁殖性状更有利,A为优势基因型。本研究的结果与文献[9-10,14-15]的结果相一致。
3.2 ITGB1基因对大白猪繁殖性能的影响
整合素β1是整合素家族成员之一,其与滋养层细胞侵润子宫内膜和子宫容受性改变密切相关[12]。郭良勇等[18]采用创造酶切位点技术对ITGB1基因多态性进行检测,结果显示,优势等位基因T的频率为0.55,本实验研究结果中优势等位基因T的频率为0.51,两者均属于中度多态;郭良勇等[19]利用DNA池测序技术研究ITGB1基因,研究结果显示基因型效应对产仔数性状有显著影响(P<0.05),3种基因型个体TNB和NBA的总体趋势为TT>TC>CC,而本研究中,虽然ITGB1基因在大白猪中同样扩增出了3种基因型TT、TC和CC,但分析结果并不一致,除品种与群体大小等差异外,统计胎次数也可能是导致各研究结果差异的主要原因。
3.3 合并基因型对大白猪繁殖性能的影响
理论上繁殖性状受较多基因的共同控制,且多个基因的合并基因型遗传效应并非各个基因型效应的简单相加,而应稍高于单个的基因型效应[20]。赵西彪等[21]在AREG、ESR和FSHβ亚基基因与猪产仔数关系研究中发现,大白猪群中,头胎总产仔数、经产胎总产仔数和经产胎产活仔数合并基因型ABBBBB最高,合并基因型AAABAB最低,分别相差4.667头/胎、4.300 头/胎和 5.667头/胎;刘超等[22]将 FSH-β、ESR、BF 3个基因合并基因型为AB AA AA的母猪其全仔数、健仔数、初生窝重比最低的AA AB AA合并基因型母猪分别高了 1.44、1.45头、2.21 kg(P<0.01)。这表明合并基因型效应明显高于各单基因效应的简单累计。
本研究中,经产母猪AACC型个体总仔数和活仔数分别比BBCC型多1.31头和1.39头、BBTT型多0.77头和 0.64头(P<0.05);AACC型个体健仔数比 BBCC和 BBTC型个体多 1.07和 0.71头(P<0.05),同样可以得知合并基因型的遗传效应显著高于单个基因效应,而不是各个基因型效应的简单叠加。
4 结论
根据本实验研究结果,PRLR基因的AA为优势基因型,A为优势等位基因,A基因能显著提高母猪产仔数,在ITGB1基因中T为优势等位基因,所以在对这一群体进行遗传改良时,可优先考虑提高猪群A和T基因的频率来提高大白猪的繁殖性能。就合并基因型而言,合并基因型效应高于单个基因型的遗传效应,且AACC是大白猪繁殖效益的有利合并基因型。因此,可通过提高AACC基因型频率来提高猪群的繁殖效益。
[1] 徐旺生.中国养猪史[M].北京:中国农业出版社出版,2009:35.
[2] 曹果清,李步高,刘建华,等.猪催乳素受体(PRLR)基因AluⅠ多态性与产仔数关系的研究[J].山西农业大学学报,2004,24(3):253-255.Cao G Q,Li B G,Wang J H,et al.Study on relationship between aluⅠpolymorphism of prolactin receptor(PRLR)gene and litter size in swine[J].Journal of Shanxi Agricultural University,2004,24(3):253-255.
[3] Yoshimura Y,Miyakoshi K,Hamatani T,et al.Role of beta 1 integrins inhuman endometrium and decidua during implantation[J].Horm Res,1998,50(Suppl 2):46-55.
[4] Das C,Basak S.Expression and regulation of integrin receptors in human trophoblast cells:role of estradiol and cytokines.[J].Indian Journal of Experimental Biology,2003,41(7):748-755.
[5] Barakat A I,Thirkill T L,et al.Effect of shear stress on migration and integrin expression in macaque trophoblast cells[J].Biochimica Et Biophysica Acta Molecular Cell Research,2002,1589:233-246.
[6] 张烨华,王立民,王聪慧,等.6个绵羊品种微卫星多态性分析[J].石河子大学学报(自然科学版),2015,33(5):558-562.Zhang Y H,Wang L M,Wang C H,el at.Microsatellite analysis of the genetic diversity in six sheep breeds in Xinjiang[J].Journal of Shihezi University(Natural Science),2015,33(5):558-562.
[7] 李莹,朱润庆,等.整合素1和层粘连蛋白在不孕症患者子宫内膜和正常早孕蜕膜组织中表达的研究[J].数理医药学杂志,2007,20(5):640-642.Li Y,Zhu R Q,el at.Study on the expression of integrinβ1 and laminin in human endometrium of infertility and normal early pregnant deciduas abstract[J].Journal of Mathematical Medicine,2007,20(5):640-642.
[8] 岳远瑞,袁晓航,周路,等.新疆7个绵羊品种MHC区段微卫星遗传多样性的分析[J].石河子大学学报(自然科学版),2014,32(4):438-443.Yue Y R,Yuan X H,Zhou L,el at.Genetic diversity of microsatellite in MHC region among seven sheep breeds in Xinjiang[J].Journal of Shihezi University(Natural Science),2010,33(4):427-431.
[9] 王立辛,苏玉虹,高继红,等.猪ESR、FSH-β和PRLR基因合并基因型对产仔数的影响[J].中国农学通报,2011,27(29):18-22.Wang L X,Su Y H,Gao J H,el at.Effects of combined genotype of ESR,FSH-β and PRLR on litter size in pigs[J].Chinese Agricultural Science Bulletin,2011,27(29):18-22.
[10] 冯富彦,李新建,吕刚,等.豫南黑猪及3个引进猪种FSHβ和PRLR基因多态性与产仔性能的关系[J].华北农学报,2011,29(5):66-70.Feng F Y,Li X J,Lv G,el at.Relationship of genetic polymorphism of fshβ and PRLR genes with litter size traits in yunan black pig and three foreign pig breeds[J].Journal of Southern China Agricultural,2011,29(5):18-22.
[11]Yang D Y,Chen H,Wang X Z.Association of polymorphisms ofleptingene with body weightand body sizes indexes in Chinese indigenous cattle[J].Journal of Genetics and Genomics,2007,34(5):400-405.
[12] Rupp R,Hernandez A,Mallard B A.Association of bovine leukocyte antigen(BoLA)DRB3.2 with immune response,mastitis,and production and type traits in Canadian Holsteins[J].Journal of Dairy Science,2007,90(2):1029-1038.
[13] 刘桂琼,曹勤忠,姜勋平,等.小梅山猪促卵泡β基因多态性及其与繁殖性能的关系[J].中国畜牧杂志,2004,40(12):10-12.Liu G Q,Cao Q Z,Jiang X P,el at.Polymorphism of FSH beta gene and its association with reproductive traits in small meishan pig[J].Chinese Journal of Animal Science,2004,40(12):10-12.
[14] Vincent A L,Evans G,Short T H.The prolactin receptor gene is associated with increased litter size in pigs[A].Proc6th World Congress on Genetics Applied Livestock Prodution[C].Armidale,Australia,1998,27:15-18.
[15] 施启顺,柳小春,刘志伟,等.5个与猪产仔数相关基因的效应分析[J].遗传,2006,28(6):652-658.Shi Q S,Liu X C,Liu Z W,el at.Effect of five genetic loci related to pig litter size[J].Hereditas,2006,28(6):652-658.
[16] Van rens B T,Evans G J,Van der Lende T.Components of litter size in gilts with different prolactin receptor genotypes[J].Theriogenology,2003,59(3):915-926.
[17] 刘庆雨,于永生,金鑫,等.松辽黑猪和长白猪催乳素受体基因第10外显子多态性与繁殖性状的关联分析[J].中国畜牧兽医,2012,39(10):191-195.Liu Q Y,Yu Y S,Jin X,el at.Association analysis on polymorphisms of prolactin receptor(PRLR)gene exon 10 with reproductive traits in songliao black pig and landrace pig[J].China Animal Husbandry,2012,39(10):191-195.
[18] 郭良勇,闫学军,王爱国,等.猪ITGB1基因多态性与产仔数的关联性分析[J].中国畜牧杂志,2012,48(21):22-25+60.Guo L Y,Yan X J,Wang A G,el at.Correlation analysis of porcine ITGB1 gene polymorphisms and litter size[J].Chinese Journal of Animal Science,2012,48(21):22-25+60.
[19] 郭良勇,傅金銮,王爱国,等.猪整合素β-1基因CRS-PCR多态性与产仔数的关联性分析[J].遗传,2012,34(7):88-95.Guo L Y,Fu J L,Wang A G,el at.Analysis of association between CRS-PCR polymorphisms of integrin β1 gene and litter size in pigs[J].Hereditas,2012,34(7):88-95.
[20] Chen K,Ning L.The combined genotypes effect of ESR and FSH-βgenes on litter size traits in five different pig breeds[J].Chin Sci Bull,2001,46(2):140-143.
[21] 赵东伟,汤青萍,李慧芳,等.利用微卫星标记分析巢湖鸭群体的遗传多样性[J].石河子大学学报(自然科学版),2010,28(4):427-431.Zhao D W,Tang Q P,Li H F,el at.An analysis of the genetic diversity of the chaohu duck by using microsatellite markers[J].Journal of Shihezi University(Natural Science),2010,28(4):427-431.
[22] 刘超,沈君叶,朱士恩,等.FSH-β、ESR、BF基因对大白猪繁殖性状的遗传效应分析[J].中国畜牧杂志,2013,49(17):6-11.Liu C,Shen J Y,Zhu S E,el at.Genetic effects of porcine FSH-β,ESR and BF genes on reproductive traits in yorkshire[J].Chinese Journal of Animal Science,2013,49(17):6-11.
The influence of polymorphisims of PRLR and ITGB1 genes on reproduction traits of Yorkshire sows
Shen Yongqiao1,Hu Jiuying2,Sun Jingli1,Lu Huiwen1,Wang Deming2,Huahng Tao1*
(1 College of Animal Science and Technolongy,Shihezi University,Shihezi,Xinjiang 832003,China;2 Xinjiang Chia Tai Food Co.,Ltd.,Wujiaqu,Xinjiang 831301,China)
To investigate the influence of polymorphisms of PRLR and ITGB1 genes on reproduction performance of Yorkshire sows,genotypes of the sows were detected by PCR-RFLP technique and the correlation with reproduction performance was analyzed.The results showed that,for PRLR gene,there were no significant difference between the reproductive traits of 3 genotypes in first-parity sows (P>0.05);but in multiparous sows,total number born(TNB),number born alive(NBA)and number healthy birth(NHB)all showed a tendency of AA>AB>BB,the TNB of genotype AA were 0.55 (P<0.05)and 0.13 more than that of genotype BB and AB respectively,the NBA of genotype AA,AB were 0.59(P<0.05)and 0.43(P<0.05)higher than BB respectively,the NHB of genotype AA was 0.5(P<0.05)higher than BB.For ITGB1 genes,there were no significant differences among genotypes.For combined genotypes,the litter weight (LW)of genotype ABCC was 1.35 (P<0.05),heavier than BBTT in first-parity sows;in multiparous sows,the NHB of genotype AACC were 1.07(P<0.05)and 0.71(P<0.05)more than BBCC and BBTC,the TNB and NBA of genotype AACC were 1.31 (P<0.05)and 1.39 (P<0.05)more than BBCC,the TNB and NBA of AACC were 0.77(P<0.05)and 0.64(P<0.05)higher than BBTT.
sows;PRLR;ITGB1;reproductive performance
S828
A
10.13880/j.cnki.65-1174/n.2017.02.003
1007-7383(2017)02-0146-07
2016-04-21
国家国际科技合作项目 (2014DFA31840)
沈永巧(1992),女,硕士研究生,研究方向为动物遗传育种与繁殖,e-mail:1525533695@qq.com。
*通信作者:黄涛(1978-),男,副教授,从事猪分子育种研究,e-mail:taohuang100@sina.com。

