制作木质纤维材料超薄切片的软化及固定技术
邓立红
北京林业大学材料科学与技术学院 北京 100083
制作木质纤维材料超薄切片的软化及固定技术
邓立红
北京林业大学材料科学与技术学院 北京 100083
将木质纤维材料样品制作成超薄切片,再利用透射电子显微镜进行观察分析,是研究木质纤维材料超微结构的重要手段,过程中超薄切片的质量至关重要。由于木质纤维材料结构性质的特异性,其超薄切片样品的制作过程也有相应的要求。经过详细调研近些年国内外相关文献,对木质纤维材料样品超薄切片制作过程中软化和固定过程的原理、方法及应用情况进行了阐述和总结,为相关研究提供技术参考。
透射电子显微镜;木质纤维;软化;固定
木质纤维植物细胞壁主要组分为纤维素、半纤维素以及木质素,三者有机结合在一起,形成相对稳定而又复杂的细胞骨架。观察分析各组分在细胞壁层中的发育、分布及细胞壁层内部的超微结构,历来是植物学、木材化学、制浆化学的重要内容。1932年Ruska发明的以电子束为光源的透射电子显微镜(Transmission Electron Microscopy,简称TEM),具有光学显微镜所不能及的高分辨率,能够观察到小于0.2 um的超微结构,被广泛使用于生物材料的超微结构研究当中。由于电子的穿透能力有限,在使用透射电子显微镜观察样品前,必须先将样品经过一系列前处理后,用超薄切片机切割成厚度不超过100 nm(50 nm以下更适宜)的超薄切片,才能得到满足研究要求的电镜照片。
一般木质纤维材料样品切片前的处理过程包括软化、固定、冲洗脱水、渗透以及包埋这几个步骤。由于取材及研究目的差异,前处理过程也有差异。有些样品必须软化而无须固定,有些样品不能进行软化而必须固定。本文将根据以往的文献报道,对木质纤维材料制作超薄切片的软化及固定处理技术进行总结介绍。
1 软化
相比其他生物材料,木质纤维材料有一些特性:细胞种类多,经常含有硅质细胞、栓质细胞或石细胞;细胞壁较厚,细胞壁中含结晶结构。这使得材料样品质地坚硬粗糙,容易损伤超薄切片机昂贵的钻石刀刃。为了避免这一现象发生,在不影响实验结果的情况下,可以对样品进行软化处理。
1.1 软化机理
木质纤维材料是由40%~50%的纤维素、15%~30%的半纤维素、20%~40%的木质素为三大主要组分的天然复合材料。软化处理采用物理或化学方法处理材料,使材料变柔软,以利于切片,减少对刀片的磨损。软化机理主要包括两点。第一,利用三大主要组分的软化性质。三大组分的分子结构特征使其具有向玻璃化转变的性质[1]。在热作用下,能向玻璃态转化,使材料具有黏弹性而变得柔软[2,3],尤其是木素的黏弹性更显著[4];湿热耦合作用还可以降低木材半纤维素和木质素的玻璃化转变温度[5]。第二,利用水、有机溶剂、酸、碱对纤维素非结晶区、半纤维素及木质素产生润胀或轻微降解,为分子剧烈运动提供自由体积空间,使材料各组分间的结合力减弱而软化[6,7]。在具体软化过程中,这两种机理经常同时起作用。
1.2 软化方法
基于以上两种软化机理,研究得到了很多种用于切片的软化处理方法,可粗分为化学法和物理法两种。主要包括水热法、氨水-醋酸法、聚乙二醇法、醋酸法、过氧化氢-冰醋酸法、氢氟酸法、三甘醇法、酒精乙醇法等。操作时一般是在加热或室温条件下,用水、水蒸气或以上试剂浸泡处理样品数小时至数天,再将样品清洗干净进行后续处理。表1汇集了近年文献中所用的一些软化方法。
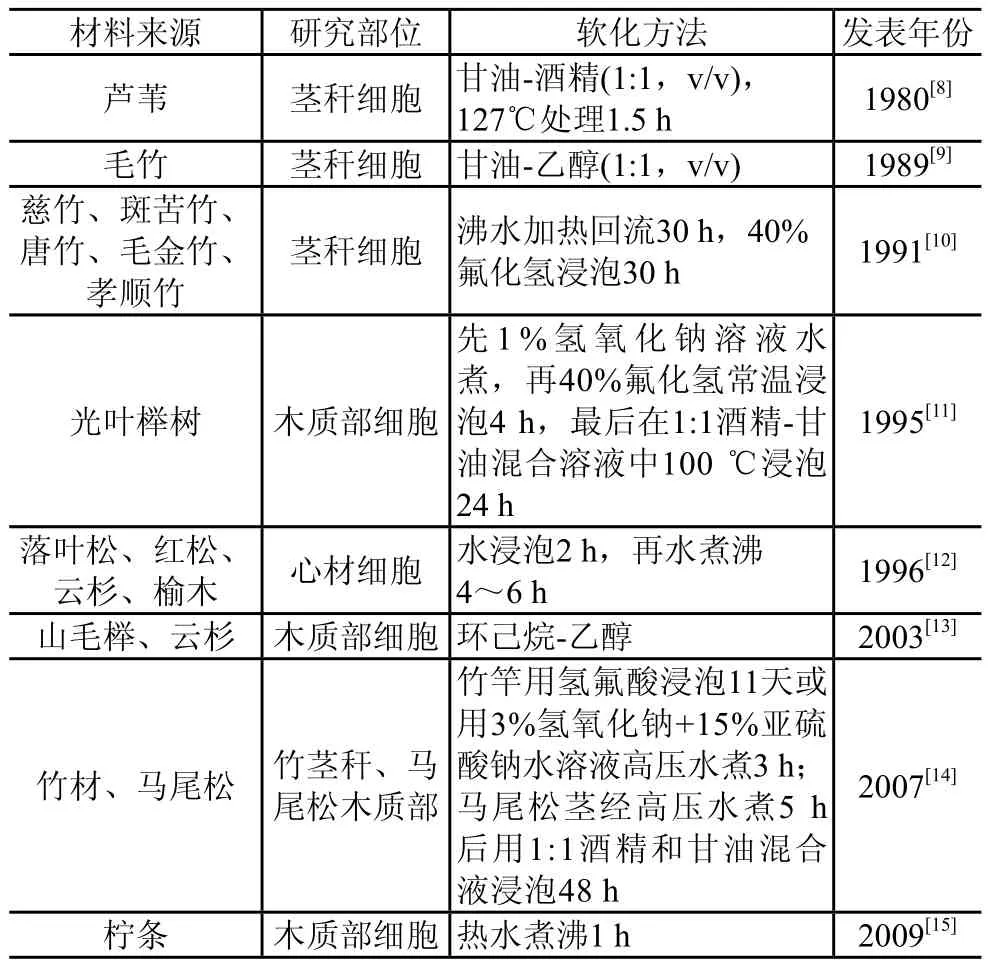
表1 木质纤维材料超薄切片软化处理示例
软化对材料的细胞壁结构或多或少有改变,当研究材料为活体取样时,为了维持样品的原始形态结构,就一定不能软化样品。因此软化往往是针对风干材进行的。另外在个别情况下,例如实验过程与制作超薄切片的软化过程基本一致,则不需要对实验材料进行软化。Cordt等曾采用透射电镜观察针叶木木热处理过程中细胞壁的变化情况[16]。他们将欧洲赤松经过有机溶剂抽提和热水抽提,然后在不同温度下进行热处理,研究不同热处理温度对细胞壁的影响。这个处理过程实际已经起到软化的作用,所以热处理后材料直接经渗透包埋用于切片观察。各种材料的细胞结构和生物学特性有差异,因此软化过程最好在文献的基础上适当改进,才能获得理想的结果。
2 固定
对于从活体上取下的新鲜材料,为了维持细胞和组织的原有形态结构,必须对样品进行固定。否则,离体的组织会出现干枯和萎缩,外界的微生物也会浸入组织进行破坏。同时,细胞内各种酶还有活力,会使细胞壁自溶解体,材料结构发生变化[17]。而固定时所采用的固定剂通过凝固、生成化合物等使蛋白质内部结构发生改变,使酶失活,达到阻止内源性溶酶体酶对自身组织和细胞的自溶、抑制细菌和霉菌的生长的目的。
新鲜样品取下来后,需要随即投入置于具塞小试管或干净蜡版上的固定液中,使样品细胞快速失去活性。如果材料漂浮于固定液上,可以用真空泵进行减压抽气,排除材料内部空气,以利固定液渗入,材料下沉[17]。
但是,对于风干的木质纤维材料,因为细胞早已木质化,失去水分和活性,不容易被微生物污染而改变形态结构,可以不进行固定处理,这也是植物纤维材料样品相对于其他生物材料样品的一个特征。此时如果进行固定处理,是为了增加切片的反差[18]。
2.1 常用固定剂及固定原理
影响固定过程最重要的因素是固定液的类型。常用于超薄切片制作的固定剂有锇酸(四氧化锇,OsO4)、醛类、高锰酸钾等。
锇酸可以与脂类、糖类和蛋白质反应而起到固定作用。其对脂类的固定作用可以补充醛类固定剂对脂类固定不足的缺点。同时能增加膜的反差,起到“电子染色”作用,细胞膜结构比较清晰。但锇酸渗透力弱,所以样品块要小。
醛类固定剂主要有甲醛、戊二醛和多聚甲醛。固定原理在于醛基能与蛋白质的氨基作用,产生交联反应而起固定作用,但具体的反应过程迄今尚未完全探清[19]。戊二醛是经常使用的固定剂,在植物切片中使用更多。戊二醛与蛋白质反应速度快,是优良的前固定剂。但它的渗透速度较慢,必要时配合甲醛或锇酸使用效果更佳。戊二醛起作用时经常需要氧气参与,由于大块样品内部氧气供应不足,戊二醛在样品内部无法形成稳定的产物,导致样品内部的固定效果不佳。因而在使用戊二醛固定时,小块的样品固定效果较理想。电镜固定通常用市售的25%的戊二醛水溶液,用缓冲液稀释成需要的浓度,最常用的浓度为3%~4%。
高锰酸钾可以与脂类反应而固定磷脂膜的结构,增强膜结构的反差,如细胞质膜、高尔基体、线粒体的嵴突和叶绿体的片层等,但不能保存细胞的许多其他成分。其穿透性强,因而较适用于有厚细胞壁的竹木材样品。
2.2 固定过程
各种固定剂都有优缺点,为了使固定效果更完全,普遍采用双重固定法。表2整理介绍了近年文献中介绍的木质纤维材料的固定过程。
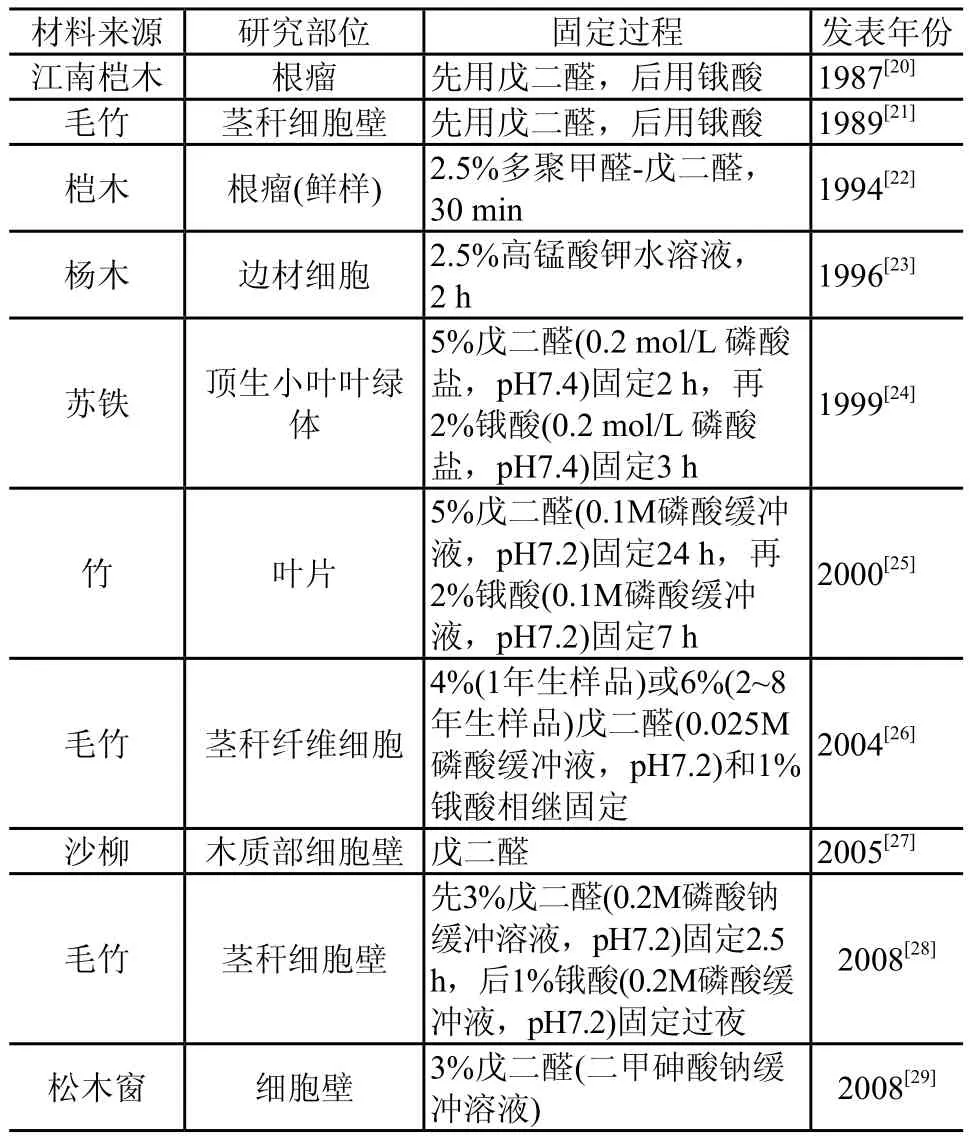
表2 木质纤维材料超薄切片固定处理示例
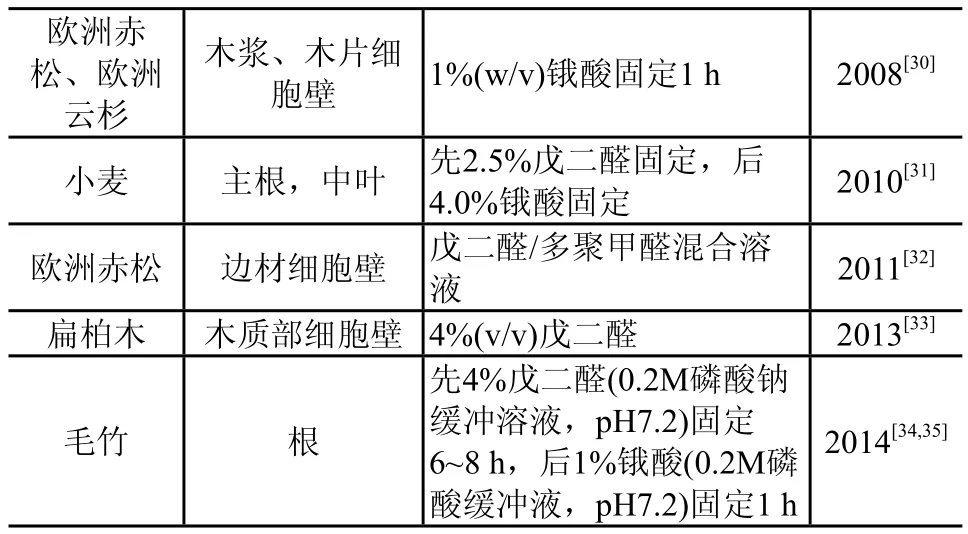
表2 (续)
由表2可以看出,对于木质纤维材料,用得最普遍的固定剂是戊二醛和锇酸,一般将它们配合使用,即戊二醛作为前固定剂,锇酸作为后固定剂。磷酸缓冲溶液用得较多。差异主要体现在固定剂浓度及固定时间,这两个因素的水平最好在实验基础上确定。
也有不对样品进行固定的情况。尤华明等研究了竹材和马尾松材的切片技术,在没有固定过程的情况下也取得了理想的透射电镜效果[14]。Adya等将脲醛树脂黏合辐射松木木片,通过透射电镜研究树脂在辐射松管胞中的渗透过程。并没有经过软化、固定处理,利用树脂对木片的黏合过程中直接渗透、包埋样品,切片,切片经染色后,也得到了满足实验要求的透射电镜照片[36,37]。
3 结束语
(1)任何软化过程都会在一定程度上改变细胞原始结构,所以对于新鲜活体取下的材料一定能进行软化处理。对于已经失去活性的材料,也应尽可能选择条件温和、软化效果又能达到要求的软化过程,合适的软化过程应该在实验基础上得到。
(2)固定处理对于活体取样一般是必需的,大多数风干材为了提高切片质量也进行固定处理。多数文献以戊二醛作为前固定剂,锇酸作为后固定剂。固定剂浓度、时间也需要在实验基础上得到。但目前并未见专门研究木质纤维材料固定技术的报道。
[1]Rattanadecho P.The simulation of microwave heating of wood using arectangular wave guide:in fl uence of frequency and samplesize[J]. Chemical Engineering Science,2006,61(14):4798-4811.
[2]Frederick AK. Moisture dependent softening behavior of wood[J]. Wood and Fiber Science, 2001,33(3);492-507.
[3]张力平,张秋慧.木材软化技术的初步研究[J].木材工业,1994,8(2):21-23.
[4]Margaretha A, Lennart S. Softening of wood polymers induced by moisture studied dynamic studied dynamic FTIR specktroscopy[J].Journal of Applied Polymer Science, 2004,94(5):2032-2040.
[5]蒋佳荔,吕建雄.木材动态黏弹性的湿热耦合效应[J].林业科学,2014,50(12):101-108.
[6]李军.微波加热软化木材的弯曲工艺研究[J].林产工业,1998,25(6):4-6.
[7]李军.氨水处理与微波加热联合软化木材的弯曲工艺[J].南京林业大学学报,1998,22(6):55-59.
[8]轻工业部造纸研究所纤维形态组. 芦苇的超微结构以及木素和硅在结构中的分布[J].造纸技术通讯,1982(1):15-27.
[9]房桂干,王菊华.毛竹的形态学特性、超微结构及木素分布[J].中国造纸学报,1989(1):41-49.
[10]全金英,黄金生.制浆用竹材生物结构及化学组成的研究[C].中国造纸学会第六届学术年会论文选编,1991:80-87.
[11]徐柏生,陈敏忠.木材超薄切片及超微结构的初步研究[J].华南农业大学学报,1992,19(S):82-83.
[12]陈柏林,洛向玉.玻璃刀制备木材超薄切片的研究[J].东北林业大学学报,1996,24(3):84-89.
[13]Fromm J, Rockel B. Wanner G,Lignin distribution in wood cell walls determined by TEM and backscattered SEM techniques[J].Journal of Structural Biology, 2003, 143(1):77-84.
[14]尤华明,刘银春.竹杆、马尾松茎木质材料超薄切片技术[J].福建林学院学报,2007,27(4):376-379.
[15]许凤,毛健贞.柠条正常木与受拉木纤维细胞超微结构及木质素微区分不研究[J].中国造纸学报,2009,24(4):15-19.
[16]Cordt Z, Jorg F.Ultrastructural development of the softwood cell wall during pyrolysis, Holzforschung[J]. 2009,63(2):248-253.
[17]董渭祥,高小彦.植物超薄切片制备技术[J].植物生理学通讯,1982,17(5):32-35.
[18]许明坤,姜笑梅.透射电镜用木材试样的复型和超薄切片技术[J].林业科学,1992,28(3):287-288.
[19]孙忠权,陆文.低浓度多聚甲醛固定对蛋白质免疫印迹技术的改良[J].中国生物化学与分子生物学报,2013,29(12):1187-1193.
[20]谢卿楣,王炎林.江南桤木根瘤及其内生菌超微结构的研究[J].福建林学院学报,1987,7(3):13-18.
[21]房桂干,王菊华.毛竹的形态学特性、超微结构及木素分布[J].中国造纸学报,1989,9(4):42-49.
[22]吴祖洪,周国璋.四川桤木根瘤主要氮素同化酶活力及其超微结构研究[J].林业科学研究,1994,7(6):630-633.
[23]陈敏忠,王传槐.白腐菌云芝腐朽杨木的超微结构研究[J].南京林业大学学报,1996,20(1):48-52.
[24]Zuo B Y, Zhang Q. Chloroplast ultrastructure of seven cycads from tropical rainforest and dry habitat[J]. Biology and Conservation of Cycads, 1999, 248-253.
[25]尤华明.4种竹叶超薄切片技术的研究[J].福建林学院学报,2000,20(1):30-33.
[26]甘小洪,丁雨龙.毛竹茎秆纤维发育过程的超微结构观察[J].植物学通报,2004,21(2):180-188.
[27]许凤,钟新春. 沙柳的超微结构及其木素微区分布的研究[J].造纸学报,2005,20(1):6-9.
[28]刘波.毛竹发育过程中细胞壁形成的研究[D].北京:中国林业科学研究院,2008.
[29]Jong SK, Adya PS.Ultrastrucral characteristics of cell wall disintegration of Pinus spp.in the windows of an old buddhist temple exposed to natural weathering[J],International Biodeterioration and Biodegradation, 2008,61(2):194-198.
[30]Dinesh F, Geoffrey D. Exploring scots pine fibre development mechanisms during TEM processing: Impact of cell wall ultrastructure (morphological and topochemical) on negative behavior[J].Olzforschung, 2008,63(5):597-607.
[31]Xin X, Feng Q.the effect of Pb-Cu interaction on ultrastruture of wheat[A].International Conference on Multimedia Technology[C]. Ningbo, Institute of Electrical and Electronics Engineers, 2010,1587-1589.
[32]Mathias R, Gerald K.Topochemical investigation of early stages of lignin modification within individual cell wall layers of Scots pine (Pinussylvestris L.) sapwood infected by the brownrot fungus Antrodiavaillantii(DC.:Fr.) Ryv.[J]. International Biodeterioration and Biodegration, 2011,65(7):913-920.
[33]Rie E, Junji S. Evaluation of cell wall reinforcement in feather keratin-treated waterlogged wood as imaged by synchrotron X-ray microtomography (μXRT) and TEM[J]. Holzforschung,2013,67(7):795-803.
[34]Junren C, Danli P. Effect of copper toxicity on root morphology,ultrastructure and copper accumulation in Moso bamboo:Phyllostachyspubescens[J].ZeitschriftFürNaturforschung C Journal of Biosciences, 2014, 69(9-10):399-406.
[35]Dan L, Junren C. Effect of Zn toxicity on root morphology,ultrastructure, and the ability to accumulate Zn in Moso bamboo: Phyllostachyspubescens[J]. Environmental Science and PollutionResearch ,2014, 21(23):13615-13624.
[36]Christian L, Geoffrey D. Tem/FE-SEM studies on tension wood fibres of Acer spp., Fagussylvataca L. and Quercusrobur L.[J].Wood Science and Technology, 2009, 43(7):691-702.
[37]Adya PS, Arif N. Urea-formaldehyde resin penetration intoPinus radiate tracheid walls assessed by TEM-EDXS[J]. Holzforschu ng,2015,69(3):303-306.
Softening and Fixation for Preparing Ultrathin Section of Lignocellulosic Meterials
Deng Lihong
Collge of Material Science and Technology, Beijing Forestry University, Beijing, 100083, China
Using transmission electron microscopy observation is an important means to study the ultrastructure of lignocellulosic materials, and the effect depends largely on the quality of the ultrathin section. Because of the special structure and property of the lignocellulosic materials, the preparing of their ultrathin section owns speci fi city itself. This paper investigates the related literatures in recent years to summarize the principles, methods and application of softening and fi xation process during preparing ultrathin section of lignocellulosic materials, to provide technical reference for related research.
transmission electron microscopy; lignocellulose; softening; fi xation
邓立红,博士,高级实验师。
质检公益性行业科技专项:竹木及水果等植物检验处理装备与技术研究—熏蒸处理对竹木制品材料理化性状影响的研究(编号:201410054-04)。

