发光二极管630 nm红光和460 nm蓝光照射对日本大耳白兔皮肤创面愈合的影响
李彦红,张继刚,徐艳峰,韩云林,江彬彬,黄 澜,朱 华,徐玉环,杨维玲,秦 川
1中国医学科学院 北京协和医学院 医学实验动物研究所卫生部人类疾病比较医学重点实验室&国家中医药管理局人类疾病动物模型三级实验室,北京 1000212中国人民解放军火箭军总医院皮肤科,北京 100088
·论 著·
发光二极管630 nm红光和460 nm蓝光照射对日本大耳白兔皮肤创面愈合的影响
李彦红1,张继刚2,徐艳峰1,韩云林1,江彬彬1,黄 澜1,朱 华1,徐玉环1,杨维玲2,秦 川1
1中国医学科学院 北京协和医学院 医学实验动物研究所卫生部人类疾病比较医学重点实验室&国家中医药管理局人类疾病动物模型三级实验室,北京 1000212中国人民解放军火箭军总医院皮肤科,北京 100088
目的 观察发光二极管(LED)630 nm红光和460 nm蓝光照射对日本大耳白兔皮肤创面愈合的影响。方法 采用日本大耳白兔8只,建立兔背部皮肤创伤模型,每只兔子3个伤口,分别给予红、蓝光距离15 cm垂直照射(15 min/次)和自然愈合处理。照射至创伤后第21天,观察各组创面愈合数目、愈合面积,计算创伤愈合面积百分比,比较两种光源的治疗作用;HE染色观察新生组织结构;Masson染色观察胶原纤维增生情况;免疫组织化学分析新生皮肤纤维细胞生长因子(FGF)、表皮生长因子(EGF)、内皮细胞生长因子(CD31)、增殖细胞核抗原(Ki- 67)及炎性细胞因子(CD68)的表达情况。结果 红光组、蓝光组和对照组的愈合率分别为50.0%(4/8)、25.0%(2/8)和12.5%(1/8)。自造模后第12天起,红光组伤口的愈合面积百分比均明显高于蓝光组及对照组(P<0.05或P<0.01)。建模后第21天,红光组新生皮肤厚度为(2.95±0.34)mm,明显高于对照组的(2.52±0.42)mm(F=3.182,P=0.016)。胶原纤维平均光密度为0.15±0.03,明显高于蓝光组的0.09±0.01(F=7.316,P=0.012)和对照组的0.07±0.01(F=7.316,P=0.003)。免疫组织化学检测结果显示,红光组的EGF、FGF、CD31抗原、Ki- 67表达较蓝光组和对照组明显增多,CD68较蓝光组和对照组明显减少(P<0.05或P<0.01)。结论 LED 红光照射可促进日本大耳白兔皮肤创面愈合,其可能是通过引起皮肤表皮细胞和血管内皮细胞生长及纤维组织增生来促成的。
发光二极管;皮肤创伤;日本大耳白兔;增生;炎症
ActaAcadMedSin,2017,39(3):301-306
轻度、小范围的皮肤创面可自身修复愈合,但当伤口缺损很大并累及真皮层甚至皮下组织,需通过皮肤移植进行治疗[1]。因自体皮来源有限,对于大面积损伤,可能需要多次移植,这样不仅增加了手术风险,也易造成新的创伤。发光二极管(light emitting diode,LED)光源具有方便、无痛、费用低等优点,可用来治疗皮肤创伤伤口,为临床治疗该病提供了新的途径。随着半导体技术的发展,各种波长的LED被开发出来,且其光强度不断变强,为LED光疗法在生物医学中的应用奠定了基础,并在皮肤医学应用领域得到推广。由于LED光源波长越长,波频越低,穿透性越高,因此不同光源照射产生的生物效应也不同。本研究观察了LED 630 nm红光和460 nm蓝光照射对日本大耳白兔皮肤创面愈合的影响,初步探讨了其导致组织结构改变的机制。
材料和方法
实验动物及材料 日本大耳白兔,6~8周龄,2.5 kg左右,雌雄各4只,购自北京富龙腾飞养殖中心[许可证号:SYXK(京)2013- 0004],饲养在中国医学科学院医学实验动物研究所新药安全评价中心及管理普通级动物房[许可证号:SYXK(京)2010- 0030)],每天光照明暗各12 h,相对湿度40%~60%,温度18~25℃,每笼1只,自由摄食和饮水。本实验操作已经中国医学科学院医学实验动物研究所实验动物使用管理委员会批准(ILAS-PL- 2014- 005)。
LED灯(GY225)由山西光宇半导体照明股份有限公司提供。抗体内皮细胞标记分子CD31(ab199012,500 μl,Abcam);增殖细胞核抗原蛋白Ki-67(ab15580,200 μg,Abcam);表皮生长因子(epidermal growth factor,EGF)(Ls-B11905,50 μg,LSBio);成纤维细胞生长因子(fibroblast growthfactor,FGF)(ab955,500 μl,Abcam);巨噬细胞标记分子CD68(ab199012,500 μl,Abcam)。抗兔、抗小鼠和抗山羊二抗(PV9001、PV9002、PV9003,18 ml,北京中杉金桥公司)。
兔创伤模型的构建及皮肤创伤光源照射 将兔背部皮肤用电推子脱毛,消毒,3%戊巴比妥钠麻醉(40 mg/kg)后固定,用利刀在其背部正中两侧共制造3个直径2 cm左右的圆形切口,深至肌肉筋膜,每只兔子3个伤口,分别给予LED灯红光(波长630 nm,功率50 mw/cm2)、蓝光(波长460 nm,功率50 mw/cm2)隔日垂直照射[2]和自然愈合处理(对照组),光源与伤口距离均为15 cm。具体为:当兔用红光照射时,蓝光和自然愈合创面用双层金属锡箔纸盖住,医用透明胶带固定;蓝光照射时,同样方法遮住红光和自然愈合创面;锡箔纸有皱褶或裂隙及时更换。照射顺序为每只动物红光创面先照射的,第2次改为蓝光先照射,以后依次交替进行;同理蓝光创面先照射的,第2次改为红光区先照射,以后依次交替进行。
创面观察 照射过程中观察创面愈合时间、愈合数目、愈合面积及愈合百分比。愈合标准:创面完全由上皮组织覆盖,结痂褪去。
皮肤组织病理学检查 实验观察至第21天,即对照组有1个伤口愈合时,将兔用3%戊巴比妥钠过量麻醉并放血致死,解剖取红光照射、蓝光照射及自然愈合区的皮肤组织,10%福尔马林溶液固定,石蜡包埋切片。
HE染色:切片脱蜡至水,经苏木素染色,盐酸酒精分化,氨水返蓝后伊红染色,脱水透明封片,光学显微镜下进行观察。
Masson染色:皮肤切片脱蜡至水,丽春红染液染色5~10 min,1%磷钨酸分化2 min后亮绿复染5 min,1%冰醋酸溶液洗1 min,经酒精脱水,二甲苯透明后封片,光学纤维镜下进行观察。
免疫组织化学染色:切片脱蜡至水,抗原修复,封闭后加一抗CD31(稀释比例1∶100)、Ki-67(稀释比例1∶2000)、EGF(稀释比例为1∶100)、FGF(稀释比例1∶100)、CD68(稀释比例1∶100),4℃过夜,加相应二抗工作液,DAB显色,苏木素复染,流水冲洗后,脱水透明封片,光学显微镜下进行观察。
创面照射图片采用ImageJ(v2.1.4.7,NIH,美国)软件进行面积分析。染色切片采用ScanScopeCS/GL切片扫描仪(Aperio,美国)扫描,Image-pro plus软件进行图像结果分析。
统计学处理 采用SPSS 17.0统计软件,所有数据以均数±标准差表示,组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
创面愈合情况 皮肤伤口在造模后第3天开始结痂,渗出及红肿减轻;红光组在第7天部分伤口创面开始缩小,第11天明显减小,17 d左右开始愈合,21 d结痂褪去;蓝光组及自然愈合组动物伤口创面缩小的时间较红光组晚2~3 d,愈合也慢(图1)。至观察结束(造模第21天),即对照组出现1个伤口创面愈合时,红光组、蓝光组和对照组的愈合率分别为50.0%(4/8)、25.0%(2/8)和12.5%(1/8)。自造模后第12天起,红光组伤口的愈合面积百分比均明显高于蓝光组及对照组(P<0.05或P<0.01)(表1)。
病理检测结果 建模后第21天,创伤皮肤表面可见不同程度的瘢痕形成。HE染色结果显示,各组动物皮下均有不同程度的纤维组织增生,还可见到坏死,炎细胞浸润,毛囊结构缺失(图2)。Masson染色

1:红光组;2:蓝光组;3:对照组
1:red light group;2:blue light group;3:control group
图 1 皮肤创伤恢复过程
Fig 1 The healing process of skin wounds
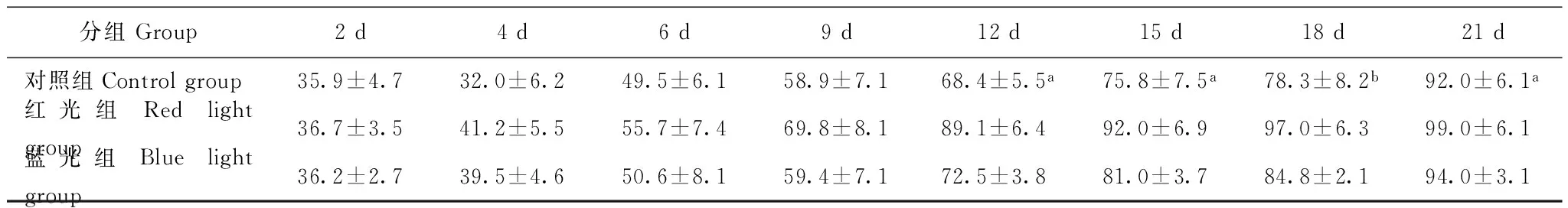
表 1 不同时间各组创伤愈合面积百分比的比较(n=8,%)
与红光组比较,aP<0.05,bP<0.01
aP<0.05,bP<0.01 compared with red light group
结果显示,各组胶原纤维组织均明显增生(图3)。红光组新生皮肤厚度为(2.95±0.34)mm,明显高于对照组的(2.52±0.42)mm(F=3.182,P=0.016)。红光组胶原纤维平均光密度为0.15±0.03,明显高于蓝光组的0.09±0.01(F=7.316,P=0.012)和对照组的0.07±0.01(F=7.316,P=0.003)。免疫组织化学检测结果显示,红光组的EGF、FGF、CD31抗原、Ki67表达较蓝光组和对照组明显增多,CD68较蓝光组和对照组明显减少(P<0.05或P<0.01)(图4、表2)。
讨 论
皮肤创伤模型主要是模拟人类伤口愈合过程中所出现症状,如伤口开裂、溃疡、伤口不愈合或愈合后瘢痕产生等,为探究伤口愈合机制及药物研发提供一个良好的工具[3]。皮肤创伤涉及皮下组织及筋膜属于严重创伤,创伤愈合主要分炎症反应、细胞增殖、组织重塑-胶原沉积3个阶段,至最后一个阶段,含胶原纤维的瘢痕形成大概需要1个月时间[4]。在模型制作过程中,选择全层皮肤切除创伤模型(深达肌肉筋膜),创面直径约2 cm的圆形切口(但由于兔皮肤张力的存在,切口并不呈现圆形),经实验证明这种创伤模型愈合时间相对较长,且与临床该类创面愈合时间一致[5],可以更好地评估疗效和观察创伤愈合的自然过程。LED光源在各个方向发光强度并不均匀,在轴向方向光强最大,光线与轴向方向角度越大,光强越小[6],所以选择垂直照射。光在介质中传导会导致介质

A.红光组;B.蓝光组;C.对照组
A. red light group;B. blue light group;C. control group
图 2 皮肤组织HE染色(×100)
Fig 2 HE staining of skin tissue(×100)

A.红光组;B.蓝光组;C.对照组
A. red light group;B. blue light group;C. control group
图 3 皮肤组织Masson 染色(×40)
Fig 3 Masson staining of skin tissue(×40)
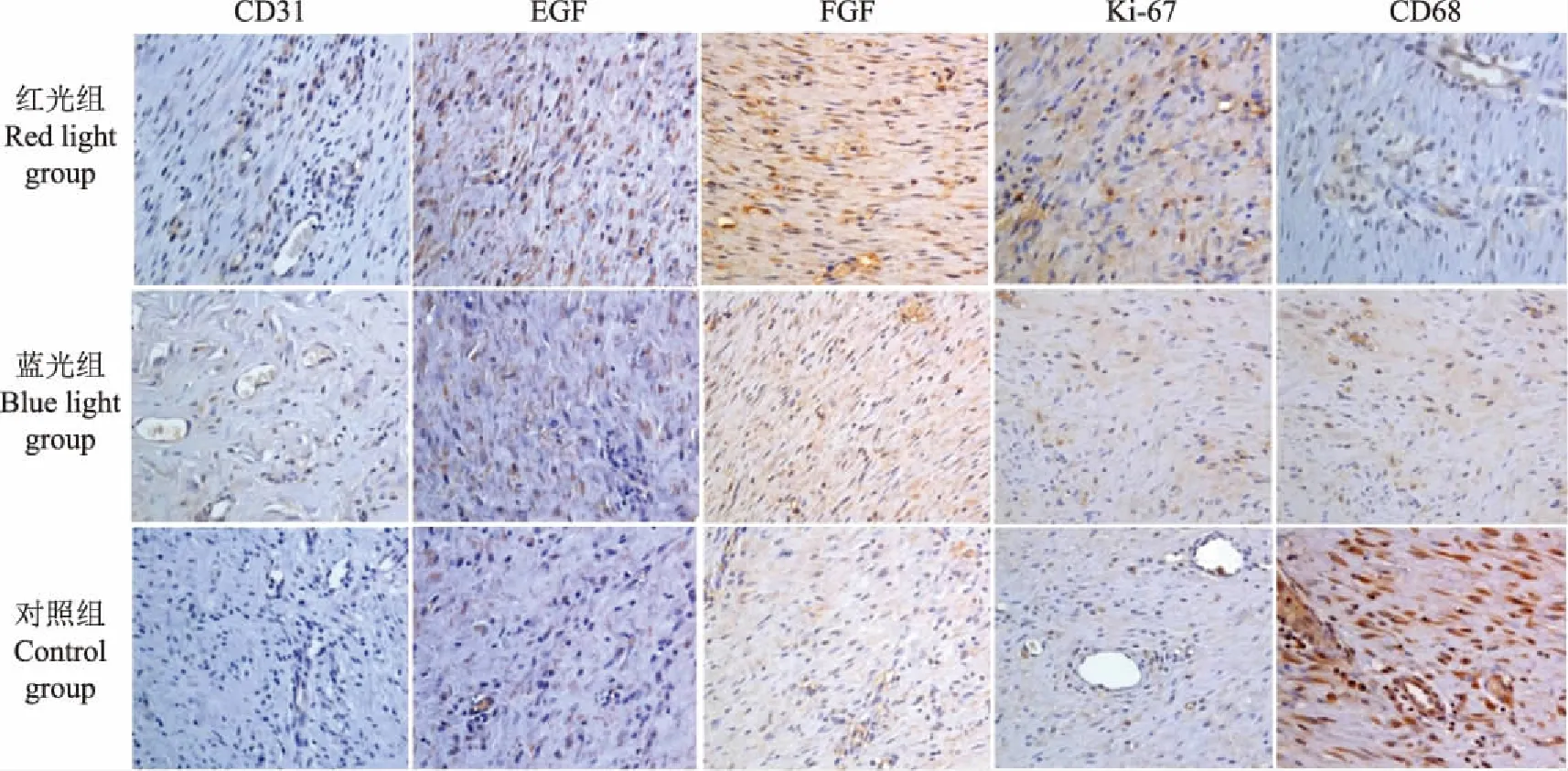
EGF:表皮生长因子;FGF:成纤维细胞生长因子
EGF:epidermal growth factor;FGF:fibroblast growth factor
图 4 皮肤免疫组织化学染色结果(×200)
Fig 4 Immuohistochemical staining of skin(×200)

表 2 各组免疫组织化学统计结果的比较(n=8,x-±s)
EGF:表皮生长因子;FGF:成纤维细胞生长因子;EGF、FGF、CD31单位为平均光密度值;Ki-67、CD68单位为个数/mm2;与红光组比较,aP<0.05,bP<0.01
EGF:epidermal growth factor;FGF:fibroblast growth factor;the unit of EGF,FGF,and CD31 was mean density,and the unit of Ki-67,CD68 was number/mm2;aP<0.05,bP<0.01 compared with red light group
对光的吸收,随距离增加,光强逐渐衰减,但在空气中较短传播距离(20 cm内)衰减很少,小于0.01%[6]。根据LED光源用于医学治疗方面的文献,每次照射时间选择10 min[7- 8]~20 min[9- 10],效果尚可,因此本研究选择了中间值,每次照射15 min,来观察疗效。
LED光源具有价格低廉、性能稳定、耐振动、功耗低、可采用电池供电移动性强、使用寿命长、对环境污染少等优点,目前在发光强度、峰值波长、半波带宽等各项参数性能上有很大提高[11],这些特点非常适用于疾病的诊断和治疗。Whelan等[12]和赵飞等[13]分别在SD大鼠和家兔皮肤上进行创伤实验,选用单波长红外线LED和高压氧(hyperbaric oxygen,HBO)结合治疗,促进创伤愈合,其他波长范围光源未检测,且作用机制不详。LED红外线波长(800~1200 nm)可照射皮肤深度为5~10 mm,多与其他光源设备联合治疗皮肤损伤性疾病[14]。LED黄光波长为570~590 nm,穿透深度为0.5~2 mm,多应用在皮肤光老化及激光治疗的辅助疗法[14]。LED红光是一种可见光,波长范围在620~770 nm间,其在可见光范围内具有最深的组织穿透能力,可照射深入皮肤内大约6 mm,直接到达真皮网状层,从而影响皮肤真皮层纤维母细胞生长[15],可用于创伤愈合、光损伤及皮肤癌等方面的治疗。LED蓝光波长范围是400~470 nm,研究表明其穿透深度浅,穿透距离为皮下1 mm左右,也被用于皮肤损伤的治疗[14]。因此本研究选择了波长630 nm的红光[16- 17]和波长460 nm的蓝光[5]LED灯,研究其对兔皮肤创伤的治疗效果及机制分析。
本研究通过在创伤愈合时间、数目、面积百分比及病理改变等方面进行比较观察,结果证明波长630 nm的LED红光灯在治疗这种兔创伤模型中,相对于蓝光及对照组,伤口愈合时间缩短,治愈率高。此外,本研究还检测了创伤模型动物新生皮肤组织纤维增生厚度,发现红光组相对其他组增生明显,推测可能与红光可影响真皮纤维母细胞增生[14- 15]和血管生成有关[18]。新生皮肤组织增生阶段包括血管内皮细胞和成纤维细胞,经检测红光组皮肤内皮细胞生长因子、EGF、FGF及Ki- 67表达增多,而内皮细胞生长因子、EGF与FGF可以相互协同作用,共同促进创伤愈合[19],这些均说明LED红光组创伤皮肤组织细胞增生活跃,有助于伤口愈合和恢复。随着胶原纤维的增多,瘢痕形成,由于局部张力的作用,瘢痕中的胶原纤维最终与皮肤表面平行。新生组织同样存在炎症反应,在炎症增生阶段主要浸润的炎细胞为巨噬细胞,本研究结果显示炎性巨噬细胞浸润在红光组相对其他两组明显减少,炎症反应相对轻。文献报道LED红光具有一定的抗炎效果,主要通过调节炎症因子的释放,抑制促炎因子的活性发挥作用[20],与本研究相符合,但是确切的调节功能还不清楚,本研究结果可为了解其抗炎机制提供依据。
综上,LED红光照射较蓝光照射在治疗皮肤创伤方面具有一定的效果,其可促进皮肤组织细胞增生,尤其是成纤维细胞、血管内皮细胞和表皮细胞增生,从而加速伤口愈合,并具有一定的抗炎作用。该方法具有方便、无痛、费用低等优点,有可能为临床治疗创伤性皮肤病提供新的途径。本研究由于受到灯源制作时间的限制,仅对两个波段的光源进行了研究,今后将进一步研究其他波段及不同功率光源的治疗效果,以期最终找到最佳治疗光源。
[1]史佩娜,高梦娜,陶健敏,等.皮肤创伤修复机制及治疗方法研究进展[J].浙江医学,2014,36(15):1349- 1353.
[2]de Sousa AP,Santos JN,Dos Reis JA Jr,et al. Effect of LED phototherapy of three distinct wavelengths on fibroblasts on wound healing:a histological study in a rodent model [J]. Photomed Laser Surg,2010,28(4):547- 552.
[3]Davidson JM. Animal models for wound repair [J]. Arch Dermatol Res,1998,290(Suppl):S1- S11.
[4]Broughton G,Janis JE,Attinger CE. The basic science of wound healing [J]. Plast Reconstr Surg,2006,117(7 suppl):12s- 34s.
[5]Weiss RA,McDaniel DH,Geronemus RG,et al. Clinical experience with light-emitting diode(LED)photomodulation [J]. Dermatol Surg,2005,31(9 Pt 2):1199- 1205.
[6]赵飞.局部氧疗结合近红外线发光二极管照射促进伤口愈合装置的研究[D].2008,中国人民解放军第四军医大学.
[7]Niu T,Tian Y,Cai Q,et al. Red light combined with blue light irradiation regulates proliferation and apoptosis in skin keratinocytes in combination with low concentrations of curcumin [J].PLoS One,2015,10(9):e0138754.
[8]Park KY,Han TY,Kim IS,et al. The effects of 830 nm light-emitting diode therapy on acute herpes zoster ophthalmicus:a pilot study [J].Ann Dermatol,2013,25(2):163- 167.
[9]蒋琪霞,周昕,彭青,等.红光和红外线辅助伤口治疗的照射时间与效果观察[J].医学研究生学报,2011,24(4):381- 385.
[10]Morton CA,Scholefield RD,Whitehurst C,et al. 44 study to determine the efficacy of blue light in the treatment of mild to moderate acne [J]. J Dermatolog Treat,2005,16(4):219- 223.
[11]霍彦明,王志远,封丽华. LED光源在医学中的应用[J].灯与照明,2010,34(4):59- 61.
[12]Whelan HT,Buchmann EV,Whelan NT,et a1. NASA light emitting diode medical applications from deep space to deep Bea.Space Technology and Applications International Forum[C].Melville New York:American Institute of Physics,2001:35- 45.
[13]赵飞,屈景辉,郑瑞国,等. 局部氧疗结合近红外线LED照射促进家兔伤口愈合[J].第四军医大学学报,2007,28(21):1976- 1978.
[14]Opel DR,Hagstrom E,Pace AK,et al. Light-emitting diodes a brief review and clinical experience [J]. J Clin Aesthet Dermatol,2015,8(6):36- 44.
[15]Niu T,Tian Y,Ren Q,et al. Red light interferes in UVA-induced photoaging of human skin fibroblast cells[J]. Photochem Photobiol,2014,90(6):1349- 1358.
[16]赵琴.630 nm红光治疗斑秃的疗效观察[J].中国美容医学,2013,22(4):1085- 1086.
[17]Teuschl A,Balmayor ER,Redl H,et al. Phototherapy with LED light modulates healing processes in aninvitroscratch-wound model using 3 different cell types [J]. Dermatol Surg,2015,41(2):261- 268.
[18]de Sousa AP,Paraguassú GM,Silveira NT,et al. Laser and LED phototherapies on angiogenesis [J]. Lasers Med Sci,2013,28(3):981- 987.
[19]秦全红,王德文. 成纤维细胞在皮肤创伤愈合中的作用及其调控[J]. 国外医学创伤与外科基本问题分册,2000,21(1):33- 38.
[20]Choi H,Lim W,Kim I,et al. Inflammatory cytokines are suppressed by light-emitting diode irradiation of P. gingivalis LPS-treated human gingival fibroblasts:inflammatory cytokine changes by LED irradiation [J].Lasers Med Sci,2012,27(2):459- 467.
Effects of 630 nm Red and 460 nm Blue Light Emitting Diode Irradiation onHealing of the Skin Wound in Japanese Big-ear White Rabbit
LI Yanhong1,ZHANG Jigang2,XU Yanfeng1,HAN Yunlin1,JIANG Binbin2,HUANG Lan1,ZHU Hua1,XU Yuhuan1,YANG Weiling2,QIN Chuan1
1Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health & Key Laboratoryof Human Diseases Animal Models,State Administration of Traditional Chinese Medicine,Institute of Medical Laboratory Animal Science,CAMS and PUMC,Beijing 100021,China2Department of Dermatology,the General Hospital of the PLA Rocket Force,Beijing 100088,ChinaCorresponding author:QIN Chuan Tel:010- 87778141,E-mail:qinchuan@pumc.edu.cn;YANG Weiling Tel:010- 66343105,E-mail:ywlderma@sina.com
Objective To observe the effects of 630 nm red light and 460 nm blue light emitting diode irradiation on the healing of skin wounds in Japanese big-ear white rabbits. Methods The skin wound model was established with 8 Japanese big-ear white rabbits. Three parts of vulnus in each rabbit were used:two parts of vulnus were irradiated vertically by red and blue LED light,respectively(15 min/time),and the distance between lights and wounds was 15 cm;the 3rdpart of the wound was used as a control. On the 21stday of the wounds exposure to light,the number of healing wounds and the percentage of healing area were recorded and the treatment effect of these two light sources was compared. HE staining was used to analyze the newborn tissue structure. Masson staining was used to observe the proliferation of skin collagen fibers. Immuohistochemical staining was used to analyze fibroblast growth factor(FGF),epidermal growth factor(EGF),endothelial growth factor(CD31),proliferating cell nuclear antigen(Ki- 67),and inflammatory cytokines(CD68)infiltration in the skin. Results The healing rate in the red light,blue light,and control groups was 50.0%(4/8),25.0%(2/8),and 12.5%(1/8),respectively. Since the 12thday after modeling,the healing area percentage in the red light group was significantly higher than those in the blue light and control groups(P<0.05,P<0.01). On the 21stday after modeling,the skin thickness of the red light group was(2.95±0.34)mm,which was significantly higher than that in control group [(2.52±0.42)mm;F=3.182,P=0.016)]. The average optical density of collagen fibers was 0.15±0.03 in red light group,which was significantly higher than that of the blue light group(0.09±0.01;F=7.316,P=0.012)and control(0.07±0.01;F=7.316,P=0.003). The results of immunohistochemistry showed the expression levels of EGF,FGF,CD31 antigen,and Ki- 67 in the red light group were significantly higher than those in the blue light and control groups,whereas the CD68 expression was significantly lower(P<0.05 orP<0.01). Conclusion LED red light irradiation can promote the healing of skin wounds in Japanese big-ear white rabbits,which may be achieved by the effect of red light irradiation in stimulating the proliferation of skin epidermal cells,vascular endothelial cells,and fiberous tissue.
light emitting diode;skin wounds;Japanese white rabbit;proliferation;inflammation
十二五重大科技专项(2012ZX10004- 501)和国家高技术研究发展计划(863计划)课题子任务(2003AA123310)Supported by the National Major Scientific and Technological Special Project during the Twelfth Five-year Plan Period of China(2012ZX10004- 501)and the National High Technology Research and Development Program of China(863 Plan)(2003AA123310);第一、二位作者对本文贡献一致The first two authors contributed equally to this article
秦 川 电话:010- 87778141,电子邮件:qinchuan@pumc.edu.cn;
R392.31
A
1000- 503X(2017)03- 0301- 06
10.3881/j.issn.1000- 503X.2017.03.001
2016- 02- 23)
杨维玲 电话:010- 66343105,电子邮件:ywlderma@sina.com

