一种阿霉素/NO供体光敏纳米复合物的合成与性质研究
殷姝君,王晓静,王 兵,梅桂雪,孙 捷*
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200; 2.山东省医学科学院药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062)
一种阿霉素/NO供体光敏纳米复合物的合成与性质研究
殷姝君1,2,3,王晓静2,3,王 兵1,2,3,梅桂雪1,2,3,孙 捷2,3*
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200; 2.山东省医学科学院药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062)
以硫化铜纳米晶(CuS-NCs)为核心,聚N-异丙基丙烯酰胺接枝壳聚糖(PNIPAM-g-CS)微粒为壳合成一种新型光敏纳米复合材料. 在温度的调节下,N-异丙基丙烯酰胺(NIPAM)包覆CuS纳米晶,并接枝壳聚糖(CS),合成CuS杂PNIPAM-g-CS纳米复合材料. CuS在近红外光(980 nm)照射下具有光热效应,导致纳米复合物中PNIPAM-g-CS微粒受热体积收缩. 负载阿霉素,这种纳米复合物就可作为光热诱导释放阿霉素的多功能纳米载体. 再负载NO光敏供体(RBS),就可制备出阿霉素/RBS双负载的CuS杂PNIPAM-g-CS纳米载体. 在可见光(365 nm)照射下,RBS光解释放NO. 近红外光和可见光分别触发纳米载体释放阿霉素和NO,加上CuS纳米晶的光热效应,这种纳米载体可实现光触发双药物释放协同光热化疗杀伤肿瘤细胞.
CuS;纳米复合材料;药物释放;光热疗法
近年来,由于硫化铜(CuS)在光热治疗中的应用潜力,越来越多的人开始关注这种p型半导体材料[1]. CuS纳米晶具有成本低、细胞毒性小和在近红外(NIR)区域有特定吸收的特点,在近红外光的照射下,CuS纳米晶具有较高的光热转换效率,其光热消融疗法已被广泛应用[2-5]. 相比其他外界刺激(如pH、超声、氧化还原、酶、磁场等),近红外光(700~1 100 nm)是光热治疗的一种有效方式,目前已应用于控制药物释放[6-9]. 另外,近红外光能够深层渗透组织,且在组织中的吸收较小,促进了CuS纳米晶在纳米医疗中的应用[10-11]. 据报道,CuS杂介孔二氧化硅(CuS@mSiO2)纳米复合材料和乙二醇-氧化石墨烯/CuS (PEG-GO/CuS)纳米复合材料都已广泛应用于近红外光热治疗[12-15]. 为了进一步提高光热化疗的靶向性,我们增加了光调节药物释药机制(例如,低能量可见光触发药物释放机制),这使CuS纳米晶和药物载体组成的纳米复合材料在生物医学领域的应用更广泛.
本文作者在温度的调节下,N-异丙基丙烯酰胺(NIPAM)包覆CuS纳米晶(约 5.4 nm),同时接枝壳聚糖(CS),合成CuS杂PNIPAM-g-CS纳米复合材料. CuS在近红外光(980 nm)的照射下具有光热效应,导致纳米复合材料中PNIPAM-g-CS微粒出现光热敏感体积收缩. 负载阿霉素,这种纳米复合材料就可作为光热诱导释放阿霉素的多功能纳米载体. 负载阿霉素后,再负载NO光敏供体(Fe4S3(NO)7-,或简称RBS,能够在可见光的照射下释放NO),就可制备出阿霉素/RBS双负载的CuS杂PNIPAM-g-CS纳米载体. 在可见光(365 nm)照射下,纳米载体会由于RBS的光解作用释放NO. 实验结果表明,近红外光和可见光可分别触发纳米载体释放阿霉素和NO. 加上CuS的光热效应,这种纳米载体可同时实现光触发双药释放机制协同光热化疗方法杀伤肿瘤细胞.
1 实验
1.1 材料和仪器
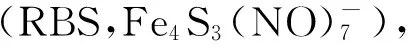
透射电子显微镜(TEM,Jeol)120 kV加速电压,UV-2450型分光光度计(岛津),动态光散射仪(DLS,马尔文仪器,记录粒径),用于TEM和DLS分析的相关样品浓度为1 g/L.
1.2 CuS杂PNIPAM-g-CS纳米复合材料的制备
柠檬酸盐稳定的CuS纳米晶的制备,参照文献[17]报道方法,稍作修改. NIPAM和CS在温度的调节下形成共聚物,再与CuS纳米晶反应,合成CuS杂PNIPAM-g-CS纳米复合材料. 称取1.5 g N-异丙基丙烯酰胺和0.1 g N,N′-亚甲基双丙烯酰胺置于250 mL三颈烧瓶中,50 mL蒸馏水溶解,并通N2脱气30 min. 在超声和搅拌下,向上述混合液缓慢加10 mL CuS纳米晶水悬浮液(2 g/L). 然后,称取0.06 g过硫酸铵(APS)溶于5 mL蒸馏水后加入上述反应液,室温(25 ℃)下反应2 h. 之后,称取0.04 g APS、0.2 g CS,量取0.2 mL乙酸溶于10 mL蒸馏水,溶解后,加入上述反应溶液中. 反应温度升高到70 ℃进一步聚合,通N2200 mL/min,300 r/min连续搅拌. 聚合反应6 h后,粗产物离心. 所得沉淀溶于蒸馏水,透析(光谱/ Por7透析膜,MWCO=5×104)5天,定时换水. 透析液用旋转蒸发仪浓缩,溶于PBS(pH=7.4)中,备用. PNIPAM-g-CS微粒的制备方法与CuS杂PNIPAM-g-CS的制备方法相同,只是没有加入CuS纳米晶.
1.3 药物负载和释放试验
将CuS杂PNIPAM-g-CS纳米复合材料(20 mg)借助超声均匀分散到25 mL阿霉素溶液中(1 g/L,含1% NaCl、pH=7.4 PBS)形成混合溶液,25 ℃连续搅拌24 h,直到溶液中阿霉素浓度恒定. 将悬浮液离心、沉淀再水洗两次以除去未结合吸附在表面的阿霉素. 负载在纳米复合材料中的阿霉素量是通过初始溶液中的总阿霉素量减去上清液中游离的阿霉素量来计算. 利用朗伯-比尔定律在480 nm下用紫外-可见光谱检测器检测溶液中游离的阿霉素. 阿霉素的负载率(LE)和承载能力(LC)计算方程如下[18-19]:
Dox-LE/%= 100 × (Mtotal-Dox-Mfree-Dox)/
Mtotal-Dox
(1)
Dox-LC/%=100 × (Mtotal-Dox-Mfree-Dox)/
Mtotal-nanocomposites
(2)
在25 ℃下,将25 mL RBS溶液(1 g/L)缓慢加到上述载药纳米复合材料中,边搅拌边加,反应24 h. 处理和计算RBS负载率的方法类似于阿霉素的计算方法,溶液中的RBS量可在375 nm下用紫外-可见分光光度法测定.
为评估近红外光触发阿霉素释放的能力,将20 mg载阿霉素纳米复合材料用20 mL PBS(10 mmol/L,pH=7.4、6.5或5.5)溶解,然后用透析管(截留分子量=5×104)透析,透析管置于蒸馏水中,室温下轻微晃动. 每隔固定的时间(0~12 h)取1 mL透析液在480 nm下,用紫外-可见分光光度计检测,计算从纳米复合材料中释放的阿霉素. 分别对没有光照射和980 nm(0.5 W)光照射0~5min的阿霉素的释放进行了研究. 研究了365 nm(0.5 W)的光照射下,0~30 min内RBS由阿霉素/RBS双负载的纳米复合材料中释放的情况. RBS的光解作用所释放的NO浓度用格里斯试剂比色法计算[20].
1.4 光热化疗的细胞毒性试验
研究CuS杂PNIPAM-g-CS纳米复合材料、游离的阿霉素、负载阿霉素或阿霉素/RBS双负载的CuS杂PNIPAM-g-CS纳米复合材料在光照之前和之后的细胞毒性. 在含5% CO2的潮湿培养箱中,用带帽25 cm2细胞培养瓶和含10%胎牛血清的培养基培养单层HeLa细胞. 当细胞长满培养瓶时,用胰蛋白酶溶液(0.25%)使HeLa细胞从表面分离,等分接种(1×104细胞)到96孔板. 培养24 h后,用10 mL含有0~1 g/L不同样品的改良无血清Dulbecco Eagle基本培养基替换原培养基,这些处理过的细胞避光培养24 h. 在0~30 min的药物释放时间期间,用980 nm的光(0.5 W)照射5 min,接着用365 nm的光照射25 min. 采用标准MTT法检测HeLa细胞的活性.
2 结果与讨论
将CuS纳米晶包埋在PNIPAM-g-CS微粒中制备CuS杂PNIPAM-g-CS纳米复合材料是一种是在聚合物基质内快速包埋无机材料的简单路线. 这条路线需要克服纳米晶和微粒之间的相分离,以及聚合中纳米晶的聚集. 在PNIPAM的低临界溶解温度(LCST,约32 ℃)之上[18-19],纳米晶和PNIPAM不能聚合. 将改性的两亲性聚合物作为可聚合基团加到纳米晶的表面,可以使CuS 纳米晶与NIPAM共聚[21],而我们是通过调节聚合温度使CuS 纳米晶直接与NIPAM聚合形成共聚物. 低于LCST(25 ℃),CuS 纳米晶和PNIPAM能很好的聚合;高于LCST(70 ℃),PNIPAM网络塌缩形成纳米球,使纳米晶陷入纳米球. 通过调节温度制备CuS杂PNIPAM-g-CS纳米复合物的方法简单易行,制备效率高且在纳米晶的表面不需要加任何修饰.
2.1 纳米复合材料的光热敏性
近红外光连续照射CuS杂PNIPAM-g-CS纳米复合材料会导致其温度快速升高,这是以CuS纳米晶为基础的纳米药物载体控制药物释放和光热消融治疗肿瘤的一个重要特征[1]. 在980 nm、0.5 W的光照射下,纳米复合材料水悬浮液的温度明显升高(图1),照射120、240和300 s后,水悬浮液的温度分别升高到34.1、40.5和42.8 ℃. 相反,PBS作为对照在近红外光的照射下温度没有明显升高(约0.5 ℃)从而说明纳米复合材料有良好的光热效率. 照射5 min后,温度就可以达到42 ℃,这个温度足以热疗杀伤肿瘤细胞. 因此,纳米复合材料可以作为一种近红外光吸收器用于光热治疗肿瘤.
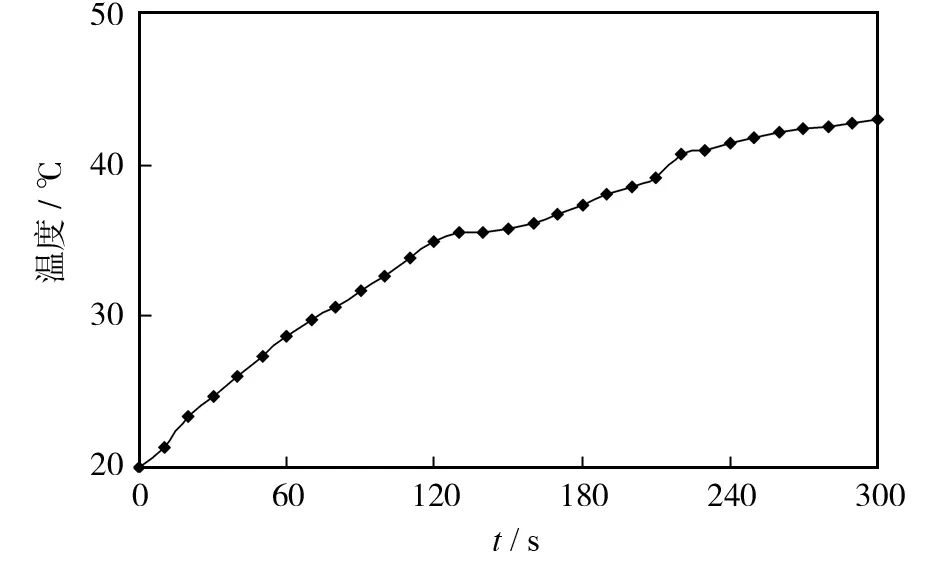
图1 光照后的CuS杂PNIPAM-g-CS纳米复合材料的水悬浮液温度变化Fig.1 Temperature change of aqueous suspension of CuS@PNIPAM-g-CS nanocomposites after irradiation
经过0~5 min的光照射,由于CuS纳米晶的光热效应,纳米复合材料的粒径呈现有规律地变化,如图2所示. 在近红外光照射时间少于120 s时,纳米复合材料的体积收缩可以忽略不计(<5%). 照射时间在120~210 s之间时,纳米复合材料的体积明显收缩且粒径从91.5 nm下降到39.9 nm. 照射时间超过210 s,体积几乎不收缩,说明形成了高度紧密的纳米复合材料. 作为对照,我们进行了相关的实验来证实纳米复合材料是由于温度升高体积缩小. 随着水浴温度的增加(25~45 ℃)CuS杂PNIPAM-g-CS纳米复合材料的粒径表现出与980 nm光照处理相似的变化趋势. 因此,CuS杂PNIPAM-g-CS纳米复合材料的巨大体积收缩可由近红外光引发CuS纳米晶光热效应产生. 药物被负载到纳米复合材料后,光热效应引起的体积收缩会将所负载药物挤压出纳米复合材料,达到控制药物释放的目的.

图2 光照时间对纳米复合材料粒径的影响Fig.2 Effect of irradiation time on hydrodynamic diameters of the nanocomposites
2.2 药物负载和光致药物释放
在25 ℃下,将不同浓度的阿霉素负载到 CuS杂PNIPAM-g-CS纳米复合材料中,反应24 h. 承载能力(LC)和负载效率(LE)随阿霉素的浓度增加而逐步增大(图3). 当阿霉素浓度从0.05 g/L增加到1 g/L时,LC从2.6%增加到48%,而LE从14.9%增加到62.3%. 这些结果表明,阿霉素负载到纳米复合材料中的多少与阿霉素的浓度密切相关. 一般来说,阿霉素分子中的酸性酚羟基和碱性氨基可与CS中的氨基和酚羟基相互作用,通过氢键形成分子间配合物,从而增加负载率[22]. 与其他小分子药物(如5-氨基水杨酸)和大分子药物(如牛血清白蛋白/ BSA)相比,阿霉素远比5-氨基水杨酸大,但又比BSA小得多. 因此,纳米复合材料和阿霉素之间没有吸附作用,从而可以有效地将阿霉素包埋进纳米材料中. 否则,随着阿霉素浓度增加,LE将会呈现减小的趋势[23].

图3 阿霉素浓度对承载能力和负载效率的影响Fig.3 Effects of Dox concentration on the LC and LE
使用不同pH的PBS缓冲液,对阿霉素的释放情况进行了研究(图4),在中性溶剂中(pH 6.5),阿霉素从复合材料中释放速度比在弱酸性溶剂中慢,在释放初期(0~2 h)阿霉素仅释放了20%,这是因为阿霉素不溶于水,所以在中性溶剂中,阿霉素会倾向于留在纳米复合材料中.

图4 不同pH下阿霉素的释放Fig.4 Release of Dox under different pH
靶向肿瘤部位快速、可控的药物释放有利于提高恶性肿瘤的治疗效果. 从图5可以看出,随着光照时间的增加(0~5 min),药物的释放速率明显加快. 照射5 min后,阿霉素的释放量达到62%以上. 没有近红外光的照射,0~2 h仅释放20%,表明近红外光照射能显著促进阿霉素的释放. 一般来说,近红外光照射诱导CuS杂PNIPAM-g-CS 纳米复合材料产生光热效应(来自CuS纳米晶),从而导致PNIPAM-g-CS微粒体积收缩,负载到PNIPAM-g-CS中的阿霉素被快速挤出,导致阿霉素快速释放. 在pH=7.4时也出现类似的释放趋势(图6). 换句话说,在不同pH条件下近红外光照射都能明显加速药物的释放. 相对于没有光照(0 min),在较高pH下,光照诱导阿霉素释放的速率加快更为明显. 不同的pH下,近红外光照射5 min后累积释放的阿霉素量几乎相同,从而进一步证实了近红外光照射触发阿霉素释放的可行性.
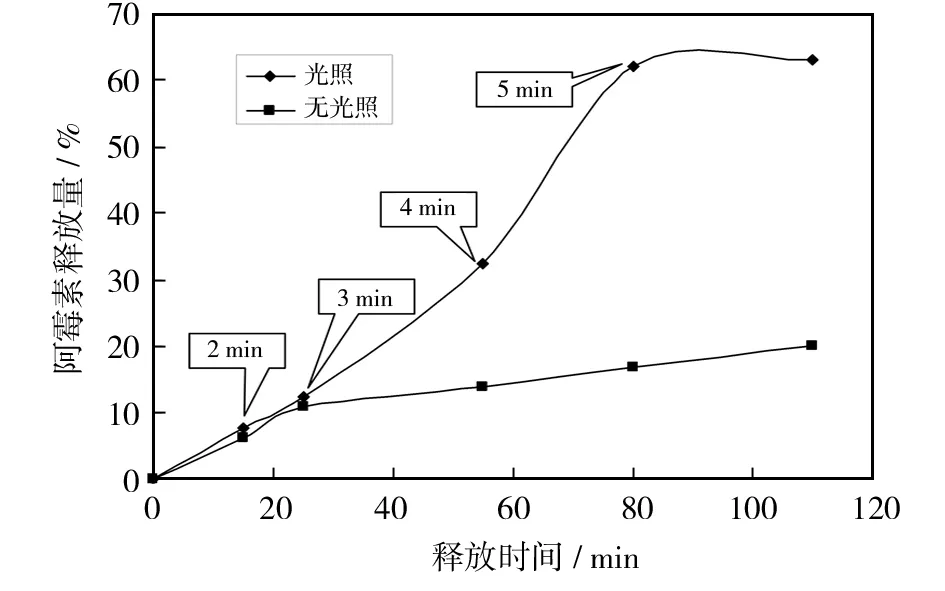
图5 光照对阿霉素释放的影响Fig.5 Effect of irradiation on the release of doxorubicin

图6 不同pH下光照时间对阿霉素释放的影响Fig.6 Effects of different irradiation time on Dox release under different pH
通过用可见光照射阿霉素/RBS双负载CuS杂PNIPAM-g-CS纳米复合材料研究NO的释放情况[24]. 如图7,365 nm光照引发NO释放率快速增加(0~25 min). 25 min后,由于NO被溶液中O2氧化,释放的NO瞬时含量有所降低[25]. 无光照时,纳米复合材料几乎不释放NO. 在25 min时,NO的释放量约为0.86 μmol/L. 尽管可以通过增大光照射功率(>0.5 W)或延长释放时间(>30 min)增加NO释放[20],但短的激发时间和更低的照射功率有利于它们在生物医学领域的应用,这些条件可以最大限度地减少光照本身对正常生理系统的潜在损伤[26].
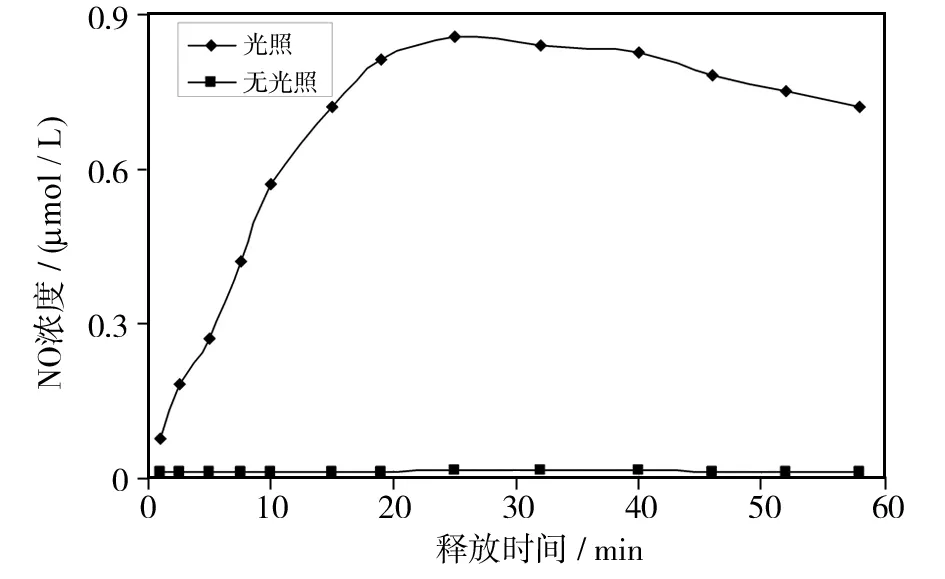
图7 光照对NO释放的影响Fig.7 Effects of irradiation on NO release
2.3 细胞毒性
为了进一步探讨CuS杂PNIPAM-g-CS、游离阿霉素、负载阿霉素的CuS杂PNIPAM-g-CS纳米复合材料的细胞毒性,将它们加到HeLa细胞中培养24 h. 如图8所示,加入CuS杂PNIPAM-g-CS的细胞存活率较高,加药量为1 g/L时,细胞存活率依然保持在84%,表明CuS杂PNIPAM-g-CS具有较低的细胞毒性和良好的生物相容性. 作为对照,CuS纳米晶也在相同的条件下进行细胞毒性实验. 加入1 g/L CuS纳米晶的HeLa细胞培养24 h后,细胞存活率为81%,说明CuS纳米细胞毒性较低. 细胞活性的增强(从81%至84%)进一步表明PNIPAM-g-CS微粒作为外壳包埋CuS纳米晶后能够提高生物相容性. 加入负载阿霉素的CuS杂PNIPAM-g-CS时,细胞活性显著下降. 样品浓度0.1~1.0 g/L,细胞存活率从83.5%降低到42%,负载阿霉素的CuS杂PNIPAM-g-CS纳米复合材料的细胞毒性(与游离阿霉素相同的阿霉素浓度)稍微低于游离阿霉素. 结果表明,由阿霉素负载的CuS杂PNIPAM-g-CS纳米复合材料释放的阿霉素仍保留高抑制癌细胞或高抗癌活性. 事实上,纳米复合材料的浓度太低也不能产生抗癌活性[18-19].
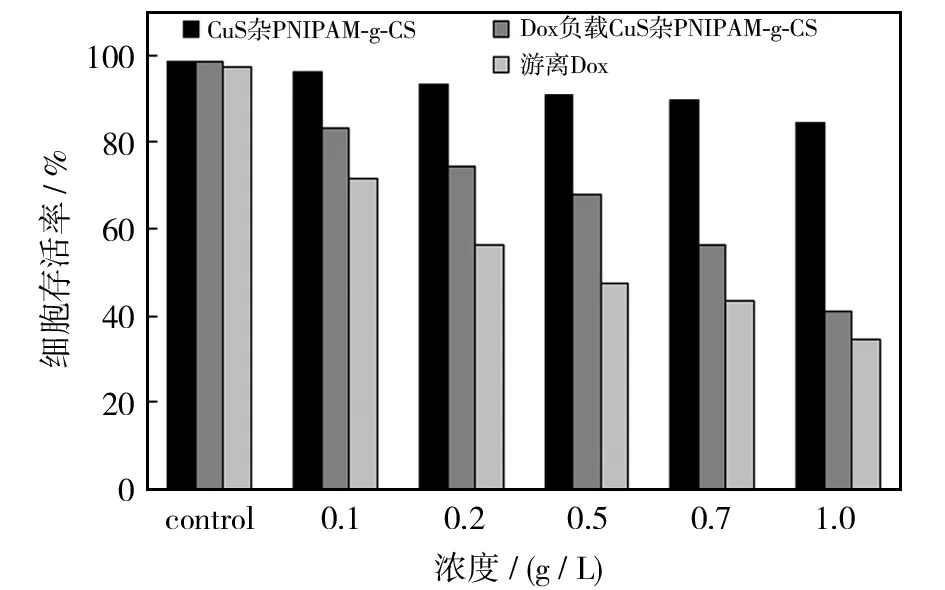
图8 不同剂量CuS杂PNIPAM-g-CS、游离阿霉素和阿霉素负载的CuS杂PNIPAM-g-CS纳米复合材料的细胞毒性Fig.8 Cytotoxicities of different doses CuS@PNIPAM-g-CS, free Dox and Dox-loaded CuS@PNIPAM-g-CS nanocomposites
低浓度的阿霉素/RBS双负载的CuS 杂PNIPAM-g-CS 纳米复合材料(0.1 g/L)在不同光照条件下的细胞毒性研究(图9),没有光照时,加入复合材料的细胞表现出较高的活性. 培养0~30 min,仍有超过78.5%的细胞保持活性. 与此相反,近红外光(980 nm)照射5 min后,细胞活性显著降低. 另外培养25 min后,HeLa细胞的存活率下降到23.5%以下,这种纳米复合材料能够显著降低HeLa细胞的活性,是由于CuS纳米晶的光热效应诱导阿霉素释放. 980 nm(0.5 W)光照射5 min后,系统的温度上升到42 ℃以上,这足以热疗杀死HeLa细胞. 同时,光热诱导温度上升导致PNIPAM-g-CS微粒体积收缩从而挤压出负载的阿霉素,使阿霉素大量快速释放. 结果表明,光热化疗能够成功杀死HeLa细胞. 除980 nm的光照射5 min外,365 nm的光照射25 min也可提高癌细胞的治疗效率,光照(365 nm)进一步加速了细胞凋亡. 0~30 min的实验过程中,相比只有980 nm光照射的情况下(细胞存活率约为23.5%),另外再用365 nm光照射能显著降低细胞活性(降低约1%),可见光(365 nm)照射下,由于RBS光解引发NO大量释放,这些释放的NO对癌细胞有相当大的细胞毒性[27]. 因此,由365 nm光照射导致的细胞大量死亡归因于NO产生的细胞毒性.
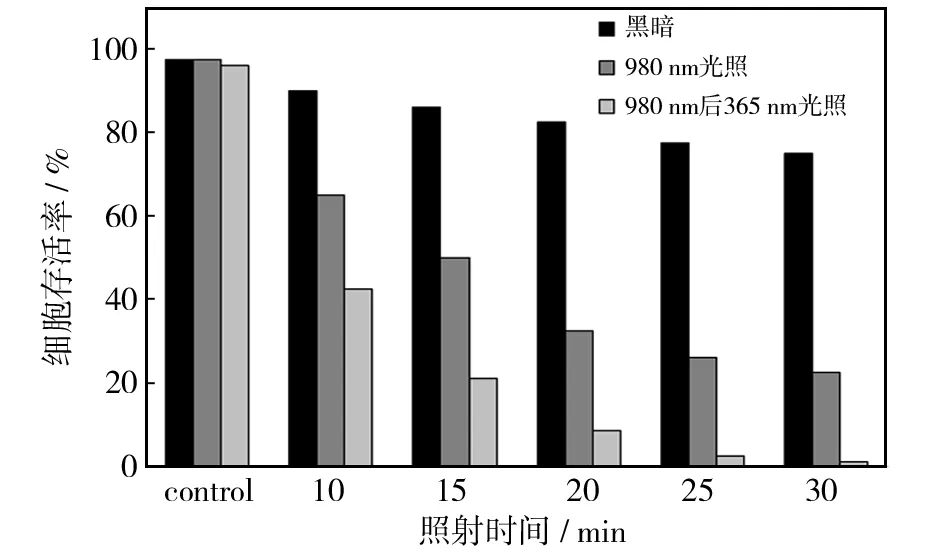
图9 光照时间对细胞存活率的影响Fig.9 Effect of irradiation time on cell viability
直接用980 nm或365 nm光照射没有加入CuS杂PNIPAM-g-CS的Hela细胞培养液,结果980 nm的光照射(0.5 W)30 min对细胞微环境温度的影响几乎可忽略不计(升高<1 ℃)[8]. 虽然365 nm光的能量高于980 nm光,但低功率(0.5 W)也不足以导致细胞微环境的温度显著升高(<3 ℃). 仅光照下温度的变化很小,进一步证实导致HeLa细胞死亡的是由光触发诱导释放的抗癌药物(阿霉素、NO)和CuS纳米晶的光热效应,而不是光本身. 根据这些实验结果说明,阿霉素和RBS双负载CuS杂PNIPAM-g-CS 纳米复合材料可以实现光调控双药物释放协同光热化疗杀伤肿瘤细胞.
3 结论
综上所述,光敏CuS杂PNIPAM-g-CS纳米复合材料是通过温度调节合成的,NIPAM随温度变化体积发生有规律地改变,从而包覆CuS纳米晶,同时接枝CS形成共聚物. CuS纳米晶在近红外光照射下具有光热效应,短时间内温度高达42 ℃,这个温度足以热疗杀伤肿瘤细胞. 并且PNIPAM-g-CS微粒在光热诱导下体积收缩,可触发阿霉素释放. 我们所制备的阿霉素和RBS双载的CuS杂PNIPAM-g-CS纳米复合材料,可在近红外光和可见光照射下分别释放阿霉素(由于PNIPAM-g-CS体积收缩被挤出)和NO(RBS光解). 实验结果表明:在体外,这种纳米复合材料实现了光触发双药释放和光热化疗协同杀伤肿瘤细胞. 在进一步研究中,我们将探索新型多功能载药纳米复合材料在治疗荷瘤小鼠方面的应用,通过多种药物的可控释放进一步寻求更有效的肿瘤治疗方式.
[1] ZHOU M, ZHANG R, HUANG M, et al. A chelator-free multifunctional [64Cu]CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy [J]. Journal of the American Chemical Society, 2010, 132(43): 15351-15358.
[2] GOEL S, CEN F, CAI W. Synthesis and biomedical applications of copper sulfide nanoparticles: from sensors to theranostics [J]. Small, 2014, 10(4): 631-645.
[3] XIAO Q, ZHENG X, BU W, et al. A core/satellite multifunctional nanotheranostic for in vivo imaging and tumor eradication by radiation/photothermal synergistic therapy [J]. Journal of the American Chemical Society, 2013, 135(35): 13041-13048.
[4] ZHA Z, WANG S, ZHANG S, et al. Targeted delivery of CuS nanoparticles through ultrasound image-guided microbubble destruction for efficient photothermal therapy [J]. Nanoscale, 2013, 5(8): 3216-3219.
[5] LIU Z, LIU X, DU Y, et al. Using plasmonic copper sulfide nanocrystals as smart light-driven sterilants [J]. American Chemical Society Nano, 2015, 9(10): 10335-10346.
[6] KIM H, KIM S, PARK C, et al. Glutathione-induced intracellular release of guests from mesoporous silica nanocontainers with cyclodextrin gatekeepers [J]. Advanced Materials, 2010, 22(38): 4280-4283.
[7] LAI J, SHAH B P, GARFUNKEL E, et al. Versatile fluorescence resonance energy transfer-based mesoporous silica nanoparticles for real-time monitoring of drug release [J]. American Chemical Society Nano, 2013, 7(3): 2741-2750.
[8] WU S, HUANG X, DU X. Glucose-and pH-responsive controlled release of cargo from protein-gated carbohydrate-functionalized mesoporous silica nanocontainers [J]. Angewandte Chemie International Edition, 2013, 52(21): 5580-5584.
[9] CAI Y, PAN H, XU X, et al. Ultrasonic controlled morphology transformation of hollow calcium phosphate nanospheres: A smart and biocompatible drug release system [J]. Chemistry of Materials, 2007, 19(19): 3081-3083.
[10] WEISSLEDER R. A clearer vision for in vivo imaging [J]. Nature Biotechnology, 2001, 19(4): 316.
[11] ZHANG L, LI Y, JIN Z, et al. An NIR-triggered and thermally responsive drug delivery platform through DNA/copper sulfide gates [J]. Nanoscale, 2015, 7(29): 12614-12624.
[12] LIU X, FU F, XU K, et al. Folic acid-conjugated hollow mesoporous silica/CuS nanocomposites as a difunctional nanoplatform for targeted chemo-photothermal therapy of cancer cells [J]. Journal of Materials Chemistry B, 2014, 2(33): 5358-5367.
[13] LIU X, REN Q, FU F, et al. CuS@mSiO2-PEG core-shell nanoparticles as a NIR light responsive drug delivery nanoplatform for efficient chemo-photothermal therapy [J]. Dalton Transactions, 2015, 44(22): 10343-10351.
[14] LU F, WANG J, YANG L, et al. A facile one-pot synthesis of colloidal stable, monodisperse, highly PEGylated CuS@mSiO2nanocomposites for the combination of photothermal therapy and chemotherapy [J]. Chemical Communications, 2015, 51(46): 9447-9450.
[15] BAI J, LIU Y, JIANG X. Multifunctional PEG-GO/CuS nanocomposites for near-infrared chemo-photothermal therapy [J]. Biomaterials, 2014, 35(22): 5805-5813.
[16] SEYFERTH D, GALLAGHER M K, COWIE M. The bridging sulfide anion reactivity of Roussin’s red salt [J]. Organometallics, 2002, 5(3): 539-548.
[17] CHEN F, HONG H, GOEL S, et al. In vivo tumor vasculature targeting of CuS@MSN based theranostic nanomedicine [J]. American Chemical Society Nano, 2015, 9(4): 3926-3934.
[18] GUI R, WANG Y, SUN J. Encapsulating magnetic and fluorescent mesoporous silica into thermosensitive chitosan microspheres for cell imaging and controlled drug release in vitro [J]. Colloids & Surfaces B Biointerfaces, 2014, 113(113C): 1-9.
[19] JIN H, LIU X, GUI R, et al. Facile synthesis of gold nanorods/hydrogels core/shell nanospheres for pH and near-infrared-light induced release of 5-fluorouracil and chemo-photothermal therapy [J]. Colloids & Surfaces B Biointerfaces, 2015, 128: 498-505.
[20] JIANG Y B, ZHANG W S, HUANG S J, et al. Assembled magnetic nanoparticles for photosensitive nitric oxide release and turn-on fluorescence detection in situ [J]. Materials Chemistry & Physics, 2015, 167: 231-235.
[21] JANCZEWSKI D, TOMCZAK N, YIN W K, et al. Designer multi-functional comb-polymers for surface engineering of quantum dots on the nanoscale [J]. European Polymer Journal, 2009, 45(1): 3-9.
[22] SHEN J M, TANG W J, ZHANG X L, et al. A novel carboxymethyl chitosan-based folate/Fe3O4/CdTe nanoparticle for targeted drug delivery and cell imaging [J]. Carbohydrate Polymers, 2012, 88(1): 239-249.
[23] PENG J R, QI T T, LIAO J F, et al. Synthesis and characterization of novel dual-responsive nanogels and their application as drug delivery systems [J]. Nanoscale, 2012, 4(8): 2694-2704.
[24] GUI R, WAN A, ZHANG Y, et al. Light-triggered nitric oxide release and targeted fluorescence imaging in tumor cells developed from folic acid-graft-carboxymethyl chitosan nanospheres [J]. RSC Advances, 2014, 4(57): 30129-30136.
[25] TAN L, WAN A, LI H. Conjugating S-nitrosothiols with glutathiose stabilized silver sulfide quantum dots for controlled nitric oxide release and near-infrared fluorescence imaging [J]. American Chemical Society Applied Materials & Interfaces, 2013, 5(21): 11163-11171.
[26] LI N, ZHAO P, ASTRUC D. Anisotropic gold nanoparticles: synthesis, properties, applications, and toxicity [J]. ChemInform, 2014, 53(7): 1756-1789.
[27] KANDOTH N, MALANGA M, FRAIX A, et al. A host-guest supramolecular complex with photoregulated delivery of nitric oxide and fluorescence imaging capacity in cancer cells [J]. Chemistry-An Asian Journal, 2012, 7(12): 2888-2894.
[责任编辑:刘红玲]
Synthesis and properties study of Dox/NO donor nanocomposites
YIN Shujun1,2,3, WANG Xiaojing2,3, WANG Bing1,2,3, MEI Guixue1,2,3, SUN Jie2,3*
(1.SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,Jinan250200,Shandong,China; 2.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,Shandong,China; 3.KeyLaboratoryforBiotechDrugsMinistryofHealth,KeyLaboratoryforRare-UncommonDiseasesofShandongProvince,Jinan250062,Shandong,China)
In this paper, we described the synthesis of a novel light-sensitive nanocomposites that consisted of CuS nanocrystal as the core and poly (N-isopropylacrylamide)-graft-chitosan (PNIPAM-g-CS) microgel as the shell. The CuS@PNIPAM-g-CS nanocomposites were synthesized by temperature-tunable copolymerization of NIPAM and CS in the presence of CuS nanocrystals. Due to the photothermal effect of CuS under NIR light (980 nm) irradiation, the nanocomposites presented photothermal-sensitive volume shrinkage of PNIPAM-g-CS microgel. After loading of doxorubicin(Dox), the nanocomposites were utilized as versatile nanocarriers for photothermal-induced release of Dox. Nitric oxide (NO) photodonors (RBS) were then loaded into nanocomposites to fabricate Dox/RBS dual-loading CuS@PNIPAM-g-CS nanocarriers. Upon visible light (365 nm) irradiation, the RBS could release NO due to the photolysis. Experimental results implied that NIR and visible light respectively triggered release of Dox and NO from nanocarriers. Together with photothermal effect of CuS, the nanocarriers realized light-triggered release of dual-drugs and synergistic chem-photothermal therapy to cancer cells.
CuS; nanocomposites; drug release; photothermal therapy
2017-01-17.
山东省自然科学基金(ZR2015YL041).
殷姝君(1991-), 女, 硕士生, 研究方向为药物化学.*
, E-mail:1143226647@qq.com.
O62
A
1008-1011(2017)03-0371-07