南山茶饼中乙醇提取物5个多酚化合物的分离纯化
包莉圆 - 钟海雁,2 -,2 王蔚婕 - 兰 芳 曹清明,2 -,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
南山茶饼中乙醇提取物5个多酚化合物的分离纯化
包莉圆1BAOLi-yuan1钟海雁1,2ZHONGHai-yan1,2王蔚婕1WANGWei-jie1兰 芳1LANFang1曹清明1,2CAOQing-ming1,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
为综合开发利用油茶资源,对南山茶饼乙醇提取物的组分进行了制备和鉴定。将经过乙酸乙酯萃取和硅胶柱层析分离纯化收集的组分XVII、XXVII、XXVIII和XXXIV 4个组分进行了HPLC制备,得到了纯度分别为99.2%,95.4%,97.5%,99.1%,97.4%的5个化合物。用安捷伦高分辩率质谱工作站Qualitative Analysis B.06.00分子式计算器对质谱准分子离子碎片进行了化学式的计算,结合化合物的裂解规律和化合物物理化学性质,鉴定为原儿茶酸和4个黄酮类化合物。化合物的核磁共振鉴定将在另外的文章中报道。
油茶;提取物;结构鉴定;高效液相色谱;核磁;质谱
黄酮类化合物具有抗氧化[1-3]、清除氧自由基[4-5]、保护心脑血管[6-7]、抗肿瘤[8-10]、抗菌[11-12]等药理活性,且毒性较低,广泛存在于自然界的多种植物和浆果中。近年来黄酮类化合物成为国内外天然药物、保健食品开发以及天然添加剂等领域的研究和开发热点。
质谱是鉴定有机化合物结构的重要手段,它不仅能够快速地测定大分子的分子量,还可根据 [M+H]+、[M-H]-、[M+Na]+准分子离子和电离碎片等质谱信息,分析化合物的裂解规律,确定物质的结构,是目前使用范围非常广泛的一种结构鉴定方法。江和源等[13]以茶籽饼粕为原料用LC-MS联用技术分析研究黄酮苷结构,根据[M+H]+[14-15]电离碎片信息确定了茶籽饼粕中的黄酮为山奈酚-3-O-鼠李糖和山奈酚-3-O-(6-O-D-葡萄糖基)-β-D-半乳糖苷。Ashihara等[16]采用HPLC-MS,根据出峰时间、紫外光谱和质谱裂解规律研究了8周龄茶(茶树)嫩叶、茎、主侧根等部位,确定了14个酚类化合物的结构。
茶油中不饱和脂肪酸的含量高达90%[17-18],具有抗氧化[19-20]、护肝[21]和抗菌[22]活性,被誉为“东方橄榄油”。中国政府高度重视油茶产业,激发了人们对油茶籽[23-24]、油茶种质资源[25-26]及茶油品质[27]等方面的研究。
南山茶(CamelliasemiserrataChi.)又叫做广宁红花油茶、广宁油茶、华南红花油茶等,属于山茶科(Theaceae)山茶属(CamelliaL.)山茶亚属的红山茶组[28]。本研究拟以南山茶饼为原料,分析南山茶饼中乙醇提取物乙酸乙酯萃取部位的化学成分,利用安捷伦高分辩率质谱工作站Qualitative Analysis B.06.00所带的分子量计算器,根据离子碎片和准分子离子精确推断了化合物的分子式,结合所得的分子式和质谱离子碎片,推断了化合物的结构,该研究方法尚未见报道。南山茶饼多酚化合物的制备和鉴定为研究油茶特征化合物的活性量效关系提供了试验基础。对于南山茶饼黄酮类化合物的深入研究,可以为油茶副产物的综合利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
油茶种子:广西藤县红羽油茶发展有限公司,中南林业科技大学谭晓风教授鉴定为南山茶种子(CamelliasemiserrataChi.)。
1.1.2 试剂
柱层析硅胶:200~300目,青岛海洋化工厂分厂;
凝胶:Sephadex LH-20,美国GE Healthcare Bio-Science AB公司。
1.1.3 仪器
质谱:UHPLC-QTOF/1290-6530型,安捷伦科技有限公司;
高效液相色谱仪(分析型): 2695-2996型,配备Waters 2996 Photodiode Array Detector检测器,美国Waters公司;
高效液相色谱仪(分析型):LC3000型,配备Newstyle NU3000 Serials UV/VIS Detector检测器,北京创新恒通科技有限公司;
分析用色谱柱:C18ME(4.6 mm×250 mm,5 μm),华谱新创科技有限公司;
色谱柱:C18HCE (4.6 mm×250 mm,5 μm):华谱新创科技有限公司;
色谱柱:Unitary C18(4.6 mm×250 mm,5 μm),华谱新创科技有限公司;
高效液相色谱仪(半制备型):LC3000型,北京创新恒通科技有限公司;
色谱柱(制备用):C18HCE(20 mm×250 mm,10 μm),华谱新创科技有限公司;
色谱柱(制备用):C18ME(20 mm×250 mm,10 μm),华谱新创科技有限公司;
氮吹仪:UGC-12WF型,北京优晟联合科技有限公司。
1.2 提取、分离和制备方法
1.2.1 茶饼的提取与粗分 冷榨法脱去南山茶种籽的油脂得到油茶饼,晾晒,粉碎,称取1 kg。用60%乙醇按料液比1∶3 (g/mL)加热回流提取3次,每次提取2 h,过滤后减压浓缩至无醇,得油茶饼粗提液2 L,加入等体积的乙酸乙酯,分3次萃取,合并萃取液,减压浓缩至溶液呈黏稠状,最终得乙酸乙酯萃取液约150 mL。
1.2.2 乙酸乙酯萃取液的精细分离和纯化 取乙酸乙酯萃取液100 mL于蒸发皿中,以少量多次的方式将200~300目硅胶(其堆密度约为1∶2.5) 40 g与样品等体积拌样,搅拌均匀后于50 ℃烘干,干法上样,进行硅胶柱层析。取500 g硅胶(200~300目)作为柱层析的填料,即柱体积(BV)为1.25 L。
通过硅胶板薄层色谱,确定洗脱剂二氯甲烷—甲醇体系的配比依次为20∶1,8∶1,5∶1,3∶1。以约1/4 BV为单位收集洗脱液,分别按顺序编号为Fr.1、Fr.2、Fr.3……。将收集到的洗脱液进行硅胶板薄层色谱检测,根据检测结果合并洗脱液。合并编号依次为I、II、III……,共40个组分,依次为I(Fr.1~2);II(Fr.3~4);……;XVII(Fr.36~39);……;XXVII(Fr.66);XXVIII(Fr.67~69);……;XXXIV(Fr.90~97)……。将各组分分别减压浓缩,冷冻干燥。
将合并后的每个组分均以少量甲醇溶解,进行高效液相色谱检测。其色谱条件:色谱仪:Waters 2695-2996型高效液相色谱仪;检测器为:Waters 2996 Photodiode Array Detector;色谱柱:Unitary C18,4.6 mm×250 mm,5 μm;流动相A为甲醇,流动相B为0.1%甲酸—水。流动相洗脱条件见表1。
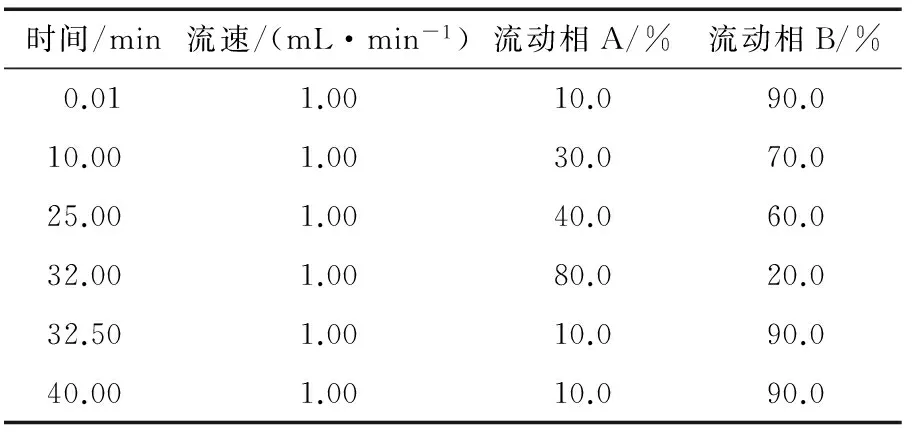
表1 HPLC色谱条件Table 1 HPLC chromatographic condition
对表 1的条件下得到的液相色谱图进行分析,确定组分XVII(Fr.36~39)、XXVII(Fr.66)、XXVIII(Fr.67~69)和XXXIV(Fr.90~97)并进行进一步的分离纯化。
(1) XVII(Fr.36~39)纯化:经过分析Fr.36~39在表 1条件下的色谱图,可知该组分中化合物较多,而且极性很接近,所以采用凝胶(Sephadex LH-20)柱层析的方法进行再次纯化。凝胶柱层析以二氯甲烷∶甲烷(8∶1)为洗脱剂,进行恒定梯度洗脱。柱体积BV为120 mL。以约1/10 BV为一个单位收集洗脱液,分别按收集顺序编号1、2、3、4……。对收集到的洗脱液用硅胶薄层层析色谱(TLC)检测,根据TLC检测结果合并洗脱液,结果为:7~11;12~17;18~21;22~79。
对其中的7~11组分(记为:XVII-I)进行液相检测,液相分析条件为:LC3000型高效液相色谱仪,色谱柱为C18HCE柱,4.6 mm×250 mm,10 μm;洗脱条件为35%甲醇—0.2%乙酸水;进样量50 μL。其液相半制备条件为LC3000型高效液相色谱仪,C18HCE柱,20 mm×250 mm,10 μm;洗脱条件35%甲醇—0.2%乙酸水;进样量1 mL。接收其主峰,并以同样的方法多针制备,减压浓缩、冷冻干燥。测定其质量和纯度。
(2) XXVII(Fr.66)纯化:经过分析Fr.66在表 1条件下的色谱图,可知该组分中化合物较少,且主峰较突出。因此直接对其进行液相半制备。其液相分析时色谱条件为:LC3000型高效液相色谱仪;C18HCE色谱柱,4.6 mm×250 mm,10 μm;洗脱剂45%甲醇—水;进样量30 μL。
Fr.66液相半制备条件为:LC3000型高效液相色谱仪;C18HCE色谱柱,20 mm×250 mm,10 μm;洗脱剂45%甲醇—水;进样量1 mL。收集其中的2号峰(记为XXVII-2),浓缩后测定纯度并称重。测定结果显示XXVII-2的纯度约为60%,无法进行核磁解析,再次进行半制备。再次半制备的色谱条件相同,但是流动相为37%甲醇—水。接收流出液,浓缩干燥,测定纯度并称重。
(3) XXVIII(Fr.67~69)纯化:Fr.67~69液相分析时的色谱条件为LC3000型高效液相色谱仪;C18ME色谱柱,4.6 mm×250 mm,10 μm;洗脱剂25%乙腈—水;进样量50 μL。其半制备条件为LC3000型高效液相色谱仪; C18ME色谱柱, 20 mm×250 mm,10 μm,洗脱剂25%乙腈—水;进样量0.3 mL。收集其中的主峰(标记为XXVIII-2),并减压浓缩,进行纯度测定。经测定结果显示该峰纯度仅为80%,需要再次进行液相分析和半制备,其条件同Fr.67~69。接收流出液,浓缩干燥,测定纯度并称重。
(4) XXXIV(Fr.90~97)纯化:Fr.90~97液相分析时的色谱条件为LC3000型高效液相色谱仪;C18HCE色谱柱,4.6 mm×250 mm,10 μm;洗脱剂25%乙腈—水;进样量30 μL。其半制备条件为LC3000型高效液相色谱仪;C18HCE色谱柱,20 mm×250 mm,10 μm;洗脱剂25%乙腈—水;进样量3 mL。收集其中的主峰,浓缩后进行纯度测定,冻干测定质量。浓缩干燥,测定纯度并称重。
1.2.3 结构鉴定 对样品成分进行质谱分析,色谱条件同每个组分的半制备,质谱条件为:电喷雾离子源正离子检测,氮气为干燥气,干燥气温度300 ℃,流速6 L/min,雾化器压力0.345 MPa,鞘气温度400 ℃,鞘气流速12 L/min,毛细管电压4 000 V,喷嘴电压0 V,参比离子流速10 μL/min,正模式参比离子121.085 5、922.092 2,采集范围100~1 000,扫描速度2 scan/s。
1.2.4 数据处理 质谱工作站软件:Agilent Mass Hunter Workstation Software,Version B.06.00,Build 6.0.633.0。色谱工作站软件:Agilent 1200 Chemstations。利用安捷伦质谱工作站自带质谱分子式计算器对碎片离子峰进行分析。
2 结果与分析
2.1 HPLC制备高纯度化合物
2.1.1 XVII(Fr.36~39)中化合物的制备 图 1是Fr.36~39组分I(记为XVII-I)的液相色谱制备图,分别接收1~3号峰,并对得到的3段接收液进行纯度检验。

图1 Fr.(36~39)-I液相色谱制备图Figure 1 Fr. (36~39)-I Chromatogram of HPLC preparation
由图1可知,1号和3号色谱峰的峰形都不够尖锐,纯度要求低于结构鉴定水平;2号峰为单一色谱峰且峰形尖锐,由色谱峰面积计算纯度在95%以上。制备得到13 mg化合物1。以40%甲醇—0.2%乙酸水液相检测其纯度为99.2%,满足做结构解析的要求。
2.1.2 XXVII(Fr.66)中化合物的制备 分别接收图2中1号和2号峰,浓缩,1号峰经检测为混合物;2号峰(XXVII-2)经检测纯度约为60%,进行再次制备。半制备色谱图见图3。

图2 Fr.66液相色谱制备Figure 2 Fr.66 Chromatogram of HPLC preparation
图3中,1号和2号色谱峰的峰形尖锐,由色谱峰面积计算纯度在90%以上。但是1号峰的质量太少;2号峰经制备得到11.8 mg化合物2,以40%甲醇—水液相检测其纯度为95.4%,满足做结构解析的要求。

图3 Fr.(66)-2液相色谱制备Figure 3 Fr. (66)-2 Chromatogram of HPLC preparation
2.1.3 XXVIII(Fr.67~69)中化合物的制备 接收图4中标志出来的2峰,合并接收液、冻干、称重、测定纯度。其中1号峰得到物质少且纯度很差,所以暂时不进一步纯化;2号峰(XXVIII-2)的质量较大,但是纯度较差,再次进行HPLC分析并半制备。半制备色谱图见图5。

图4 Fr.67~69液相色谱制备Figure 4 Fr.67~69 Chromatogram of HPLC preparation
由色谱峰面积计算,图5中1号峰、3号峰的纯度在90%以上。1号峰经制备得到5 mg化合物3;2号峰经制备得到的质量很小;3号峰经制备得到8 mg化合物4。以25%乙腈—0.1%甲酸水液相检测化合物3的纯度为97.5%,满足做结构解析的要求。经计算可得,化合物3的提取得率为10 mg/kg。以25%乙腈—0.1%甲酸水液相检测化合物4的纯度为99.1%,满足做结构解析的要求。经计算可得,化合物4的提取得率为16 mg/kg。

图5 Fr.(67~69)-2液相色谱制备图Figure 5 Fr. (67~69)-2 Chromatogram of HPLC preparation
2.1.4 XXXIV(Fr.90~97)中化合物的制备 由图6可知,1号色谱峰峰形很宽,含有多种杂质,纯度要求低于结构鉴定水平。2号色谱峰为单一峰且峰形尖锐,根据峰面积计算其纯度在90%以上。2号峰制备得到16 mg化合物5,以25%乙腈—水液相检测其纯度为97.4%,满足做结构解析的要求。
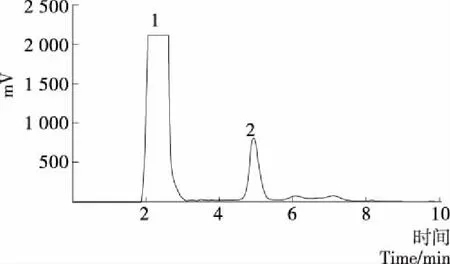
图6 Fr.90~97液相色谱制备Figure 6 Fr. 90~97 Chromatogram of HPLC preparation
2.2 单体化合物的结构鉴定
2.2.1 化合物1的结构解析 褐色晶体,易溶于甲醇、乙醇和丙酮,难溶于水和氯仿。质谱图见图7,质谱数据m/z155.034 3 [M+H]+,由安捷伦分子式计算器推测其分子式为C7H6O4。
初步推测该化合物为原儿茶酸,该化合物从南山茶果皮[29]、西南山茶叶[30]、金花茶花[31]、普通油茶的根[32]中都有提取得到。
2.2.2 化合物2的结构解析 黄色晶体,易溶于甲醇、乙醇和丙酮,难溶于水和氯仿,与盐酸镁粉显阳性反应,与三氧化铝试剂呈黄绿色荧光,与Molish呈阳性反应,提示化合物为黄酮苷类。质谱图见图 8,质谱数据m/z433.112 8 [M+H]+,由安捷伦分子式计算器推测其分子式为C21H20O10。

图7 化合物1的质谱图Figure 7 Mass spectrum of compounds 1

图8 化合物2的质谱图Figure 8 Mass spectrum of compounds 2
推断该化合物可能为以山奈酚为母核带一分子鼠李糖的黄酮类化合物,这类化合物在山茶属植物的种子或者花中报道过,包括糖的连接在山奈酚的3位[33-35]或8位[31, 36]的化合物。该化合物也可能为以芹菜素为母核带一分子葡萄糖基或者半乳糖基的黄酮类化合物,以芹菜素为母核的化合物在绿茶[37-40]和白茶[41]中报道过。
2.2.3 化合物3的结构解析 浅黄色晶体,易溶于甲醇、乙醇和丙酮,难溶于水和氯仿,与盐酸镁粉显阳性反应,三氧化铝反应呈黄绿色荧光,与Molish呈阳性反应,提示化合物为黄酮苷类。
质谱图见图9,质谱数据m/z783.237 2 [M+H]+,质子碎片m/z637.178 9 [(M+H)-146]+,449.104 9 [(M+H)-146-146]+,由安捷伦分子式计算器推测其分子式为C33H40O19。推测其结构中含有1个山奈酚母核、2组鼠李糖基、1组葡萄糖基以及1组乙酰基。
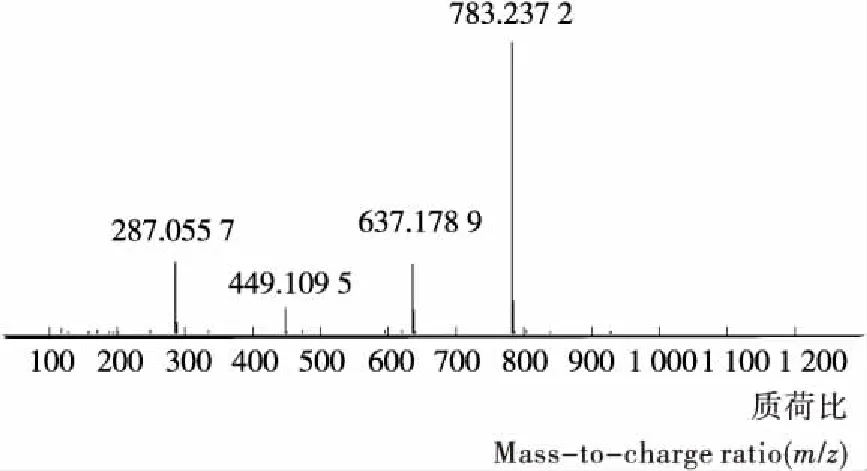
图9 化合物3的质谱图Figure 9 Mass spectrum of compounds 3
2.2.4 化合物4的结构解析 黄色晶体,易溶于甲醇、乙醇和丙酮,难溶于氯仿和水,与盐酸镁粉显阳性反应,三氧化铝反应呈黄绿色荧光,与Molish呈阳性反应,提示化合物为黄酮苷类。
质谱图见图 10,质谱数据m/z825.245 3 [M+H]+,由安捷伦分子式计算器推测其分子式为C37H44O21,质子碎片m/z679.187 3 [(M+H)-146]+,287.055 0 [(M+H)-146-42-42-162]+,根据离子碎片并结合核磁相关数据推测其含有山奈酚母核以及1个葡萄糖基和2个鼠李糖基以及2个乙酰基。

图10 化合物4的质谱图Figure 10 Mass spectrum of compounds 4
2.2.5 化合物5的结构解析 青黑色晶体,易溶于甲醇、乙醇和丙酮,难溶于氯仿和水,与盐酸镁粉显阳性反应,三氧化铝反应呈黄绿色荧光,与Molish呈阳性反应,提示化合物为黄酮苷类。
质谱图见图 11,质谱数据m/z741.233 5 [M+H]+,由安捷伦分子式计算器推测其分子式为C35H42O20,质子碎片m/z595.173 9 [(M+H)-146]+,449.113 9 [(M+H)-146-146]+,287.051 5 [(M+H)-146-146-162]+,该化合物为含有1个山奈酚母核、2个鼠李糖基和1个葡萄糖基的黄酮类化合物。

图11 化合物5的质谱图Figure 11 Mass spectrum of compounds 5
3 结论
试验中,南山茶饼提取物在乙酸乙酯萃取和硅胶柱层析分离、纯化的基础上,用液相色谱对4个组分进行了制备,得到了5个纯度为90%以上的化合物。通过高清晰质谱的分子式计算器推断了分子式,初步鉴定为原儿茶酸和4个黄酮类化合物。对于其绝对结构的确定将通过核磁鉴定进一步研究。
[1] BIGLARI F, ALKARKHI A F M, EASA A M. Antioxidant activity and phenolic content of various date palm (Phoenix dactylifera) fruits from Iran[J]. Food Chemistry, 2008, 107(4): 1 636-1 641.
[2] REHECHO S, HIDALGO O, GARCA-IIGUEZ De Cirano M, et al. Chemical composition, mineral content and antioxidant activity of Verbena officinalis L.[J]. LWT-Food Science and Technology, 2011, 44(4): 875-882.
[3] SHUI G, LEONG L P. Analysis of polyphenolic antioxidants in star fruit using liquid chromatography and mass spectrometry[J]. Journal of Chromatography A, 2004, 1022(1): 67-75.
[5] SHEN Yun, JIN Liang, XIAO Peng, et al. Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J]. Journal of Cereal Science, 2009, 49(1): 106-111.
[6] 王丽丽, 赵新淮. 紫丁香叶提取物对低密度脂蛋白氧化修饰的抑制作用[J]. 东北农业大学学报, 2007, 38(5): 641-644.
[7] 谷仿丽, 陈乃富, 戴军, 等. 山楂总黄酮和茶多酚联合调节血脂的优化配比研究[J]. 皖西学院学报, 2009, 25(2): 76-78.
[8] 陈晓燕, 邓启盼, 罗非君, 等. EGCG在肿瘤预防及治疗中作用的分子机制[J]. 生命的化学, 2011, 31(2): 207-211.
[9] 彭钰芳, 许传莲. 黄酮类化合物抑制肿瘤细胞增殖活性及构效关系[J]. 浙江理工大学学报, 2011, 28(2): 267-270.
[10] 黄进. 大豆活性成分的结构与功能评价: 肿瘤细胞凋亡、降糖、抗氧化作用[D]. 武汉: 华中农业大学, 2003: 74-93.
[11] 格根塔娜. 蒙药材库页悬钩子木的活性成分研究: 乙酸乙酯层和正丁醇层的活性成分研究[D]. 通辽: 内蒙古民族大学, 2012: 10.
[12] LOZIENE K, VENSKUTONIS P R, SIPAILIENE A, et al. Radical scavenging and antibacterial properties of the extracts from different Thymus pulegioides L. chemotypes[J]. Food Chemistry, 2007, 103(2): 546-559.
[13] 江和源, 柯昌强, 王川丕, 等. 茶籽饼粕中黄酮苷的HPLC分析、制备与MS鉴定[J]. 茶叶科学, 2005, 25(4): 56-61.
[14] 再帕尔·阿不力孜. 天然产物研究方法和技术[M]. 北京: 化学工业出版社, 2010: 5.
[15] 汤坚盛龙生. 液相色谱质谱联用技术在食品和药品分析中的应用[M]. 北京: [出版者不详], 2008: 53.
[16] ASHIHARA H, DENG W W, MULLEN W, et al. Distribution and biosynthesis of flavan-3-ols in Camellia sinensis seedlings and expression of genes encoding biosynthetic enzymes[J]. Phytochemistry, 2010, 71(5/6): 559-566.
[17] 曹永庆, 姚小华, 任华东, 等. 油茶果实矿质元素含量和油脂积累的相关性[J]. 中南林业科技大学学报, 2013, 33(10): 38-41.
[18] 朱勇, 王湘莹, 马锦林, 等. 不同物种油茶籽仁含油率及其茶油的脂肪酸组成[J]. 经济林研究, 2013, 31(2): 134-137.
[19] LEE C, YEN G. Antioxidant Activity and Bioactive Compounds of Tea Seed (Camellia oleifera Abel.) Oil[J]. J. Agric. Food Chem., 2006, 54(3): 779-784.
[20] 王进英, 钟海雁, 朱晓阳, 等. 多齿红山茶籽多酚组分的抗氧活性研究[J]. 食品与机械, 2013, 29(1): 105-107.
[21] LEE C, SHIH P, HSU C, et al. Hepatoprotection of tea seed oil (Camellia oleifera Abel.) against CCl4-induced oxidative damage in rats[J]. Food and Chemical Toxicology, 2007, 45(6): 888-895.
[23] 李好, 钟海雁, 方学智, 等. 油茶籽成熟过程中抗氧化物质的变化规律[J]. 食品与机械, 2013, 29(5): 6-9.
[24] DU Li-chun, WU Bei-li, CHEN Jian-min. Flavonoid triglycosides from the seeds of Camellia oleifera Abel.[J]. Chinese Chemical Letters, 2008, 19(11): 1 315-1 318.
[25] 刘应珍, 邹天才. 贵州山茶属植物资源及其开发利用探讨[J]. 贵州科学, 2008, 26(2): 75-81.
[26] 田晔林. 湖南省山茶属红山茶组植物分类及园林应用研究[D]. 长沙: 中南林学院, 2001: 33-37.
[27] 廖义秀, 钟海雁. 茶油贮藏的稳定性及高效液相色谱分析[J]. 食品与机械, 2013, 29(1): 173-176.
[28] 漆龙霖, 吕芳德, 李克瑞, 等. 湖南山茶属植物种质资源调查、收集和利用的研究[J]. 武汉植物学研究, 1989, 7(3): 275-284.
[29] 张微微, 于大永, 史丽颖, 等. 南山茶果皮化学成分的研究[J]. 广西植物, 2012, 32(5): 698-700.
[30] 石海峰, 冯宝民, 史丽颖, 等. 西南山茶化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2010, 27(5): 357-360.
[31] 彭晓, 于大永, 冯宝民, 等. 金花茶花化学成分的研究[J]. 广西植物, 2011, 31(4): 550-553.
[32] 佟小静. 油茶根化学成分研究[D]. 苏州: 苏州大学, 2011.
[33] TENG Xi-feng, YANG Jia-yue, YANG Chong-ren, et al. Five New Flavonol Glycosides from the Fresh Flowers of Camellia reticulata[J]. Helvetica Chimica Acta, 2008, 91(7): 1 305-1 312.
[34] 李菁. 茶籽饼抗肿瘤活性成分与茶籽壳抗氧化的初步研究[D]. 武汉: 湖北中医药大学, 2012: 29.
[35] 侯蕾, 于大永, 冯宝民, 等. 西南红山茶花化学成分的分离与鉴定[J]. 时珍国医国药, 2011, 22(7): 1 701-1 703.
[36] SONG Li-xia, WANG Xiang-she, ZHENG Xue-qin, et al. Polyphenolic antioxidant profiles of yellow camellia[J]. Food Chemistry, 2011, 129(2): 351-357.
[37] PARK J S, YEOM M H, PARK W S, et al. Enzymatic hydrolysis of green tea seed extract and its activity on 5alpha-reductase inhibition[J]. Biosci Biotechnol Biochem, 2006, 70(2): 387-394.
[38] LIN L, CHEN P, HARNLY J M. New phenolic components and chromatographic profiles of green and fermented teas[J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 8 130-8 140.
[39] KIM Y, GOODNER K L, PARK J, et al. Changes in antioxidant phytochemicals and volatile composition of Camellia sinensis by oxidation during tea fermentation[J]. Food Chemistry, 2011, 129(4): 1 331-1 342.
[40] 成桂仁, 金静兰, 文永新. 白水茶中二种新黄酮甙的结构[J]. 药学学报, 1987, 22(3): 203-207.
[41] ZHAO Yang, CHEN Pei, LIN Long-ze, et al. Tentative identification, quantitation, and principal component analysis of green pu-erh, green, and white teas using UPLC/DAD/MS[J]. Food Chemistry, 2011, 126(3): 1 269-1 277.
Isolation, purification and identification of extracts from seed ofCamelliasemiserrataChi.
(1.FacultyofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China; 2.KeyLaboratoryofCultivationandProtectionforNon-WoodForestTrees〔CentralSouthUniversityofForestryandTechnology〕,MinistryofEducation,Changsha,Hunan410004,China)
To comprehensively develop and utilizeCamelliaresources, fractions of ethanol extract ofCamelliasemiserrataChi. cake were separated and identified. Five purified compounds with purity of 99.2%, 95.4%, 97.5%, 99.1% and 97.4%, respectively, were achieved. By using affiliated molecular formula of generator by Agilent high-resolution mass spectrometry workstation Qualitative Analysis B.06.00, formula of MS fragmentation of molecular ions were calculated, combining with fragmentation patterns of compounds and physical and chemical properties, the compounds were identified as protocatechuic acid and four kinds of flavonoids.
Camellia; extract; Structure identification; HPLC; NMR; Mass spectrometry
10.13652/j.issn.1003-5788.2017.04.026

