毕赤酵母分泌表达JEV prME蛋白及其形成病毒样颗粒的免疫原性鉴定
赵鹏,江雅,王经满,范浩杰,曹瑞兵
毕赤酵母分泌表达JEV prME蛋白及其形成病毒样颗粒的免疫原性鉴定
赵鹏,江雅,王经满,范浩杰,曹瑞兵
南京农业大学动物医学院农业部动物细菌学重点实验室,江苏南京 210095

赵鹏, 江雅, 王经满, 等. 毕赤酵母分泌表达JEV prME蛋白及其形成病毒样颗粒的免疫原性鉴定. 生物工程学报, 2017, 33(5): 863–874.Zhao P, Jiang Y, Wang JM, et al. Secreted expression of Japanese encephalitis virus prME in Pichia pastoris and immunogenicity evaluation of the virus-like particles in mice. Chin J Biotech, 2017, 33(5): 863–874.
应用毕赤酵母分泌表达日本脑炎病毒 (Japanese encephalitis virus,JEV) prME蛋白,鉴定其表达效果与免疫原性,以期为JEV亚单位疫苗的研制奠定基础。RT-PCR扩增JEV SA14-14-2株基因,将其连接到毕赤酵母表达载体pPICZa-A,分别获得pPICZa-prME和携带JEV Cap蛋白C末端19个Aa信号肽的pPICZa-SprME质粒。表达载体用Ⅰ酶切线性化,通过电转化转入毕赤酵母X33并诱导发酵培养。利用SDS-PAGE和Western blotting鉴定酵母发酵上清中目的蛋白的表达情况。利用GE蛋白层析纯化柱纯化目的蛋白,利用电镜观察纯化前后的目的蛋白,将不同剂量纯化后的prME蛋白与弗氏佐剂混合以及定量纯化后的prME蛋白与不同剂量的核酸佐剂混合分别免疫4周龄小鼠,定期采血,ELISA检测被免小鼠血清的抗体水平,空斑减少试验测定抗体中和效价。SDS-PAGE结果表明毕赤酵母可以分泌表达完整的prME蛋白,目的蛋白在70–100 kDa之间;Western blotting结果显示分泌表达的prME蛋白具有良好的反应原性,进一步证明prME蛋白在酵母X33中以整体的形式分泌表达,没有发生水解切割。纯化目的蛋白,根据洗脱时间和体积表明其分子量大于1×106Da,因此推断prME蛋白可能形成多聚化的颗粒。电镜观察发现直径30–50 nm的病毒样颗粒 (Virus like particles,VLPs)。免疫试验结果表明,纯化后的重组蛋白10–15 μg/只接种小鼠在3周后抗体达到高峰值,之后逐渐下降,免疫7周后小鼠血清仍可检测到JEV抗体。将prME VLPs以10 μg /只的剂量与不同剂量的核酸佐剂配伍后接种小鼠,ELISA检测结果表明核酸佐剂可明显增强JEV prME VLPs免疫应答,免疫4周后小鼠血清的中和抗体效价为1∶80–1∶160。上述结果表明毕赤酵母表达JEVprME虽不能发生水解切割,但仍可形成VLP并诱导免疫小鼠产生较高水平中和抗体。
日本脑炎病毒,prME蛋白,毕赤酵母,病毒样颗粒,免疫原性
流行性乙型脑炎是一种由日本脑炎病毒 (Japanese encephalitis virus,JEV) 经蚊虫传播引起的人畜共患病[1]。JEV与西尼罗病毒 (West nile virus,WNV)、登革热病毒 (Dengue virus,DENV) 同为黄病毒科黄病毒属 (Flavivirus) 成员[2]。猪是JEV在自然界的重要储存宿主和扩增宿主,病毒通常在“蚊-猪-蚊”间循环传播[3]。JEV是引起母猪繁殖障碍的重要病原之一,可引起怀孕母猪流产、死胎或木乃伊胎,也可引起公猪睾丸急性炎症。该病在东亚、南亚等地区广泛流行,不但对养猪业造成了重大的经济损失,也严重威胁着人类的健康[4]。流行性乙型脑炎的防控主要通过防蚊灭蚊和疫苗免疫。
JEV为球形有囊膜病毒,直径约40 nm,其基因组为单股正链RNA,长度约为11 kb[5]。prM和E蛋白是JEV的两个重要的结构蛋白,各含有一个糖基化位点 (N15,N154)[6]。prM蛋白是未成熟病毒粒子的一部分,分子量为18–19 kDa,prM蛋白在未被宿主细胞弗林蛋白酶水解前,作为分子伴侣协助E蛋白进行正确的结构折叠、膜定位和病毒的组装。prM被弗林蛋白酶水解为M蛋白后病毒才成为成熟的病毒粒子[6-9],M蛋白参与病毒感染过程,能够诱导机体产生中和抗体[6, 10-12]。E蛋白含500个氨基酸残基,分子量约为53 kDa,囊膜糖蛋白E是病毒粒子表面主要的结构蛋白,参与病毒复制的许多过程,包括结合受体、膜融合和病毒颗粒包装等[7-9],E蛋白上有中和抗原表位,可诱导免疫保护[12]。
病毒样颗粒 (Virus like particles,VLPs) 是指由某种病毒的一个或多个结构蛋白自发组装形成的颗粒;在形态上与真正病毒粒子相同或相似,可诱导机体类似病毒感染的免疫应答;且没有病毒核酸而不能自主复制,因此具有很好的安全性[13-15]。目前,人乳头状瘤病毒 (HPV)[16]和乙型肝炎病毒[17]核衣壳蛋白VLP抗原疫苗已得到广泛应用,H9N2流感病毒[18]和Chikungunya病毒[19]囊膜蛋白VLP抗原疫苗已经研制成功并获得商业化生产。
毕赤酵母真核表达系统,可对表达的蛋白进行加工折叠和翻译后修饰,从而使表达出的蛋白具有生物活性[7, 20-21]。应用毕赤酵母甲醇氧化酶 (AOX1) 基因启动子,可严格调控外源蛋白的表达。Liu等报道应用毕赤酵母成功表达出DENV prME蛋白,并自发组装形成VLP,免疫小鼠可有效抵御同型DENV的感染致病[21]。
本研究应用毕赤酵母表达JEV prME蛋白,发现该蛋白可以被分泌表达至酵母菌培养液中,prME没有发生切割,但仍可自发组装成病毒样颗粒,毕赤酵母表达的JEV VLPs免疫小鼠可诱导产生较高水平的中和抗体。本研究为下一步研制流行性乙型脑炎亚单位疫苗提供了新思路。
1 材料与方法
1.1 材料
1.1.1 试验动物、菌株和质粒
4周龄SPF ICR小鼠购自上海西普尔必凯实验动物有限公司。大肠杆菌TOP10株、毕赤酵母X33、JEV SA14-14-2株、JEV NJ2008株、BHK细胞由南京农业大学动物医学院农业部动物疫病诊断与免疫实验室保存。pPICZa-A表达载体购自Invitrogen公司。
1.1.2 主要生化试剂与酶
Trizol、PrimeScriptTMRT-PCR kit、Premixed protein marker、DNA聚合酶、T4 DNA连接酶、RⅠ、Ⅰ、Ⅰ、DNA marker均为TaKaRa公司产品;弗氏佐剂、核酸佐剂为Sigma公司产品[22];ZeocinTM为Invitrogen公司产品;鼠源JEV E蛋白单克隆抗体4H1为本实验室自制;鼠源JEV prM单克隆抗体HZ由华中农业大学提供;山羊抗小鼠-IgG-HRP购自优宁维公司;NC膜、滤纸购自Promega公司;SDS、Tris-HCl、30%丙烯酰胺、考马斯亮蓝R-250、TEMED、过硫酸胺、酵母粉、蛋白胨、生物素、酵母氮源培养基、葡萄糖等常用试剂均购自上海生工生物工程有限公司;引物合成、基因测序由上海华大基因有限公司完成。
1.2 方法
1.2.1 JEV prME基因的克隆与鉴定
用Trizol提取JEV疫苗株SA14-14-2 RNA,按照Prime-ScriptTMRT-PCR kit的说明,将RNA反转录为cDNA。根据GenBank公布的SA14-4-2 strain (GenBank Accession No. JN604986) 序列,应用DNAstar (Version4.0) 及Primer (Version 5.0) 基因分析软件,设计扩增JEV基因引物序列JE1、JE2及扩增不含Cap C端信号肽的JEV基因引物序列JE3、JE4 (表1)。以cDNA为模板进行PCR扩增,反应体系:DNA扩增酶25 μL,上下游引物各1.0 μL,cDNA为3.0 μL,加ddH2O至总体积为50 μL。PCR程序:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min;4 ℃保存。PCR结束后,反应产物于1%琼脂糖凝胶中进行电泳检测,观察并记录结果。对扩增产物进行胶回收,并对回收结果进行凝胶检测。
1.2.2 JEV prME酵母表达载体的构建
将胶回收的PCR扩增产物JEV基因与pPICZa-A质粒用RⅠ、Ⅰ进行双酶切,将酶切后的基因片段用T4DNA连接酶连接到pPICZa-A载体上,再将连接产物转化进大肠杆菌TOP10感受态细胞中,挑取单菌落进行重组质粒提取,经双酶切鉴定正确后送上海华大基因有限公司测序。含有编码prM蛋白前19个氨基酸信号肽的重组质粒命名为pPICZa-SprME,不含Cap C端信号肽基因的重组质粒命名为pPICZa-prME。
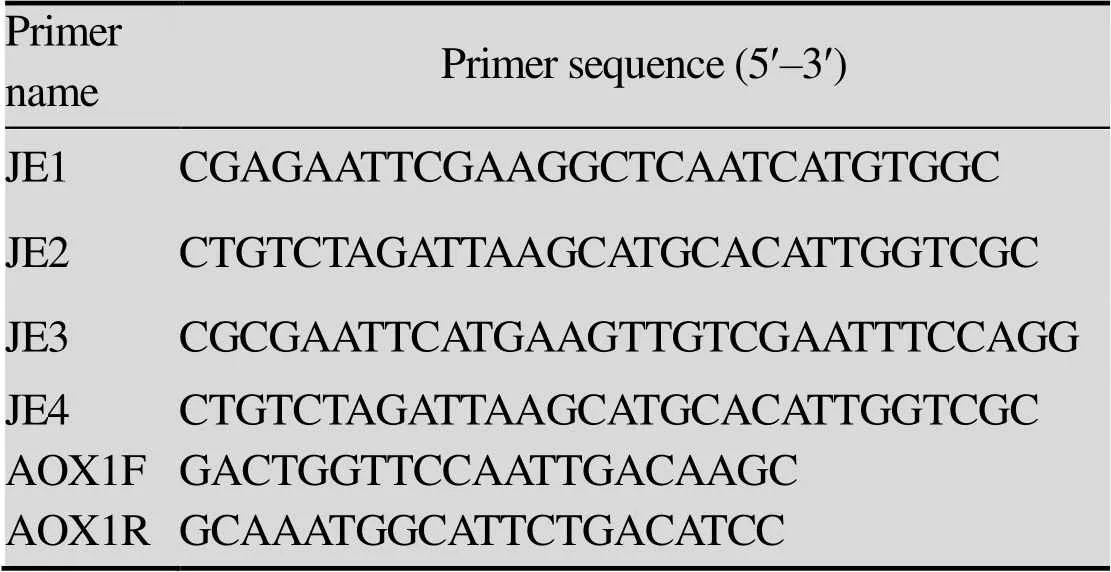
表1 PCR所需引物序列
1.2.3 导入JEV prME基因的毕赤酵母X33菌株阳性克隆筛选鉴定
将重组质粒pPICZa-SprME和pPICZa-prME用Ⅰ酶线性化后,回收线性化质粒,采用电转化方法导入到毕赤酵母菌X-33中,将质粒与酵母感受态混合放于0.2 cm电击杯中(BIO-RAD),电转条件为1.5 kV,5 ms,25 F,200 Ω。将电转化之后的转化菌在酵母培养箱30 ℃静置3 h后,涂布于YPD (1%酵母粉,2%蛋白胨,2%葡萄糖,2%琼脂粉,添加ZeocinTM100 μg/mL) 平板,倒置,酵母培养箱30 ℃静置培养3–5 d。挑取单菌于YPD培养液中,加入1‰ (/) Zeocin,30 ℃培养16–18 h,通过煮-冻-煮的方法提取毕赤酵母X33基因组,以基因组DNA为模板,应用引物AOX1F和AOX1R进行PCR鉴定,引物序列见表1,PCR步骤同1.2.1。接菌环蘸取阳性菌液在含200 μg/mL ZeocinTMYPD固体培养基划线,30 ℃培养3–5 d,获得基因阳性重组酵母菌。
1.2.4 JEV prME重组蛋白的诱导表达
用灭菌牙签挑取Zeocin抗性YPD平板上生长的单菌落,接种于5 mL的BMGY (1%酵母粉,2%蛋白胨,100 µmol/L磷酸盐缓冲液 (pH 6.0),1.34%酵母氮源培养基,4×10–5%生物素,1%甘油) 液体培养基中,在50 mL体积锥形瓶中进行激活培养,瓶口覆盖两层纱布,30 ℃、220 r/min振荡16–20 h,至600值约为2–6,此时酵母菌处于对数生长期。收集菌液,5 000 r/min室温离心5 min,收集沉淀,重悬于1 mL的BMMY (与BMGY的区别是不含1% 甘油,而含有1%甲醇) 中,转入50 mL BMMY液体培养基中,继续在250 mL体积锥形瓶中振荡培养。每间隔24 h加入250 μL 100%甲醇,进行诱导培养。试验同时设转化空载体pPICZa-A的酵母菌株为阴性对照。培养至96 h收集样品,室温12 000 r/min离心5 min,取上清液,SDS-PAGE分析蛋白表达情况。
1.2.5 酵母分泌表达的JEV prME蛋白的层析纯化与鉴定
将离心收集的酵母表达上清用0.22 μm无菌滤器过滤,收集滤液,用蛋白浓缩柱 (Biomax100,Millipore,Bedford,USA) 浓缩滤液,3 500×、4 ℃离心25 min。取浓缩液2 mL,用蛋白纯化层析柱HiPrep 16/60 Sephacry (S-400 High Resolution,GE) 纯化,流速为15 cm/h,定时分管收集流出液,每管3 mL,记录对应吸收峰,再将收集的蛋白纯化液使用蛋白浓缩柱浓缩,SDS-PAGE鉴定各层析组分。
通过Western blotting检验纯化后的重组目的蛋白,阴性对照为转化的空载体pPICZa-A酵母菌表达上清。SDS-PAGE后0.33 A恒流转膜 3 h。用5%脱脂奶粉常温封闭1.5 h,PBST漂洗3次后,分别加入1∶1 000稀释的抗JEV prM、E 蛋白的鼠源一抗,室温孵育2 h;PBST漂洗3次后,加入1∶3 000稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体 (二抗),室温孵育1.5 h,PBST漂洗3次后用Western blotting发光液和曝光机 (均购自南京Tanon公司),观察目的条带并记录结果。
将毕赤酵母表达的JEV prME蛋白上清和纯化浓缩上清在HITACHI-7650透射电镜下观察并记录结果。使用BioPhotometer D30核酸蛋白测定仪 (德国,Eppendorf) 测定纯化浓缩后的prME蛋白浓度。
1.2.6 动物免疫实验
为了分析酵母分泌表达JEV蛋白的免疫原性,开展了2次小鼠免疫实验。
第一次试验将25只4周龄雌性ICR小鼠分成5组,其中4组接种不同剂量 (2.5 μg、5.0 μg、10.0 μg和15.0 μg/小鼠) 纯化后的重组prME蛋白,免疫前抗原与弗氏完全佐剂 (Sigma公司) 以1∶1的体积混合,腹腔和背部皮下多位点免疫小鼠。阴性对照组小鼠接种200 μL PBS。
第二次动物试验将25只4周龄雌性ICR小鼠分成5组,其中4组分别接种纯化后的重组prME蛋白10.0 μg,免疫前与不同剂量的核酸佐剂 (Sigma公司) (0 μL、1 μL、5 μL、15 μL/小鼠) 配伍,核酸佐剂的浓度为50 mg/mL,腹腔和背部皮下多位点免疫小鼠。阴性对照组小鼠接种200 μL PBS。
定期收集小鼠血液,将血液样品收集到无菌血液收集管中并使其在室温下凝结2 h,4 ℃、4 500 r/min离心15 min。采集的血清在–20 ℃下储存,用于后期ELISA检测抗体及测定中和效价。
1.2.7 ELISA检测小鼠血清样品中JEV特异性抗体
应用本实验室建立的JEV抗体检测ELISA,主要步骤为用纯化的JEV ED3蛋白作为检测抗原包被板条,4 ℃过夜,将ELISA板条用封闭缓冲液 (PBS加2% BSA) 封闭,37 ℃下温育2 h,然后用PBST洗涤3次;加入1∶100稀释的小鼠血清样品,在37 ℃下温育1.5 h;洗涤3次,加入1∶3 000稀释的HRP标记的山羊抗鼠IgG抗体,在37 ℃下温育1.5 h;用PBST洗涤3次,用TMB和磷酸盐缓冲液制备显色液,依次加入到每个孔中,37 ℃下作用10 min,终止显色,读取450数值。
1.2.8 微量空斑减少试验测定小鼠血清样品中JEV特异性中和抗体水平
将56 ℃灭活的血清样品10倍稀释后再进行倍比稀释,与50PFU/0.25mL的JEV NJ2008株混合后温育,37 ℃作用1.5 h,分别加入到长满BHK单层细胞的24孔板中,37 ℃孵育1.5 h后弃去混合液;然后加入0.8 mL 1∶1体积的1%琼脂糖和2×DMEM (含有4% FBS和2%双抗),37 ℃ CO2培养箱中孵育,每天观察1次;3–4 d后出现空斑,在24孔板中加入结晶紫染色液并在室温下静置12 h固定。然后小心地弃去琼脂糖单层覆盖层,观察并记录结果。中和抗体效价计算方法为抑制50%或更多的噬斑形成的最高小鼠血清稀释倍数的倒数。
2 结果与分析
2.1 JEV prME酵母表达载体双酶切鉴定及转化酵母阳性克隆的筛选
以JEV SA-14-14-2株RNA为模板RT-PCR扩增得到大小约为2 kb的JEV基因克隆到pPICZa-A载体中,将构建的表达JEV prME蛋白的载体pPICZa-SprME和pPICZa-prME分别用RⅠ、Ⅰ双酶切鉴定 (图1A),表明成功构建表达载体。应用AOX1检测引物PCR扩增鉴定经电转化后长出的毕赤酵母菌X33单菌落,PCR结果约为2 400 bp,与理论值相符 (图1B),表明获得JEV基因转化阳性毕赤酵母菌株。
2.2 JEV prME基因转化阳性毕赤酵母菌株的诱导表达鉴定
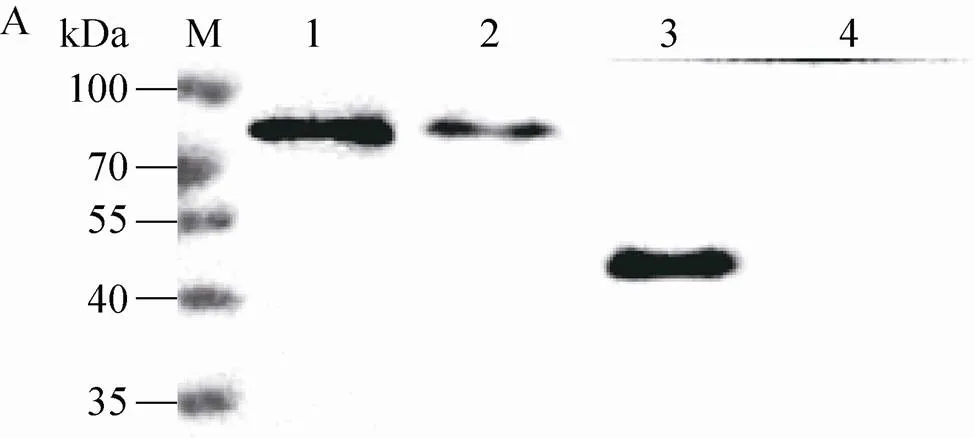
将收获的JEV基因转化阳性毕赤酵母菌发酵液离心取上清,过滤后4 ℃保存备用。SDS-PAGE鉴定基因转化阳性毕赤酵母菌表达产物,结果表明pPICZa-prME/X33和pPICZa- SprME/X33表达上清比pPICZa-A/X33表达上清均有一条增加的条带,分子量介于70–100 kDa之间 (图2)。JEV prME蛋白的理论大小为72 kDa,与表达产物分子量相近,表明毕赤酵母表达prME蛋白没有发生酶解切割。多次发酵比对发现pPICZa-SprME/X33表达上清中目的蛋白的含量明显高于pPICZa-prME/X33,因此尽管pPICZa-A表达载体带有信号肽编码基因,JEV Cap末端19个Aa的信号肽序列促进了prME蛋白的分泌表达。

图1 JEV prME酵母表达载体双酶切及转化毕赤酵母菌鉴定

图2 酵母表达重组蛋白分析
为了进一步鉴定酵母表达产物的特异性,分别应用JEV E蛋白单克隆抗体4H1和prM蛋白单克隆抗体HZ对表达产物进行免疫印迹鉴定 (图3)。阳性对照JEV NJ2008株BHK细胞毒分别在53 kDa和20 kDa位置出现特异条带,而酵母表达产物均在72 kDa附近出现特异条带,进一步表明毕赤酵母表达蛋白没有发生酶解切割。
2.3 毕赤酵母分泌表达JEV prME蛋白的层析纯化与鉴定
根据SDS-PAGE鉴定结果发现,pPICZa- SprME/X33表达的目的蛋白含量明显高于pPICZa-prME/X33,所以后期选取pPICZa- SprME/X33表达上清用于目的蛋白的纯化和动物免疫试验。将pPICZa-SprME/X33表达上清用100 kDa规格的蛋白浓缩柱离心、浓缩5倍。将浓缩的酵母表达产物用S-400 High Resolution HiPrep 16/60 Sephacry 层析柱纯化 (图4A),收集各吸收峰的层析产物,SDS-PAGE鉴定纯化产物 (图4B),发现表达产物主要存在于第一流出峰,该流出峰对应的层析产物大小理论值为1×106–20×106Da,远大于prME单体的分子量72 kDa,表明酵母表达的JEV prME蛋白可自发组装成多聚体。
BioPhotometer D30核酸蛋白测定仪测纯化浓缩后的JEV prME蛋白浓度为150 μg/mL,由于该浓度为样品浓缩后所得,根据浓缩倍数推算,最初pPICZa-SprME/X33表达的目的蛋白浓度约为35 μg/mL。

2.4 毕赤酵母分泌表达JEV prME蛋白透射电镜观察结果
毕赤酵母表达上清液直接负染后电镜观察,可看到直径在30–50 nm之间的病毒样颗粒(图5A),纯化浓缩后的表达产物在透射电镜下观察,可看到较多蛋白颗粒 (图5B)。因此,尽管毕赤酵母X33分泌表达的prME蛋白没有发生类似哺乳动物细胞表达体系中的pr-M-E之间的酶解切割,仍可自发组装成病毒样颗粒。
2.5 毕赤酵母表达prME VLPs免疫小鼠的抗体应答特征
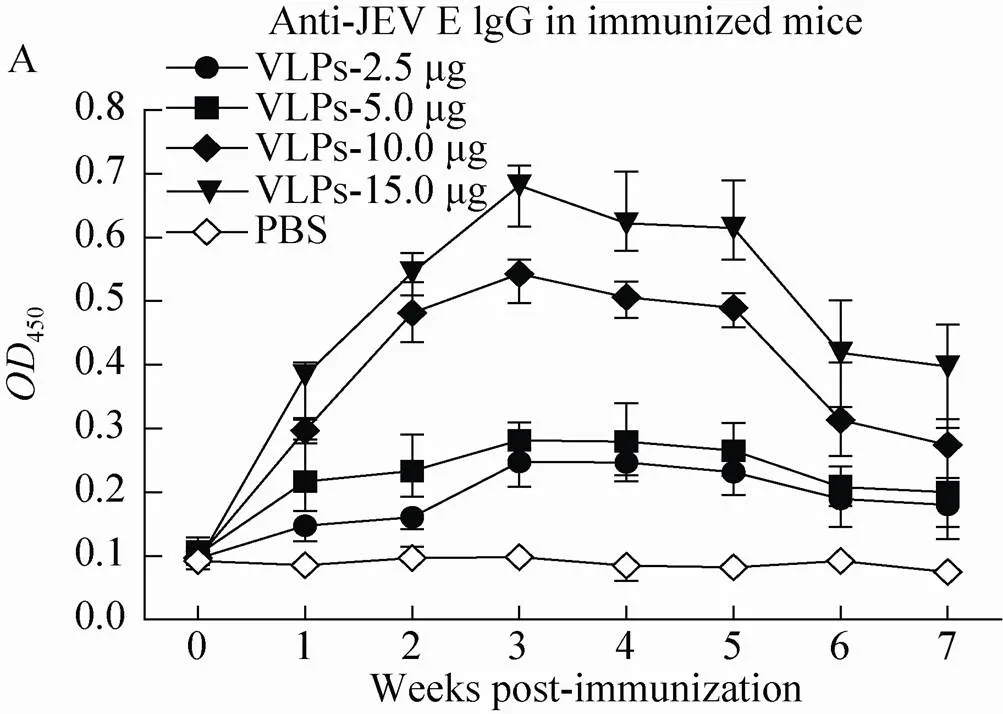
将不同剂量纯化后的毕赤酵母表达的prME VLPs与弗氏完全佐剂等体积混合后单次免疫4周龄ICR小鼠,ELISA检测采集血清中JEV特异性抗体水平。结果表明(图6A),prME VLPs诱导抗体产生具有抗原剂量相关性;10–15 μg/只接种小鼠在1 wpi即可发现JEV抗体转阳,3 wpi达到高峰,随后抗体水平逐渐下降,但在7 wpi仍为JEV 抗体阳性;2.5–5 μg/只接种小鼠产生的抗体应答不显著,没有出现高峰。为了探讨核酸免疫佐剂对酵母表达prME VLPs免疫小鼠效果的影响,将纯化后的prME VLPs以10 μg/只的剂量与不同体积的核酸佐剂配伍后免疫小鼠,ELISA检测结果表明核酸佐剂可明显增强小鼠对prME VLPs免疫应答 (图6B)。为了分析prME VLPs免疫小鼠是否诱导JEV中和抗体,选取接种剂量为prME 10 μg+15 μL小鼠4 wpi血清,通过微量空斑减少试验检测JEV中和抗体水平,结果显示免疫4周后小鼠血清的JEV中和抗体效价为1∶80–1∶160 (图6C),表明毕赤酵母表达的prME VLPs可有效诱导JEV中和抗体的产生。

图5 透射电镜观察毕赤酵母分泌表达JEVprME蛋白
3 讨论
本研究实现了JEV prME蛋白在毕赤酵母X33中的分泌表达,纯化浓缩后的目的蛋白含量约为150 μg/mL。尽管毕赤酵母分泌表达的JEV prME蛋白没有发生类似哺乳动物细胞中表达产物prM与E之间的酶解切割,但JEVprME蛋白在毕赤酵母分泌表达过程中仍可自发组装成病毒样颗粒。酵母分泌表达的JEV prME VLPs诱导免疫小鼠产生了较高水平的JEV特异性中和抗体。从而为研制新型的流行性乙型脑炎亚单位疫苗提供新的思路。
JEV在翻译过程中首先产生多聚蛋白,然后被病毒编码的NS3蛋白酶和宿主细胞弗林蛋白酶等切割为C、prM和E共3个结构蛋白以及NS1等7种非结构蛋白[10]。prM和E被宿主细胞弗林蛋白酶切割后,共同组装成病毒的囊膜,在病毒的成熟过程中pr被进一步酶解[11-12]。本研究发现酵母分泌表达JEV prME重组蛋白过程中prM与E不能被有效水解切割,可能是因为毕赤酵母不表达弗林蛋白酶。但这并没有影响prME蛋白在酵母菌内的折叠组装,在电镜下观察到毕赤酵母X33表达上清及纯化后的目的蛋白均存在直径为30–50 nm的病毒样颗粒,表明prME重组蛋白在毕赤酵母X33中可自发组装成VLPs。
研究还发现,与pPICZa-prME/X33相比,pPICZa-SprME/X33分泌表达prME蛋白的产量显著提高。因此,尽管pPICZa-A表达载体带有醇氧化酶的信号肽编码基因,JEV Cap末端19个aa的信号肽序列促进了prME蛋白的分泌表达,可能与JEV prM蛋白自身信号肽促进prME蛋白早期正确折叠有关。
本研究中毕赤酵母X33分泌表达JEVprME蛋白纯化浓缩后浓度约为150 μg/mL,最初的表达量不够理想,还不能满足规模发酵生产的要求。接下来的研究中,我们将通过Zeacin抗性筛选含多拷贝目的基因的酵母菌株、信号肽的优化、表达基因密码子毕赤酵母偏嗜性改造等多个途径进一步探究如何提高JEVprME蛋白的表达量[19, 23-24]。此外,我们设想用毕赤酵母X33共表达弗林蛋白酶和JEV prME蛋白,使prME蛋白能有效地被水解成M和E蛋白,进而使prM与 E蛋白组装形成VLP,在结构和形态上与天然病毒颗粒更相似。
将毕赤酵母表达的prME VLPs单次免疫小鼠后,ELISA检测结果表明小鼠在接种1周后即出现JEV特异性抗体明显转阳,并逐渐上升,3 wpi达到高峰,并维持抗体阳性较长时间,并且被免小鼠血清抗体具有中和JEV活性。该结果表明毕赤酵母分泌表达的JEV prME VLPs具有与天然病毒相似的免疫原性,与文献报道的酵母表达DENV、Chikungunya VLPs免疫效果相似[22, 25-26]。此外,毕赤酵母表达的JEV prME VLPs具有快速诱导机体产生抗体的特性,在应用于紧急免疫接种的情况下更有优势。
本研究还鉴定了核酸佐剂配伍JEV prME VLPs免疫小鼠的效果,结果表明,核酸佐剂有很好的免疫增强功能,可诱导小鼠产生更强的免疫应答。VLPs是纯蛋白抗原,不能有效刺激细胞模式识别受体、激发先天性免疫应答,核酸佐剂的配伍可弥补其中不足。后继的试验将具体研究被免小鼠细胞免疫应答效果。
综上所述,本研究发现毕赤酵母表达JEVprME蛋白虽不能发生水解切割,但仍可形成VLPs并诱导免疫小鼠产生较高水平中和抗体,从而为今后研制JEV亚单位疫苗抗原提供新思路。
[1] van den Hurk AF, Ritchie SA, Mackenzie JS. Ecology and geographical expansion of Japanese encephalitis virus. Annu Rev Entomol, 2009, 54(1): 17–35.
[2] Tsai WY, Hsieh SC, Lai CY, et al.C-terminal helical domains of dengue virus type 4 E protein affect the expression/stability of prM protein and conformation of prM and E proteins. PLoS ONE, 2012, 7(12): e52600.
[3] Halstead SB, Jacobson J. Japanese encephalitis. Adv Virus Res, 2003, 61: 103–138.
[4] Shahana PV, Das D, Gontu A, et al. Efficient production of Tymovirus like particles displaying immunodominant epitopes of Japanese encephalitis virus envelope protein. Protein Expr Purif, 2015, 113: 35–43.
[5] Hua RH, Li YN, Chen ZS, et al. Generation and characterization of a new mammalian cell line continuously expressing virus-like particles of Japanese encephalitis virus for a subunit vaccine candidate. BMC Biotechnol, 2014, 14: 62.
[6] Konishi E, Pincus S, Paoletti E, et al. Mice immunized with a subviral particle containing the Japanese encephalitis virus prM/M and E proteins are protected from lethal JEV infection. Virology, 1992, 188(2): 714–720.
[7] Kwon WT, Lee WS, Park PJ, et al. Protective immunity of-expressed recombinant envelope protein of Japanese encephalitis virus. J Microbiol Biotechnol, 2012, 22(11): 1580–1587.
[8] Keelapang P, Sriburi R, Supasa S, et al. Alterations of pr-M cleavage and virus export in pr-M junction chimeric dengue viruses. J Virol, 2004, 78(5): 2367–2381.
[9] Pugachev KV, Guirakhoo F, Mitchell F, et al. Construction of yellow fever/St. Louis encephalitis chimeric virus and the use of chimeras as a diagnostic tool. Am J Trop Med Hyg, 2004, 71(5): 639–645.
[10] Sato T, Takamura C, Yasuda A, et al. High-level expression of the Japanese encephalitis virus E protein by recombinant vaccinia virus and enhancement of its extracellular release by the NS3 gene product. Virology, 1993, 192(2): 483–490.
[11] Kim JM, Yun SI, Song BH, et al. A single N-linked glycosylation site in the Japanese encephalitis virus prM protein is critical for cell type-specific prM protein biogenesis, virus particle release, and pathogenicity in mice. J Virol, 2008, 82(16): 7846–7862.
[12] Konishi E, Mason PW. Proper maturation of the Japanese encephalitis virus envelope glycoprotein requires cosynthesis with the premembrane protein. J Virol, 1993, 67(3): 1672–1675.
[13] Garcea RL, Gissmann L. Virus-like particles as vaccines and vessels for the delivery of small molecules. Curr Opin Biotechnol, 2004, 15(6): 513–517.
[14] Chackerian B. Virus-like particles: flexible platforms for vaccine development. Expert Rev Vaccines, 2007, 6(3): 381–390.
[15] Wispelaere MD, Ricklin M, Souque P, et al. A lentiviral vector expressing Japanese encephalitis virus-like particles elicits broad neutralizing antibody response in pigs. Plos Neglect Trop D, 2015, 9(10): e0004081.
[16] Koutsky LA, Ault KA, Wheeler CM, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med, 2002, 347(21): 1645–1651.
[17] Scolnick EM, McLean AA, West DJ, et al. Clinical evaluation in healthy adults of a hepatitis B vaccine made by recombinant DNA. JAMA, 1984, 251(21): 2812–2815.
[18] Pushko P, Tumpey TM, Bu F, et al. Influenza virus-like particles comprised of the HA, NA, and M1 proteins of H9N2 influenza virus induce protective immune responses in BALB/c mice. Vaccine, 2005, 23(50): 5751–5759.
[19] Kramer RM, Zeng YH, Sahni N, et al. Development of a stable virus-like particle vaccine formulation against Chikungunya virus and investigation of the effects of polyanions. J Pharm Sci, 2013, 102(12): 4305–4314.
[20] Pattenden LK, Middelberg APJ, Niebert M, et al. Towards the preparative and large-scale precision manufacture of virus-like particles. Trends Biotechnol, 2005, 23(10): 523–529.
[21] Liu WQ, Jiang HN, Zhou JM, et al. Recombinant dengue virus-like particles from: efficient production and immunological properties. Virus Genes, 2010, 40(1): 53–59.
[22] Saraswat S, Athmaram TN, Parida M, et al. Expression and characterization of yeast derived Chikungunya virus like particles (CHIK-VLPs) and its evaluation as a potential vaccine candidate. PLoS Neglect Trop D, 2016, 10(7): e0004782.
[23] Purdy DE, Chang GJ. Secretion of noninfectious dengue virus-like particles and identification of amino acids in the stem region involved in intracellular retention of envelope protein. Virology, 2005, 333(2): 239–250.
[24] Sugrue RJ, Cui TA, Xu QR, et al. The production of recombinant dengue virus E protein usingand. J Virol Methods, 1997, 69(1/2): 159–169.
[25] Wei HY, Jiang LF, Xue YH, et al. Secreted expression of dengue virus type 2 full-length envelope glycoprotein in. J Virol Methods, 2003, 109(1): 17–23.
[26] Guzmán MG, Rodríguez R, Rodríguez R, et al. Induction of neutralizing antibodies and partial protection from viral challenge in Macaca fascicularis immunized with recombinant dengue 4 virus envelope glycoprotein expressed in. Am J Trop Med Hyg, 2003, 69(2): 129–134.
(本文责编 郝丽芳)
Secreted expression of Japanese encephalitis virus prME inand immunogenicity evaluation of the virus-like particles in mice
Peng Zhao, Ya Jiang, Jingman Wang, Haojie Fan, and Ruibing Cao
Key Laboratory of Animal Bacteriology, Ministry of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
The study was to express prME protein of Japanese encephalitis virus (JEV) inandthen to evaluate the immunological properties of the recombinant protein in mice, so as to explore a new way for subunit vaccine development of JEV. The JEVgene was amplified by RT-PCR with genome RNA of JEV vaccine strain SA14-14-2 and subcloned into pPICZa-A vector, designated as pPICZα-prME. pPICZα-SprME was constructed same as pPICZα-prME besides with the additional 19 Aa signal peptides coding gene of the JEV cap protein C terminal. Thelinearized expression vector was integrated into the genome ofX33 under the control of the alcohol oxidase (AOX1) promoter and induced with methanol during fermentation expression. The expression of JEV prME protein was identified by SDS-PAGE and Western blotting, and then it was purified by S-400 High Resolution HiPrep 16/60 Sephacry. The expressed products ofwere visualized by electron microscopy. In the immunization test, four groups of four-week old female mice were immunized subcutaneously with different doses purified JEV prME protein with complete Freund’s adjuvant at a volumetric ratio of 1:1 and a control group was injected with sterile PBS. 10 μg/dose purified JEV prME protein mixing different doses nucleic acid adjuvant (Naa) was vaccinated in mice as the same mode. SDS-PAGE and Western blotting indicate that JEV prME was not cleaved between prM and E during secreted expression inThe purified recombinant prME was eluted in the first eluting peak which indicated that its molecular weight about 1×106Da to 20×106Da and may form a multimeric. Both the culture supernatant and the purified protein, examined by electron microscopy, we found to contain JEV virus like particles (VLPs) with diameters of 30–50 nm. The anti-JEV VLPs antibody titration reached peak at 3 wpi and still maintained in mice at 7 wpi inoculated with 10 μg and 15 μgprME. The strong antibody response was observed when the mice immunized with prME mixing nucleic acid adjuvant, which elicited high neutralizing antibody titer among 1:80 to 1:160. In conclusion, although JEV prME protein expressed inwas not cleaved, which formed VLPs and showed efficient immunological properties in mice experiments.
Japanese encephalitis virus,prME protein,, virus like particles, immunological properties
January 21, 2017; Accepted:April 5, 2017
Ruibing Cao. Tel: +86-25-84397619; E-mail: crb@njau.edu.cn
10.13345/j.cjb.170026
Supported by:Special Funds for Agro-scientific Research in the Public Interest (No. 201203082).
国家公益性行业科研专项(No. 201203082) 资助。

