红凤菜花色苷三种提取方法的工艺优化和比较
,少平,,少华,,*
(1.福建省农业科学院亚热带农业研究所,福建漳州 363005; 2.宁波市食品检验检测研究院,浙江宁波 315048)
红凤菜花色苷三种提取方法的工艺优化和比较
张帅1,张少平1,郑云云1,张少华2,郑开斌1,*
(1.福建省农业科学院亚热带农业研究所,福建漳州 363005; 2.宁波市食品检验检测研究院,浙江宁波 315048)
本研究分别采用传统水浴提取法、微波辅助提取法和超声波辅助提取法对红凤菜花色苷进行提取并作工艺优化。以添加了0.6%柠檬酸的20%乙醇溶液为提取溶剂,水浴提取法的最优提取工艺参数为料液比1∶11 (g/mL),提取温度80 ℃,提取时间120 min,花色苷提取物得率7.70%,色价1.44;微波辅助提取法的最优提取工艺参数为料液比1∶7 (g/mL),提取功率700 W,提取时间2.0 min,花色苷提取物得率6.65%,色价1.26;超声波辅助提取法的最优工艺参数为料液比1∶11 (g/mL),功率270 W,提取温度80 ℃,提取时间90 min,花色苷提取物得率8.25%,色价1.16。三种提取方法中,微波提取法的提取时间最短,超声波提取法的花色苷提取物得率最高,传统水浴法的花色苷提取物色价最高。
红凤菜,花色苷,水浴,微波,超声波
菊科三七草属红凤菜[Gynurabicolor(Roxb. ex Willd.)DC.],又名紫背天葵、紫背菜、观音菜等[1],其茎表皮和叶背面富含花色苷,具有抗氧化[2]、抗炎[3]、提高免疫力[4]、诱导白血病细胞HL60[5]和结肠癌细胞HCT116凋亡[6]、促进生物铁利用率[7]和降血糖[8]等功效,在亚洲作为药食两用蔬菜栽培。然而,由于红凤菜具有特殊生味,不利于作为蔬菜直接食用,因此,开展红凤菜功能性成分提取工作十分必要。研究表明,红凤菜花色苷比紫甘蓝、紫苏、紫薯的花色苷稳定性更高,清除自由基能力比矢车菊素-3-葡萄糖苷更强,且安全无毒,是一种极具潜力的天然食品色素,将红凤菜花色苷提取物添加于食品中,不仅能赋予食品良好色泽,同时可以保鲜和增加营养价值[9-11]。
目前关于红凤菜花色苷提取工艺的研究有少量报道[12-13],提取剂从蒸馏水、乙醇到甲醇不一,提取原料亦有干品和鲜品的差别,因此很难准确比较不同提取方法的优劣。本实验以安全无毒害的柠檬酸-乙醇溶液为提取剂,采用水浴浸提法、微波辅助提取法和超声波辅助提取法3种不同的方法对新鲜红凤菜进行花色苷提取,在单因素实验的基础上通过正交设计对提取工艺进行优化,拟获得经济、科学的提取条件,为红凤菜资源开发及其功能性色素在食品工业中的应用提供参考。
1 材料与方法
1.1材料与仪器
红凤菜 采摘自福建省农业科学院亚热带农业研究所实验田;一水柠檬酸(提取剂用) 食品级,购自潍坊英轩实业有限公司;无水乙醇、磷酸氢二钠、一水柠檬酸(缓冲液用) 分析纯,购自西陇化工。
UV-1240型紫外分光光度计 日本岛津;BS110S型分析天平 北京赛多利斯仪器系统有限公司;HH-2型恒温水浴锅 金坛市新航仪器厂;WP700型微波炉 乐金电子(天津)电器有限公司;GZX-9246MBE型电热鼓风干燥箱 上海博讯实业有限公司;FD-1型冷冻干燥机 北京博医康实验仪器有限公司;KQ300-DE型超声波清洗机 昆山舒美超声仪器有限公司。
1.2实验方法
1.2.1 红凤菜花色苷的提取 红凤菜叶片洗净擦干剪成约8 mm×8 mm小块,准确称量10.0 g,加入一定量柠檬酸-乙醇溶液为提取剂,分别采用水浴浸提法、超声波辅助提取法、微波辅助提取法进行提取,静置至室温,100目尼龙网布过滤,以提取剂定容,测定提取液吸光度。
1.2.2 提取剂和检测波长的确定 为了保障红凤菜花色苷提取液在食品加工中的安全性和稳定性,本实验采用柠檬酸-乙醇溶液为提取剂。参考刘伶文等[13]方法,乙醇浓度采用20%。在料液比1∶9 (g/mL),60 ℃水浴提取90 min条件下,考察不同质量浓度柠檬酸(0.2%、0.4%、0.6%、0.8%、1.0%)提取时提取液最大吸收波长和吸光值的变化,选择具有最大吸光值的柠檬酸浓度配制提取剂,对应的最大吸收波长选定为检测波长。
1.2.3 水浴提取法 花色苷浓度与溶液吸光度呈线性关系[12],因此,通过提取液吸光度的大小比较可知提取液中花色苷含量的高低,即提取量的高低,从而得到因素水平对花色苷提取效果的影响。固定提取温度60 ℃,提取时间90 min,考察不同料液比(1∶5、1∶7、1∶9、1∶11、1∶13 g/mL)对花色苷提取量的影响,加入提取剂使提取液体积统一至130 mL后在λmax处测定吸光值;固定料液比1∶11 (g/mL),提取时间90 min,考察不同提取温度(40、50、60、70、80 ℃)对花色苷提取量的影响,加入提取剂使提取液体积统一至110 mL后在λmax处测定吸光值;固定提取温度80 ℃,料液比1∶11 (mg/mL),考察不同提取时间(30、60、90、120、150、180 min)对花色苷提取量的影响。
在单因素实验基础上,以L9(34)正交实验确定红凤菜花色苷水浴浸提法的最佳提取工艺条件,因素水平如表1所示。
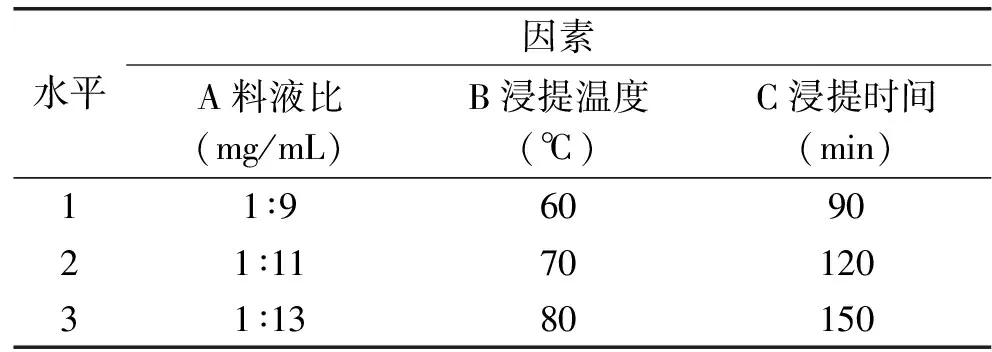
表1 红凤菜花色苷的水浴浸提法正交实验因素水平Table 1 Factors and standards of orthogonal test of water bath extraction of anthocyanidins from Gynura bicolor
1.2.4 微波辅助提取法 固定微波功率420 W,微波时间1.5 min,考察不同料液比(1∶5、1∶7、1∶9、1∶11、1∶13 g/mL)对花色苷提取量的影响;固定微波时间1.5 min,料液比1∶7 (g/mL),考察不同微波功率(140、280、420、560、700 W)对花色苷提取量的影响;固定料液比1∶7 (g/mL),微波功率560 W,考察微波时间(0.5、1.0、1.5、2.0、2.5、3.0 min)对花色苷提取量的影响。
在单因素实验基础上,以L9(34)正交实验确定红凤菜花色苷微波辅助提取法的最佳提取工艺条件,因素水平如表2所示。提取后加入提取剂使提取液体积统一至90 mL后测定吸光值。

表2 红凤菜花色苷的微波辅助提取法正交实验因素水平Table 2 Factors and standards of orthogonal test of microwave-assisted extraction of anthocyanidins from Gynura bicolor
1.2.5 超声波辅助提取法 固定超声波功率210 W,提取温度60 ℃,超声波时间60 min,考察不同料液比(1∶5、1∶7、1∶9、1∶11、1∶13 g/mL)对花色苷提取量的影响;固定提取温度60 ℃,提取时间60 min,料液比1∶11 (g/mL),考察不同超声波功率(180、210、240、270、300 W)对花色苷提取量的影响;固定超声波功率300 W,提取时间60 min,料液比1∶11 (g/mL),考察不同提取温度(40、50、60、70、80 ℃)对花色苷提取量的影响;固定超声波功率300 W,料液比1∶11 (g/mL),提取温度80 ℃,考察不同超声时间(30、60、90、120、150 min)对花色苷提取量的影响。
在单因素实验基础上,以L9(34)正交实验确定红凤菜花色苷超声波辅助提取的最佳工艺条件,因素水平如表3所示。
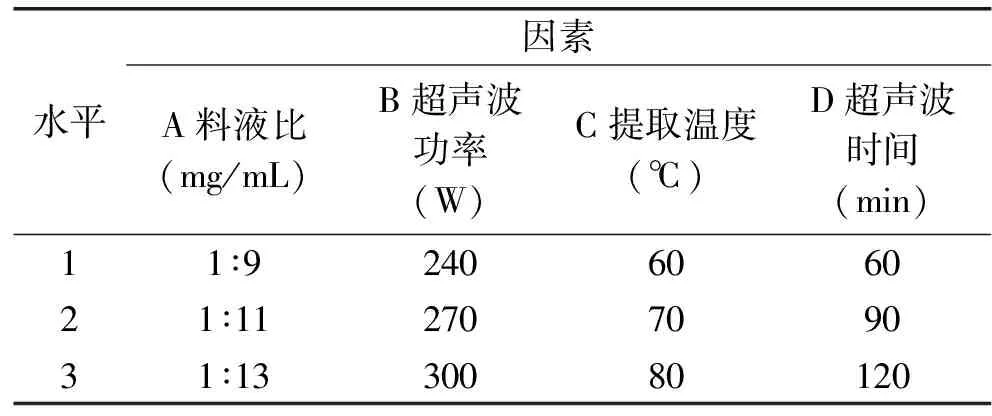
表3 红凤菜花色苷的超声波辅助提取法正交实验因素水平Table 3 Factors and standards of orthogonal test of ultrasonic-assisted extraction of anthocyanidins
1.2.6 三种提取方法的比较 按照正交实验得到的最佳提取工艺条件,采用水浴提取法、微波辅助提取法、超声波辅助提取法对红凤菜花色苷进行提取,比较花色苷提取物的得率和色价。
1.2.7 花色苷提取物得率的测定 将红凤菜花色苷提取液浓缩烘干至恒重,称量重量,按下式计算:
1.2.8 色价的测定 参考国标中食品色素葡萄皮红的色价测定方法[14]。花色苷提取液冷冻干燥,称取一定量(精确到0.0001 g)加入pH3.0柠檬酸缓冲液定容至100 mL(0.2 mol/L Na2HPO3∶0.1 mol/L柠檬酸=4.11∶15.89,V/V),混匀,以缓冲液做空白,在最大吸收波长处(536 nm)测定样品的吸光值,吸光值控制在0.3~0.7范围内,否则调整样品液浓度,再重新测定。按下式计算色价:

1.2.9 数据处理 每组数据重复三次测定,以DPS对实验数据进行分析,以Origin进行作图。
2 结果与分析
2.1提取溶剂及检测波长的确定
采用酸性溶液提取有助于提高花色苷的稳定性。本实验以柠檬酸-乙醇溶液为红凤菜花色苷的提取剂。柠檬酸能降低体系pH,提高体系中H+浓度,促进花色苷向黄烊阳离子方向平衡;此外柠檬酸与花色苷的羟基发生酰化反应,降低其反应活性,从而提高花色苷的稳定性[15]。

表4 不同柠檬酸浓度下提取液的最大吸收波长Table 4 Maximum absorption wavelength of extract under different concentration of citric acid
为确定提取溶剂(柠檬酸-乙醇)中柠檬酸的最适提取浓度和相对应的检测波长,本实验测定了柠檬酸浓度为0.2%~1.0%范围时红凤菜花色苷提取液的最大吸收波长及对应的吸光值。结果如表4和图1所示,在柠檬酸浓度为0.2%、0.4%、0.6%、0.8%、1.0%时,红凤菜花色苷提取液的最大吸收波长保持536 nm不变;对应的吸光值在一定范围内随着柠檬酸浓度升高,花色苷吸光值逐渐增大;当柠檬酸浓度大于0.6%时,吸光值没有显著变化。因此提取剂确定为20%乙醇与0.6%柠檬酸的混合溶液,检测波长为536 nm。
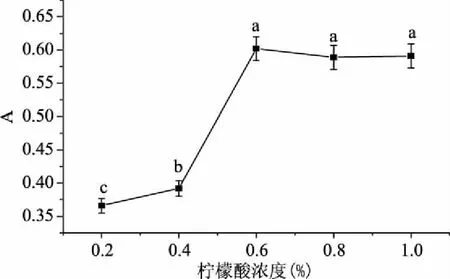
图1 不同柠檬酸浓度对红凤菜花色苷提取效果的影响Fig.1 Effects of different concentration of citric acid on extraction of anthocyanin from Gynura bicolor注:不同小写字母代表在水平比较时有显著差异,p<0.05,图2~图6同。
2.2红凤菜花色苷的水浴提取
2.2.1 单因素实验
2.2.1.1 料液比对花色苷提取量的影响 结果如图2所示,在料液比1∶5~1∶11 (g/mL)范围内时,随提取剂增加吸光度升高,即花色苷提取量增大,这是因为在花色苷提取过程中,红凤菜细胞内外浓度差减小,会使提取速度下降,因此在一定范围内,提取剂的增加有利于花色苷的溶出。当料液比为1∶11 (g/mL)时,继续增大提取剂体积,花色苷提取量无显著提高甚至有所下降,因此选择料液比1∶11 (g/mL)较合适。
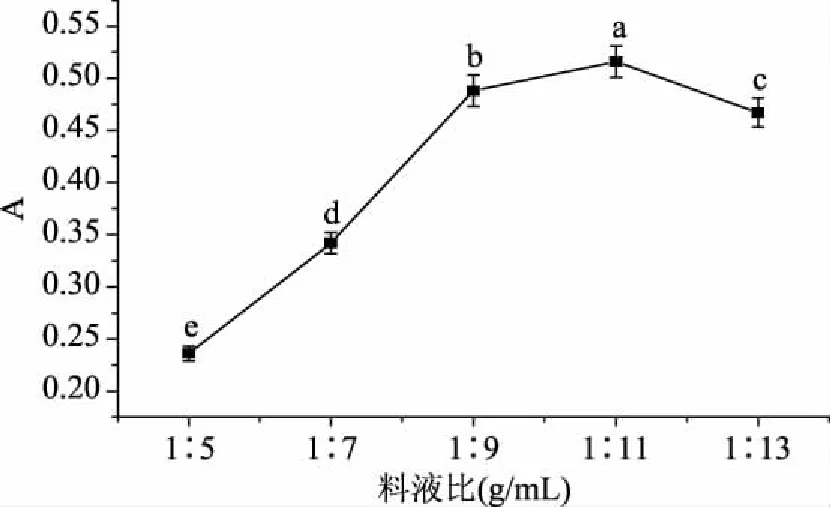
图2 不同料液比对红凤菜花色苷提取量的影响Fig.2 The effect of material-solvent ratio on the extraction of anthocyanidins from Gynura bicolor
2.2.1.2 提取温度对花色苷提取量的影响 结果如图3所示,随着温度升高,红凤菜花色苷的提取量增大。这是由于温度升高对叶片细胞壁和细胞膜的破坏力增大,同时分子运动速度加快,促使红凤菜花色苷溶出,提取量迅速升高。尽管大量研究表明花色苷对热不稳定,其最适提取温度在60 ℃以下[16-18],但本实验结果显示,在80 ℃范围内红凤菜花色苷的提取量随温度升高持续提高,对热稳定性较好,这得益于红凤菜花色苷的多酰基化结构[10]。

图3 不同提取温度对花色苷提取量的影响Fig.3 The effect of temperature on the extraction of anthocyanidins from Gynura bicolor
2.2.1.3 提取时间对花色苷提取量的影响 结果如图4所示,提取时间在30~90 min时,随着提取时间增加,红凤菜细胞壁和细胞膜被破坏,细胞内的物质流出,花色苷提取量迅速提高;当提取时间继续增加,细胞内外渗透压减小,提取速率降低;当提取时间大于120 min,红凤菜花色苷提取量没有显著增加,表明此时提取已经趋于平衡。
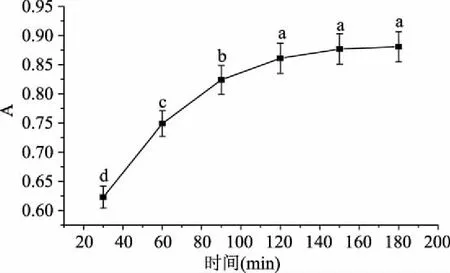
图4 不同提取时间对花色苷提取量的影响Fig.4 The effect of extraction time on the extraction of anthocyanidins from Gynura bicolor
2.2.2 正交实验 由表5和表6正交实验结果分析可知,最优因素水平组合为A2B3C2,即料液比1∶11 (mg/mL),提取温度80 ℃,提取时间120 min。验证实验表明在该最优组合下提取液吸光值为0.822。三个因素对提取液吸光度的影响顺序依次是温度>时间>料液比,表6显示温度为显著影响因子(p=0.0230<0.05)。
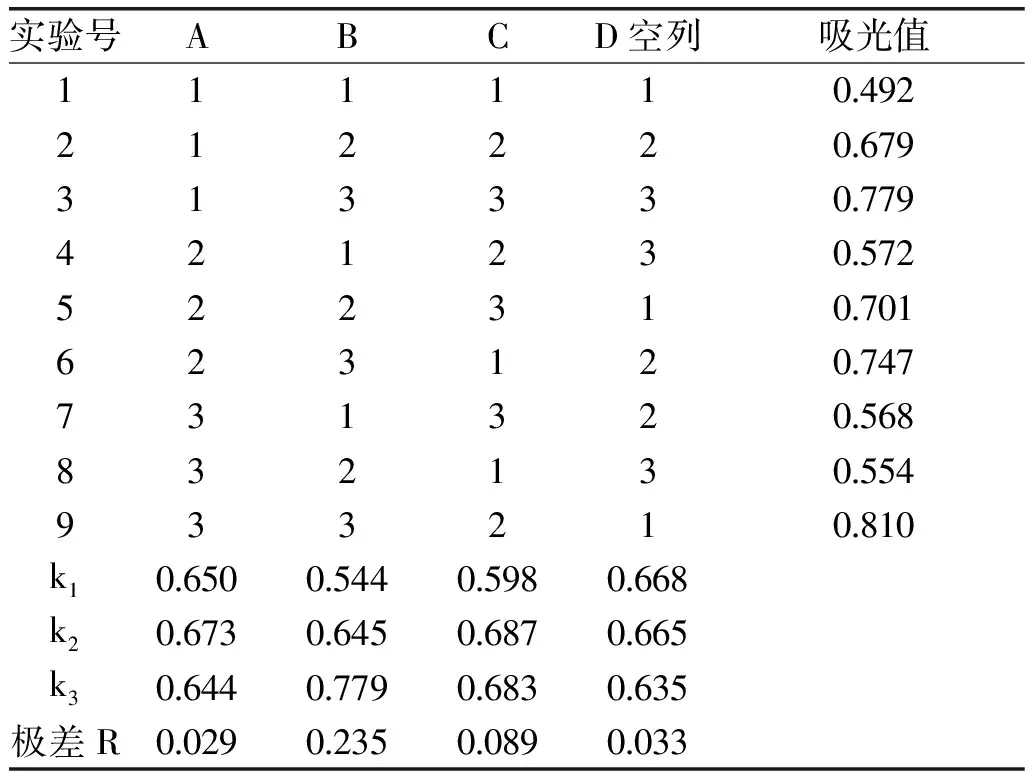
表5 红凤菜花色苷的水浴浸提法正交实验结果Table 5 Results of orthogonal test of water bath extraction of anthocyanidins from Gynura bicolor
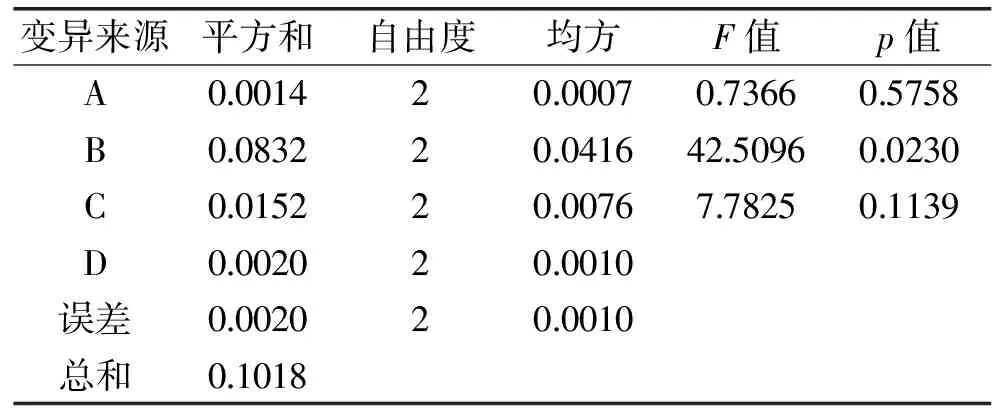
表6 方差分析Table 6 Analysis of variance
2.3红凤菜花色苷的微波辅助提取
2.3.1 单因素实验 实验结果如图5所示,微波辅助提取红凤菜花色苷的单因素实验结果分别为料液比1∶7 (mg/mL),微波功率560 W,提取时间2.0 min,其吸光度最高。
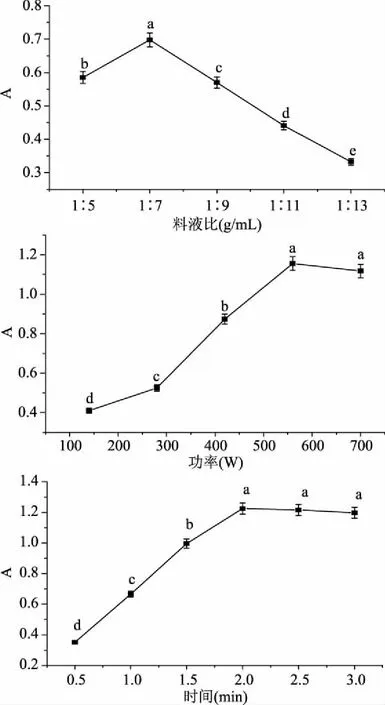
图5 微波提取法三种影响因素的实验结果Fig.5 The effects of three factors respectively with microwave-assisted extraction on the extraction of anthocyanidins from Gynura bicolor
2.3.2 正交实验 由表7和表8正交实验结果分析可知,最优因素水平组合为A2B3C2,即料液比1∶7 (mg/mL),提取功率700 W,提取时间2 min。验证实验表明在该最优组合下提取液吸光值为0.926。三个影响因素对提取液吸光度的影响顺序依次是料液比>功率>时间。其中料液比(p=0.0039<0.01)为极显著影响因子,微波功率(p=0.0235<0.05)为显著影响因子。

表7 红凤菜花色苷的微波辅助提取法正交实验结果Table 7 Results of orthogonal test of microwave-assisted extraction of anthocyanidins from Gynura bicolor

图6 超声波辅助提取四种因素对花色苷提取的影响Fig.6 The effects of four factors respectively with ultrasonic-assisted extraction on the extraction of anthocyanidins from Gynura bicolor

表8 方差分析Table 8 Analysis of variance
2.4红凤菜花色苷的超声波辅助提取
2.4.1 单因素实验 实验结果如图6所示。超声波辅助提取红凤菜花色苷的单因素实验条件分别为料液比1∶11 (mg/mL),超声波功率300 W,提取温度80 ℃,超声波时间90 min,其吸光度最高。
2.4.2 正交实验 由表9和表10正交实验结果分析可知,最优因素水平组合为A2B2C3D2,即料液比1∶11(mg/mL),功率270 W,提取温度80 ℃,提取时间90 min。验证实验表明在该最优组合下提取液吸光值为0.831。四个影响因素对提取液吸光度的影响顺序依次是提取温度>超声波时间>料液比>超声波功率,其中温度(p=0.0198<0.05)和时间(p=0.0384<0.05)为显著影响因子。

表9 红凤菜花色苷的超声波辅助提取法正交实验结果Table 9 Results of orthogonal test of ultrasonic-assisted extraction of anthocyanidins
2.5三种提取方法的比较

表11 三种提取方法的比较Table 11 The comparison of three extraction methods on the extraction of anthocyanidins
注:竖排不同上标小写字母表示差异显著(p<0.05)。
水浴浸提法、微波辅助提取法和超声波辅助提取法对红凤菜花色苷提取效果的比较如表11所示。
传统的水浴浸提法所需时间最长,需要120 min,超声波辅助提取法和微波辅助提取法能显著缩短红凤菜花色苷的提取时间,尤其是微波辅助提取法,仅需2.0 min。表明三种提取方法中,微波辅助提取法是最合适红凤菜花色苷快速提取的方法。快速提取是微波提取技术的典型特征之一,微波辐射穿透力强,其辐射能产生的热效应能迅速引起细胞结构的破坏,促进目标组分在溶剂中扩散[19]。这三种提取方法在提取时间上的显著差异也再次表明,温度是影响红凤菜花色苷提取速率极关键的因素。
花色苷提取物的得率由大到小是超声波辅助提取法>水浴浸提法>微波辅助提取法。提取物的色价却是水浴浸提法最高,为1.44,超声波辅助提取法最低,为1.16。
色素的色价除了与花色苷本身的结构和浓度相关外,还受到体系中的金属离子、酶、有机酸、类黄酮、糖及其降解产物等多种成分的影响[20]。红凤菜中除了花色苷外,还含有类胡萝卜素、原儿茶酸、山奈酚、槲皮素、叶黄素、黄酮等组分[21-22],这些组分对花色苷具有辅色或减色的效果,而含量的差异使得辅色或减色的效果有差异,在混合体系中作用则更为复杂,这些原因使得提取物的色价不同[23]。有文献显示,微波提取法和超声波法均不会改变花色苷的化学组成[24-25],若该结论在本实验中适用,则引起三种提取方法所得的色素提取物色价的不同,主要是由于各组分的含量不一引起的。另,由于红凤菜叶片的结构特点,即花色苷分布在叶背一薄层的细胞中,与其他常见的花色苷提取原料如蓝莓相比(提取物色价10.85)[26],红凤菜色素提取物色价不高,在提取后可通过进一步纯化提高色价。
3 结论
以添加了0.6%柠檬酸的20%乙醇溶液为提取溶剂,经正交优化实验后得到新鲜红凤菜花色苷的最优提取工艺。
水浴提取法:三个影响因素对红凤菜花色苷提取液吸光度的影响顺序依次是温度>时间>料液比,最优因素水平组合为料液比1∶11 (mg/mL),提取温度80 ℃,提取时间120 min。花色苷提取物得率7.70%,色价1.44。
微波辅助提取法:三个影响因素对红凤菜花色苷提取液吸光度的影响顺序依次是料液比>功率>时间,最优因素水平组合为料液比1∶7 (mg/mL),提取功率700 W,提取时间2.0 min。花色苷提取物得率6.65%,色价1.26。
超声波辅助提取法:四个影响因素对红凤菜花色苷提取液吸光度的影响顺序依次是温度>时间>料液比>功率,最优因素水平组合为料液比1∶11 (mg/mL),功率270 W,提取温度80 ℃,提取时间90 min。花色苷提取物得率8.25%,色价1.16。
本提取实验中三种方法各有特点,研究者或企业可根据提取目的选择适合的提取方法。传统水浴法设备要求简单,成本低,且得到的花色苷产品色价高,即品质高;而微波提取法在快速提取方面有无可比拟的显著优势,在短时间内即可获得很大的产量,适合扩大化生产中使用;超声波法尽管提取得率最高,但色价最低,品质不高,与微波法相比提取效率也无优势,因此在色素工业化生产中不推荐使用超声波法。
[1]中国科学院中国植物志编辑委员会.中国植物志第七十七卷第一分册[M].北京:科学出版社,1999.
[2]Lu C H,Yang H C,Chang W L,et al. Development of beverage product from Gynura bicolor,and evaluation of its antioxidant activity[J]. Genomic Medicine Biomarkers and Health Sciences,2012,4(4):131-135.
[3]Wu C C,Lii C K,Liu K L,et al. Antiinflammatory activity of Gynura bicolor(Hong Feng Cai)ether extract through inhibits nuclear factor kappa B activation[J]. Journal of Traditional and Complementary Medicine,2013,3(1):48-52.
[4]Hsieh S L,Wu C C,Liu C H,et al. Effects of the water extract ofGynurabicolor(Roxb. & Willd.)DC on physiological and immune responses to Vibrio alginolyticus infection in white shrimp(Litopenaeusvannamei)[J]. Fish and Shellfish Immunology,2013,35(1):18-25.
[5]Hayashi M,Iwashita K,Katsube N,et al. Kinjiso(GynurabicolorDC.)colored extract induce apoptosis in HL60 leukemia cells[J]. Nippon Shokuhin Kagaku Kogaku Kaishi,2010,49(8):519-526.
[6]Teoh W Y,Tan H P,Ling S K,et al. Phytochemical investigation ofGynurabicolorleaves and cytotoxicity evaluation of the chemical constituents against HCT 116 cells[J]. Natural Product Research,2016,30(4):448-451.
[7]Wu C C,Chang W L,Lu C H,et al. Effects of extracts fromGynurabicolor,(Roxb. & Willd.)DC. on iron bioavailability in rats[J]. Journal of Food & Drug Analysis,2015,23(3):425-432.
[8]Chen J,Mangelinckx S,Adams A,et al. Chemical constituents from the aerial parts ofGynurabicolor[J]. Natural Product Communications,2012,7(12):1563-1564.
[9]Teoh W Y,Sim K S,Moses Richardson J S,et al. Antioxidant capacity,cytotoxicity,and acute oral toxicity of Gynura bicolor[J]. Evidence-Based Complementary and Alternative Medicine,2013(2013):10.
[10]Shimizu Y,Imada T,Zhang H,et al.Identification of novel poly-acylated anthocyanins fromGynurabicolorleaves and their antioxidative activity[J]. Food Science and Technology Research,2010,16(5):479-486.
[11]Shimizu Y,Imada T,Ohno T,et al. Characteristics ofGynurabicolorDC. color and its applications as a novel natural food color[J]. Nippon Shokuhin Kagaku Kogaku Kaishi,2010,57(12):539-545.
[12]庄莹莹,彭妙会,李雁群.红凤菜紫色素提取和分离[J].食品工业科技,2012,33(13):288-290.
[13]刘伶文,孙蕊,毛俊梅,等.超声波辅助提取紫背天葵红色素[J].应用化工,2015(6):1054-1056.
[14]GB 28313-2012,食品安全国家标准食品添加剂葡萄皮红[S].
[15]Ducamp-Collin M N,Ramarson H,Lebrun M,et al. Effect of citric acid and chitosan on maintaining red colouration of litchi fruit pericarp[J]. Postharvest Biology and Technology,2008,49(2):241-246.
[16]曾绍校,彭彬,陈洁,等.响应面法优化西番莲果皮花色苷提取工艺[J].中国食品学报,2014,14(1):104-113.
[17]李芳,阮长青,汤凯欣,等.黑小豆种皮花色苷的提取及体外抗氧化活性研究[J].天然产物研究与开发,2016(4):561-567.
[18]Chen M,Zhao Y,Yu S. Optimisation of ultrasonic-assisted extraction of phenolic compounds,antioxidants,and anthocyanins from sugar beet molasses[J]. Food Chemistry,2015,172:543-550.
[19]Zheng X,Xu X,Liu C,et al. Extraction characteristics and optimal parameters of anthocyanin from blueberry powder under microwave-assisted extraction conditions[J]. Separation and Purification Technology,2013,104(5):17-25.
[20]Sari P,Wijaya C H,Sajuthi D,et al. Colour properties,stability,and free radical scavenging activity of jambolan(Syzygiumcumini)fruit anthocyanins in a beverage model system-Natural and copigmented anthocyanins[J]. Food Chemistry,2012,132(4):1908-1914.
[21]陈剑,MANGELINCKX S,李维林,等.红凤菜地上部分的化学成分[J].植物资源与环境学报,2014,23(2):114-116.
[22]Chao C Y,Liu W H,Wu J J,et al. Phytochemical profile,antioxidative and anti-inflammatory potentials ofGynurabicolorDC.[J]. Journal of the Science of Food and Agriculture,2015,95(5):1088-1093.
[23]Sari P,Wijaya C H,Sajuthi D,et al. Colour properties,stability,and free radical scavenging activity of jambolan(Syzygiumcumini)fruit anthocyanins in a beverage model system-Natural and copigmented anthocyanins[J]. Food Chemistry,2012,132(4):1908-1914.
[24]Sun Y,Liao X,Wang Z,et al. Optimization of microwave-assisted extraction of anthocyanins in red raspberries and identification of anthocyanin of extracts using high-performance liquid chromatography - mass spectrometry[J]. European Food Research and Technology,2007,225(3):511-523.
[25]罗水忠,潘利华.超声辅助提取对蓝莓花青素提取率、抗氧化活性及化学组成的影响[J].食品工业科技,2015,36(8):235-239.
[26]郑红岩,于华忠,刘建兰,等.大孔吸附树脂对蓝莓花色苷的分离工艺[J].林产化学与工业,2014,34(4):59-65.
OptimizationandcomparisonofthreeextractionmethodsofanthocyaninfromGynurabicolor
ZHANGShuai1,ZHANGShao-ping1,ZHENGYun-yun1,ZHANGShao-hua2,ZHENGKai-bin1,*
(1.Institute of Subtropical Agriculture,Fujian Academy of Agricultural Sciences,Zhangzhou 363005,China; 2.Ningbo Institute for Food Control,Ningbo 315048,China)
In this study,traditional water bath extraction method(WBE),microwave-assisted extraction method(MAE)and ultrasonic-assisted extraction method(SAE)were adopted to extract anthocyanin from the leaves ofGynurabicolor(Roxb. ex Willd.)DC. respectively. 0.6% citric acid was added to 20% ethanol as extraction solvent,and the optimal extraction conditions of WBE were as follows:the ratio of material to liquid was 1∶11 (g/mL),the extraction temperature was 80 ℃,and the extraction time was 120 min. The yield of anthocyanin extract was 7.70% and the color value was 1.44. Meanwhile,the optimum extraction parameters of MAE were as follows:the ratio of material to liquid was 1∶7 (g/mL),the power was 700 W,the extraction time was 2.0 min,the yield of anthocyanin extract was 6.65% and the color value was 1.26. Besides,the optimum extraction parameters of SAE were as follows:the ratio of material to liquid was 1∶11 (g/mL),the power was 270 W,the extraction temperature was 80 ℃,the extraction time was 90 min,the yield of anthocyanin extract was 8.25% and the color value was 1.16. Among these three extraction methods,the MAE had the highest extraction efficiency,the SAE had the highest yield of pigment extract,and the WBE had the highest color value,however.
Gynurabicolor;anthocyanin;water bath;microwave;ultrasonic
2016-12-20
张帅(1989-),女,硕士,研究实习员,研究方向:植物功能性成分提取与应用,E-mail:zszs_yx@163.com。
*通讯作者:郑开斌(1966-),男,博士,研究员,研究方向:作物育种及品质分析,E-mail:409119296@qq.com。
福建省农业科学院青年人才创新基金(2015CX-16);福建省属公益类科研院所基本科研专项(2016R1012-4);福建省农业科学院科技创新PI项目(2016PI-2)。
TS201.1
:B
:1002-0306(2017)12-0270-07
10.13386/j.issn1002-0306.2017.12.049

