薏苡仁油β环糊精包合物的制备及其表征
,,, ,*
(1.扬州大学医学院,江苏扬州 225001;2.连云港中医药高等职业技术学校,江苏连云港 222007)

徐蓉蓉1,高垚垚1,周云龙2,胡荣1,*
(1.扬州大学医学院,江苏扬州 225001;2.连云港中医药高等职业技术学校,江苏连云港 222007)
采用饱和水溶液法制备薏苡仁油β-环糊精(β-CD)包合物;Box-Behnken响应面法优化并验证制备条件为:包合投料质量比(β-CD∶薏苡仁)为9∶1,包合温度45 ℃,包合时间6 h。通过SEM、DSC、FTIR、XRD表征薏苡仁油β-CD包合物的形成;HPLC法测定β-CD对薏苡仁油包合率达63%;包合物溶液以最大浓度(63 mg/mL)、最大给药量(0.04 mL/g)小鼠灌胃14 d后,心、肝、脾、肺、肾整体观察和各脏器切片均无明显病理变化,提示制备的薏苡仁油β-CD包合物食用安全,可进一步进行功效研究。
薏苡仁油,β-CD包合物,Box-Behnken响应面设计,高效液相,急性毒性实验
薏苡(Coixlaohryma-jobiL.)是药食同源植物[1],在古籍《本草纲目》和《神农本草经》都有记载。经研究发现,薏苡仁具有祛风湿,美容养颜,解热养胃等功效[2]。据报道,薏苡仁油有抗肿瘤[3-4]、镇痛[5]、抗炎[6]、降脂[7]等药理活性。薏苡仁油的药理作用众多,但水溶性差、生物利用度低等缺点极大地限制其应用。目前临床应用制剂主要有注射剂和软胶囊(康莱特),但仍存在静脉炎和静脉血管硬化等不良反应。近年来,对薏苡仁油的制剂研究已初步展开,有学者曾用β-CD、羟丙基-β-CD[11-13]对薏苡仁油进行包合,但采用正交实验优化制备工艺精度不高、预测性不佳,且未考察薏苡仁油β-CD包合物口服安全性[14]。
因此,为增加薏苡仁油的稳定性和溶出吸收利用度,本实验采用饱和水溶液法制备薏苡仁油β-CD包合物,经高效液相测定包合物的包合率,并通过Box-Behnken响应面法优化其制备工艺,采用SEM、DSC、FTIR、XRD等对包合物进行表征。此外,本研究还进行小鼠灌胃急性毒性实验以考察其口服安全性,意欲开发固体功能食品如粉末薏苡仁油冲剂或片剂。
1 材料与方法
1.1材料与仪器
薏苡仁 北京同仁堂饮片有限责任公司;薏苡素(质量分数≥99.7%) 上海源叶生物科技有限公司(批号YM0325YB14);β-环糊精(β-CD)、丙酮、乙醇、石油醚 均为分析纯,国药集团化学试剂公司;清洁级ICR小鼠(体质量18~22 g) 扬州大学比较医学中心许可证号:(SCXK(苏)2012-0004)。
磁力搅拌器 上海沪西分析仪器厂;DSC 8500 差示扫描量热仪 美国PerkinElmer公司;Tensor27傅里叶变换红外光谱仪 德国Bruker公司;S-4800场发射扫描电子显微镜 日本Hitachi High-Technologies公司;D8 Advance多晶X射线衍射仪 德国Bruker-AXS公司;Waters e2695高效液相色谱仪和Waters 2998 PDA检测器 美国Waters公司。
1.2实验方法
1.2.1 薏苡仁油的提取 将薏苡仁粉碎,丙酮为溶剂,液料比4︰1,70 ℃恒温索氏提取器回流提取1.5 h即可[15]。按《中国药典》2015年版记载方法测定薏苡仁油的理化常数。
1.2.2 饱和水溶液法制备薏苡仁油β-CD包合物 恒温45 ℃,将50 gβ-CD加入1000 mL蒸馏水中,溶解后将薏苡仁油5.6 g滴入其中,300 r/min搅拌6 h,冷藏2 h,滤出包合物,称重。
1.2.3β-CD对薏苡仁油包合率测定
1.2.3.1 薏苡仁油中指标成分薏苡素的色谱分析条件 Symmetry C18柱(250 mm×4.6 mm,5 μm);乙腈∶水=3∶7为流动相,流速0.5 mL/min;柱温25 ℃,进样量40 μL,检测波长232 nm。
1.2.3.2 色谱分析样品溶液的配制 薏苡素对照品溶液:精密称取薏苡素对照品2 mg,用20 mL乙醇溶解,制成0.1 mg/mL薏苡素乙醇溶液。
β-CD空白样品溶液:β-CD 1.0 g溶解在100 mL蒸馏水中,定容得1%β-CD水溶液。
薏苡仁油供试品溶液:精密称取1 g薏苡仁油于20 mL容量瓶中,乙醇溶解定容至刻度,得50 mg/mL的薏苡仁油乙醇溶液。
薏苡仁油β-CD包合物供试品溶液:精密称取“1.2.2”项下制备的薏苡仁油β-CD包合物10 g,用10 mL石油醚分两次洗涤,洗液滤至10 mL容量瓶中,得未包入的薏苡仁油石油醚溶液。
1.2.3.3 包合率的测定 精密分取“1.2.3.2”项下制备的0.1 mg/mL薏苡素乙醇溶液,用乙醇稀释至质量浓度分别为5、10、15、20、25 μg/mL,按“1.2.3.1”条件分别进样40 μL,记录色谱图及峰面积,绘制标准曲线。
分别吸取“1.2.3.2”项下制备的β-CD水溶液、薏苡仁油乙醇溶液及未包入的薏苡仁油石油醚溶液,按“1.2.3.1” 色谱条件分别进样40 μL,记录各峰面积,根据薏苡素的标准曲线,计算薏苡仁油中薏苡素含量和未包入的薏苡仁油量,进而求出β-CD对薏苡仁油的包合率。
包合率=W包/W投=(W投-W游)/W投
式中,W投为总投入薏苡仁油量,W包为包入的薏苡仁油量,W游为未包入仍游离的薏苡仁油量。
1.2.4 薏苡仁油β-CD包合物制备工艺单因素考察
1.2.4.1β-CD与薏苡仁油比例对包合率的影响 包合温度50 ℃,包合时间6 h,搅拌速度设为300 r/min,分别以β-CD∶薏苡仁油=3∶1、5∶1、7∶1、9∶1、11∶1投料比进行包合。
1.2.4.2 包合温度对包合率的影响β-CD∶薏苡仁油=7∶1,包合时间6 h,搅拌速度300 r/min,分别在20、30、40、50、60 ℃条件下进行包合。
1.2.4.3 包合时间对包合率的影响β-CD∶薏苡仁油=7∶1,包合温度40 ℃,搅拌速度300 r/min,包合时间分别在2、4、6、8、10 h条件下进行包合。
1.2.4.4 搅拌速度对包合率的影响β-CD∶薏苡仁油=7∶1,包合温度40 ℃,包合时间6 h,分别在200、300、400、500、600 r/min转速下进行包合。
1.2.5 薏苡仁油β-CD包合物制备工艺响应面实验优化 根据单因素影响实验及相关文献报道[16-18],选取β-CD︰薏苡仁油投料比、包合温度及包合时间3个因素进行考察,以包合率为评价指标,采用Box-Behnken响应面实验设计筛选薏苡仁油β-CD最佳工艺参数,实验因素与水平设计见表1。

表1 因素与水平表Table 1 Factors and levels table
1.2.6 薏苡仁油β-CD包合物的表征
1.2.6.1 SEM 将β-CD和薏苡仁油β-CD包合物经导电胶粘样、喷金镀膜后置于场发射扫描电镜中观察其表面形态特征。
1.2.6.2 DSC 将薏苡仁油、β-CD、薏苡仁油与β-CD物理混合物(9 gβ-CD与1 g薏苡仁油混合搅匀),薏苡仁油β-CD包合物进行差示量热分析。吹扫气(N2)20 mL/min,升温速度为10 ℃/min,温度范围30~300 ℃。
1.2.6.3 FTIR 分别取薏苡仁油、β-CD、薏苡仁油与β-CD物理混合物以及薏苡仁油β-CD包合物适量,与KBr混合压片,在4000~400 cm-1范围内测定其红外谱图。
1.2.6.4 XRD 分别取适量β-CD、薏苡仁油与β-CD物理混合物、薏苡仁油β-CD包合物进行X-射线衍射检测:Cu-Kα辐射,Lynxeye阵列探测器,管电压为40 kV,管电流为40 mA,扫描角度范围为5 °~40 °,扫描速度0.3 步/s。
1.2.7 薏苡仁油β-CD包合物小鼠灌胃急性毒性实验 小鼠60只,随机分为空白对照组20只和实验组40只,雌雄各半,禁食不禁水12 h。在预实验的基础上灌胃给与薏苡仁油β-CD包合物溶液最大浓度(63 mg/mL),最大给药容量(0.04 mL/g),空白对照组给予等体积的蒸馏水。灌胃后观察并记录小鼠生理反应及死亡情况,常规饲养14 d后处死并解剖小鼠,取其心、肝、脾、肺、肾等做病理切片观察是否有病理变化。
1.2.8 数据统计与分析 所有数据都以平均值±标准差表示,应用SPSS 20.0软件进行数据处理。利用Design-Expert 8.06软件对响应面实验结果进行方差分析,p<0.05认为具有显著差异。
2 结果与分析
2.1提取的薏苡仁油理化性状
薏苡仁提油率5.8%,其色淡黄,澄明,油状,气微,味淡;相对密度0.915;折光率1.472;皂化值192 mg KOH/g;碘值102 g碘/100 g。
2.2包合率的测定
β-CD、薏苡素对照品、薏苡仁油、未包入的薏苡仁油各溶液色谱图见图1。以浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得薏苡素标准曲线方程:Y=174918X-94541(R2=0.9994),薏苡素检测浓度在5~25 μg/mL范围内线性关系良好。经HPLC法测得薏苡仁油中指标成分薏苡素的量,计算β-CD对薏苡仁油包合率为63%。

图1 不同样品的高效液相色谱图Fig.1 HPLC chromatogram of different samples注:a.β-CD空白样品;b.薏苡素对照品;c.薏苡仁油;d.未包入的薏苡仁油。
2.3借鉴单因素考察进行响应面设计
随着投料比(β-CD∶薏苡仁油值)的增加,包合率逐渐增大,当投料比为9∶1时,包合率最高,当投料比大于9∶1时包合率增加幅度不大。因此在响应面实验中,将投料比设定为7∶1、9∶1、11∶1。在20~40 ℃范围内,随着温度的升高,包合率明显增加,当温度高于40 ℃以后,包合率升高幅度不大。考虑到薏苡仁油受热不稳定,将包合温度定为30、40、50 ℃。搅拌时间为2 h时,薏苡仁油包合不充分,搅拌6 h时,包合率最高,6 h后搅拌时间延长包合率下降,可能是因为β-CD分子空穴大,搅拌时间延长导致薏苡仁油从空腔析出,故将搅拌时间设定为4、6、8 h。500 r/min以下的低速搅拌速度对包合率影响不大,故在响应面实验中将搅拌速度设定为300 r/min,不再将其作为影响因素考察。
2.4薏苡仁油β-CD包合物制备工艺优化实验

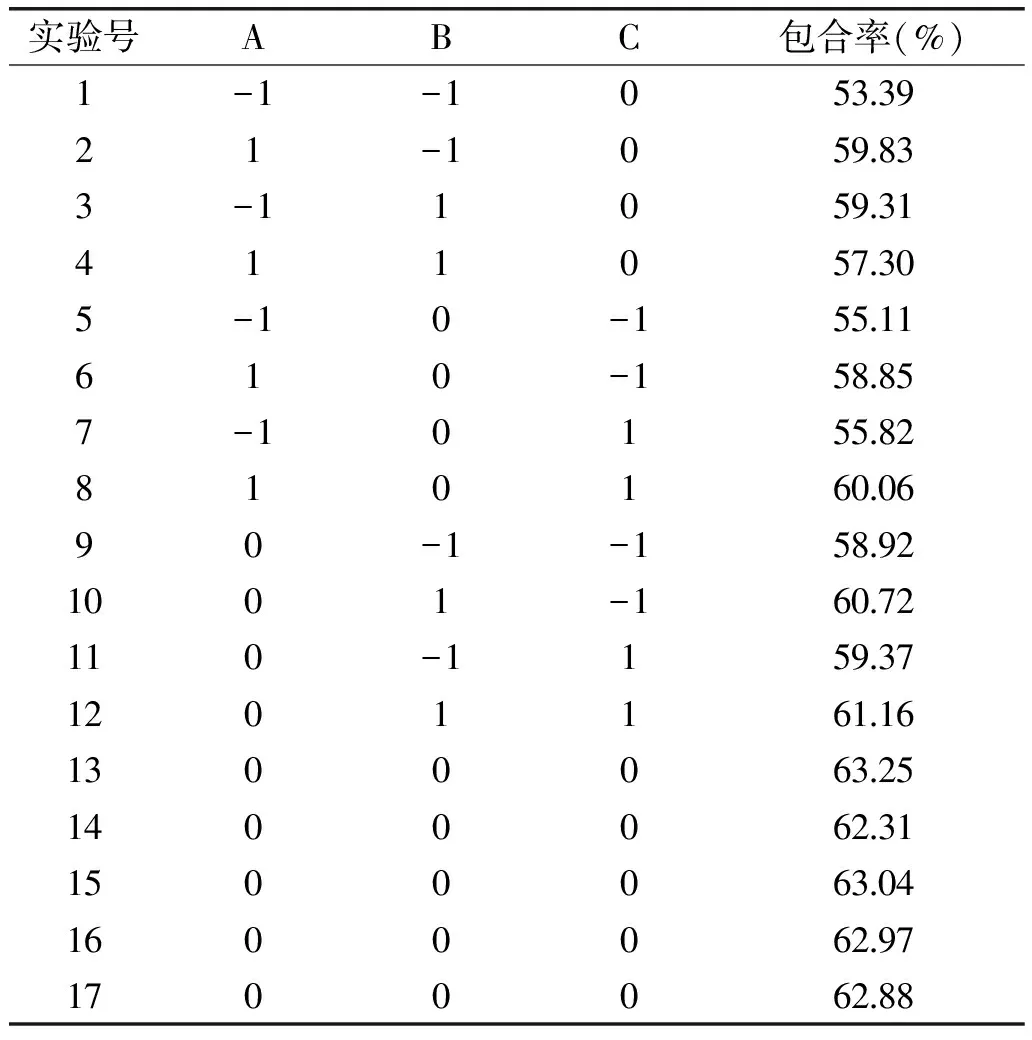
表2 响应面分析实验设计及结果Table 2 Program and experimental results of response surface methodology(RSM)
薏苡仁油β-CD包合物响应面(图2)可直观的反映:投料比和包合温度对薏苡仁油β-CD包合物包合率的影响显著。在包合温度和包合时间不变的条件下,随着投料比的增加,包合率先上升后趋向平缓。在投料比和包合时间不变的情况下,包合率先随着包合温度的增大而升高,达40 ℃后包合率升高不显著。当投料比和包合温度不变时,随着包合时间的增加,包合率先升高后下降,6 h达最大值。
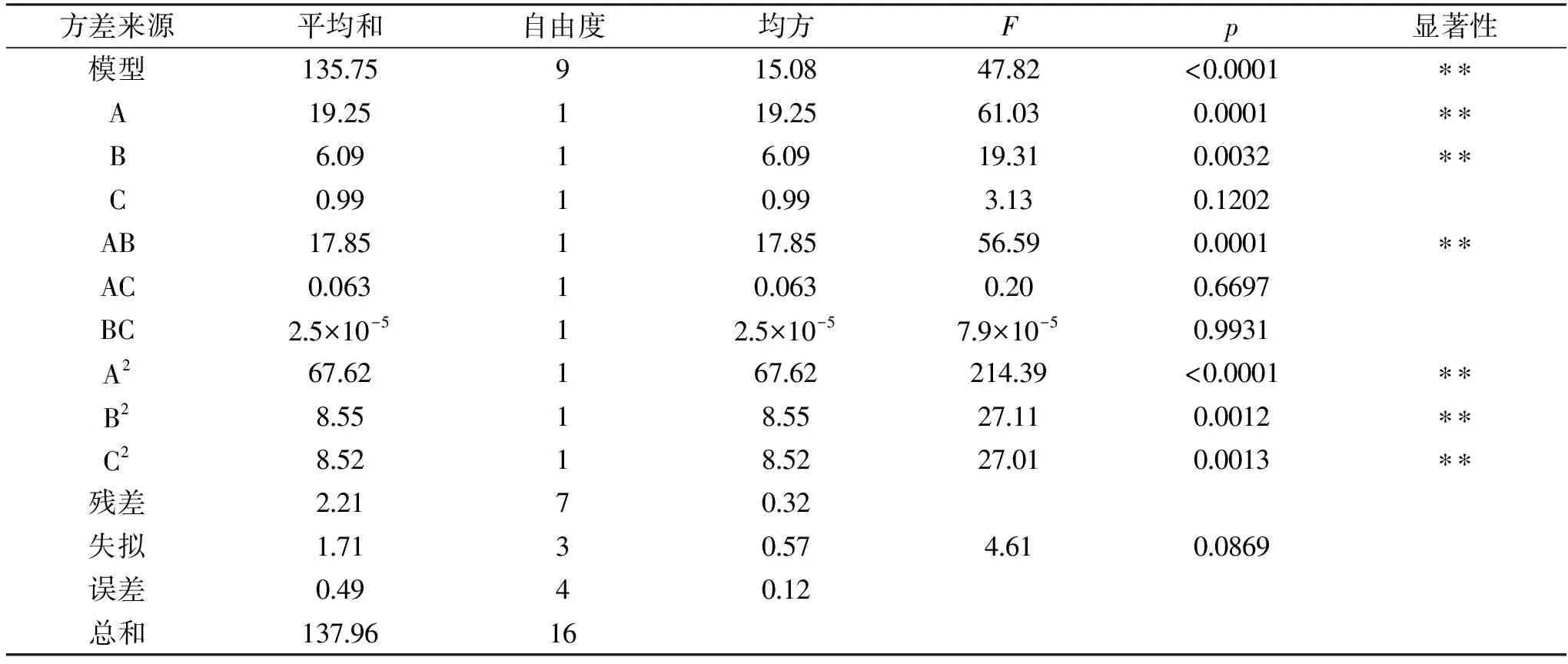
表3 方差分析Table 3 Variance analysis
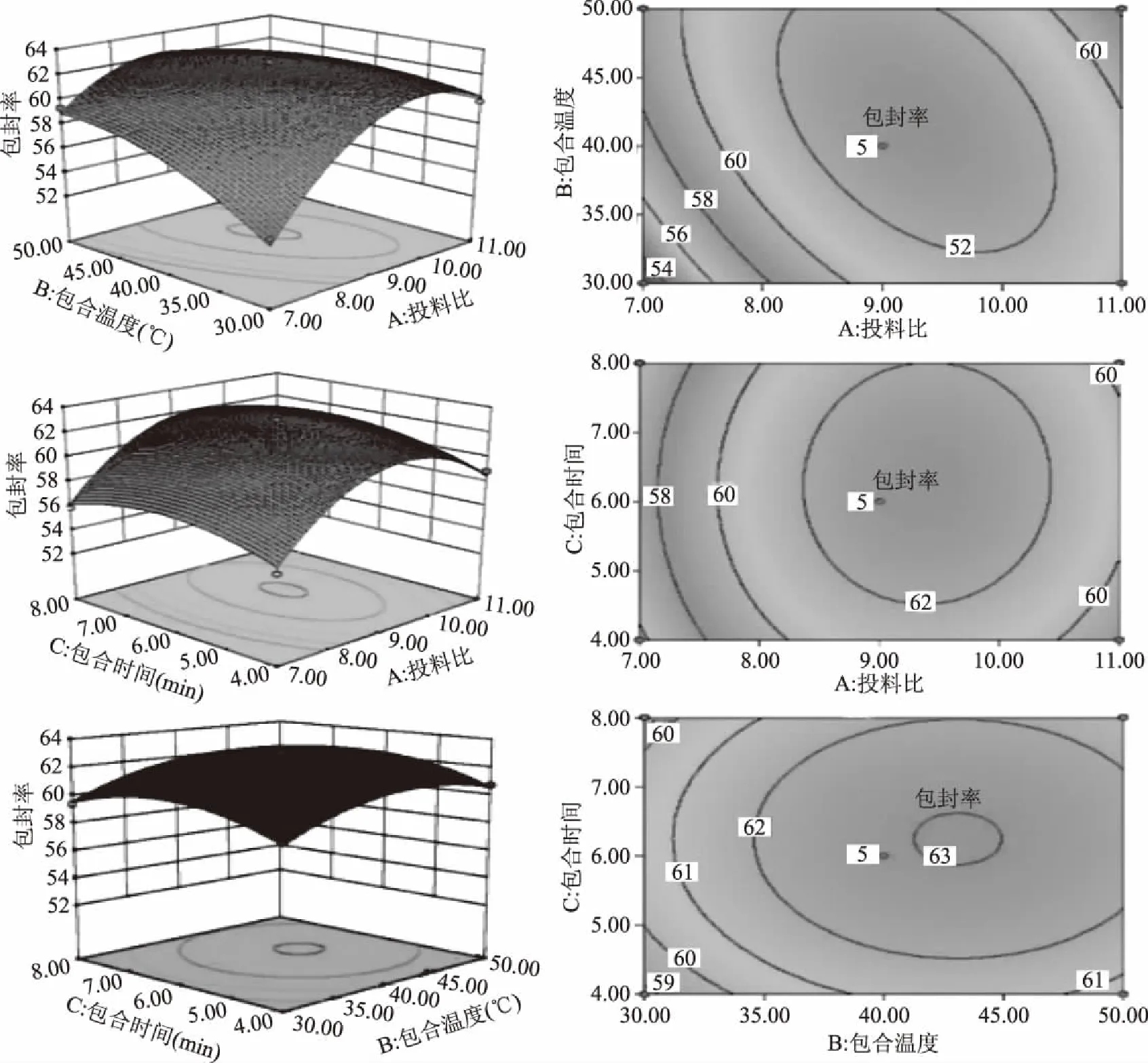
图2 薏苡仁油β-CD包合物响应面和等高线图Fig.2 Response surface and contour map of β-CD inclusion complexes of Adlay seed oil
根据等高线图(图2)可知,投料比和包合温度的等高线图呈椭圆形,说明两者交互作用显著;投料比和包合时间、包合温度和包合时间的等高线图接近圆形,说明其交互作用均不显著。
通过回归模型预测的薏苡仁油β-CD包合物制备最优条件:β-CD∶薏苡仁投料比为9.28∶1,包合温度42.00 ℃,包合时间6.26 h,包合率预测值为63.11%。为了便于操作最优条件修正为β-CD∶薏苡仁=9∶1,包合温度45 ℃,包合时间6 h ,在此条件下,β-CD对薏苡仁油的包合率达63%,与预测值相差不大,标准差为0.11%,模型真实可靠。
2.5薏苡仁油β-CD包合物的表征
2.5.1 SEM 图3可见β-CD的形态为板块状晶体,而薏苡仁油β-CD包合物呈碎粒状颗粒。

图3 β-CD(a)和薏苡仁油-β-CD包合物(b)SEM图(1000×)Fig.3 SEM pictures of β-CD(a)and β-CD inclusion complexes of Adlay seed oil(b)(1000×)
2.5.2 DSC 如图4所示,薏苡仁油无相变峰,β-CD在T=117.2 ℃出现一个吸热峰,物理混合物的热流曲线呈现β-CD的特征,包合物的热流曲线也呈现β-CD的特征,但因薏苡仁油的包入使其吸热峰在T=114.6 ℃出现。

图4 不同样品的DSC图Fig.4 DSC spectra of different samples注:a. 薏苡仁油;b. β-CD;c. 薏苡仁油和β-CD物理混合物;d. 薏苡仁油β-CD包合物;图5同。
2.5.3 FTIR 图5为薏苡仁油、β-CD、薏苡仁油与β-CD物理混合物以及薏苡仁油-β-CD包合物的FTIR谱图在1000~750 cm-1的指纹区和4000~3000 cm-1的功能团区都有同类峰群;包合物与物理混合物的整个面貌最相似,只是归属于薏苡仁油的在1745~1715 cm-1的羰基峰和薏苡仁油中指标成分薏苡素的2925 cm-1的-NH-峰,包合物的较弱,说明包合后C=O、N—H键强减弱,形成了较稳定的新物相。

图5 不同样品的FTIR谱图Fig.5 FTIR spectra of different samples
2.5.4 XRD 图6显示,β-CD与物理混合物的衍射峰基本相似,后者的衍射峰较平缓;包合物与前两者相比各衍射峰强度大幅度减弱,说明包合物的结晶度大幅度降低,由此说明β-CD包合薏苡仁油形成新的物相。

图6 不同样品的XRD谱图Fig.6 XRD spectra of different samples注:a薏苡仁油和β-CD物理混合物;b薏苡仁油β-CD包合物;c. β-CD。
2.6急性毒性实验
小鼠灌胃薏苡仁油β-CD包合物1 h内,出现卧缩成团、毛发竖立现象,与空白组相比活动减少,但5 h后两组无明显差异。14 d内小鼠未有死亡例,大小便、皮毛和肤色均正常。对比灌胃和空白组小鼠的心、肝、脾、肺、肾肉眼观察均无病变,经固定、脱水、固体石蜡包埋、切片、H.E染色、封片观察,见图7,细胞形态无异常,说明薏苡仁油β-CD包合物对小鼠主要器官无明显毒性反应。

图7 各脏器的病理切片Fig.7 Pathological sections of each organ注:空白组:A心,B肝,C脾,D肺,E肾,灌胃包合物组:a心,b肝,c脾,d肺,e肾。
3 结论
本实验采用饱和水溶液法制备薏苡仁油β-CD包合物,通过响应面实验优化其制备工艺,得到最佳工艺参数为β-CD∶薏苡仁=9∶1,包合温度45 ℃,包合时间6 h,包合率达63%。包合率是经高效液相测定薏苡仁油中薏苡素含量而推算得出,由此避免仅通过萃取称重所带来的称量误差。同时也利用薏苡素(含N—H、C=O)的结构特征,采用SEM、DSC、FTIR、XRD等方法对包合物进行验证,科学合理,准确可靠。本文进行小鼠灌胃急性毒性实验以保证功能食品的使用安全。本文为薏苡仁油粉末化和食品领域的应用提供基础实验依据,其功效评价和长期毒性实验有待于进一步完成。
[1]刘聪燕,黄萌萌,周静,等.不同产地薏苡仁药效成分含量与体外抗肺癌活性的相关性分析[J].中国实验方剂学杂志,2015,21(11):7-10.
[2]谢晶,刘丽宅,卢曼曼,等.薏苡仁的营养价值与食用功效的研究进展[J].粮食加工,2016,41(3):50-52.
[3]Wang L F,Chen J Y,Xie H H,et al. A polysaccharide fraction of adlay seed(Coixlachryma-jobiL.)induces apoptosis in human non-small cell lung cancer A549 cells[J]. Biochemical and Biophysical Research Communications,2013,61(21):5103-5113.
[4]Lu X Y,Liu W,Wu J H,et al. A polysaccharide fraction of adlay seed(Coixlachryma-jobiL.)induces apoptosis in human non-small cell lung cancer A549 cells[J]. Biochemical and Biophysical Research Communications,2013,430(2):846-851.
[5]陶小军,雷雪霏,李云兴,等.薏苡仁油的镇痛止血作用[J].中国实验方剂学杂志,2010,16(17):161-163.
[6]李彦龙,伍春,廖志峰,等.薏苡仁水提液对溃疡性结肠炎大鼠血清IL-6、IL-10的影响[J].辽宁中医药大学学报,2013,15(9):42-45.
[7]Wang Q Y,Du Z Y,Zhang H. Modulation of gut microbiota by polyphenols from adlay(Coixlacryma-jobiL.var.ma-yuenStapf.)in rats fed a high-cholesterol diet[J]. International Journal of Food Sciences And Nutrition,2016,66(7):783-789.
[8]李春艳.浅论β-环糊精在药物制剂中的应用[J].中国医药指南,2012,10(9):53-54.
[9]万广闻,谢辉,毛春芹,等.β-环糊精、羟丙基-β-环糊精对薄荷醇的包合行为差异性研究[J].中国中药杂志,2016,41(18):3336-3341.
[10]Kogawa A C,Nunes S H R,Mendonca J N,et al. Recent Advances in the Study of the Inclusion Complex Darunavir-beta-Cyclodextrin by LC-MS[J]. Journal of Aoac International,2016,99(3):626-637.
[11]李卫红,王喜明,赵红革.薏苡仁油β-环糊精包合工艺研究[J].中国新药与临床药理,2014,25(5):624-628.
[12]王付田,靳子明,郭敏.薏苡仁油-羟丙基-β-环糊精包合物制备工艺研究[J].中国中医药信息杂志,2010,17(10):56-57.
[13]Qu D,He J J,Liu C Y,et al. Triterpene-loaded microemulsion using Coix lacryma-jobi seed extract as oil phase for enhanced antitumor efficacy-preparation andinvivoevaluation[J]. International Journal of Nanomedicine,2014(9):109-119.
[14]陶小军,徐志立,雷雪霏,等.薏苡仁油急性毒性和刺激性实验研究[J].辽宁中医药大学学报,2013,15(3):39-40.
[15]洪星,徐剑,郑小霞.薏苡仁油提取方法研究进展[J].亚太传统医药,2016,12(15):68-70.
[16]伍永富,吴品江,魏萍,等.Box-Behnken设计-效应面法优化木犀草素-β-环糊精包合物的制备工艺研究[J].中草药,2010,41(7):1094-1099.
[17]郝吉福,李菲,王建筑,等.两种实验优化方法的比较研究:在制备薄荷油-β-环糊精包合物过程中的应用[J].中成药,2011,33(8):1319-1323.
[18]Gu L L,Zhao Y,Lu W G. Preparation,optimization,characterization andinvivopharmacokinetic study of asiatic acid tromethamine salt-loaded solid lipid nanoparticles[J]. Drug Development and Industrial Pharmacy,2016,42(8):1325-1333.
PreparationandcharacterizationofAdlayseedoilandβ-cyclodextrininclusioncomplexes
XURong-rong1,GAOYao-yao1,ZHOUYun-long2,HURong1,*
(1.School of Medicine,Yangzhou University,Yangzhou 225001,China; 2. Lianyungang Higher Vocational Technical College Traditional Chinese Medicine,Lianyungang 222007,China)
To prepare theβ-cyclodextrin inclusion ofAdlayseed oil with a saturated aqueous solution. The optimum by Box-Behnken response surface design were as follows-the ratio ofβ-CD toAdlayseed oil 9∶1(g/g),stirring temperature 45 ℃,inclusion time 6 h. The inclusion was characterized by SEM,DSC,FTIR and XRD. Entrapment efficiency of the inclusion determined by HPLC was 63%. In the acute toxicity test,the mice which were fed with the highest concentration(63 mg/mL)and maximum dosage(0.04 mL/g),no death was found in the experimental mice after 14 days. No organ abnormalities were found and no organ pathology in sliced observation. The prepared inclusion complexes were safety for oral administration to be better for further study of efficacy.
Adlayseed oil;β-cyclodextrin inclusion;Box-Behnken response surface design;HPLC;acute toxicity test
2016-11-28
徐蓉蓉(1993-),女,硕士研究生,研究方向:药食两用制剂开发,E-mail:893077009@qq.com。
*通讯作者:胡荣(1957-),女,大学本科,教授,研究方向:药剂学,E-mail:prhurong@163.com。
扬州大学(大学生)科技创新基金项目(x20160794)。
TS225
:B
:1002-0306(2017)12-0258-06
10.13386/j.issn1002-0306.2017.12.047

