固定化精氨酸脱亚胺酶的制备与性质研究
, , ,,
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
固定化精氨酸脱亚胺酶的制备与性质研究
蒋航宇,张涛*,江波,沐万孟,缪铭
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
从7种大孔型离子交换树脂中筛选出固定化效果最好的弱碱性苯乙烯系阴离子交换树脂D301-G,通过先吸附后交联的方法对精氨酸脱亚胺酶进行固定化条件及固定化酶性质研究。经单因素实验,结果表明,最佳固定化条件为每克树脂加入156 U精氨酸脱亚胺酶液,pH4.0,28 ℃条件下吸附4 h后,在4 ℃冷却,加入戊二醛溶液至体系内戊二醛体积分数为0.07%,4 ℃下交联4 h,最优条件下固定化酶活回收率可达85%以上。固定化酶的最适温度和pH分别为50~60 ℃和5.0~5.5,较游离酶具有更高的温度稳定性,同时固定化酶的米氏常数Km值比游离酶高。固定化酶在重复使用8次后仍保留57.7%的酶活,表明该固定化酶具有较好的操作稳定性,可为连续生产瓜氨酸提供技术依据。
精氨酸脱亚胺酶,树脂,固定化,瓜氨酸
瓜氨酸是一种非蛋白质、非必需氨基酸,其主要合成途径是通过尿素循环在肠道中产生。研究表明,瓜氨酸具有保护DNA[1-2]、维持心血管系统[3-4]、减少运动中内脏的损失[5]、促进肌肉蛋白生成[6]、提高人体性功能[7]等生理功能。因此,瓜氨酸作为一种重要的功能性成分,其市场需求量日益增加。
目前,瓜氨酸生产主要有化学法、提取法、发酵法和酶法四种方法。化学法[8]是在碱性条件下水解精氨酸得到含旋光对映体的瓜氨酸,其产物纯化复杂,污染环境。提取法是从植物中分离所得,由于工艺复杂、成本高等原因,其在工业上的应用受到严重限制。发酵法[9]是目前生产瓜氨酸的普遍方法,有安全、成本低、反应条件温和等优点,但由于发酵液成分复杂,产物纯化相对困难。因此,最近研究者们开始采用微生物的精氨酸脱亚胺酶法制备瓜氨酸,此法产物浓度高,纯化步骤少,产物无DL型对映体结构。然而,酶法应用于工业催化生产受到酶稳定性差、难以回收等缺点的限制。通过酶的固定化技术处理,将酶束缚在一定的空间中,不仅能克服游离酶在应用方面的局限性,还保留酶的催化作用。Kozo等[10]人曾使用聚丙烯酰胺凝胶固定化恶臭假单胞菌细胞生产瓜氨酸,Yang[11]使用壳聚糖固定化粪肠球菌细胞连续生产瓜氨酸,均取得较好的成果。但是,由于细胞内酶系统的复杂性,细胞固定化生产法可能会产生不必要的副产物或将得到的目标产物分解,而固定化酶则没有这方面的缺点。以树脂为载体吸附酶分子的方法具有操作简便、条件温和、损失较小、成本较低等优点,因此受到不少研究者的推崇。本文使用树脂作为精氨酸脱亚胺酶的固定化载体,研究酶固定化的条件及固定化酶的酶学性质,为酶法合成瓜氨酸的工业应用提供理论基础及新思路。
1 材料与方法
1.1材料与仪器
产酶工程菌株(EscherichiacoliBL21-pET28a-ADI) 由本实验室构建及保藏;发酵培养基(LB培养基) 10 g/L 胰蛋白胨,5 g/L NaCl,5 g/L酵母提取物;酵母提取物、胰蛋白胨、卡那霉素(kanamycin,Kan)、异丙基-β-D-硫代半乳糖苷(Isopropylβ-D-1-thiogalactopyr-anoside,IPTG)、L-瓜氨酸、二乙胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、截留量35 kDa的透析袋 生工生物工程(上海)有限公司;大孔型离子交换树脂D202-Ⅱ、D301R、D318、D301G、D311 江苏苏青集团;大孔型离子交换树脂DR116、DA201-B 沧州宝恩吸附材料科技有限公司;NaCl、Na2HPO4、NaH2PO4、25%戊二醛溶液、咪唑、三水合乙酸钠、三乙胺、四氢呋喃、甲醇、乙腈等 中国医药集团化学试剂有限公司;L-精氨酸(L-Arg) 纯度99%,浙江宁波科瑞生物工程有限公司;Ni2+琼脂糖凝胶色谱柱 美国通用(瑞典乌普萨拉)电气医疗集团;蛋白电泳Marker 宝生物工程(大连)有限公司。
SW-CJ-1FD超净工作台 苏净集团安泰空气技术有限公司;Centrifuge5804R高速冷冻离心机 德国Eppendorf公司;pH计 梅特勒-托利多仪器有限公司;细胞破碎仪 宁波新芝生物科技股份有限公司;SHA-2冷冻恒温水浴振荡器 江苏太仓实验设备厂;Agilgent高效液相色谱系统 美国Agilgent公司。
1.2实验方法
1.2.1 精氨酸脱亚胺酶的制备 挑取已构建完成的产酶菌株E.coliBL21-pET28a-ADI接种至含50 μg/mL Kan的发酵培养基中,37 ℃、转速200 r/min下培养至发酵液OD600为0.5~0.6,加入终浓度0.8 mmol/L的IPTG,在28 ℃、转速200 r/min下诱导9 h,8000 r/min离心10 min收集菌体,用磷酸盐缓冲液(50 mmol/L,pH5.5)洗涤3次后重悬,冰浴中超声破碎15 min(功率22 W,破碎1 s,间歇2 s)。在4 ℃下8000 r/min离心15 min后收集上清液,即粗酶液。
采用镍柱纯化蛋白[12]。首先,用缓冲液A(50 mmol/L PBS,500 mmol/L NaCl,pH7.0)对Ni2+螯合琼脂糖树脂柱进行预平衡;加入粗酶液后用缓冲液B(50 mmol/L PBS,500 mmol/L NaCl,pH7.0,50 mmol/L咪唑)平衡;最后用缓冲液C(50 mmol/L PBS,500 mmol/L NaCl,pH7.0,500 mmol/L咪唑)将目的酶洗脱后回收。回收酶液用含10 mmol/L EDTA的磷酸盐缓冲液(50 mmol/L PBS,pH5.5)于4 ℃冷室中低温过夜透析后于4 ℃冰箱储藏备用。所得酶液蛋白浓度用Lowry法测定[13],并进行SDS-PAGE分析[14]。
1.2.2 树脂预处理 大孔型离子交换树脂先用95%乙醇浸泡4 h,用去离子水洗至中性;再用1 mol/L NaOH浸泡4 h,用去离子水洗至中性;最后用1 mol/L HCl浸泡4 h,用去离子水洗至中性,用两倍以上树脂体积的去离子水将其浸泡,放置于4 ℃冰箱保存备用。
1.2.3 固定化条件的研究
1.2.3.1 固定化树脂种类的选择 取各种处理后的树脂D202-Ⅱ、D301R、D318、D301G、D311、DR116、DA201-B各加入52 U/g树脂的酶液,再加入20 mmol/L、pH5.5的磷酸盐缓冲液至反应体系为1 mL。在28 ℃、200 r/min条件下吸附4 h。冷却至4 ℃后,加入5 μL、1%戊二醛并混匀,在4 ℃下静置交联2 h。去掉上清液,所得固定化酶用磷酸盐缓冲液洗涤三次后浸泡在20 mmol/L、pH5.5的磷酸盐缓冲液中,制备完毕后,取一定样品测定酶活和酶活回收率,剩余样品置于4 ℃冰箱备用。
1.2.3.2 固定化工艺条件研究 加酶量:以D301-G型树脂为固定化载体,初始加酶量分别为13、26、52、104、156、208、260 U/g树脂,再加入20 mmol/L pH5.5的磷酸盐缓冲液至吸附体系为1 mL。在28 ℃、200 r/min条件下吸附4 h。冷却至4 ℃后,加入5 μL、1%戊二醛,混匀,在4 ℃下静置交联2 h,测定酶活和回收率。
吸附pH:以D301-G型树脂为固定化载体,初始加酶量为156 U/g树脂,加入pH分别为3.0~7.5的20 mmol/L的缓冲溶液至吸附体系为1 mL。在28 ℃、200 r/min条件下吸附4 h。冷却至4 ℃后,加入5 μL、1%戊二醛,混匀,在4 ℃下静置交联2 h,测定酶活和回收率。
吸附温度:以D301-G型树脂为固定化载体,初始加酶量为156 U/g树脂,加入pH为4.0的缓冲溶液至吸附体系为1 mL。在分别在温度4、15、20、28、3、35、40 ℃,200 r/min条件下吸附4 h。冷却至4 ℃后,加入5 μL、1%戊二醛,混匀,在4 ℃下静置交联2 h,测定酶活和回收率。
吸附时间:以D301-G型树脂为固定化载体,初始加酶量为156 U/g树脂,加入pH为4.0的缓冲溶液至吸附体系为1 mL。在28 ℃、200 r/min条件下分别吸附0、1、2、3、4、5、6、7、8、9、10 h。冷却至4 ℃后,加入5 μL、1%戊二醛,混匀,在4 ℃下静置交联2 h,测定酶活和回收率。
戊二醛浓度:以D301-G型树脂为固定化载体,初始加酶量为156 U/g树脂,加入pH为4.0的缓冲溶液至吸附体系为1 mL。在28 ℃、200 r/min条件下吸附4 h。冷却至4 ℃后,分别加入0、1、3、5、7、10、20、30、40 μL、1%戊二醛(即交联体系戊二醛浓度为0.0、0.01%、0.03%、0.05%、0.07%、0.1%、0.2%、0.3%、0.4%),混匀,在4 ℃下静置交联2 h,测定酶活和回收率。
交联时间:以D301-G型树脂为固定化载体,初始加酶量为156 U/g树脂,加入pH为4.0的缓冲溶液至吸附体系为1 mL。在28 ℃、200 r/min条件下吸附4 h。冷却至4 ℃后,加入7 μL、1%戊二醛,混匀,在4 ℃下静置分别交联0、1、2、3、4、5、6、7、8 h,测定酶活和回收率。
1.2.4 精氨酸脱亚胺酶酶活的测定 游离酶活力测定:取500 μL 100 g/L L-精氨酸溶液和400 μL 20 mmol/L pH5.5的磷酸盐缓冲液于试管中,加入100 μL酶液,充分混匀,45 ℃水浴下反应10 min,迅速煮沸10 min终止反应,10000 r/min离心10 min后,测定上清液瓜氨酸含量。
固定化酶活测定:取0.5 g固定化酶,加入500 μL 100 g/L L-精氨酸溶液和500 μL 20 mmol/L pH5.5的磷酸盐缓冲液,混匀,在45 ℃条件下反应10 min后,迅速煮沸10 min终止反应后,取上清液,10000 r/min离心10 min后,测定上清液瓜氨酸含量。
酶活定义:1 min时间内产生1 μmol L-瓜氨酸所需的酶量为一个酶活力单位(1 U)。
酶活回收率(%)=(固定化酶酶活/用于固定化的总酶活)×100
1.2.5 瓜氨酸检测方法 HPLC条件[15]:Angilent 1200;色谱柱:Hypersil ODS(5 μm,4.0 mm×250 mm);流动相A:水2 L,三水合乙酸钠13 g,三乙胺0.4 mL,四氢呋喃5 mL,pH7.2±0.5;流动相B:2 L,三水合乙酸钠15 g,水/甲醇/乙腈(体积比1∶2∶2),pH7.2±0.5;流动相A与流动相B梯度洗脱,A/B相流量比在0、20、24、25.5和28.5 min时分别为92∶8、62∶38、0∶100、0∶100和92∶8。总流速:1.0 mL/min;柱温:40 ℃;进样量:10 μL;检测器:紫外检测器;检测波长:338 nm,发射波长262 nm。
标准曲线的绘制:配制0.2 g/L L-瓜氨酸溶液,分别取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL加入试管并用去离子水补充至2 mL。取400 μL溶液至液相小瓶,根据上述条件进行HPLC检测,以瓜氨酸浓度为横坐标x,峰面积为纵坐标y,绘制得到标准曲线方程y=135875x+33.259,R2=0.9956。
1.2.6 固定化精氨酸脱亚胺酶性质的研究
1.2.6.1 温度对酶活及稳定性的影响 最适反应温度的确定:将固定化酶及游离酶反应体系分别置于40~65 ℃中,按照1.2.4节实验方法进行酶反应。将最适反应温度下样品的酶活力定义为100%。热稳定性的研究:将固定化酶及游离酶分别在20~50 ℃中预保温30 min后,按照1.2.4节实验方法进行酶反应,测其残余酶活。将保温0 min的样品的酶活力定义为100%。
残余酶活(%)=(经保温处理后的酶活/处理前的酶活)×100
1.2.6.2 pH对酶活及稳定性的影响 最适pH的确定:将预保存在pH4.0~7.5缓冲液的固定化酶及游离酶按照1.2.4节实验方法进行酶反应。将最适反应pH下样品的酶活力定义为100%。pH稳定性的研究:将相同浓度的固定化酶及游离酶分别在pH为4.0~7.5的缓冲液中于4 ℃预保存12 h,将pH调至5.5后按照1.2.4节实验方法进行酶反应,测其残余酶活。将最稳定pH下的样品的酶活力定义为100%。
残余酶活(%)=(在不同pH处理后的酶活/处理前的酶活)×100
1.2.6.3 固定化对米氏常数的影响 分别配制4、6、8、10、20、30 mmol/L浓度的L-精氨酸溶液,加入游离酶和固定化酶,按照1.2.4节实验方法,测定游离酶和固定化酶酶活,绘制双倒数曲线1/V-1/S,V表示酶的反应速度,S表示底物浓度。通过计算获得游离酶和固定化酶的双倒数方程,根据双倒数方程求得Km值。
1.2.6.4 固定化酶操作稳定性的研究 在最优条件下对酶进行固定化,取一定量的固定化酶,取0.5 g固定化酶,加入500 μL 100 g/L L-精氨酸溶液和500 μL 20 mmol/L pH5.0的磷酸盐缓冲液,混匀,在55 ℃条件下反应10 min后,立即吸取上清液煮沸终止反应,用缓冲溶液洗涤固定化酶三次后重复上述操作,连续进行8次。将第一次测得的固定化酶活力定义为100%。
1.3数据处理
实验中每个数据处理重复三次,应用Origin 9.0和Excel软件作图。
2 结果与分析
2.1精氨酸脱亚胺酶的制备
通过SDS-PAGE电泳鉴定,经Ni2+螯合琼脂糖树脂柱后酶液呈现单一的蛋白条带,达到电泳纯,分子量约为54.1 kDa(图1)。通过Lowry法测定纯化后的酶液的蛋白含量,结果显示纯酶液蛋白浓度为2.64 mg/mL,纯酶液的酶活力为345.84 U/mL,可用于做固定化酶的研究。

图1 精氨酸脱亚胺酶电泳图谱Fig.1 Electrophoresis map of the arginine deiminase注:1.Marker;2.粗酶液;3. Ni2+螯合琼脂糖树脂柱后酶液。
2.2精氨酸脱亚胺酶固定化条件的优化
2.2.1 固定化树脂种类 吸附分为多个连续复杂的步骤,其过程中同时存在吸附和解吸过程,吸附树脂的颗粒孔径、极性,以及吸附树脂表明的功能基团的性质,即极性、酸碱性、氢键成键能力等都会对吸附选择性和吸附行为产生影响[16]。由表1结果可知,在相同条件下,树脂种类对吸附效果的影响较大。7种大孔型离子交换树脂均对精氨酸脱亚胺酶有一定的吸附作用,其中大孔弱碱性苯乙烯系阴离子交换树脂D301G的回收率最高,其化学稳定性好、表面积和吸附量相对较大,抗污能力强。其中树脂D202-Ⅱ、DA201-B和DR116固定化效果较差,可能是由于D202-Ⅱ和DA201-B是强碱性而DR116为弱酸性,不利于精氨酸脱亚胺酶分子与载体的结合,甚至可能使酶结构发生改变而影响其催化活性。树脂D311和D318的固定化效果也不理想,可能是由于其骨架结构为丙烯酸系,与苯乙烯系树脂相比与精氨酸脱亚胺酶分子的亲和性较低。虽然树脂D301R与D301G的分类及骨架型号相同,但由于生产厂家和生产方式的不同其特性不尽相同,结果表明,树脂D301G对精氨酸脱亚胺酶的吸附性更强。因此,选择D301G树脂作为固定化载体材料最佳。
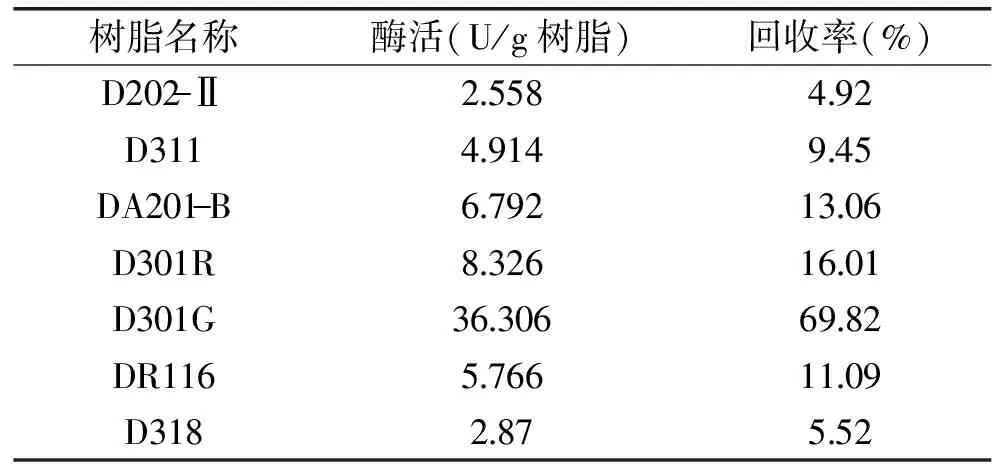
表1 不同树脂的固定化效果Table 1 Effect of various resins on immobilization
2.2.2 加酶量 在不同加酶量下酶活及酶活回收率如图2所示,固定化酶酶活随加酶量的升高而增加,而酶活回收率在加酶量低于156 U/g树脂时随加酶量增加而增加,在加酶量高于156 U/g树脂时随加酶量增加而逐渐减少。这是由于载体的活性基团的量是一定的,随着加酶量的增加树脂吸附能力逐渐趋于饱和,在酶分子与树脂的结合达到饱和之后当载体的酶负载量增加,反而会发生分子相互重叠,空间位阻加大,酶分子的空间可塑性被限制[17],因此虽然酶活一直逐渐增加,但当载体所吸附的酶趋于饱和后酶的回收率开始降低。因此,选择156 U/g树脂为最佳初始加酶量。

图2 加酶量对酶固定化的影响Fig.2 Effects of volume of enzyme on enzyme immobilization
2.2.3 pH 研究不同吸附pH下固定化酶活的吸附情况,结果如图3所示,在吸附pH为4.0时固定化酶活最高。当pH小于4.0时酶活随pH的增加而增加,pH大于4.0后,相对酶活随着pH的增加而逐渐降低。因为pH能对精氨酸脱亚胺酶分子上的巯基或酚羟基的酸碱分布有影响[18],pH的过高或过低都会影响酶与载体的共价连接及酶的空间构象,以及酶分子与载体的亲和吸附力,由此造成酶活力的改变。结果可知pH为4.0时固定化酶的吸附效果最佳。

图3 pH对酶固定化的影响Fig.3 Effects of pH on enzyme immobilization
2.2.4 温度 不同吸附温度对吸附效果的影响如图4所示,在28 ℃条件下,固定化酶活最高。在4 ℃到28 ℃时,固定化酶活随吸附温度的升高而增加,这是由于酶蛋白吸附树脂是一个吸热过程,温度较低,树脂对酶的吸附较困难,随着温度的升高,树脂和酶分子获得更多的能量,吸附量也相应提高。当温度超过最适温度28 ℃时,温度升高可能引起酶结构的变化,同时分子运动的加剧一方面使酶分子吸附到树脂上,另一方面也容易从树脂上脱落。同时温度过高会对酶分子的空间结构产生破坏[19]。因此,最佳吸附温度为28 ℃。

图4 温度对酶固定化的影响Fig.4 Effects of temperature on enzyme immobilization
2.2.5 吸附时间 选择吸附时间为0~10 h分别进行固定化,其他固定化条件不变。结果如图5所示,当吸附时间小于4 h时,酶活随时间的增加而增加;在吸附4 h时酶活达到最高117.14 U/g树脂;吸附4 h后,酶活随时间的增加而逐渐减少。可能是由于固定化初期,载体的载酶量随着时间的增加而增加,同时载体对酶分子的吸附能力也逐渐减弱。因此随着吸附能力逐渐丧失,受到反应介质的影响,部分已固定的酶分子也逐渐失活、脱落,导致固定化酶活降低[20]。结果表明,吸附时间为4 h时固定化效果最好。
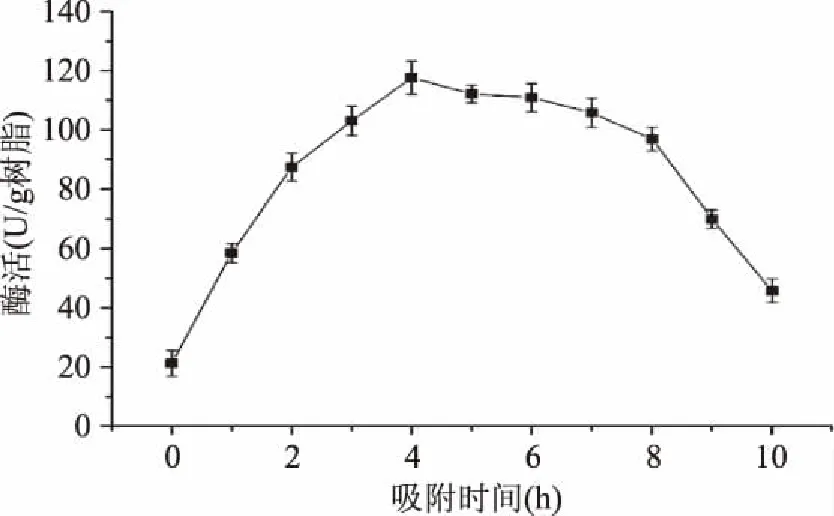
图5 吸附时间对酶固定化的影响Fig.5 Effect of adsorption time on enzyme immobilization
2.2.6 戊二醛浓度 在戊二醛浓度为0~0.4%的体系下分别进行交联,结果如图6所示,当戊二醛浓度低于体积分数0.07%时,酶活随着浓度的增加而增加,当戊二醛浓度为体积分数0.07%时,酶活达到最高;当戊二醛浓度大于体积分数0.1%时,酶活随着浓度的增加而逐渐降低。戊二醛是使载体的氨基与酶分子的氨基形成席夫碱而实现酶与载体的共价结合。戊二醛既是固定化的交联剂也是一种酶的变性剂,因此戊二醛浓度较低时有利于酶与载体的交联,但当戊二醛用量过高时,可能造成酶分子之间的交联重叠,而使酶分子构象发生改变,造成已固定在载体上的酶失活[21],因此戊二醛用量的选择尤为重要。结果表明,戊二醛浓度为体积分数0.07%时效果最佳。

图6 戊二醛浓度对酶固定化的影响Fig.6 Effect of glutaraldehyde volume concentration on enzyme immobilization
2.2.7 戊二醛交联时间 选取不同交联时间0~8 h分别进行交联,如图7所示,当交联时间小于4 h时,酶活随着时间的增加而增加,在4 h时达到最大值后,酶活随时间的增加而逐渐减少。戊二醛交联初期,在温度较低且静置环境下,酶活逐渐增加;酶与树脂交联达到饱和后,在戊二醛的继续作用下,酶分子开始自联或逐渐变性[22],酶活逐渐降低。由此可知,戊二醛交联4 h为最适交联时间。

图7 戊二醛交联时间对酶固定化的影响Fig.7 Effect of crosslinking time on enzyme immobilization
2.3 固定化精氨酸脱亚胺酶酶学性质的研究
2.3.1 温度对固定化酶酶活及稳定性的影响 图8可知,游离酶和固定化的最适温度基本相同,在50~60 ℃范围内。由图9可知,固定化酶与游离酶相比具有更优的温度稳定性,在保温温度低于30 ℃时它们的温度稳定性结果基本一致,而当保温温度大于30 ℃时,固定化酶的温度稳定性明显优于游离酶。在酶与载体结合后分子热稳定性提高,可能是由于酶分子与载体结合后刚性增强,不易折叠变形,使固定化酶对温度改变的敏感度降低[19]。
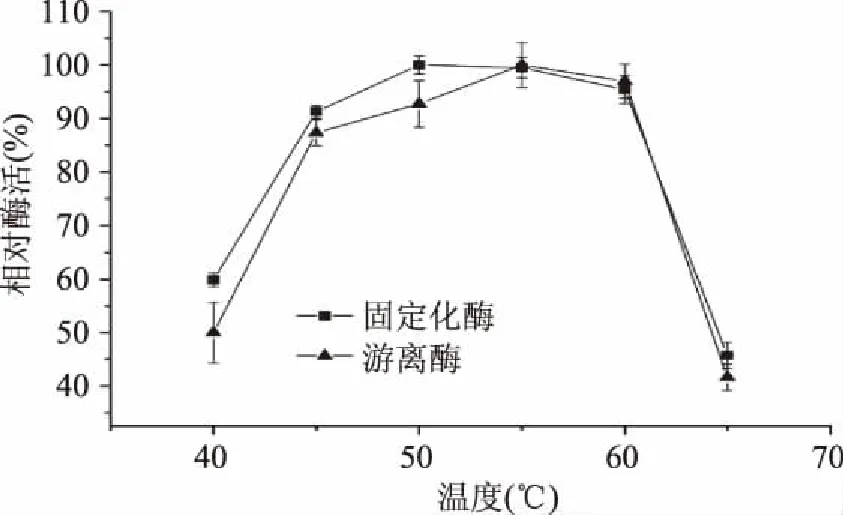
图8 温度对精氨酸脱亚胺酶活性的影响Fig.8 Effects of temperature on activity of arginine deiminase

图9 温度对精氨酸脱亚胺酶稳定性的影响Fig.9 Effect of immobilization on thermostability of arginine deiminase

图10 pH对精氨酸脱亚胺酶活性的影响Fig.10 Effect of pH on activity of arginine deiminase
2.3.2 pH对固定化酶酶活及稳定性的影响 由图10可以看出固定化酶的最适pH比游离酶低,由5.5~6.0变为5.0~5.5,这是由于载体D301G内的H+质子存在着扩散阻滞作用,以及D301G树脂是一种弱碱性载体,这样的微环境与本体溶液之间的质子形成浓度差,使精氨酸脱亚胺酶的最适pH和稳定pH向酸性方向移动[17]。由图11可知,由于载体与酶分子作用,固定化酶的pH稳定性也向酸性方向移动。同时,在偏离最适pH后稳定性较游离酶提高,在pH7.5时仍保留60%以上的酶活。由此可以看出,固定化酶最稳定pH向酸性方向偏移,而稳定性优于游离酶。
2.3.3 酶反应动力学研究 由图12计算得固定酶的米氏常数Km为11.79 mmol/L,较游离酶的米氏常数Km(10.95 mmol/L)高。这表示固定化酶的底物亲和力较游离酶低,这是由于固定化的过程中酶分子的空间构象发生变化[19],同时由于载体一定的阻隔作用,使酶与底物接触时的空间障碍或扩散位阻增加,一定上影响两者之间的亲和力,使固定化酶Km提高。

图12 游离酶与固定化酶酶促反应动力学Fig.12 Kinetic paramerters of free arginine deiminase and immobilized enzyme
2.4固定化酶的操作稳定性

图13 固定化酶操作稳定性Fig.13 The operational stability of immobilized enzyme
在最优固定化条件下对精氨酸脱亚胺酶进行固定化,并在最适反应温度和pH下测得固定化酶的酶活为132.7 U/g树脂,85.11%的酶活回收率。固定化酶的操作稳定性如图13所示,固定化酶的相对酶活随着反应次数的增加而逐渐降低,但在使用8次后仍保留57.7%的酶活。由于部分酶与载体连接不够紧密[23],固定在载体上的酶脱落,固定化酶在几次使用后酶活力下降,也可能是底物与酶分子的反复结合后活性部位的变形[24],导致酶催化效率的降低。结果表明固定化精氨酸脱亚胺酶相对于只能使用一次的游离酶而言,使用效率提高,并具有较好的操作稳定性。
3 结论
本实验优化了采用大孔型离子交换树脂固定精氨酸脱亚胺酶的条件,在最优条件下,固定化酶活力为132.7 U/g树脂,酶活回收率达85.11%。通过研究固定化酶的酶学性质发现,固定化酶的最适反应温度与游离酶相近均为55 ℃左右,而温度稳定性在35~50 ℃下高于游离酶;固定化酶的最适pH和最稳定pH较游离酶向酸性方向偏移,最适pH由5.5~6.0变为5.0~5.5,而在pH4.5~5.0时固定化酶的稳定性高于游离酶;固定化酶的米氏常数为11.79 mmol/L,较游离酶的亲和力有所降低。在重复操作8次之后固定化酶仍保留57.7%的酶活。精氨酸脱亚胺酶的树脂固定化具有成本低,操作简单,制备条件温和,可有效提高酶的稳定性及使用效率等优点,适合用于工业化生产瓜氨酸。
[1]Akashi K,Miyake C,Yokota A. Citrulline,a novel compatible solute in drought-tolerant wild watermelon leaves,is an efficient hydroxyl radical scavenger[J]. Febs Letters,2001,508:438-442.
[2]Luke A,Esposito S M,Alexander Panov,et al. Wallace Mitochondrial disease in mouse results in increased oxidative stress[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96:4820-4825.
[3]Chernyavskaya O G,hishkanova N V,Il’Chenko A P,et al. Synthesis ofα-ketoglutaric acid by Yarrowia lipolytica yeast grown on ethanol[J]. Applied Microbiology & Biotechnology,2000,53:152-158.
[4]Wiesinger H. Arginine metabolism and the synthesis of nitric oxide in the nervous system[J]. Progress in Neurobiology,2001,64:365-391.
[5]Kim V W,Wijnands K A P,Meesters D M,et al. L-Citrulline Improves Splanchnic Perfusion and Reduces Gut Injury during Exercise[J]. Medicine & Science in Sports & Exercise,2014,46:2039-2046.
[6]Jourdan M,Nair K S,Carter R E,et al. Citrulline stimulates muscle protein synthesis in the post-absorptive state in healthy people fed a low-protein diet - A pilot study[J]. Clinical Nutrition,2014,34:449-456.
[7]Khatun M M,Hossain M S,Khalekuzzaman M,et al.Invitroplant regeneration from cotyledon and internodes derived callus in watermelon(CitruluslanatusThumb.)[J]. Int J Sustain Crop Prod,2010,5(4):25-29.
[8]Plimmer R H A. The Analysis of Proteins The Estimation of Arginine by Decomposition with Alkali[J]. Biochemical Journal,1916,10:115-119.
[9]Okumura S,Shibuya M,Konishi S,et al. The Fermentative Production of L-Citrulline[J]. Agricultural & BiologicalChemistry,1964,28:742-743.
[10]Kozo Y,Tadashi S,Tetsuya T,et al. Continuous production of L-citrulline by immobilized Pseudomonas putida cells[J]. Biotechnology & Bioengineering,1974,16:1589-1599.
[11]Yang Z. Immobilization of Enterococcus faecalis cells with chitosan-A new process for the industrial production of l-citrulline[J]. Process Biochemistry,2015,50:1056-1060.
[12]Laurie E,Rebecca G,Tonny J. Methods and kits for purifying his-tagged proteins-WO 2005035092 A1[P]. 2005.
[13]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193:265-275.
[14]Yuen S W,Chui A H,Wilson K J,et al. Microanalysis of SDS-PAGE electroblotted proteins[J]. Bio Techniques,1989,7:74-83.
[15]牟昳,袁其朋,翁南梅,等.高效液相色谱分析L-瓜氨酸的研究[J]. 北京化工大学学报(自然科学版),2004,31:110-112.
[16]娄嵩,刘永峰,白清清.邸多隆大孔吸附树脂的吸附机理[J].化学进展,2012,24:1427-1436.
[17]孔维,周慧,刘辉,等.固定化葡萄糖异构酶最适pH的调节[J].中国生物化学与分子生物学报,1992:212-215.
[18]Liu J F,Liu H,Tan B,et al. Reversible immobilization of K. fragilisβ-galactosidase onto magnetic polyethylenimine-grafted nanospheres for synthesis of galacto-oligosaccharide[J]. Journal of Molecular Catalysis B Enzymatic,2012,82:64-70.
[19]范钦华,周小凡.固定化植物酯酶的制备及应用[J].现代化工,2015,35(3):112-115.
[20]曾家豫,赵蔓,杨红,等.改性离子交换树脂固定化漆酶及其动力学性质研究[J]. 西北师范大学学报:自然科学版,2004,50:86-91.
[21]陈辉,张剑波,王维敬,等.壳聚糖固定化云芝漆酶的制备及特性[J].北京大学学报(自然科学版),2006,42:254-258.
[22]李秋喜,林春芳,沐万孟,等. 海藻酸钠固定细胞产D-阿洛酮糖的研究[J].食品工业科技,2015(7):172-176.
[23]王冕,王如福,张茜.固定化酸性蛋白酶载体的选择及其性质[J].食品科学,2015,36:89-94.
[24]张汝壮,周彦波,朱明英,等. 离子交换树脂固定接枝脂肪酶[C].全国博士生学术年会,2012,31(5-6):54-57.
Preparationandcharacterizationofimmobilizedargininedeiminase
JIANGHang-yu,ZHANGTao*,JIANGBo,MUWan-meng,MIAOMing
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Arginine deiminase(ADI)was immobilized on 7 kinds of ion-exchange resins,in which D301-G was the best material for the immobilization. And the enzyme was immobilized by cross-linkage of glutaraldehyde. After single-factor experiments,the optimal immobilized conditions were enzyme load of 156 U/g resin,4-hour absorption at 28 ℃,pH4.0,the glutaraldehyde concentration of 0.07% and 4-hour cross-linking action at 4 ℃. Besides,the activity recovery yield of the immobilized enzyme reached above 85%.The optimal temperature and pH of the immobilized enzyme was 50~60 ℃ and 5.0~5.5,respectively,and it presented higher thermostability and higher Kmthan that of the free enzyme. The immobilized enzyme retained 57.7% of its initial enzyme activity after reuse for eight times. The results showed the enzyme immobilized which provided a technical basis for the application of arginine deminase industrially continuously producing citrulline.
arginine deiminase;resin;immobilization;citrulline
2016-12-14
蒋航宇(1992-),女,硕士研究生,研究方向:食品生物技术,E-mail:jhy921fendou@163.com。
*通讯作者:张涛(1973-),女,博士,教授,研究方向:食品功能配料的研究与开发,E-mail:zhangtao@jiangnan.edu.cn。
十二五863计划糖质资源高效生物利用关键技术研究(2013AA102102)。
TS201.2+5
:A
:1002-0306(2017)12-0129-07
10.13386/j.issn1002-0306.2017.12.024

